Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Acta Medica Colombiana
versão impressa ISSN 0120-2448
Acta Med Colomb vol.47 no.4 Bogotá jul./dez. 2022 Epub 25-Maio-2023
https://doi.org/10.36104/amc.2022.2233
Trabajos originales
La enfermedad neurológica en los tiempos del COVID-19. Una serie de casos
aFacultad de Ciencias de la Salud, Universidad Autónoma de Bucaramanga-UNAB
bServicio de Psiquiatría; Instituto Neu rológico Hospital Internacional de Colombia-FCV. Grupo de Ciencias Neurovasculares; Instituto Neurológico; Hospital Internacional de Colombia-FCV. Floridablanca (Colombia).
c MD, MSc, MBA. Servicio de Neurología. Instituto Neu rológico Hospital Internacional de Colombia-FCV. Grupo de Ciencias Neurovasculares; Instituto Neurológico; Hospital Internacional de Colombia-FCV. Floridablanca (Colombia).
Introducción:
se presenta una serie de pacientes con compromiso neurológico e infección por SARS-CoV-2 y se revisa la evidencia al respecto.
Pacientes y métodos:
estudio descriptivo, retrospectivo de pacientes consecutivos RT-PCR positivos para SARS-CoV-2 del servicio de neurología desde el 1° de agosto hasta 31 de diciembre de 2020.
Resultados:
registramos 30 pacientes, 16 hombres (53%), edad media: 65±17.3. En el 53% el compromiso neurológico antecedió los síntomas respiratorios y el diagnóstico de infección por SARS-CoV-2. A nivel sindromático se observó: ACV 43% (13), crisis convulsivas 10% (3), encefalopatía posterior reversible 10% (3), encefalopatía 7% (2), trastorno psicótico breve 7% (2), mielopatía 3% (1), síndrome de Guillain-Barré 3% (1), cefalea 3% (1), vasculitis 3% (1), hemorragia intracerebral 3% (1), crisis miasténica 3% (1) y neuritis óptica recurrente 3% (1).
Conclusiones:
el compromiso neurológico por el SARS-CoV-2 produce una gran variedad de síntomas y puede ser la primera manifestación incluso sin el desarrollo de síntomas respiratorios por esta infección. (Acta Med Colomb 2022; 47. DOI:https://doi.org/10.36104/amc.2022.2233).
Palabras clave: SARS-CoV-2; COVID-19; neurología; complicaciones neurológicas; ACV
Introduction:
we present a series of patients with neurological problems and SARS-CoV-2 infection, and review the respective evidence.
Patients and methods:
a retrospective descriptive study of consecutive RT-PCR SARS-CoV-2-positive patients in a neurology department from August 1 to December 31, 2020.
Results:
we recorded 30 patients: 16 men (53%), with a mean age of 65±17.3. In 53%, the neu rological problem preceded the respiratory symptoms and SARS-CoV-2 infection diagnosis. At the syndromic level, the following were found: CVAs 43% (13), seizures 10% (3), posterior reversible encephalopathy 10% (3), encephalopathy 7% (2), brief psychotic disorder 7% (2), myelopathy 3% (1), Guillain-Barré syndrome 3% (1), headache 3% (1), vasculitis 3% (1), intracerebral hemorrhage 3% (1), myasthenic crisis 3% (1) and recurrent optic neuritis 3% (1).
Conclusions:
SARS-CoV-2 induced neurological problems produce a wide variety of symptoms and may be the first manifestation, even without the development of respiratory symptoms from this infection. (Acta Med Colomb 2022; 47. DOI:https://doi.org/10.36104/amc.2022.2233).
Keywords: SARS-CoV-2; COVID-19; neurology; neurological complications; CVA
"En todo caso, la tragedia fue una conmoción no sólo entre su gente, sino que afectó por contagio al pueblo raso, que se asomó a las calles con la ilusión de conocer aunque fuera el resplandor de la leyenda".
EL AMOR EN LOS TIEMPOS DEL CÓLERA,
GABRIEL GARCÍA MÁRQUEZ
Introducción
En diciembre de 2019 en Wuhan China, se conocieron los primeros casos de pacientes con neumonía atípica por un nuevo coronavirus (SARS-CoV-2) y el 10 de abril de 2020 se publicó la primera serie de casos de pacientes con compromiso neurológico por SARS-CoV-2 1. En los si guientes meses la casuística sobre tres escenarios neurológi cos del virus (desenmascara, desencadena y/o coexiste) que aumentó con base en los resultados de estudios en modelos animales y en los reportes publicados 2. El SARS-CoV-2 en su superficie cuenta con la proteína S de unión, con gran afinidad por el receptor de la enzima convertidora de angiotensina 2 (ACE2), expresada en tejidos como el epitelio de las vías respiratorias, el riñon, intestino delgado y en el sistema nervioso con especial predilección por la corteza motora y del cíngulo, ventrículos laterales, bulbo olfatorio, y más recientemente se ha descubierto en la superficie de las neuronas y células gliales 2,3. La transferencia transináptica desde las terminaciones nerviosas periféricas, por ejemplo, localizadas en las vías respiratorias, permite que el virus se disemine de manera retrograda hasta el sistema nervioso central (SNC) y periférico (SNP) 4. Otras teorías propuestas de invasión a SNC han sido a través del bulbo olfatorio y la barrera hematoencefálica (BHE 5-7. El paso a través de la BHE puede darse por migración leucocitaria conocida como "mecanismo de caballo de troya" y por el paso directo a través de la BHE patológicamente permeable como consecuencia de la inflamación sistémica característica de la enfermedad por COVID-19 5-7. Ahora empezamos a conocer los diferentes tipos de compromisos neurológi cos, incluso en pacientes con síntomas neurológicos como primera manifestación de la infección por SARS-CoV-2. Se presenta una serie de casos de pacientes hospitalizados con diagnóstico de infección por SARS-CoV-2 a partir de los cuales se revisa la evidencia en la literatura frente al compromiso neurológico.
Pacientes y métodos
Estudio descriptivo retrospectivo y observacional de una serie de casos de pacientes con compromiso neurológico infectados por SARS-CoV-2, atendidos en el servicio de neurología del Hospital Internacional de Colombia, entre 1° de agosto y 31 de diciembre de 2020. La revisión inclu yó 30 pacientes de ambos sexos, mayores de 18 años con compromiso neurológico al ingreso hospitalario o durante la hospitalización, con diagnóstico confirmado por RT-PCR para SARS-CoV-2 en muestra de hisopado nasal y orolin gual. El estudio se realizó de acuerdo con los principios de la Declaración de Helsinki. Este estudio fue aprobado por el Comité de Ética en Investigación-CEI de la Fundación Cardiovascular de Colombia-HIC.
Se revisaron las historias clínicas electrónicas, los ha llazgos de laboratorio, LCR y los exámenes radiológicos de todos los pacientes. Se recopiló información sobre edad, sexo, comorbilidades, NIHSS (National Institute of Health Stroke Scale, por sus siglas en inglés), síntomas típicos por COVID-19 (fiebre, tos, congestión nasal, diarrea, dolor de garganta, dolor abdominal, náusea o vómito), con los cuales se clasificó cada uno de los pacientes entre sintomático o asintomático, utilizando la definición de la American Thora cic Society8. La severidad del COVID-19 e identificación del riesgo para la indicación de manejo por cuidado crítico se midió a través de la escala National Early Warning Score (NEWS2). Los síntomas neurológicos se agruparon de acuer do con el nivel del compromiso en SNC (mareo, cefalea, alteración de la conciencia, síntomas neurovasculares agudos, afasia, convulsión, vértigo, desorientación) y en SNP (anos mia, ageusia, alteración visual, dolor, debilidad muscular). Los estudios radiológicos revisados incluyeron radiografía y/o tomografía computarizada (TC) de tórax, TC de cráneo simple y/o contrastada, resonancia magnética (RM) cerebral simple y/o contrastada, el reporte del registro de electroence falograma, así como otras pruebas realizadas de acuerdo con las necesidades de atención clínica de cada paciente.
Cada una de las manifestaciones neurológicas fueron con firmadas por neurólogos de la institución. La alteración de conciencia se definió como el cambio del nivel de conciencia (somnolencia, estupor y coma); el síndrome confusional como alteración del contenido de conciencia (confusión y delirio); el diagnóstico de ataque cerebrovascular isquémico (ACV) fue confirmado a través de TC de cráneo y/o RM cerebral; la convulsión con base en los síntomas clínicos al momento de la presentación; la mielopatía inflamatoria se definió como afectación de la médula espinal confirmado por RM de columna espinal; el síndrome de Guillain-Barré (SGB) confirmado por estudios de conducción nerviosa; el síndrome de encefalopatía posterior reversible (EPR) confirmado por RM cerebral. El desenlace funcional de los pacientes con ACV se midió con la escala de Rankin modificada (Rankin-m).
La información fue almacenada en un archivo de Excel previamente codificado por los investigadores. El análisis estadístico se realizó utilizando el programa SPSS en su versión 25; las variables continuas se analizaron utilizando los promedios con su respectiva desviación estándar (DE) y las variables categóricas se expresaron como frecuencias absolutas y relativas en porcentajes.
Resultados
Se presenta el compromiso neurológico en 30 pacientes con edad promedio de 65±17.3 años, 53% hombres y 47% mujeres. Ningún paciente era trabajador sanitario. En 53% el compromiso neurológico antecedió la presentación de síntomas respiratorios y el diagnóstico de infección por SARS-CoV-2 (asintomáticos respiratorios) y fue el motivo de consulta hospitalaria (Figura 1). En 47% el compromiso neurológico se evidenció en el transcurso de la hospitali zación por COVID-19 con una mediana de 5.5 días (Q1: 1-Q3: 36). El 83% presentó afectación en SNC y 17% en SNP. Desde la perspectiva sindromática, se observó ACV 43% (13), crisis convulsivas 10% (3), EPR 10% (3), encefalopatía 7% (2), trastorno psicótico breve 7% (2), mielopatía 3% (1), SGB 3% (1), cefalea 3% (1), vasculitis cerebral 3% (1) y hemorragia intracerebral 3% (1). Solo dos pacientes desarrollaron un episodio de reactivación y/o recaída de patologías neurológicas preexistentes, el primero como una crisis miasténica y el segundo como una neuritis óptica (Figura 1). En los antecedentes médicos sólo el 24% no presentaban ninguna comorbilidad y en 76% una o más comorbilidades, entre las que se destacan hipertensión ar terial, diabetes, obesidad, arritmia cardiaca y enfermedad neurológica previa.
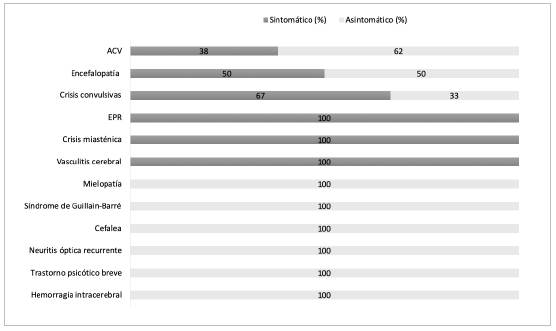
Figura 1 Distribución de los compromisos neurológicos entre los pacientes sintomáticos y asintomáticos respiratorios.
En ocho de los 13 pacientes con ACV (61.53%), la presentación al evento cerebrovascular precedió la sintomatología respiratoria y el diagnóstico de infección por SARS-CoV-2, mientras que en los cinco restantes el ACV se diagnosticó en las 24 horas siguientes a la hospitalización por síntomas respiratorios por COVID-19. La edad promedio de estos pacientes fue 77±11.9 años. La radiografía y/o la TC de tórax mostró lesiones pulmonares características en todos los cinco pacientes sintomáticos respiratorios y sólo en tres de los ocho pacientes asintomáticos respiratorios al ingreso. Todos los ACV correspondieron a gran vaso, siendo 71.4% 10 en territorio de la arteria cerebral media. La mediana de NIHSS al ingreso de los pacientes asintomáticos respiratorios fue de 15.5 (Q1: 6.75-Q3: 2.25). En los pacientes sintomáticos respiratorios solo fue posible evaluar el NIHSS en dos de ellos (tres y cinco puntos respectivamen te), debido a que los pacientes restantes se encontraban en estado de sedación en unidad de cuidados intensivos (UCI) debido al compromiso ventilatorio. La escala NEWS 2 tuvo una mediana de tres puntos (Q1: 1-Q3: 6). El Rankin-m de egreso fue 0-2 en 38%, 3-4 en 16% y seis (46%) pacientes fallecieron (tres por compromiso respiratorio y tres por transformación hemorrágica intraparenquimatosa).
Tres pacientes presentaron crisis convulsivas con edades de 61, 69 y 79 años, sin antecedentes de epilepsia. Uno de los pacientes ingresó por crisis generalizadas tónico-clónicas (seis episodios en 15 días), sin síntomas respiratorios previos. Los dos pacientes restantes, presentaron ageusia, anosmia y síntomas respiratorios leves entre uno y ocho días previos. En todos los casos la radiografía de tórax mostró opacidades alveolares bilaterales típicas. En dos de los ca sos el electroencefalograma mostró actividad lenta difusa sin actividad epileptiforme. La TC de cráneo solo en uno de los pacientes fue normal, en otro de los casos mostraba edema cerebral difuso y en el tercero un sangrado subcorti cal frontal derecho. Dos de los pacientes fallecieron como consecuencia del síndrome de distrés respiratorio agudo del adulto (SDRA) asociado al COVID-19.
Los tres pacientes con diagnóstico de EPR, con edades de 45, 54 y 58 años, habían requerido ingreso en UCI por su compromiso respiratorio. Los síntomas neurológicos fueron evidentes en dos pacientes durante las primeras 48 horas post-extubación, caracterizados por alteración del estado de conciencia persistente en un caso y por una crisis comicial en otro. Estos dos pacientes fallecieron a causa del SDRA por COVID-19. En el tercer paciente el compromiso neurológico se presentó un mes después del inicio de la en fermedad por COVID-19, con hemiparesia izquierda, afasia global y ceguera cortical. Este paciente presentó al tercer día del inicio resolución completa del compromiso neurológico. La RM cerebral en los tres pacientes mostraba signos de edema vasogénico con compromiso de la sustancia blanca yuxtacortical parietal y occipital de distribución simétrica y bilateral (Figura 2C).
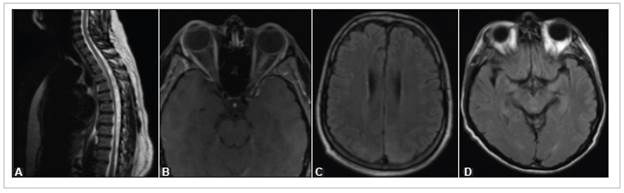
Figura 2 Lesiones de los pacientes de la serie. A) Paciente 10: RM de la columna dorsal ponderada en T2, muestra hiperintensidad del cordón medular por mielopatía longitudinalmente extensa. B) Paciente 17: RM orbitaria ponderada en T1 con saturación grasa, muestra engrosamiento y realce del nervio óptico izquierdo. C) Paciente 26: RM cerebral con ligera hiperinten sidad cortico-subcortical en la región parieto-occipital, de manera bilateral y simétrica en secuencias T2-FLAIR. D) Paciente 29: RM cerebral con hiperintensidad en los dos hipocampos y mesencéfalo de localización central y posterior en secuencias T2-FLAIR.
En dos pacientes se hizo el diagnóstico de encefalopatía aguda, con edades de 58 y 76 años. La TC de cráneo fue nor mal en ambos casos. Uno de ellos ingresó en el contexto de una encefalopatía hipertensiva sin síntomas respiratorios y el segundo paciente, por síntomas respiratorios con requerimien to de soporte ventilatorio, quien al día cuatro presenta clínica compatible con encefalopatía (somnolencia y mioclonías). En ambos casos la radiografía de tórax mostraba opacidades pulmonares típicas, y el desenlace fue hacía la mejoría, el primero al término de dos meses y el segundo a los 30 días.
Una paciente de 34 años asintomática respiratoria de butó con dolor neuropático agudo (dermatomas T4-T6), paresia del miembro inferior derecho, plejía del miembro inferior izquierdo y alteración del control de los esfínteres. Al examen se le encontró hiperreflexia y espasticidad en miembros inferiores. La radiografía de tórax fue normal y la RM medular evidenció hiperintensidad y realce del medio de contraste desde el primer al quinto segmento de la médula espinal dorsal (Figura 2A). Se descartaron lesio nes desmielinizantes a otros niveles del SNC y la paciente mejora de manera significativa tras un ciclo de cinco días con metilprednisolona.
Un paciente de 71 años se diagnosticó síndrome de Guillain-Barré, debutó con un cuadro de tres días de evolución de cuadriparesia flácida arrefléctica rápidamente ascendente y diparesia facial. Este paciente ingresa sin síntomas res piratorios y la radiografía de tórax de ingreso fue normal. El LCR al octavo día del inicio de los síntomas mostró disociación albúmino-citológica (proteínas: 148.1 mg/dL) y los estudios de neuroconducción fueron compatibles con polineuropatía mixta sensitiva-motora, axonal y mielínica, y ausencia de ondas F en las cuatro extremidades. El pa ciente recibió cinco recambios por plasmaféresis con una recuperación significativa de la fuerza y la movilidad en las cuatro extremidades.
Un paciente de 27 años, seis días antes de su ingreso a urgencias desarrolla cefalea de tipo opresivo en región occipital, de intensidad moderada que rápidamente progresa a ser severa. También presentaba fonofobia, mialgias proximales y fatiga, pero sin fiebre, tos, dolor abdominal, ni diarrea. Al examen neurológico, la radiografía de tórax y la TC de cráneo fueron normales. El manejo con ibuprofeno intravenoso no mejoró los síntomas. Se diagnosticó infección por SARS-CoV-2 al segundo día de hospitalización. Después del séptimo día de la administración de esteroides intravenosos el paciente mejora. Fue dado de alta con recomendación de cumplir cuarentena y manejo ambulatorio.
Un paciente de 65 años consulta al servicio de urgencias porque desde hace ocho días, presentaba cefalea en región frontal bilateral de intensidad severa y de tipo opresiva, malestar general, fiebre, rinorrea hialina y artralgia. La radiografía de tórax mostraba opacidades pulmonares. El primer día de hospitalización se diagnosticó infección por SARS-CoV-2. Cuatro días después la cefalea empeora y el paciente presenta amaurosis fugaz en el ojo izquierdo. El análisis de LCR fue completamente normal (estudios FilmArray, Genexpert, KOH, tinta china, Gram y adenosina desaminasa negativos). La imagen ponderada en T2-FLAIR de la RM cerebral, mostró hiperintensidades en ambos hi pocampos y en región central y posterior del mesencéfalo (Figura 2D) con diagnóstico de vasculitis cerebral. Fue ingresado en UCI neurológica y se administró acetaminofén y fluidos intravenosos. El paciente mejora su sintomatología 18 días después y egresa asintomático.
Dos pacientes se recibieron en el servicio de emergencias por inquietud motora, irritabilidad, alucinaciones visuales estructuradas, y se les hizo diagnóstico de trastorno psicótico breve (DSM V). En el primer paciente de 59 años sintomático respiratorio, se documentó hipoglucorraquia (39 mg/dL) y se descartó etiología infecciosa (KOH, tinta china, gram, adenosina desaminasa, GenExpert, FilmArray negativos). La radiografía de tórax y la TC de cráneo fueron normales; este paciente recibió manejo por psiquiatría con risperidona y al décimo día se le dio egreso por mejoría clí nica. El segundo caso, corresponde a un paciente de 74 años quien era asintomático respiratorio. La radiografía de tórax mostraba lesiones pulmonares, la TC de tórax con signos de tromboembolismo pulmonar bilateral, y falleció al tercer día de hospitalización por sus complicaciones respiratorias.
Un paciente de 52 años con un antecedente de miastenia gravis, ingresa con falla ventilatoria aguda en el contexto de una crisis miasténica. Al ingreso por tomografía y radiografía de tórax se evidencian cambios típicos por COVID-19 y tromboembolismo pulmonar derecho, requiriendo intuba ción orotraqueal por nueve días. Se trató con cinco recambios con plasmaféresis, piridostigmina y metilprednisolona con una evolución favorable, extubación exitosa y egreso a casa.
Una paciente de 23 años con un diagnóstico previo de neuritis óptica idiopática en el ojo izquierdo, ingresa por deterioro de la agudeza visual de dos días de evolución en el ojo derecho.
Esta paciente no tenía ningún síntoma respiratorio y la radiografía de tórax de ingreso fue normal. La RM orbi taria y medular, mostró engrosamiento e hiperintensidad del nervio óptico izquierdo en su porción intraorbitaria, intracanalicular e intracraneal con realce marcado del medio de contraste y engrosamiento de la porción intracraneal del nervio óptico derecho hasta el nivel del quiasma óptico, sin ningún compromiso en médula espinal (Figura 2B). Recibe tratamiento con metilprednisolona (1 gr/día por tres días) con recuperación de la agudeza visual y se le da egreso con esteroides ambulatorios.
La mortalidad general fue de 35% (11), 50% (7) en los pa cientes que ingresaron sintomáticos respiratorios y 25% (4) en los pacientes que consultaron sólo por síntomas neurológicos (asintomáticos respiratorios). Como causa de muerte se iden tificó el SDRA en cinco pacientes, hemorragia intracerebral en tres, e hipertensión endocraneana en tres pacientes.
Discusión
En nuestra serie se encontró que en 53% de los pacientes el compromiso neurológico fue la primera manifestación clínica, sin síntomas respiratorios y en estos pacientes el diagnóstico de SARS-CoV-2 se realizó como parte de los protocolos de tamizaje general en tiempo de pandemia. Este es un hallazgo clave de alerta en la práctica clínica, pues si bien en algunos casos no es posible establecer una relación temporal, la infección por SARS-CoV-2 puede debutar como un síndrome neurológico, sin síntomas respiratorios e incluso ser la única manifestación de la infección (Figura 3) 9. Aunque el compromiso neurológico es menor que la enfermedad pulmonar por COVID-19, se ha reportado en series de casos intrahospitalarios que en 13.5% los síntomas neurológicos se presentan dos días posteriores al inicio de los síntomas respiratorios iniciales, en 43% de manera simultá nea y diferente a lo encontrado en nuestros casos, tan sólo el 2% los síntomas neurológicos son el debut del COVID-19 10. El compromiso más frecuente en SNC fue ACV, crisis convulsivas, encefalopatía, EPR, y complicaciones parainfecciosas como mielitis longitudinal, SGB, neuritis óptica y vasculitis similar a lo publicado hasta el momento 11.
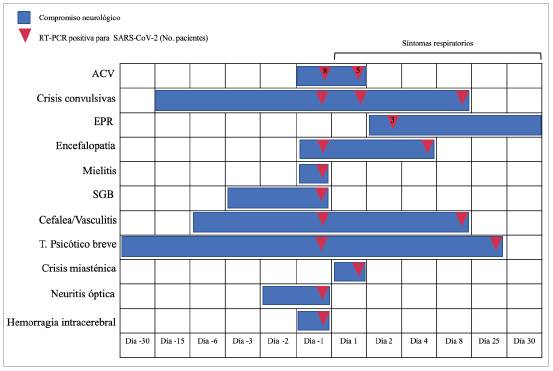
Figura 3 Cronología del compromiso neurológico desde los días de presentación inicial de la enfermedad y los días desde el inicio de los síntomas res piratorios hasta el diagnóstico de SARS-CoV-2. El día uno corresponde al día de inicio de síntomas respiratorios. (En color).
Durante la pandemia por SARS-CoV-2 se han reportado ACV de mayor severidad y mortalidad intrahospitalaria en adultos jóvenes sin comorbilidades con compromiso de gran vaso, y en adultos mayores con comorbilidades cardiovas culares 12-17. En la mayoría de los pacientes de nuestra serie el ACV fue la primera manifestación siendo asintomáticos respiratorios, similar a lo recientemente publicado que sugiere que el riesgo de presentar un ACV es mayor en adultos jóvenes asintomáticos respiratorios, e incluso meses posteriores al diagnóstico de infección por COVID-19 18. En los casos de ACV intrahospitalarios el diagnóstico fue temprano (media de un día) en contraste con lo reportado en la literatura (media de 10 días) 1. En solo uno de los casos, se estableció una etiología cardioembólica definida correspondiendo a fibrilación auricular (paciente 4), hacien do la salvedad que en seis pacientes no se pudieron hacer estudios etiológicos debido al rápido deterioro y muerte. Los estudios de autopsias de pacientes con COVID-19 han evidenciado lesiones muy sugestivas de isquemia en SNC entre otros órganos, las que podrían estar relacionadas con el estado protrombótico y de hipercoagulabilidad asociado en la COVID-19 19-21. Ahora, la relación causal entre el SARS-CoV-2 y el ACV sigue en debate, pero lo cierto es que la infección por este virus se asocia a ACV severos y de alta mortalidad, condicionada por el compromiso respi ratorio de la COVID-19, y en otros además por la severidad del ACV 22.
La reducción en el umbral convulsivo se ha asociado a infecciones virales 23,24 y para el caso del COVID-19 se ha planteado que la tormenta de citoquinas pueda ser la causa de crisis convulsivas y la alteración del estado de conciencia en pacientes con antecedente de epilepsia 1,25. En nues tra serie ninguno de los tres pacientes tenía antecedente de epilepsia y en los dos casos con crisis convulsivas y compro miso respiratorio su desenlace fue hacia la muerte. Se estima que 10% de los pacientes SARS-CoV-2 positivos intubados y sedados en UCI, presentan crisis convulsivas subclínicas 25, lo que para nuestros pacientes solo se observó en un caso y en quien el diagnóstico fue EPR, patología con una mayor incidencia en pacientes con COVID-19 severa con ingreso en UCI, de mayor edad, comorbilidades de base y alta mortalidad 25,26.
Así como se presenta en otras infecciones virales, el SARS-CoV-2 puede predisponer el desarrollo de patologías de nervio periférico como el SGB y de la unión neuromuscular como la miastenia gravis 27. El SGB en pacientes con COVID-19 se presenta entre los días 10 y 21 posterior al inicio de los síntomas respiratorios y predominan las va riantes con compromiso de los pares craneales (47%) 27. El manejo recomendado sigue siendo la inmunoglobulina o plasmaféresis dado que no comprometen la inmunidad natural 27. Por otra parte, la inmunosupresión se ha pos tulado como protectora al reducir la tormenta de citoquinas, por ejemplo en pacientes con miastenia gravis, en quienes el curso del COVID-19 aunque es más severa, tienden a un desenlace favorable como lo observado en el paciente 14 de nuestra serie 28.
Las complicaciones neurológicas en pacientes con infec ción por SARS-CoV-2 pueden ser directas de acuerdo con la expresión neuronal del receptor ACE2 como en la cefalea, anosmia y disgeusia, síntomas más frecuentes durante días, o entre el séptimo y décimo día desde el inicio del COVID-19 29,30. De acuerdo a la intensidad o gravedad, la cefalea por sí misma no es una de las causas más frecuentes de consulta a emergencia en hospitales de alta complejidad, y explicaría la baja incidencia de este síntoma en una serie hospitalaria 30. También puede haber complicaciones indirectas como consecuencia de los estados de hipoxia y alteraciones parainfecciosas, debido a la respuesta inmune adaptativa del huésped (Tabla 1) 31. El fenómeno parainfeccioso se ha descrito en casos de mielitis aguda necrotizante asociados con polineuropatía axonal y de neuritis óptica con anticuerpos anti-MOG positivos, los cuales tienen una rápida respuesta tras el uso de corticoides 32-35, como lo observado en nuestra paciente con neuritis óptica. Las complicaciones postinfecciosas, en su mayoría abarcan un amplio espectro de manifestaciones neuropsiquiátricas como depresión, ansiedad y trastornos afectivos, hasta la esfera neurocognitiva-conductual como alteración de la memoria y trastornos psicóticos 36 como lo observado en nuestros pacientes 9 y 19.
Tabla 1 Clasificación de las complicaciones neurológicas según la naturaleza neuroinvasiva del SARS-CoV-2.
| Indirectas | Directas | Parainfecciosas |
|---|---|---|
| ACV | Anosmia | Encefalomielitis aguda diseminada |
| Cefalea | Hiposmia | Mielitis |
| Ataxia | Disgeusia | Neuritis óptica |
| Encefalopatía aguda necrotizante | Miastenia gravis | |
| Alteración del estado de conciencia | Síndrome de Guillain-Barré | |
| Crisis convulsivas | Parkinsonismo |
Aunque no existe consenso entre expertos, en esta pan demia, independiente del compromiso respiratorio en los pacientes con síntomas neurológicos, mínimo se debe indicar la radiografía de tórax. Adicionalmente, la TC de cráneo sim ple como imagen inicial en pacientes estables con sospecha clínica de ACV, y la RNM cerebral y/o medular en aquellos casos cuyas decisiones médicas dependan de esta o que se requiera la valoración del cordón medular y sus raíces 37.
Los autores del presente manuscrito reconocen las limitaciones existentes, en primer lugar fue su tamaño de muestra. Sin embargo, se presenta un número de casos con una base hospitalaria general en los que se pudo observar en la mayoría de ellos síntomas del compromiso neurológico sin que fuera aún evidente el compromiso respiratorio de la infección por SARS-CoV-2 y se aporta información del compromiso por este virus con un comportamiento diferente a lo observado en otras publicaciones. Adicionalmente se cabe aclarar que la captación de pacientes fue desarrollado previo al inicio del plan nacional de vacunación contra SARS-CoV-2 que tuvo lugar en abril del año 2021.
Conclusiones
El compromiso neurológico por el SARS-CoV-2 pro duce una gran variedad de síntomas, siendo el ACV el más frecuente. En más de la mitad de nuestros pacientes, el compromiso neurológico se presenta como primera manifes tación. La mortalidad en los pacientes con manifestaciones neurológicas está asociada a las complicaciones respiratorias y es mayor en los pacientes con ACV.
References
1. Mao L, Jin H, Wang M, Hu Y, Chen S, He Q, et al. Neurologic Manifestations of Hospitalized Patients with Coronavirus Disease 2019 in Wuhan, China. JAMA Neurol 2020;77(6):683-690. https://doi.org/10.1001/jamaneurol.2020.1127 [ Links ]
2. Zubair AS, McAlpine LS, Gardin T, Farhadian S, Kuruvilla DE, Spudich S. Neuropathogenesis and neurologic manifestations of the coronaviruses in the age of coronavirus disease 2019: A review. JAMA Neurol 2020;77(8): 1018-1027. https://doi.org/10.1001/jamaneurol.2020.2065 [ Links ]
3. Chen R, Wang K, Yu J, Howard D, French L, Chen Z, et al. The Spatial and Cell-Type Distribution of SARS-CoV-2 Receptor ACE2 in the Human and Mouse Brains. Front Neurol 2021;11. https://doi.org/10.3389/fneur.2020.573095 [ Links ]
4. Netland J, Meyerholz DK, Moore S, Cassell M, Perlman S. Severe acute re spiratory syndrome coronavirus infection causes neuronal death in the absence of encephalitis in mice transgenic for human ACE2. J Virol 2008;82(15):7264-7275. https://doi.org/10.1128/JVI.00737-08 [ Links ]
5. Zhou L, Zhang M, Wang J, Gao J. Sars-Cov-2: Underestimated damage to nervous system. Travel Med Infect Dis 2020;36. https://doi.org/10.1016/j.tmaid.2020.101642 [ Links ]
6. Baig AM, Khaleeq A, Ali U, Syeda H. Evidence of the COVID-19 Virus Targeting the CNS: Tissue Distribution, Host-Virus Interaction, and Proposed Neurotropic Mechanisms. ACS Chem Neurosci 2020; 11(7): 995-998. https://doi.org/10.1021/acschemneuro.0c00122 [ Links ]
7. Paniz-Mondolfi A, Bryce C, Grimes Z, Gordon RE, Reidy J, Lednicky J, et al. Central nervous system involvement by severe acute respiratory syndrome coronavirus-2 (SARS-CoV-2). J Med Virol 2020;92(7):699-702. https://doi.org/10.1002/jmv.25915 [ Links ]
8. Jamil S, Mark N, Carlos G, Cruz CSD, Gross JE, Pasnick S. Diagnosis and Management of COVID-19 Disease. Am J Respir Crit Care Med. 2020 May 15;201(10):P19-P20. doi: 10.1164/rccm.2020C1. PMID: 32223716. https://www.thoracic.org/patients/patient-resources/resources/covid-19-diagnosis-and-mgmt.pdf (Acceso 14 marzo, 2021). [ Links ]
9. Trejo-Gabriel-Galán JM. Stroke as a complication and prognostic factor of CO VID-19. Neurologia 2020;35(5):318-322. https://doi.org/10.1016/j.nrl.2020.04.015 [ Links ]
10. Frontera JA, Sabadia S, Lalchan R, Fang T, Flusty B, Millar-Vernetti P, et al. A Prospective Study of Neurologic Disorders in Hospitalized Patients With COVID-19 in New York City. Neurology 2021;96(4):e575-e586. https://doi.org/10.1212/WNL.0000000000010979 [ Links ]
11. Helms J, Kremer S, Merdji H, Clere-Jehl R, Schenck M, Kummerlen C, et al. Neurologic features in severe SARS-COV-2 infection. New Engl J Med 2020;382(23):2268-2270. [ Links ]
12. Hui DS, Joynt GM, Wong KT, Gomersall CD, Li TS, Antonio G, et al. Impact of severe acute respiratory syndrome (SARS) on pulmonary function, functional capacity and quality of life in a cohort of survivors. Thorax 2005;60(5):401-409. https://doi.org/10.1136/thx.2004.030205 [ Links ]
13. Fridman S, Bullrich MB, Jimenez-Ruiz A, Costantini P, Shah P, Just C, et al. Stroke risk, phenotypes, and death in COVID-19: Systematic review and newly reported cases. Neurology 2020;95(24): E3373-E3385. https://doi.org/10.1212/WNL.0000000000010851 [ Links ]
14. Han H, Yang L, Liu R, Liu F, Liu F, Wu K-, et al. Prominent changes in blood coagulation of patients with SARS-CoV-2 infection. Clin Chem Lab Med 2020;58(7):1116-1120. https://doi.org/10.1515/cclm-2020-0188 [ Links ]
15. Varga Z, Flammer AJ, Steiger P, Haberecker M, Andermatt R, Zinkernagel AS, et al. Endothelial cell infection and endotheliitis in COVID-19. Lancet Acta Med Colomb N0NN; 47 DOI: https://doi.org/10.36104/amc.N0NN.NN33 2020;395(10234):1417-1418. https://doi.org/10.1016/S0140-6736(20)30937-5 [ Links ]
16. Beyrouti R, Adams ME, Benjamin L, Cohen H, Farmer SF, Goh YY, et al. Characteristics of ischaemic stroke associated with COVID-19. J Neurol Neurosurg Psychiatry 2020;91(8):889-891. https://doi.org/10.1136/jnnp-2020-323586 [ Links ]
17. Lighter J, Phillips M, Hochman S, Sterling S, Johnson D, Francois F, et al. Obesity in patients younger than 60 years is a risk factor for COVID-19 hospital admission. Clin Infect Dis 2020;71(15):896-897. https://doi.org/10.1093/cid/ciaa415 [ Links ]
18. Tu TM, Seet CYH, Koh JS, et al. Acute Ischemic Stroke During the Convales cent Phase of Asymptomatic COVID-2019 Infection in Men. JAMA Netw Open. 2021;4(4):e217498. doi:10.1001/jamanetworkopen.2021.7498 [ Links ]
19. Zhang Y, Xiao M, Zhang S, Xia P, Cao W, Jiang W, et al. Coagulopathy and antiphospholipid antibodies in patients with covid-19. New Engl J Med 2020;382(17):E38. [ Links ]
20. Merad M, Martin JC. Pathological inflammation in patients with COVID-19: a key role for monocytes and macrophages. Nat Rev Immunol 2020; 20(6): 355-362. https://doi.org/10.1038/s41577-020-0331-4 [ Links ]
21. Deliwala S, Abdulhamid S, Abusalih MF, Al-Qasmi MM, Bachuwa G. Encephalopathy as the Sentinel Sign of a Cortical Stroke in a Patient Infected With Coronavirus Disease-19 (COVID-19). Cureus. 2020;12(5):e8121. https://doi.org/10.7759/cureus.8121. [ Links ]
22. Bekelis K, Kbekelis@gmail.com, Missios S, Ahmad J, Labropoulos N, Schirmer CM, Calnan DR, et al. Ischemic Stroke Occurs Less Frequently in Patients with COVID-19: A Multicenter Cross-Sectional Study. Stroke 2020:3570-3576. https://doi.org/10.1161/STROKEAHA.120.031217 [ Links ]
23. Wilcox KS, Vezzani A. Does brain inflammation mediate pathological outcomes in epilepsy? Adv Exp Med Biol. 2014;813:169-83.DOI: 10.1007/978-94-017-8914-1_14 [ Links ]
24. Barker-Haliski ML, Loscher W, White HS, Galanopoulou AS. Neuroinflamma tion in epileptogenesis: Insights and translational perspectives from new models of epilepsy. Epilepsia 2017;58:39-47. https://doi.org/10.1111/epi.13785 [ Links ]
25. Chen T, Wu D, Chen H, Yan W, Yang D, Chen G, et al. Clinical characteristics of 113 deceased patients with coronavirus disease 2019: Retrospective study. 8. https://doi.org/10.1136/bmj.m1091BMJ 2020;36 [ Links ]
26. Filatov A, Sharma P. Neurological complications of coronavirus disease (COVID-19): encephalopathy. Cureus. 2020; 12(3):e7352. DOI 10.7759/cureus.7352 [ Links ]
27. Trujillo Gittermann LM, Valenzuela Feris SN, von Oetinger Giacoman A. Relation between COVID-19 and Guillain-Barré syndrome in adults. Systematic review. Neurologia 2020;35(9):646-654. https://doi.org/10.1016/j.nrl.2020.07.004 [ Links ]
28. Anand P, Slama MCC, Kaku M, Ong C, Cervantes-Arslanian AM, Zhou L, et al. COVID-19 in patients with myasthenia gravis. Muscle Nerve 2020;62(2):254-258. https://doi.org/10.1002/mus.26918 [ Links ]
29. Barón-Sánchez J, Santiago C, Goizueta-San Martín G, Arca R, Fernández R. Smell and taste disorders in Spanish patients with mild COVID-19. Neurologia 2020;35(9):633-638. https://doi.org/10.1016/j.nrl.2020.07.006 [ Links ]
30. Porta-Etessam J, Matías-Guiu JA, González-García N, Gómez Iglesias P, Santos-Bueso E, Arriola-Villalobos P, et al. Spectrum of Headaches Associ ated With SARS-CoV-2 Infection: Study of Healthcare Professionals. Headache 2020;60(8):1697-1704. https://doi.org/10.1111/head.13902 [ Links ]
31. Desforges M, Le Coupanec A, Dubeau P, Bourgouin A, Lajoie L, Dubé M, et al. Human coronaviruses and other respiratory viruses: Underestimated opportunistic pathogens of the central nervous system? Viruses 2019;12(1). https://doi.org/10.3390/v12010014 [ Links ]
32. Sotoca J, Rodríguez-Álvarez Y. COVID-19-associated acute necrotizing my elitis. Neurol Neuroimmunol Neuroinflamm 2020;7(5). https://doi.org/10.1212/NXI.0000000000000803 [ Links ]
33. Poyiadji N, Shahin G, Noujaim D, Stone M, Patel S, Griffith B. COVID-19-associated acute hemorrhagic necrotizing encephalopathy: Imaging features. Radiology 2020;296(2):E119-E120. https://doi.org/10.1148/radiol.2020201187 [ Links ]
34. AlKetbi R, AlNuaimi D, AlMulla M, AlTalai N, Samir M, Kumar N, et al. Acute myelitis as a neurological complication of Covid-19: A case report and MRI findings. Radiol Case Rep 2020;15(9): 1591-1595. https://doi.org/10.1016/j.radcr.2020.06.001 [ Links ]
35. Zhou S, Jones-Lopez EC, Soneji DJ, Azevedo CJ, Patel VR. Myelin Oligodendrocyte Glycoprotein Antibody-Associated Optic Neuritis and Myelitis in COVID-19. J Neuroophthalmol 2020;40(3):398-402. https://doi.org/10.1097/WNO.0000000000001049 [ Links ]
36. Lopez-Leon S, Wegman-Ostrosky T, Perelman C, Sepulveda R, Re bolledo PA, Cuapio A, Villapol S. More than 50 Long-term effects of COVID-19: a systematic review and meta-analysis. medRxiv 2021. https://doi.org/10.1101/2021.01.27.21250617 [Preprint] [ Links ]
37. Khalili N, Haseli S, Bahrami-Motlagh H, Keshavarz E, Khalili N, Langroudi TF, et al. Neurologic Involvement in COVID-19: Radiologists' Perspective. Acad Radiol 2020;27(7):1051-1053. https://doi.org/10.1016/j.acra.2020.04.035 [ Links ]
Recibido: 15 de Junio de 2011; Aprobado: 21 de Abril de 2022











 texto em
texto em 


