Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804On-line version ISSN 2357-3791
Rev.Colomb.Quim. vol.34 no.1 Bogotá June 2005
Luis Enrique Cuca Suárez1Óscar Eliécer Bañol Vargas1
1Departamento de Química. Facultad de Ciencias. Universidad Nacional de Colombia. Bogotá, Colombia. Correo electrónico: lecucas@unal.edu.co
RESUMEN
Del extracto etanólico de madera de Beilschmiedia tovarensis fueron aisladas e identificadas dos nuevas chalconas: 2’, 6’-dihidroxi-4’-isopenteniloxi-3,4(3’’’ ’, 3’’ ’’-dimetilpirano) chalcona y 4,2’, 6’- trihidroxi-3’, 4’ metilenodioxi-3-isopentenilchalcona. El aislamiento y la purificación fueron realizados por técnicas cromatográficas. La elucidación estructural de estos compuestos se determinó mediante técnicas espectroscópicas (IR, RMN-1H, 13C y EM).
Además, fue probada la actividad biológica in vitro del extracto etanólico de madera, dando resultados significativos para actividad antimicrobiana en cepas Gram(+): Staphylococcus aureus y Enterococcus faecalis. Las pruebas de actividades antimalárica y antituberculosa dieron resultados negativos.
Palabras clave: Lauraceae, Beilschmiedia tovarensis, chalcona, actividad antimicrobiana.
ABSTRACT
Two new chalcones: 2’, 6’-dihydroxy-4-isopenteniloxy-3,4(3’’ ’,3’’ ’-dimethylpyrano) chalcone and 4,2’, 6’- trihydroxy-3’,4’-metilenodioxo-3-isopentenilchalcone were isolated from the wood ethanolic extract of Beilschmiedia tovarensis. Isolation was performed by chromatographic techniques. The elucidation of the structure of the compounds was accomplished by spectroscopic techniques (IR, NMR-1H, 13C and MS).
Also, the crude wood extract was tested in vitro for biological activity, having significant results for antimicrobial activity in Gram (+) stumps: Sataphylococcus aureus and Enterococcus faecalis. Test of antimalarial and antituberculosis activities gave negative results.
Key words: Lauraceae, Beilschmiedia tovarensis, chalcona, antimicrobial activity.
INTRODUCCIÓN
La especie Beilschmiedia tovarensis pertenece a la familia Lauraceae (1), abunda en la región del eje cafetero y se conoce comúnmente con el nombre de laurel blanco. Tradicionalmente se tienen diversos usos, que van desde la utilización por la incorruptibilidad de sus maderas como material para la construcción de enseres domésticos y viviendas, hasta el uso de las partes aéreas en infusión como paliativo en las enfermedades del colon y en trastornos digestivos (2).
El género Beilschmiedia comprende 11 especies (3) que se distribuyen ampliamente dada su fácil adaptabilidad a condiciones climáticas variadas; es posible encontrarlas en pisos térmicos entre los 450 a 2500 metros sobre el nivel del mar. La especie Beilschmiedia tovarensis no tiene ningún estudio fitoquímico precedente a éste.
PARTE EXPERIMENTAL
En la cromatografía de columna (CC) se usó sílica gel (Merck,40-63 µm), para CCD se emplearon cromatoplacas Merck de sílica gel HF254 de 0,3 mm de espesor. Los espectros IR fueron tomados en un equipo Perkin Elmer FTIR-1000 del Departamento de Química de la Universidad Nacional, sede Bogotá. Los espectros de RMN1H en un BRUKER-400, empleando CDCl3 como solvente, los desplazamientos químicos fueron referenciados con el patrón interno TMS (1H 400 MHz y 13C 100 MHz). Los espectros de masas (EMIE), 70 eV fueron tomados en un equipo MS 80 RFA de la Universidad de Wayne (Estados Unidos).
Material vegetal. Las muestras de madera de B. tovarensis fueron suministradas por el Centro Nacional de Investigaciones del Café (Cenicafe), recolectadas en la reserva del bosque de Las Hortensias (Dosquebradas- Risaralda), por el ingeniero forestal Carlos Mario Ospina Vallejo. Una muestra de herbario reposa en el Herbario de la Universidad de Antioquia con el número COP-458723.
Extracción y aislamiento
El material vegetal seco y molido, 3250 g de madera, fue extraído por maceración en frío con etanol (EtOH) al 96% obteniéndose 54,15 g del extracto. éste se fraccionó por cromatografía de columna empacada con sílica gel y eluida con C6H5CH3 incrementando la polaridad con AcOEt, hasta una mezcla de C6H5CH3-AcOEt (7:3). Se recolectaron siete fracciones, marcadas como M1 a M7. El análisis por IR de las anteriores fracciones revela la presencia de compuestos aromáticos en las fracciones M2, razón por la cual se decide proceder a su purificación; las demás se dejan para estudios posteriores.
La fracción M2 (5,31 g) fue sometida a CC eluyendo con C6H6-AcOEt de polaridad creciente (95:5 hasta 6:4) obteniéndose ocho fracciones que se rotularon M2-1 a M2-8. Después del estudio por CD, se continuaron purificando las fracciones M2-4 (102 mg) y M2-5 (43 mg). La fracción M2-4 se sometió a CC repetitiva eluyendo con C6H6 hasta obtener el compuesto 1 (28 mg). La fracción M2-5 se sometió a lavado con éter de petróleo y luego con MeOH para obtener el compuesto 2 (36 mg).
Evaluación de la actividad antimicrobiana
Para este test se siguió el protocolo estandarizado en el Instituto de Inmunología de Colombia (FIDIC) por el doctor José Manuel Lozano. Se prepara un patrón disolviendo de 15 a 20 mg del extracto a ensayar en un mL de etanol, y a partir de éste se hacen diluciones 1:1 y 1:10 en PBS (buffer de fosfato salino). De cada una de las diluciones anteriores se aplican 2 y 8 µL en pozos de siembra sobre agar-agarosa de baja electroendoósmosis. Posteriormente se siembran aproximadamente 40 millones de bacterias obtenidas por replicación y se adiciona tripticasa de soya como medio superior para luego proceder al incubado. La evaluación de la actividad antimicrobiana se hizo contra referentes de kanamicima (Km), tetraciclina (Tc), ampicilina (Amp) y contra blancos de etanol y PBS.
RESULTADOS Y DISCUSIÓN
El compuesto 1 es un aceite que dio positivo el ensayo de FeCl3, lo que reveló la presencia de OH fenólico.
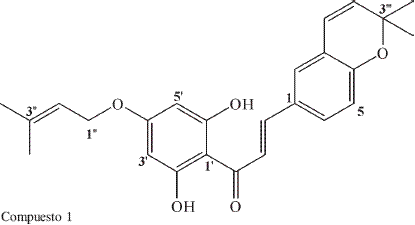
En el IR de 1 se observan señales en 3389 cm-1 (tensión OH), 1220 cm-1 (flexión CO) confirmativa de OH fenólico; señal en 1712 cm-1 (tensión C=O), 2853-2924 cm-1(tensión CH).
El experimento DEPT-135 (Tabla 1) permitió determinar que el compuesto 1 posee 10 grupos CH, 4CH3, 1CH2 y por diferencia con el espectro de RMN-13C se deducen 10 Carbonos cuaternarios; de estos últimos, cinco son oxigenados (dos de ellos hidroxilados). Lo anterior permitió deducir la fórmula molecular C25H26O5 para el compuesto 1. El EMIE del compuesto 1 muestra un ión molecular m/z 406, que confirma la fórmula condensada.
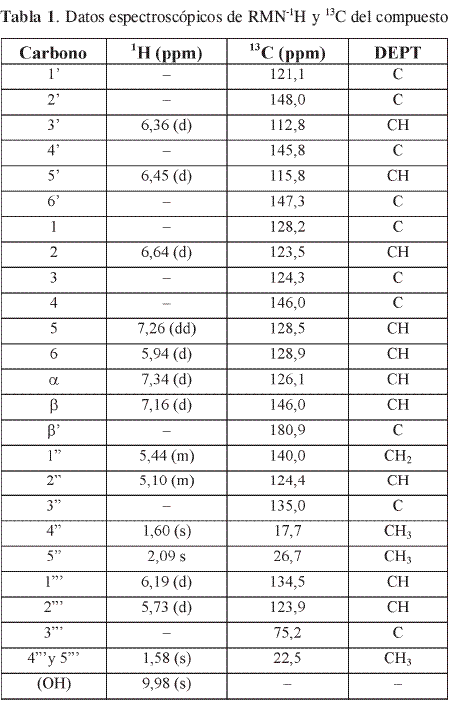
El espectro RMN-1H, muestra señales en δ 9,98 (s, 2H), por su desplazamiento químico corresponde a hidrógenos de grupos hidroxilo en posición orto a un carbonilo, también aparecen señales en δ 7,34 (d, J=17Hz,1H), δ 7,16 (d, J=17 Hz, 1H) las cuales son características de un sistema vinílico cuyos protones están en posición trans; lo anterior permite determinar que el núcleo básico del compuesto 1 es de una charcona; además, aparecen señales de un sistema AB que indican la presencia de un anillo tetra sustituido en δ 6,45 (d, J=3Hz,1H), δ 6,36 (d, J=3Hz,1H) que corresponden a protones sobre anillo aromático en posición meta; señales en δ 7,26 (dd, J=8 y 4Hz, 1H), δ 5,94 (d, J=8Hz, 1H) y δ 6,64 (d,J=4Hz, 1H) característico de un sistema AMXpara 3 protones sobre anillo aromático formando un sistema orto y meta, característico de un anillo trisustituido; señales de un anillo crománico (6) δ 6,19 (d, J=9Hz, 1H), δ 5,73 (d, J=9Hz, 1H), δ 1,58 (s, 6H); también se observaron señales características de un grupo isoprenilo unido a un oxígeno δ 5,44 (m, 2H), δ 5,10 (m, 1H), δ 1,60 (s, 3H) y δ 2,09 (s, 3H). El anterior análisis permite ubicar en el núcleo de la chalcona los dos sustituyentes establecidos, el isopreniloxi en la posición 4’ y un hidroxilo en 6’, el anillo crománico en la posición 3,4. Estas sustituciones se confirman por los fragmentos que muestra el EM con los fragmentos m/z 222 (47%) y m/z 194 (14%) característicos para el anillo A de la chalcona y m/z 213 (23%) y 185 (38%) característicos para el anillo B, obteniéndose la estructura del compuesto 1 que corresponde a 2’, 6’-dihidroxi-4’-isopreniloi-3,4 (3’ ’’, 3’’ ’ -dimetil pirano) chalcona. Las asignaciones espectroscópicas de RNM aparecen en la Tabla 1. Este compuesto no está reportado en la literatura como producto natural.
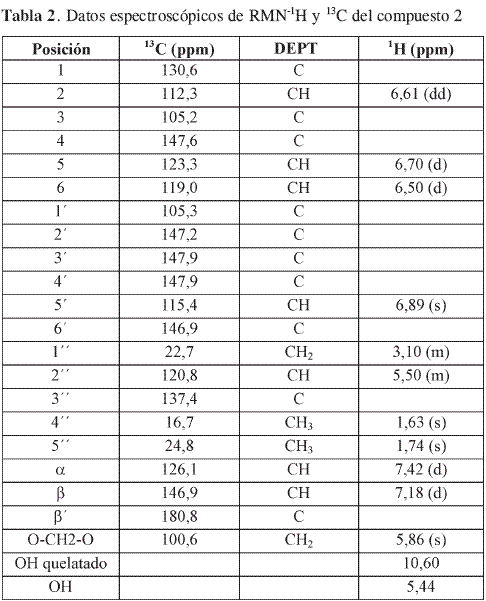
El compuesto 2 muestra en RMN-13C,21 carbonos; con el experimento DEPT- 135 se pueden detectar 2CH3, 2CH2, 7CH y por comparación con el 13C 10C cuaternarios; de estos últimos, seis son oxigenados (uno correspondiente C=O, 180,75 ppm) y cuatro no oxigenados lo cual permite proponer una fórmula condensada para el compuesto 2 de C21H17O6.
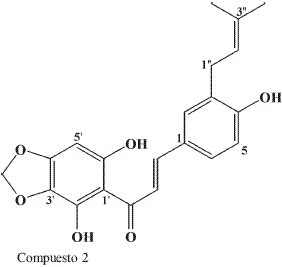
El espectro RMN-1H del compuesto 2 mostró las siguientes señales características de un compuesto tipo chalcona: δ 10,60 (s, 2H), δ 7,24 (d, J=16Hz, 1H), δ 7,18 (d, J=16Hz, 1H), en RMN-13C presenta una señal en 180 ppm característica de un grupo carbonilo. Además, el RMN-1H muestra señales de cuatro protones aromáticos, δ 6,85 (s, 1H), δ 6,70 (d, J=8,5Hz, 1H), un acoplamiento ortometa δ 6,61 (dd, J=8,5 y 2,2Hz, 1H) y un acoplamiento meta en δ 6,50 (d, J= 2,2Hz, 1H); señal en δ 5,86 (s, 2H) característica de un grupo mutilen-dioxi (O-CH2-O); δ 5,50 (m, 1H), δ 3,10 (m, 2H), δ 1,63 (s, 3H) y δ 1,74 (s, 3H) característicos de un grupo isoprenilo (7), señal en δ 5,44 (sancho, 1H) característico de un protón hidroxilico sobre anillo aromático.
El EMIE del compuesto 2 muestra un ión molecular m/z 368 y dos picos importantes característicos de una 2-hidroxichalcona, que permiten ubicar los sustituyentes; m/z 181 (39%) indica que en un anillo está el metileno dioxi y dos hidroxilos, y m/z 215 (18%) indica que en el otro está un grupo isopropilo y un hidroxilo.
El análisis anterior permite asignar el nombre del compuesto 2 como 4,2’, 6’- trihidroxi-3’, 4’-metilenodioxi- 3-isopentenilchalcona, compuesto que no está reportado en la literatura, las asignaciones espectroscópicas correspondientes se encuentran en la Tabla 2.
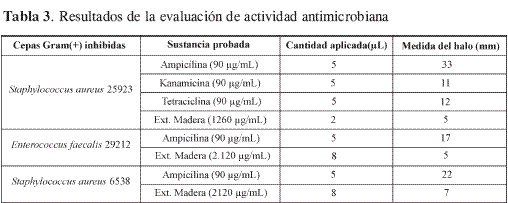
Resultados de la evaluación de la actividad antimicrobiana
La técnica de difusión radial permite, a través de la medición del halo de inhibición, estimar la capacidad bactericida o bacteriostática de un extracto o metabolito, el cual puede actuar lesionando la pared celular o inhibiendo la producción de sustancias vitales del microorganismo.
De las cepas Gram(-) probadas: Escherichia coli, cepa 25922; Salmonella tiphymurium, cepas EG-10627, 14028-S, MS-7953, ninguna fue inhibida por el extracto probado (madera de B. tovarensis).
El extracto etanólico de madera mostró actividad antimicrobiana frente a cepas Gram(+) Staphyloccus aureus (cepas 25923 y 6538) y Enterococcus fecalis (cepa 29212).Tabla 3
Agradecimientos: Agradecemos al Departamento de Química de la Universidad Nacional de Colombia, al doctor José Manuel Lozano del FIDIC, por su asesoría en los ensayos de actividad biológica; al ingeniero agrónomo Carlos Mario Ospina Vallejo y al doctor Gabriel Cadena del Centro Nacional de Investigaciones del Café Cenicafe por la consecución y el aporte de las muestras. Al doctor Ricardo Fierro por la toma de los espectros de RMN en el equipo de la Universidad Nacional, sede Bogotá, y al doctor Eduardo Palomino por la toma de los espectros de masas.
BIBLIOGRAFÍA
1. Gentry, H. (1993). A field Guide to the families and Genera of Woods plants of Northwest South América With Supplementary Notes on Herbaceous Taxa. Conservation International U.S.A., pp. 484-495. [ Links ]
2. Atta, A.; Alkofahi, A. (1998). Antinociceptive and anti-inflammatory effects of some Jordanian medicinal plant extracts. J. of Ethnopharmacology, 60, 117-124. [ Links ]
3. Instituto Nacional de Biodiversidad Missouri Botanical. (2002). Current Specimen List for Beilschmiedia tovarensis. [ Links ]
4. Gottlieb, O. (1992). Review article chemosystematics of the lauraceae. Phytochemistry, 11, 1537-1550. [ Links ]
5. Cogollo, A. (2003). Caracteres taxonómicos en Lauraceae. U. Antioquia. Medellín. Colombia, pp.35-37. [ Links ]
6. Tomazela, D.; Pupo, M.; Passador, E. (2000). Pyrano chalcones and a flavone from Neoraputia magnifica and their Tripanosoma cruzi glicosomal glyceraldehyde-3-phosphate dehydrogenase- inhibitory antivities. Phytochemistry. 55, 643-651. [ Links ]
7. Koorbanally, N.; Randrianarivelojosia, M.; Ufford, L. (2003). Chalcones from the seed of Cedrelopsis grevei (Ptaeroxylaceae). Phytochemistry. 62, 1225-1229. [ Links ]














