Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804On-line version ISSN 2357-3791
Rev.Colomb.Quim. vol.34 no.1 Bogotá June 2005
Geovanna Tafurt G.1 Jairo R. Martínez1 Elena E. Stashenko1
1Laboratorio de Cromatografía, Centro de Investigación en Biomoléculas (Cibimol), Escuela de Química, Facultad de Ciencias, Universidad Industrial de Santander. Correo electrónico: elena@tucan.uis.edu.co
RESUMEN
En este trabajo se evaluaron las actividades antioxidantes in vitro de los aceites esenciales de Origanum vulgare L., Rosmarinus officinalis L. y Coriandrum sativum L., en emulsiones de agua en aceite (Ag/Ac) y aceite en agua (Ac/Ag), sometidas al deterioro oxidativo por medio de la radiación ultravioleta A-visible (UVAVIS). En la emulsión de Ag/Ac (margarina), el aceite esencial de orégano presentó actividad antioxidante superior a la del cilantro y el romero, e incluso a la de la vitamina E, en concentraciones de 1, 10 y 20 g/kg. Se estableció además, que la acción antioxidante in vitro de los aceites esenciales de orégano y cilantro aumentaba con su concentración en la margarina. Por último, el aceite esencial de orégano presentó una acción protectora más baja en la emulsión de Ac/Ag.
Palabras clave: antioxidantes, aceites esenciales, emulsiones, radiación ultravioleta.
ABSTRACT
In this work, the antioxidant activities of Origanum vulgare L., Rosmarinus officinalis L. and Coriandrum sativum L. essential oils were evaluated in water in oil (W/O) and oil in water (O/W) emulsions subjected to oxidative deterioration caused by exposure to UVA-VIS radiation. O. vulgare L. essential oil exhibited a higher antioxidant protection followed by the C. sativum L. and R. officinalis L. essentials oils in W/O emulsion (margarine). The O. vulgare L. essential oil has an antioxidant activity higher than C. sativum L., R. officinalis and vitamin E at 1, 10 and 20 g/kg. Moreover, in vitro antioxidant activities of the O. vulgare L., and C. sativum L. increased with their concentration in W/O emulsion (margarine). Finally, O. vulgare L. essential oil antioxidant activity was lower in O/W emulsion.
Key words: Antioxidants, essentials oils, emulsions, ultraviolet radiation.
INTRODUCCIÓN
Aunque a menudo los efectos nocivos de los antioxidantes sintéticos sobre animales de experimentación no son extrapolables a la especie humana por las diferencias fisiológicas y anatómicas, los consumidores perciben que las sustancias naturales son más inocuas que las sintéticas y, por ello, las prefieren. Ante esto, y sabiendo que las sustancias naturales se utilizan desde la antigüedad, varios centros de investigación, entre ellos el Laboratorio de Cromatografía de la Universidad Industrial de Santander, vinculado al Centro de Investigación en Biomoléculas (Cibimol), están buscando, en las fuentes naturales, nuevas sustancias con propiedades antioxidantes, que puedan reemplazar a los antioxidantes sintéticos comúnmente utilizados; claro está, después de un estudio exhaustivo de sus propiedades fisicoquímicas y toxicológicas.
El objetivo de esta investigación fue evaluar la acción de los aceites esenciales de Origanum vulgare L., Rosmarinus officinalis L. y Coriandrum sativum L. contra el deterioro oxidativo causado por radiación UVA-VIS en emulsiones de Ag/Ac y Ac/Ag. Para llevar a cabo estos ensayos fue escogida una emulsión como sustrato lipídico porque, aunque estos aceites esenciales fueron evaluados por Contreras (1), Delgado (2), Salgar (3) y Fuentes (4) sobre aceites vegetales, la acción de las sustancias antioxidantes puede variar desde el efecto antioxidante hasta el pro-oxidante, de acuerdo con el medio de reacción utilizado, según indican los trabajos de Schwarz et al. (5), Jacobsen et al. (6), Mei et al. (7), Pekkarinen et al. (8), Van Ruth et al. (9), Foti, et al. (10), Huang et al. (11, 12), Frankel et al. (13) y Prior et al. (14), entre otros.
Según lo anterior, ya que la composición del medio de reacción incide sobre los valores observados de la actividad antioxidante se requiere, antes de aplicar una sustancia como posible antioxidante, evaluar la actividad del mismo en el sistema donde se desee aprovechar, de tal modo, que los resultados obtenidos permitirán confirmar si la actividad antioxidante se mantiene en diversos medios de reacción, de lo contrario, se requerirán ensayos adicionales a través de los cuales se busque la explicación de los efectos observados o nuevos antioxidantes que sean más efectivos en el sistema empleado. Es precisamente con base en este antecedente que se realizó el estudio de la actividad antioxidante en dos emulsiones con características diferentes para confirmar si la actividad antioxidante de los aceites esenciales de Origanum vulgare L., Rosmarinus officinalis L. y Coriandrum sativum , varía o se mantiene, con respecto a la actividad que presentaron en los aceites vegetales.
En esta investigación se determinó el hexanal como compuesto orgánico volátil generado, ya que según Makinen (15), Puertas (16) y Belitz et al. (17), entre otros, el hexanal es uno de los productos volátiles mayoritarios generados durante el deterioro oxidativo de ácidos grasos insaturados y, en particular, del ácido linoleico, el cual en este caso fue el ácido graso poliinsaturado que se encontró en mayor porcentaje en las muestras lipídicas estudiadas. Para establecer el efecto de la adición de los aceites esenciales a las emulsiones se determinó el hexanal generado en el sistema después de ser sometido al deterioro oxidativo acelerado con radiación UVA-VIS, en la forma de su derivado hidrazónico, mediante la técnica de cromatografía de gases de alta resolución acoplada a un micro detector de captura de electrones, HRGC-ECD, según la metodología descrita por Stashenko et al. (18, 19).
PARTE EXPERIMENTAL
Reactivos y materiales
La vitamina E (97%), la pentafluorfenilhidracina, PFPH (97%) y el hexanal (98%) fueron adquiridos de Aldrich Chemical Co (Milwaukee, WI, EE.UU.); el metanol y el hexano, grado HPLC, se obtuvieron de Mallinckrodt (Phillipsburg, NJ, EE.UU.); el butilhidroxianisol BHA (> 98,5%), el sulfato de sodio anhidro, grado analítico, y el dodecilsulfato de sodio, SDS (> 99%), se adquirieron de Merck-Schuchardt (Hohenbrum, Alemania). El L(+)-ácido ascórbico, grado analítico, se obtuvo de Merck (Darmstadt, Alemania).
Las plantas utilizadas para esta investigación, cultivadas en la Corcova (Tona, Santander), fueron adquiridas en el mercado local y posteriormente identificadas y clasificadas en el Herbario de la UIS por el profesor Humberto García de la siguiente forma: Rosmarinus officinalis L. con número de inclusión 11154 y número de colección 1, Coriandrum sativum L. con número de inclusión 11155 y número de colección 2, y Origanum vulgare L. con número de inclusión 11156 y número de colección 3.
Los aceites esenciales fueron aislados por hidrodestilación (HD), a partir de aproximadamente 2 kg del material vegetal fresco, finamente picado, depositado en un balón de destilación de dos bocas de 6 L con 500 mL de agua destilada. Después de dos horas de destilación, se recogieron los componentes volátiles condensados (aceite esencial), usando un baño refrigerante Fisher Scientific (Isotemp, Refrigerated Circulator, Model 901).
Preparación de muestras
Se usaron dos emulsiones como sustratos lipídicos para evaluar la actividad antioxidante in vitro de los aceites esenciales, junto con la vitamina E y el ácido ascórbico. La primera emulsión se preparó mezclando aceite vegetal en agua y empleando como tensoactivo SDS (emulsión de Ac/Ag) y la segunda fue una margarina comercial (emulsión de Ag/Ac), adquirida en el mercado local (Bucaramanga, Colombia). El aceite vegetal y la margarina se escogieron entre varias muestras comerciales con base en el contenido más alto de ácidos grasos insaturados, en particular, del ácido graso linoleico. Las mezclas entre los sustratos lipídicos y los antioxidantes se prepararon como se describe a continuación:
Emulsión de Ag/Ac: los aceites esenciales, la vitamina E y el ácido ascórbico se mezclaron cada uno por separado con la margarina comercial hasta obtener concentraciones de 1, 5, 10 y 20 g/kg. Las mezclas así obtenidas se calentaron hasta fusión y se enfriaron. Luego se homogeneizaron a 23000 rpm (1 min) en un agitador Ultraturrax (Labortechnik Staufen, Alemania). Las emulsiones de Ag/Ac utilizadas como blanco se prepararon de igual forma a la descrita anteriormente, pero sin la adición de aceite esencial, vitamina E o ácido ascórbico.
Emulsión de Ac/Ag: la mezcla de aceite: agua se realizó en una relación 4:1, colocando la fase aceitosa sobre la acuosa y mezclando en el agitador Ultraturrax a 23000 rpm (1 min). La fase acuosa se elaboró previamente, por disolución de SDS al 7% (p/p, sobresaturada). En la preparación de la fase aceitosa, los aceites esenciales y la vitamina E se mezclaron cada uno por separado con aceite vegetal, hasta obtener concentraciones de 1, 5, 10 y 20 g/kg. En el caso particular del ácido ascórbico, éste se adicionó a la fase acuosa de tal modo que su concentración en la emulsión correspondió a 0,8, 4,0, 8,0 ó 16,0 g/kg. Las emulsiones de Ac/Ag utilizadas como blanco se prepararon de igual forma a la descrita anteriormente, pero sin la adición de aceite esencial, vitamina E o ácido ascórbico.
Deterioro oxidativo
Para estudiar el deterioro oxidativo los sustratos lipídicos se depositaron (0,10 ± 0,01 g) en tubos cónicos de 1,5 mL de poli(propileno) (Brand, Postfach, Wertheim, Alemania). Las muestras fueron dispuestas en la región intermedia entre un refrigerante y 6 lámparas fluorescentes de 16 x 225,1 mm y 6 vatios de potencia, ubicadas de forma circular en el interior de un fotorreactor UVA-VIS (λ:334-436 nm), construido en el laboratorio,y se irradiaron durante 24 horas.
ANÁLISIS CROMATOGRÁFICO
Análisis del hexanal
El hexanal, producto final de oxidación del ácido linoleico, generado en las muestras irradiadas, se extrajo en forma de su derivado hidrazónico, PFPH-hexanal, según la metodología descrita por Stashenko et al. (18, 19). Para la obtención y extracción de este derivado se adicionaron a las muestras irradiadas metanol (0,1 mL) y una solución de PFPH (4000 ppm) en hexano (1 mL). Después de agitar durante 1 min a 2500 rpm, la mezcla se centrifugó durante 5 min; de la fase orgánica obtenida se extrajeron 900 µL, los cuales se evaporaron hasta 250 µL. Sobre este residuo se adicionó metanol (1 mL), con el objeto de extraer el derivado formado y precipitar la grasa presente en el extracto. Una vez más la mezcla se centrifugó, y el líquido sobrenadante se extrajeron 900 µL, de los cuales se inyectó 1,0 µL al cromatógrafo de gases para su respectivo análisis. La cuantificación del derivado PFPH-hexanal se realizó en un cromatógrafo de gases HP (Hewlett-Packard, Palo alto-California) 6890 PLUS con control electrónico de presión, dotado de un microdetector de captura de electrones (µ-ECD, 63Ni), un inyector automático HP 7683, un puerto de inyección split/splitless y un sistema de datos HP Chemstation HP Rev. A. 06.03 [509]. La identificación del PFPH-hexanal en las muestras irradiadas se realizó con base en su tiempo de retención, comparándolo con el de la hidrazona patrón.
Análisis de aceites esenciales
Los aceites esenciales se analizaron en un cromatógrafo de gases de alta resolución Agilent Technologies (Palo alto-California) modelo 6890 Series PLUS, acoplado a un detector selectivo de masas (MSD) Agilent Technologies 5973 Network, con sistema de datos HP MS ChemStation G17001DA, según la metodología descrita por Contreras (1), Delgado (2), Salgar (3) y Puertas (16). La ionización en el MSD se realizó mediante impacto de electrones, con energías medias de 70 eV, a una temperatura de 230 °C en la cámara de ionización, y con un analizador másico cuadrupolar operado en el modo full scan, haciendo barridos desde la masa nominal 35 hasta 300 D. Para la identificación de compuestos se recurrió a las bibliotecas de espectros de masas NBS75K y Wiley 138K. Se empleó una columna capilar DB-1 (J & W Scientific Folsom, CA, USA) de 60 m (L) x 0,25 mm (D.I.), de sílice fundida con fase estacionaria apolar de 100%-poli(dimetilsiloxano) de 0,25 m (df) de grosor, entrecruzada e inmovilizada sobre la pared del capilar de sílice.
Análisis de la actividad antioxidante
La actividad antioxidante (AA), de los aceites esenciales, la vitamina E y del ácido ascórbico, en las emulsiones analizadas, se evaluó mediante la cuantificación del hexanal (aumento de su concentración), después del deterioro oxidativo causado por la radiación UVA-VIS, según la metodología descrita por Stashenko et al. (18, 19). La siguiente ecuación fue utilizada para calcular la AA:
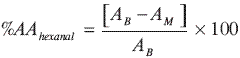
donde:
AB: área del pico cromatográfico del hexanal en el blanco.
AM: área del pico cromatográfico del hexanal en la muestra, sometida a la oxidación.
RESULTADOS Y DISCUSIÓN
Caracterización de los aceites esenciales
La identificación de los componentes presentes en los aceites esenciales, extraídos por HD, se llevó a cabo con base en los índices de Kováts (20, 21), el análisis de sus espectros de masas y por su comparación con los espectros en las bases de datos.
En el aceite esencial de orégano, obtenido por HD con el rendimiento de 0,6%, los siguientes fueron compuestos mayoritarios: carvacrol (51,4%), p-cimeno (10,0%), trans-β-cariofileno (6,4%) y α-bergamoteno (3,1%). Estos compuestos también se encontraron en los AE de orégano estudiados por Puertas (16), Salgar (3) y D’Antuono et al. (21).
En el aceite esencial de cilantro, obtenido con el rendimiento de 0,1%, se encontraron como compuestos mayoritarios los siguientes: n-decanol (15,2%), decanal (12,9%), (E)-2-decenal (8,5%), undecanal (3,9%) y nonano (3,4%). Esta composición fue similar a la reportada por Contreras (1), Delgado (2) y Potter (23). A pesar de las similitudes halladas, los estudios realizados por Puertas (16), Salgar (3) y Lamparsky et al. (24), sobre esta planta revelan, que el linalol es el componente principal de la mayoría de los AE obtenidos de cilantro. Con respecto a esto último, Lassanyi et al. (25, 26) explicaron que las diferencias encontradas en la composición del aceite de cilantro se debían a la edad y la fisiología de la planta, las cuales influían sobre la cantidad y la ubicación de los compuestos en sus tejidos.
El rendimiento de la extracción del aceite esencial de romero fue de 0,7%. El alcanfor (28,7%), eucaliptol (15,9%), α-pineno (10,4%), canfeno (7,6%) y β-pineno (5,1%) fueron los compuestos mayoritarios. Los mismos compuestos también se reportaron en los estudios realizados por Contreras (1), Puertas (16), Salgar (3), Fournier et al. (27) y Rosua et al. (28), entre otros.
Las condiciones agroecológicas del cultivo y los parámetros operacionales del proceso de extracción son las variables que inciden sobre la composición y el rendimiento de los aceites esenciales. Según indican Bandoni (29) y D’Antuono et al. (21), las variaciones en las condiciones agroecológicas inducen cambios morfológicos, histológicos y fisiológicos en la planta, mientras que la eficiencia de la HD está relacionada con los parámetros operacionales, tales como tiempo, temperatura de la extracción y cantidad de agua empleada, entre otros. Adicionalmente, teniendo en cuenta que los aceites esenciales obtenidos mediante HD, normalmente presentan notas más fuertes y un color más oscuro con respecto a los producidos por otros métodos, se recomienda el uso suplementario de presiones reducidas, lo cual puede contribuir al no deterioro de los constituyentes del aceite esencial durante la extracción.
Actividad antioxidante
En la Tabla 1 se indican las actividades antioxidantes de las sustancias naturales y sintéticas evaluadas en la margarina comercial. El aceite esencial de orégano presentó mayor protección contra la oxidación lipídica, seguido de los de cilantro y romero. Además, se observó que la acción antioxidante de los aceites esenciales de orégano y cilantro aumentó proporcionalmente a su concentración en la margarina. Los resultados reportados por Contreras (1), Delgado (2), Salgar (3) y Fuentes (4) sobre la actividad antioxidante de los aceites esenciales de cilantro, romero y orégano en otros sistemas modelo coinciden con los presentados en este estudio y muestran que estos aceites efectivamente inhiben el deterioro oxidativo acelerado.

En cuanto al modo de acción de las sustancias antioxidantes evaluadas en este trabajo se conoce, por ejemplo, según lo mostrado por Makinen (15), Pokorny et al. (30) y Belitz et al. (17), que los tocoferoles actúan a través de mecanismos de ruptura de cadena atrapando radicales alquilo, alcoxilo y peroxilo, y originan a su vez especies radicalarias antioxidantes, estabilizadas por resonancia y poco reactivas. Adicionalmente, la disminución de la actividad antioxidante de los tocoferoles se debe a que los radicales tocoferoxilo generados pueden ocasionar el deterioro de los ácidos grasos al inducir la reducción de los metales presentes en el medio. Los metales reducidos son más activos en la descomposición homolítica de hidroperóxidos hasta radicales alcoxilo y, a su vez, tales radicales también pueden promover las reacciones en cadena.
Makinen (15) y Gutteridge (31), entre otros, exponen que el ácido ascórbico actúa como antioxidante de ruptura de cadena, ‘‘barredor’’ de especies reactivas de oxígeno y quelador de iones metálicos. Además, tiene la habilidad de interactuar sinérgicamente con el radical tocoferoxílo, reduciéndolo. Cuando el anión-radical del ácido ascórbico se encuentra en un sistema in vivo es reducido por los sistemas enzimáticos NADP o NADPH. Además de las propiedades antioxidantes, se conoce que el ácido ascórbico puede actuar como pro-oxidante en la presencia de iones metálicos y en altas concentraciones de ascorbato.
El mecanismo de la acción antioxidante de los aceites esenciales no se conoce con toda certeza. Sin embargo, en un estudio realizado por Fotti et al. (32), se sugiere que el γ-terpineno, presente en varios aceites esenciales, actúa como antioxidante al retardar la peroxidación del ácido linoleico, porque los radicales peroxilo formados a partir de éste (HOO.) reaccionan rápidamente con los radicales peroxilo del ácido linoleico (LOO.). De tal forma que se disminuye la concentración de los radicales peroxilo del ácido linoleico (LOO.) en el estado estacionario. Adicionalmente, autores como Puertas et al. (33), Choi et al. (34) y Williams et al. (35) han mostrado que algunos aceites esenciales y sus fitoconstituyentes poseen la capacidad de atrapamiento del catión- radical 2,2’-azinobis- (3-etilbenzotiazolina- ácido sulfónico) ABTS+ y del radical 2,2-difenil-1-picrilhidracilo DPPH igual o superior a la de antioxidantes sintéticos como la vitamina E, el trolox y el ácido ascórbico. En el estudio realizado por Williams et al. (35) se presenta un esquema de reacción donde el eugenol (fitoconstituyente de varios aceites esenciales) atrapa el radical DPPH de manera similar a la de la vitamina E. Adicionalmente, Puertas et al. (33) mostraron que los aceites esenciales de orégano y romero poseen una capacidad alta para el atrapamiento del radical ABTS+, en comparación con el aceite esencial de cilantro.
En resumen, la actividad antioxidante de los aceites esenciales de orégano, cilantro y romero se puede atribuir a tres razones principales: 1) la presencia del fenol carvacrol, que puede ejercer actividad similar al eugenol, BHA, BHT y vitamina E (30, 33, 35). ésta es la causa fundamental por la que el aceite esencial de orégano presenta actividad antioxidante; 2) la presencia de hidrocarburos antioxidantes monoterpenos y/o sesquiterpenos, que también pueden actuar como antioxidantes a través de mecanismos similares a los propuestos por Fotti et al. (32) para el γ-terpineno. éste es el motivo por el cual se considera que los aceites esenciales que no contienen fenoles, como los de cilantro y romero, presentan actividad antioxidante; y 3) el efecto sinérgico (30, 36) entre los componentes del aceite esencial y la margarina. Es decir, que algunos compuestos que no presentan actividad antioxidante notoria, al ser mezclados, pueden aumentar la capacidad de las moléculas que sí son antioxidantes. Este fenómeno de sinergia pudo presentarse en los AE de orégano y cilantro, mientras que en el de romero no, siendo una de las razones probables por la que la actividad en este aceite esencial no aumentó con la concentración. Finalmente, el efecto sinérgico y la presencia del fenol carvacrol pueden ser las razones fundamentales por las que el AE de orégano en concentraciones de 10 y 20 g/kg en la margarina presenta actividad antioxidante superior a la del ácido ascórbico y de la vitamina E.
La determinación de la actividad antioxidante del aceite esencial de orégano en la margarina y en la emulsión Ac/Ag con dodecilsulfato de sodio, SDS, se realizó por medio de la cuantificación del hexanal generado. Los resultados obtenidos en estas pruebas, que se muestran en la Tabla 2, indican que este aceite esencial protege tanto a la margarina como a la emulsión de Ac/Ag contra el deterioro oxidativo causado por la radiación UVA-VIS. Sin embargo, la actividad antioxidante del aceite esencial de orégano presenta notorias diferencias entre las emulsiones evaluadas. Así, por ejemplo, para un contenido de aceite esencial de 10 g/kg se determinaron actividades antioxidantes de 40 ± 3,4 y 91 ± 5,1% en la emulsión de Ac/Ag y en la margarina, respectivamente. Estas variaciones han sido explicadas en varios artículos científicos (5-14). Los estudios realizados por Schwarz et al. (5) indican que se pueden presentar variaciones al evaluar las actividades antioxidantes en emulsiones Ac/Ag y aceites, ya que la sustancia activa como antioxidante, de acuerdo con las interacciones físicas y químicas que posea con el resto de sustancias presentes en el medio, puede desplazarse o ubicarse en cualquiera de las fases e incluso en la interfase, de tal modo que los antioxidantes polares protegen preferencialmente a los aceites, mientras que los antioxidantes apolares preservan mayoritariamente a las emulsiones de Ac/Ag. En el caso de emulsiones de Ag/Ac, como las margarinas, se prevé que la acción antioxidante será similar a la encontrada en el aceite, lo cual es evidenciado al comparar los resultados obtenidos en este estudio con los reportados por Contreras (1), Delgado (2), Puertas (16), Salgar (3) y Fuentes (4). Según lo reportado por McClements et al. (36), las variaciones pequeñas encontradas al realizar esta comparación se deben, entre otros factores, a diferentes fuentes y procedimientos para acelerar la oxidación lo cual, eventualmente, no sólo puede cambiar el mecanismo de oxidación, sino la manera de acción de los antioxidantes.
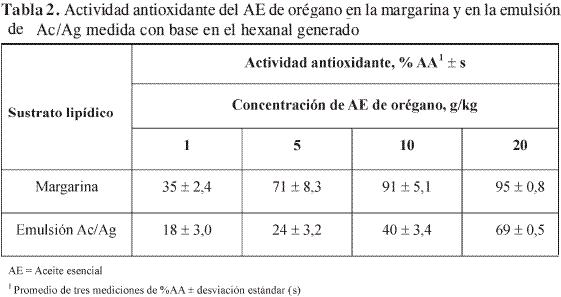
En resumen, según indican los trabajos de Schwarz et al. (5), Jacobsen et al. (6), Mei et al. (7), Pekkarinen et al. (8), Van Ruth et al. (9), Foti et al. (10), Huang et al. (11, 12), Frankel et al. (13), Prior et al. (14) y McClements et al. (36), las diferencias observadas entre los valores de la actividad antioxidante del aceite esencial de orégano en la margarina y en la emulsión de Ac/Ag pueden ser atribuidas a los siguientes factores: 1) variación en el contenido de oxígeno introducido durante la homogeneización de las muestras a altas velocidades; 2) la naturaleza y la cantidad de antioxidantes presentes en los productos comerciales (β-carotenos, ter-butilhidroxiquinona, butil-hiroxianisol, tocoferoles, etc); 3) los componentes de la fase acuosa (aminoácidos, proteínas, surfactantes, ácidos, bases y buffers); 4) las características interfaciales, tales como la carga eléctrica y las barreras física y química. Todos los factores mencionados influencian la localización y la acción de las sustancias protectoras presentes en el aceite esencial, y las de los pro-oxidantes que se encuentran en el medio o se generan durante la reacción de oxidación.
CONCLUSIONES
Se evaluó la actividad antioxidante de la vitamina E, el ácido ascórbico y los aceites esenciales de orégano, romero y cilantro en las emulsiones de Ag/AC (margarina) y de Ac/Ag, a través de la cuantificación del hexanal, en un sistema de reacción donde el deterioro oxidativo se aceleró por medio de la radiación UVA-VIS.
Los aceites esenciales de cilantro, orégano y romero, la vitamina E y el ácido ascórbico exhibieron diferentes efectos antioxidantes en la emulsión de Ag/Ac (margarina). Entre los aceites esenciales estudiados, el de orégano presentó mayor protección, seguido por los de cilantro y romero.
En la emulsión de Ag/Ac el aceite esencial de orégano exhibió actividad antioxidante mayor que la de la vitamina E para concentraciones de 1, 10 y 20 g/kg. Además, se determinó que la acción antioxidante de los aceites esenciales de orégano y cilantro aumentaba proporcionalmente con su concentración en la margarina.
Se estableció que los valores de la actividad antioxidante del aceite esencial de orégano fueron diferentes al ser evaluados en la emulsión de Ag/Ac o en la de Ac/Ag, siendo mayor la protección brindada a la margarina.
Agradecimientos: El presente trabajo se realizó gracias al apoyo financiero de Colciencias (Proyecto 1102-115-96).
BIBLIOGRAFÍA
1. Contreras, N. (2002). Evaluación de la actividad antioxidante in vitro de algunos aceites esenciales en el proceso de peroxidación lipídica inducida por la radiación ultravioleta. Tesis de maestría. Química. Universidad Industrial de Santander. Facultad de Ciencias. Bucaramanga. [ Links ]
2. Delgado, W. A. (2002). Evaluación en dos sistemas lipídicos modelo de la actividad antioxidante in vitro de tres aceites esenciales extraídos de plantas pertenecientes a la familia Umbelliferae. Tesis de maestría. Química. Universidad Industrial de Santander. Facultad de Ciencias. Bucaramanga. [ Links ]
3. Salgar, W. (2002). Evaluación en dos sistemas lipídicos modelo de la actividad antioxidante in vitro de aceites esenciales extraídos de las plantas pertenecientes a la familia Labiatae. Tesis de maestría. Química. Universidad Industrial de Santander. Facultad de Ciencias. Bucaramanga. [ Links ]
4. Fuentes, H. V. (1999). Monitoreo de la termodegradación de los ácidos grasos en los aceites vegetales de consumo humano, por medio de la cromatografía de gases de alta resolución y evaluación in vitro de la actividad antioxidante de productos naturales. Tesis de grado. Química. Universidad Industrial de Santander. Facultad de Ciencias. Bucaramanga. [ Links ]
5. Schwarz, K.; Huang, S. W.; German, J. B.; Tiersch, B.; Hartmann, J.; Frankel E. N. (2000). Activities of antioxidants are affected by colloidal properties of oil in water and water- in-oil emulsions and bulk oils. J. Agric. Food Chem. 48, 4874. [ Links ]
6. Jacobsen, C.; Schwarz, K.; Stockmann,H.; Meyer, A. S.; Adler-Nissen, J. (1999). Partitioning of selected antioxidants in mayonnaise. J. Agric. Food Chem. 47, 3601. [ Links ]
7. Mei, L.; Mcclements, D. J.; Decker, E. A. (1999). Lipid oxidation in emulsions as affected by charge status of antioxidants and emulsion droplets. J. Agric. Food Chem. 47, 2267. [ Links ]
8. Pekkarinen, S.; Stockmann, H.; Schwarz, K.; Heinonen, I. M.; Hopia, A. I. (1999). Antioxidant activity and partitioning of phenolic acids in bulk and emulsified methyl linoleate. J. Agric. Food Chem. 47, 3036. [ Links ]
9. Van Ruth, S. M.; Roozen, J. P.; Posthumus, M. A.; Jansen, F. J. H. M. (1999). Volatile composition of sunflower oil-in-water emulsions during initial lipid oxidation: influence of pH. J. Agric. Food Chem. 47, 4365. [ Links ]
10. Foti, M.; Piattelli, M.; Baratta, M. T.; Ruberto, G. (1996). Flavonoids, coumarins, and cinnamic acids as antioxidants in a micellar system. Structure-activity relationships. J. Agric. Food Chem. 44, 497. [ Links ]
11. Huang, S. W.; Hopia, A.; Schwarz, K.; Frankel, E. N.; German, J. B. (1996). Antioxidant activity of α-tocopherol and trolox in different lipid substrates: bulk oil vs oil in water emulsions. J. Agric. Food Chem. 44, 444. [ Links ]
12. Huang, S. W.; Frankel, E. N.; Schwarz, K.; German, J. B. (1996). Effect of pH on antioxidant activity of α-tocopherol and trolox in oil-in-water emulsions. J. Agric. Food Chem. 44, 2496. [ Links ]
13. Frankel, E. N.; Huang, S. W.; Kanner, J. (1994). Interfacial phenomena in the evaluation of antioxidants: bulk oil vs emulsions.J. Agric. Food Chem. 42, 1054. [ Links ]
14. Pryor, W. A.; Strickland, T.; Church, D. (1988). Comparison of the efficiencies of several natural and synthetic antioxidants in aqueous sodium dodecyl sulfate micelle solutions. J. Am. Chem. Soc. 110, 2224. [ Links ]
15. Makinen, M. (2002). Lipid hydroperoxides: effects of tocopherols and ascorbic acid on their formation and descomposition. Academic dissertation. University of Helsinki. Helsinki. Online: http://ethesis.helsinki.Fi/julkaisut/maa/skemi/vk/makinen/lipidhyd.pdf [ Links ]
16. Puertas, M. (2002). Desarrollo de un método analítico para la determinación de compuestos carbonílicos volátiles y la evaluación de la posible actividad antioxidante in vitro de algunos productos naturales y sintéticos. Tesis de doctorado. Química. Universidad Industrial de Santander. Facultad de Ciencias. Bucaramanga. [ Links ]
17. Belitz, H. D.; Grosch, W. (1999). Food Chemistry. Segunda edición. Springer-Verlag. Berlín. [ Links ]
18. Stashenko, E. E.; Ferreira, M. C.; Sequeda, L. G.; Mateus, A.; Cervantes, M.; Martínez, J. R. (1997). Desarrollo de un método para monitoreo de la degradación oxidativa en lípidos y evaluación de la actividad antioxidante de productos naturales. Arte y Ciencia Cosmética. 8, 20. [ Links ]
19. Stashenko, E. E.; Ferreira, M. C.; Sequeda, L. G.; Martínez, J. R.; Wong, J. W. (1997). Comparison of extraction methods and detection system in the gas chromatographic analysis of volatile carbonyl compounds. J. Chromatogr. A. 779, 360. [ Links ]
20. Kovats, E. (1965). Gas chromatographic characterization of organic substances in the retention index system. Advan. Chromatogr. 1, 229. [ Links ]
21. Jenings, W.; Shibamoto, T. (1980). Qualitative analysis of flavor and fragrances volatiles by capillary glass chromatography. Primera edición. Academic Press, Inc. New York. [ Links ]
22. D´antuono, L. F.; Galletti, G. C.; Bocchini, P. (2000). Variability of essential oil content and composition of Origanum vulgare L. Populations from a north mediterranean area (Liguria region, northern italy). Ann. Bot. 86, 471. [ Links ]
23. Potter, T. L. (1996). Essential oil composition of cilantro. J. Agric. Food Chem. 44, 1824. [ Links ]
24. Lamparsky, D.; Klimes, I. (1988). Heterocyclic trace components in the essential oil of Coriander. Perfum. Flav. 13, 17. [ Links ]
25. Lassanyi, Zs.; Lorincz, C. (1970). Test on terpenoids presents in parts of Coriandrum sativum l. III. Histology of the developing structures of Coriandrum sativum l. var "luc" and properties of volatile oils canals.Acta Agron. Acad. Scient. Hung. 19, 25. [ Links ]
26. Lassanyi, Zs.; Lorincz, C. (1967). Test on terpenoids presents in parts of Coriandrum sativum l. I. Thin-layer chromatographic examination of the volatile oil of pericarpium and seedling of the "lucs" variety . Acta Agron. Acad. Scient. Hung. 16, 95. [ Links ]
27. Fournier, G.; Habib, J.; Reguigui, A.; Safta, F.; Guetari, S.; Chemli, R. (1989). Etude de divers echantillons d´huile essentielle de romarin de tunisie. Plant. Medic. Phytoth. 23, 180. [ Links ]
28. Rosua, J. L.; García-Granados, A. (1987). Analyse des huiles essentielles d´especes du genre Rosmarinus l. et leur interet entant que caractere taxonomique. Plant. Med. Phythotherap. 21, 138. [ Links ]
29. Bandoni A. (2000). Los recursos vegetales aromáticos en Latinoamérica. CYTED. Editorial Universidad Nacional de la Plata. La Plata. [ Links ]
30. Pokorny, J.; Yanishlieva, N.; Gordon, M. (2001). Antioxidants in food: practical applications. CRC Press, Woodhead Publishing Limited. Cambridge. [ Links ]
31. Gutteridge, J. M. C.; Halliwell, B. (1994). Antioxidants in nutrition, health and disease. Oxford University Press Inc. New York. [ Links ]
32. Foti, M.; Ingold, K. U. (2003). Mechanism of inhibition of lipid peroxidation by γ-terpinene, an unusual and potentially useful hydrocarbon antioxidant. J Agric. Food Chem. 51, 2758. [ Links ]
33. Puertas, M. A.; Hillebrand, S.; Stashenko, E.; Winterhalter, P. (2002). In vitro radical scavenging activity of essential oils from columbian plants and fractions from oregano (Origanum vulgare l.) essential oil. Flavour Fragr. J. 17, 380. [ Links ]
34. Choi, H. S.; Song, H. S.; Ukeda, H.; Sawamura, M. (2000). Radical- scavenging activities of citrus essential oils and their components: detection using 1,1-diphenyl-2- picrylhydrazyl. J. Agric. Food Chem. 48, 4156. [ Links ]
35. Williams, W. B.; Covelier, M. E.; Berset, C. (1995). Use of a free radical method to evaluate antioxidant activity. Lebensm.-Wiss. U.-Technol. 28, 25. [ Links ]
36. McClements, D. J.; Decker, E. A. (2000). Lipid oxidation in oil-in-water emulsions: impact of molecular environment on chemical reactions in heterogeneous food systems. Con. Rev. Food Sci. 65, 1270. [ Links ]














