Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804On-line version ISSN 2357-3791
Rev.Colomb.Quim. vol.34 no.1 Bogotá June 2005
Adrián Mauricio Vargas1ángela Patricia Rivera Camelo2Carlos Eduardo Narváez Cuenca3
1Programa de Ingeniería de Alimentos, Universidad de la Amazonia, Florencia-Caquetá, Colombia.
2Facultad de Ciencias, Universidad de la Amazonia, Florencia-Caquetá, Colombia.
3Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia, Bogotá, Colombia.Correo electrónico: cenarvaezc@unal.edu.co
RESUMEN
Con el propósito de conocer la evolución de algunos componentes antioxidantes de la pulpa de arazá durante el almacenamiento de los frutos, éstos se cosecharon en su madurez fisiológica y se almacenaron durante seis días a 25 °C. Se encontró que los frutos presentan su máximo climatérico luego de dos días de almacenamiento y, al llegar al sexto día, sus características sensoriales están marcadamente deterioradas. Los contenidos de ácido ascórbico y fenólicos disminuyeron durante el almacenamiento. Los niveles encontrados de ácido ascórbico, compuestos fenólicos y la actividad anti-oxidante muestran que la contribución de la pulpa de arazá al potencial antioxidante, cuando se compara con otros alimentos, en la dieta humana es buena.
Palabras clave: arazá, Eugenia stipitata Mc Vaugh, sistema antioxidante, compuestos fenólicos, ácido ascórbico.
ABSTRACT
In order to know the evolution in some antioxidants from the pulp of araza fruit during its ripening, fruits were harvested in their physiological maturity and stored at 25 °C during 6 days. Fruits showed a climacteric maximum after 2 days of storage; at 6th day their sensorial characteristics were widely deteriorated. Ascorbic acid, free and bound phenolics were depleted during storage. Ascorbic acid, phenolics and antioxidant activity showed that antioxidant contribution of araza pulp to human diet is important.
Key words: araza, Eugenia stipitata Mc Vaugh, antioxidant system, phenolics, ascorbic acid.
INTRODUCCIÓN
Los compuestos antioxidantes, presentes en forma natural en los alimentos, cada día cobran mayor importancia debido al papel que desempeñan en la salud humana, puesto que previenen y eliminan aquellas sustancias potencialmente nocivas y generadoras de desórdenes y enfermedades en el ser humano. La protección que las frutas y los vegetales brindan contra las enfermedades degenerativas como cáncer, enfermedades cardiovasculares, cerebrovasculares y sus propiedades antimutagénicas y antienvejecimiento ha sido atribuida a su alto contenido de diversos antioxidantes (1-10).
Los procesos degenerativos se han relacionado con la acción de especies reactivas de oxígeno (EROS) que dañan los componentes celulares, y los efectos terapéuticos sobre estas enfermedades están vinculados con el sistema antioxidante. Las EROS son sustancias inestables tales como radical superóxido (O2-.), oxígeno singulete (1O2), peróxido de hidrógeno (H2O2) y radical hidroxilo (.OH); estas especies atacan las proteínas de los tejidos, los fosfolípidos poliinsaturados de las membranas celulares y los ácidos nucleicos de las células. Al actuar, se activan reacciones en cadena que pueden incluso llevar a la muerte de las células (7).
Durante el metabolismo celular se producen EROS con un propósito específico o por accidente químico. En las células vegetales estas especies se generan durante los procesos de maduración y se incrementan durante la senescencia (11); además, su producción puede verse anormalmente incrementada frente a diversas condiciones de estrés (6). Por su parte, las EROS pueden llegar al organismo humano por ingestión de grasas deterioradas, por acción de los rayos UV, algunas drogas, metales pesados, sustancias orgánicas y contaminantes atmosféricos (7).
Si bien la producción de EROS es un fenómeno natural, dinámico y continuo, el daño que estos compuestos pueden provocar depende de un delicado equilibrio con los sistemas antioxidantes que protegen a las células de los organismos. Los mecanismos de defensa en tejidos vegetales para mantener unos niveles adecuados de estas especies son múltiples y variados, y pueden dividirse en dos grupos: enzimático, en donde se encuentran la catalasa, superóxido dismutasa, glutatión peroxidasa, glutatión reductasa, ascorbato peroxidasa, guaiacol peroxidasa, entre otras, y un segundo grupo, no enzimático, en donde se ubican tocoferoles, carotenoides, ácido ascórbico, glutatión, polifenoles, flavonoides, sustancias nitrogenadas y oligoelementos (1-9). Así como los vegetales poseen un sistema estructurado para el control de EROS, los humanos están provistos también de un sistema enzimático similar al vegetal con algunas excepciones (por ejemplo no se encuentra la guaiacol peroxidasa), y de un sistema no enzimático, de origen endógeno, como glutatión, urato, ubiquinol y proteínas plasmáticas (7). El papel importante que en este ámbito juegan las frutas y hortalizas radica en que tras su consumo, el sistema antioxidante humano se ve potenciado puesto que los componentes no enzimáticos de los vegetales pueden ser utilizados como tal por las células animales.
El fruto de arazá, de la región amazónica colombiana, se proyecta día tras día como un elemento productivo tendiente a mejorar el renglón socioeconómico de la región; sus características organolépticas lo hacen apetecible y sus componentes nutricionales prometen un beneficio para la salud de las personas principalmente de esta región que lo consumen dentro de sudieta regular. La pulpa del fruto se caracteriza por poseer pH (2,0), °Brix (4,0) bajos y unos contenidos en base seca de carbohidratos entre 70 a 80,6%, proteína 6,0 a 10,9%, pectina 3,4%, vitamina C0,77 a 7,4%, calcio 0,16 a 0,22%, magnesio de 0,08 a 0,12%, entre otros (12). Este trabajo se planteó con el objetivo de evaluar la variación en la concentración de algunos constituyentes antioxidantes solubles no enzimáticos de la pulpa de arazá durante el almacenamiento de frutos frescos a condiciones de su región de origen, para de esta manera entrar a analizar el potencial antioxidante que tienen los frutos cuando alcanzan su madurez de consumo.
MATERIALES Y MÉTODOS
Frutos de arazá. Fueron adquiridos de cultivos aledaños al casco urbano del municipio de Florencia, Caquetá, en la Amazonia colombiana. Debido a que estos frutos son muy susceptibles a sufrir daño mecánico durante su cosecha y transporte, especialmente cuando están maduros, la cosecha se debe realizar cuando el fruto no ha llegado a su madurez organoléptica: como criterio de selección se usó el color (10% amarillo en corteza). Una vez desinfectados se almacenaron durante 6 días en condiciones ambientales de la ciudad de Florencia (25 °C, H.R. 80%, precipitación anual de 3600 mm3, 400 m.s.n.m). En los frutos enteros se midió la intensidad respiratoria cada día y en la pulpa el contenido de ácido ascórbico, fenólicos libres, enlazados, totales y actividad antioxidante cada dos días. Todos los reactivos empleados fueron grado analítico.
Patrón respiratorio y evolución de la maduración.En los frutos enteros se evaluó la producción de CO2 cada día como se describe en un trabajo previo (13). Además, se recurrió a la descripción de las características sensoriales del fruto entero y de la pulpa cada dos días, a través de un panel entrenado conformado por seis miembros.
Cuantificación de ácido ascórbico. Se efectuó en la pulpa cada dos días, de acuerdo con el método de la 2–Nitroanilina, para lo cual se hizo lectura de absorbancia a 540 nm empleando una curva de calibración con ácido ascórbico (14).
Determinación de fenólicos libres, enlazados y totales. La técnica se basó en la aplicada en un trabajo previo (15). La extracción se efectuó por macerado y posterior agitación durante 2 horas de 1 g de pulpa con 2 ml de metanol acuoso al 80% para obtener los compuestos fenólicos libres, o 2 ml de metanol acidulado (80-19-1, metanol-agua-HCl) para extraer los compuestos fenólicos totales y posterior centrifugación. Sobre el pélet se realizó una segunda extracción. La medida de los compuestos fenólicos en el sobrenadante se hizo usando el reactivo de Folin-Ciocalteu y lectura espectrofotométrica a 765 nm. Para evaluar la evolución de la concentración de los compuestos fenólicos los resultados fueron expresados como mg de D(+)catequina/ g pulpa seca, para lo cual se efectuó una curva de calibración con D(+)catequina. Además, en la madurez sensorial de los frutos, para ampliar el espectro de comparación con otros vegetales, los resultados fueron expresados como mg ácido gálico/g pulpa seca, empleando una curva de calibración con patrón de ácido gálico. Los compuestos fenólicos enlazados fueron hallados por diferencia entre los totales y los libres. A través de una curva de calibración de ácido ascórbico se corrigió la respuesta que este compuesto da en la cuantificación de fenólicos.
Cuantificación de la capacidad antioxidante. Se midió de acuerdo con el método de la decoloración del β-caroteno (1). Se adicionaron 500 L de solución clorofórmica de β-caroteno 0,4 mg/mL en un recipiente de vidrio de 100 mL, y se evaporó al vacío a temperatura ambiente. Se incorporaron 20 µL de ácido linoléico, 200 µL de Tween 20 y 200 µL del extracto metanólico acidulado. Posteriormente se adicionaron 50 mL de agua destilada oxigenada a 50 °C y se agitó fuertemente. La mezcla se incubó a 50 °C durante 2 h. Se leyó la absorbancia a 470 nm a intervalos de 10 min durante 2 h. Se corrió un testigo adicionando la solución acuosa de metanol acidulado, en lugar del extracto de la pulpa. Para calcular la actividad antioxidante se evaluó la pendiente al graficar la absorbancia de la suspensión en función del tiempo de reacción y se expresó como:
AA/g pulpa seca = (Pendiente muestra–Pendiente testigo)*100/Pendiente testigo*g pulpa seca
Humedad. Para expresar los resultados del contenido de ácido ascórbico, fenólicos y actividad antioxidante con base en la materia seca, se determinó la humedad de la pulpa por secado en estufa a 65 °C hasta peso constante.
Análisis de datos. El almacenamiento de los frutos se realizó por triplicado en un diseño completamente al azar, y sobre cada fruto se efectuaron las determinaciones antes mencionadas. Sobre las variables de respuesta se efectuaron los ANOVA, se calcularon los valores promedio y las desviaciones estándar, y se comparó la diferencia entre los promedios por la prueba de Tukey.
RESULTADOS Y ANÁLISIS
Patrón respiratorio y evolución de la maduración. Los frutos de arazá presentaron el patrón típico de un fruto climatérico, con un máximo en su respiración luego de dos días de la recolección (Figura 1); este climaterio está en relación con una serie de eventos bioquímicos que llevan a que los frutos desarrollen sus características sensoriales para alcanzar su madurez de consumo. El máximo respiratorio obtenido aquí es menor al reportado cuando estos frutos son almacenados a 20 °C momento en que aparece el máximo en la intensidad respiratoria luego de 6 días de almacenamiento (16). La rápida pérdida de peso (Figura 1) de los frutos muestra un factor importante para manejar durante su comercialización.
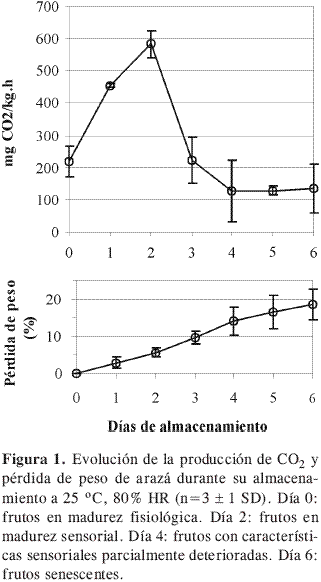
En los frutos cosechados en su madurez fisiológica (Día 0) el color de la corteza fue verde y ocupaba aproximadamente un 90% del fruto, el restante era amarillo claro; el olor era característico de frutos verdes y la textura firme al tacto. La pulpa era blanca con matices verdes y firme al tacto, su aroma era típico de frutos verdes, su sabor característico no estaba presente y se resaltaba el astringente.
Luego de dos días de almacenamiento el color de los frutos cambió notablemente y el color amarillo brillante predominó; el aroma del fruto entero y de la pulpa fue característico frutal, ácido, maduro; el fruto se ablandó de acuerdo con un estado de madurez sensorial. El sabor frutal y poco astringente, y el color amarillo característico, se desarrollaron.
A partir del cuarto día algunas características sensoriales decayeron. Los frutos exhibieron un color amarillo oscuro con manchas difusas de color café que ocuparon alrededor de un 20% de la superficie; el aroma siguió siendo característico; los frutos fueron más blandos de lo normal. El color amarillo de la pulpa se acentuó, pero perdió su sabor característico y se notó blanda y disgregada.
Al sexto día de almacenamiento hubo un deterioro avanzado en las características sensoriales. Aparecieron manchas entre marrón y negro que ocuparon entre un 40 y un 60% de la superficie de los frutos; el aroma típico desapareció; hubo ablandamiento excesivo. La pulpa perdió su sabor característico y cobró importancia el sabor avinagrado; su color fue amarillo- naranja, con algunas manchas de color café y mayor grado de disgregación.
De acuerdo con la evolución de las características sensoriales y el patrón respiratorio es de sugerir que el climaterio de los frutos de arazá se da dos días luego de cosechado y almacenado a 25 °C. La rápida maduración, en relación con un alto metabolismo oxidativo, puede conducir a una alta producción de EROS (11), por lo que sería de esperar un consumo intenso de sus antioxidantes; esto se muestra a continuación.
Cuantificación de ácido ascórbico. Tras la evaluación del contenido de ácido ascórbico (Figura 2A) se encontró que éste disminuye de manera significativa durante el almacenamiento. En un trabajo previo se reporta una tendencia similar cuando los frutos de arazá fueron almacenados entre 7 a 20 °C (16). En su madurez sensorial el contenido de ácido ascórbico de la pulpa de arazá (1,92 mg/g pulpa seca ó 0,30 mg/g pulpa húmeda) se ubica en el extremo inferior de los niveles de este componente en la parte comestible de frutos clasificados como ricos en vitamina C, dentro de los cuales se ubican la guayaba (Psidium guajava L.) (14,3 mg/g pulpa seca) en el límite superior, y el anón (Annona squamosa L.) (1,32 mg/g pulpa seca) en el límite inferior (17). Teniendo en cuenta que se precisa un consumo de 60 mg de ácido ascórbico/ día (18), se requeriría de 200 g de pulpa de arazá (B.H.) para satisfacer la necesidad mínima de este componente, por lo que esta fruta puede entrar a complementar la dosis requerida en conjunto con otras fuentes de esta vitamina.
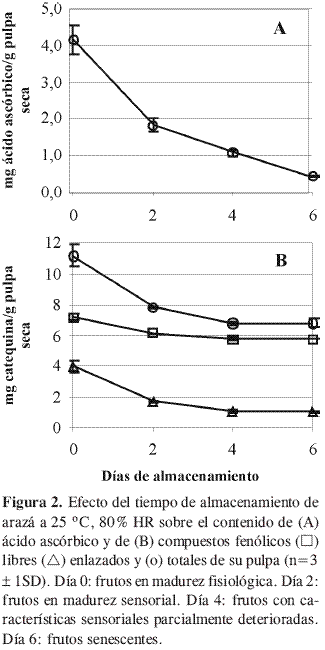
La disminución observada en los niveles de ácido ascórbico durante la maduración, muy marcada durante los 2 primeros días de almacenamiento, puede estar asociada a su alta tasa respiratoria (Figura 1), en la que se generan EROS. En este panorama, enzimas como ascorbato peroxidasa y ascorbato reductasa, encargadas de detoxificar las células, pueden jugar un papel importante al usar el ácido ascórbico como sustrato. Por otro lado, el ácido ascórbico como tal puede actuar como antioxidante interactuando directamente con este tipo de especies, con la consecuente disminución de sus niveles (7, 19).
Determinación de fenólicos libres y totales. Después de la evaluación del contenido de los compuestos fenólicos se observó una disminución durante la maduración (Figura 2B). En otros trabajos se reporta una disminución en el contenido de fenólicos totales durante la maduración de fresa; por el contrario, en frambuesa, este mismo tipo de compuestos aumenta durante la maduración (5). Sumado a lo anterior, durante la maduración de diversos cultivos de pimentones el contenido de fenólicos totales se incrementa en unas variedades y disminuye en otras (4).
En su madurez de consumo el contenido de fenólicos totales en mg de catequina/ g pulpa en arazá (7,8 B.S. ó 1,2 B.H.) se encuentra en el intervalo de contenido en mg de catequina/g de materia seca de diferentes frutas, hortalizas y tubérculos estudiadas, con ‘‘cranberry’’ (Vaccinium oxycoccus) en el límite superior (46 mg catequina/g materia seca) y papa (Solanum tuberosum) en el límite superior (1,7 mg catequina/g materia seca) (2,3). De otro lado, al efectuar la comparación expresando el contenido de fenólicos como mg ácido gálico/g pulpa en la madurez sensorial del arazá (4,1 B.S. ó 0,64 B.H.), contra los contenidos en diversos vegetales se encuentra que el contenido en el arazá se ubica en el intervalo, con ‘‘crowberry’’ (Empetrum nigrum) (50,8 mg ácido gálico/g materia seca) en el límite superior, y arveja (Pisum sativum) (0,4 mg ácido gálico/g materia seca) en el límite inferior (9). Las anteriores comparaciones indican que la contribución que hace el arazá en compuestos de carácter fenólico es buena, si bien el valor absoluto debe ser visto en complemento con la identidad química, no evaluada en este trabajo, puesto que es conocido que la capacidad antioxidante es dependiente del tipo de fenol en estudio (8, 10).
Los compuestos fenólicos enlazados disminuyeron de manera importante (Figura 2B) durante los dos primeros días de almacenamiento y permanecieron constantes durante los días cuatro y seis; el descenso significativo durante los días dos y cuatro respecto al día de la cosecha debe estar asociado a una alta actividad glucosidasa. Esta actividad glucosidasa genera los carbohidratos y las respectivas agliconas, por lo que el contenido de fenólicos libres debería verse incrementado. A pesar de esto, se observa que los compuestos fenólicos libres en la pulpa de arazá también disminuyeron de manera significativa durante los días dos y cuatro respecto al momento de la cosecha.
Es conocido que los compuestos fenólicos libres pueden ser atacados a una mayor velocidad que los enlazados por enzimas como polifenoloxidasa y peroxidasa. Estas enzimas pueden actuar sobre este tipo de sustratos bajando los niveles de EROS con la consecuente generación de colores pardos como resultado de la polimerización de las quinonas (generadas durante la acción de estas enzimas) a melaninas (20, 21), disminuyendo por lo tanto sus niveles. Además, en general los fenólicos libres –en mayor medida que los enlazados– pueden contribuir a la disminución de EROS por formación de especies más estables reduciéndose así los niveles de los compuestos de carácter fenólico (8, 10); como resultado final se obtiene la disminución de los compuestos fenólicos durante el almacenamiento del arazá.
La mayor velocidad de degradación de ácido ascórbico y de compuestos fenólicos se presentó durante los dos primeros días, lo que coincide con el pico climatérico. Este fenómeno se relaciona con la mayor producción de EROS que se espera se presente durante el alto metabolismo oxidativo vinculado al climaterio.
Evaluación de la actividad antioxidante. La actividad antioxidante, expresada en base seca (Figura 3), fue máxima en los frutos sensorialmente maduros. Teniendo en cuenta que el contenido de ácido ascórbico y fenólicos disminuyó durante la maduración, es de suponer que hay otros antioxidantes más efectivos que hacen que la evolución de la actividad antioxidante medida por el método del -caroteno muestre el comportamiento aquí observado. En los frutos maduros el valor de actividad antioxidante (AA/g materia seca) es superior al reportado en productos como papa morada (Solanum tuberosum L.) (7600) y germen de trigo (8112), e inferior al de cebolla cabezona (Allium cepa L.) (11275), mora (Vaccinium corymbosum L.) (11512) y cereza (Prunus avium L.) (10312) (1). Si bien estos valores ponen al arazá como una buena fuente de actividad antioxidante es necesario complementar este tipo de estudio in vitro con estudios in vivo en donde se evalúe el efecto benéfico que se puede lograr en la salud humana tras el consumo de este fruto.
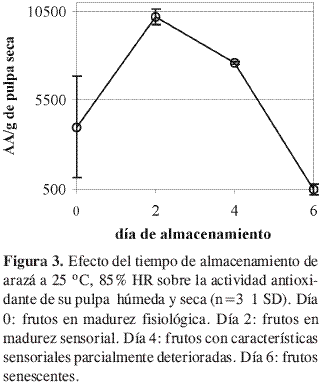
Aunque durante la maduración del arazá el ácido ascórbico y los compuestos fenólicos disminuyeron, la actividad antioxidante tendió a aumentar; esto significa que durante la maduración podrían generarse productos de condensación o incremento en algunos compuestos fenólicos que aporten a una mayor actividad antioxidante, o que hay otro tipo de compuestos que contribuyen de manera significativa con el potencial antioxidante, no estudiados aquí. Por otro lado, este estudio muestra que el arazá es una fuente de vitamina C, de compuestos fenólicos y de actividad antioxidante, proyectándose como un fruto benéfico con un excelente potencial antioxidante.
BIBLIOGRAFÍA
1. Velioglu, Y. S.; Mazza, G.; Gao, L.; Oomah, B. D. (1998). Antioxidant activity and total phenolics in selected fruits, vegetables, and grain products. J. Agric. Food Chem. 46, 4113-4117. [ Links ]
2. Vinson, J. A.; Su, X.; Zubik, L.; Bose P. (2001). Phenol antioxidant quantity and quality in foods: fruits. J. Agric. Food Chem. 49, 5315-5321. [ Links ]
3. Vinson, J. A.; Hao, J.; Su, X.; Zubik, L. (1998). Phenol antioxidant quantity and quality in foods: vegetables. J. Agric. Food Chem. 46, 3630-3634. [ Links ]
4. Howard, L. R.; Talcott, S. T.; Brenes, C. H.; Villalon, B. (2000). Changes in phytochemical and antioxidant activity of select pepper cultivars (Capsicum species) as influenced by maturity. J. Agric. Food Chem. 48, 1713-1720. [ Links ]
5. Wang, S.Y.; Lin, H.S. (2000). Antioxidant activity in fruits and leaves of Blackberry, Raspberry and Strawberry varies with cultivar and development stage. J. Agric. Food Chem. 48, 140-146. [ Links ]
6. Hegedüs, A.; Erdei, S.; Hováth, G. (2001). Comparative studies of H2O2 detoxifying enzymes in green and greening barley seedling under cadmium stress. Plant Sci. 160, 1085-1093. [ Links ]
7. Hansberg, T. W. Biología de las especies de oxígeno reactivas (2002). Mensaje bioquímico 26, 19-54. [ Links ]
8. Heim, K. E.; Tagliaferro, A. R.; Bobilya, D. J. (2002). Flavonoid antioxidant: chemistry and structure- activity relationships. J. Nutricional Biochem. 13, 572-584. [ Links ]
9. Kähkönen, M. P.; Hopia, A. I.; Vuorela, H. J.; Rauha, J-P.; Pihlakja, K.; Kujala, T. S.; Heinonen, M. (1999). Antioxidant activity of plant extracts conteing phenolic compounds. J Agric. Food Chem. 47, 3954-3962. [ Links ]
10. Sakihama, Y.; Cohen, M. F.; Grace, S. C.; Yamasaki, H. (2002). Plant phenolic antioxidant and prooxidant activities: phenolics-induced oxidative damage mediated by metals in plants. Toxicology 177, 67-80. [ Links ]
11. Jiménez, A.; Gómez, J. M.; Navarro, E.; Sevilla, F. (2002). Changes in the antioxidative system in mitochondria during ripening of pepper fruits. Plant Physiol. Biochem. 40, 515-520. [ Links ]
12. Ariza, C. A. (2001). Especies promisorias de la Amazonia: conservación, manejo y utilización del germoplasma. Bogotá. Salvador Rojas González Ed. [ Links ]
13. Narváez, C. C. E.; Restrepo, P. (2002). Efecto del almacenamiento de la uva caimarona (Pourouma cecropiifolia) a diferentes temperaturas sobre la actividad de polifenoloxidasa y peroxidasa. Rev. Col. Quim. 31, 131-44. [ Links ]
14. Bernal, I. (1998). Análisis de alimentos. Guadalupe. Bogotá. pp. 114-116. [ Links ]
15. Narváez, C. C. E. (2004). Efecto del choque térmico de arazá (Eugenia stipitata Mc Vaugh) sobre la tolerancia al frío. Rev. Col. Quim. 32, 93-102. [ Links ]
16. Hernández, G. M. S. (2001). Conservación del fruto de arazá (Eugeniastipitata Mc Vaugh) durante la poscosecha mediante la aplicación de diferentes técnicas. Tesis Ph. D. en Ciencias Agrarias. Facultad de Agronomía. Universidad Nacional de Colombia. Bogotá. pp. 71-102. [ Links ]
17. Instituto Colombiano de Bienestar Familiar, ICBF (1978). Tabla de composición de alimentos colombiano. Colombia. pp. 52-53. [ Links ]
18. Badui, D. S. (1999). Química de los alimentos, Longman de México Editores, S. A. México. p. 357. [ Links ]
19. Horemans, N.; Foyer, C. H.; Potters, G.; Asard, H. (2000). Ascorbate funtion and associated transport system in plants. Plant Physiol. Biochem. 38, 531-540. [ Links ]
20. Hirota, S.; Shimoda, T.; Takahama, U. (1998). Tissue and spatial distribution of flavonol and peroxidase in onion bulbs and stability of flavonol glucosides during boiling of the scales. J. Agric. Food Chem. 46, 3497-3502. [ Links ]
21. Richard-Forget, F. C.; Gauillard, F. A. (1997). Oxidation of chlorogenic acid, catechins, and 4-methylca-techol in model solutions by combinations of pear (Pyrus communis Cv. Williams) polyphenol oxidase and peroxidase: A possible involvement of peroxidase in enzymatic browning. J. Agric. Food Chem. 45, 2472-2476. [ Links ]














