Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804On-line version ISSN 2357-3791
Rev.Colomb.Quim. vol.34 no.2 Bogotá Dec. 2005
Augusto Rivera1Jaime Ríos-Motta1Rodolfo Quevedo1Pedro Joseph-Nathan2
1Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia. Ciudad Universitaria. Bogotá,D. C., Colombia. Correo electrónico: ariverau@unal.edu.co
2Departamento de Química, Centro de Investigación y de Estudios Avanzados del Instituto Politécnico Nacional, Apartado 14-740, México D. F., 07000 México.
RESUMEN
Se ensayaron algunos fenoles como nucleófilos en la reacción tipo Mannich en medio básico frente al aminal macrocíclico 1,3,6,8-tetrazatriciclo[4.4.1.13,8] dodecano (TATD). Dependiendo del grado de sustitución del fenol empleado, se obtuvieron: 1,3- bis- [2’- hidroxibencil] imidazolidinas regioselectivamente, 2,6-di[3’- (2’’-hidroxibencil)-1’-metilenimidazolidin]fenoles y 3,3’-etilen-bis-(3,4-dihidro-2H-1,3-benzoxazinas).
Palabras clave: orto-regioselectividad,reacciones Mannich, bencilimidazolidinas,bis-benzoxazinas.
ABSTRACT
Several phenols were tested as nucleophilesin Mannich-type reactions with the macrocyclic aminal 1,3,6,8-tetraazatricyclo[4.4.1.13,8]dodecane (TATD) in basic medium. Depending on the degree of substitution of the phenol employed,1,3-bis-[2’-hydroxybenzyl]imidazolidines, 2,6-di[3’-(2’’-hydroxybenzyl)-1’- methyleneimidazolidin] phenols and 3,3’-ethylene-bis-(3,4-dihydro-2H-1,3- benzoxazines) were obtained.
Key words: orto-regioselectivity,Mannich reactions, benzylimidazolidine,bis-benzoxazine.
INTRODUCCIÓN
La reacción de Mannich se usa ampliamente en la síntesis de aminas secundarias y terciarias y se emplea como una etapa intermedia en la síntesis de muchas moléculas bioactivas y productos naturales complejos (1). En nuestro grupo de investigación,desde tiempo atrás se han llevado a cabo reacciones tipo Mannich en medio básico con fenol y algunos fenoles p-sustituidos (2) 2a-d empleando como agente aminometilante 1,3,6,8-tetrazatriciclo[4.4.1.13,8] dodecano (TATD) 1 para producir o-regioselectivamente, en un solo paso, bases de Mannich del tipo 1,3-bis[2´-hidroxi-5´-sustituidobencil] imidazolidinas (BISBIAs) 3a-d con rendimientos que varían entre 20 y 30% (Figura 1).
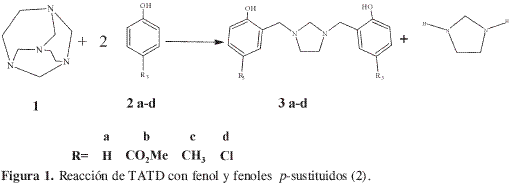
Estudios posteriores demostraron la utilidad sintética de las 1,3-bis[5’- sustituidas- 2’-hidroxibencil]imidazolidinas como materias primas en la obtención de 3,3’-etilen-bis(3,4-dihidro-2H-1,3-benzoxazinas) (3); 2-sustituidos-1,3-bis (2’- hidroxi-5’-sustituidos-bencil)-imidazolidinas(4); N,N’-bis(2’-hidroxibencil)etilendiamina (tetrahidrosalenos) (5) y de heterocalixarenos (6); estos últimos compuestos son de interés químico en la síntesis de catalizadores quirales (7, 8) y en química supramolecular (9).
Los estudios de la reacción de Mannich en medio ácido empleando fenolesindican que la aminometilación es o-regioselectiva (10, 11), aunque se conoce un reporte (12) sobre regioselectividad cuando esta reacción de Mannich se realizó con compuestos fenólicos sin medio ácido. Con estos experimentos se demostró que las reacciones tipo Mannich de TATD con fenoles también son orto-regioselectivas y que, contrario a lo hallado en la literatura (13), cuando el medio es básico, no es indispensable que el fenol sea p-sustituido, con al menos una posición orto libre, para que ocurra la reacción. Las bases de Mannich obtenidas mediante aminometilación en posición orto al grupo hidroxilo, en especial para el fenol y los fenoles para-sustituidos con sustituyentes orientadores a sus respectivas posiciones orto, permitieron demostrar la orto-regioselectividad de la reacción. Estos resultados constituyen un nuevo aporte al mayor entendimiento de la regioselectividad de estas reacciones y de hecho contradicen parcialmente la clasificación hecha por Chotana y col. (14), según la cual, los sistemas aromáticos para-sustituidos usualmente no reaccionan con regioselectividad bien definida,y ocasionalmente sólo uno de los tres posibles arreglos exhibe buena regioselectividad. Los citados autores postulan igualmente que cuando ambos grupos en posición para orienten entre sí a sus respectivas posiciones orto, el compuesto en cuestión puede ser excelente sustrato para la reacción de sustitución electrofílica aromática, pero su regioselectividad será baja.
En este artículo se discute la influencia del grado de sustitución en el anillo fenólico tanto en la regioselectividad como en el transcurso mismo de la reacción, en especial en la formación de bis-1,3-benzoxazinas (BISBOAs 5m-o) cuando se emplearon los fenoles 2m-o que tienen las posiciones 3 y 5 sustituidas.La inesperada formación de 5m-o sin la aparente presencia de BISBIAs ni de formaldehído libre en el medio de reacción constituye una excepción notable en las reacciones tipo Mannich en medio básico de TATD con fenoles.
PARTE EXPERIMENTAL
General
Tanto el 1,3,6,8-tetrazatriciclo [4.4.1.13,8]dodecano (TATD) (15) como el p-fluorofenol y el p-yodofenol (16) fueron preparados por procedimientos descritos en la literatura, y los fenoles: p-cresol, p-clorofenol,p-bromofenol, o-cresol, m-cresol,4-cloro-3-metilfenol, 2-t-butil- 4- metoxi-fenol, 2,6-dimetilfenol, 3,5-dimetilfenol,2,4,5-triclorofenol, 4-cloro-3,5-dimetilfenol,fueron adquiridos en la casa Merck.Las reacciones se llevaron a cabo en mezclas de etanol y agua o dioxano y agua.
Los espectros de infrarrojo se tomaron en un equipo Perkin-Elmer Paragon FT-IR. Los espectros de RMN de 1H y 13C se registraron en soluciones de CDCl3, a temperatura ambiente y usando TMS como referencia interna, en un aparato Varian XL 300 operado a 299.993 MHz para protón y a 75.489MHz para 13C. Los espectros de masas se realizaron por impacto electrónico en un espectrómetro de masas Hewlett-Packard modelo 5973. Los análisis de carbono, nitrógeno e hidrógeno se llevaron a cabo en un analizador elemental Carlo Erba 1106. Los puntos de fusión se tomaron con un equipo Electrothermal y se expresan sin corregir.
Método general: reacción entre TATD y fenoles
A una solución de TATD 1 (0,500, 3 mmol) en agua (5 mL) se adicionó el respectivo fenol (x g, 6 mmol) disuelto en dioxano (5 mL; método A) o etanol (5 mL; método B). La mezcla de reacción se agitó por tiempos variables a 40-42 °C. La reacción se monitoreó por C.C.D. y una vez se consideró finalizada se retiró el disolvente a presión reducida y el producto crudo obtenido se purificó por cromatografía en columna (silica gel) eluyendo con mezclas variables de benceno: acetato de etilo, 9:1 hasta 1:9.
1,3-bis[2’-hidroxi-5’-fluorobencil] imidazolidina 3e. (C17H18N2O2F2) Sólido blanco, p.f. 120-121 °C, rend. 12,5%. Espectro de 1H-RMN δ: 2,97 (4H, s, H-4 y H-5); 3,54 (2H, s, H-2); 3,86 (4H, s,Ar-CH2); 6,71 (2H, sistema ABCX, JBA= 3,0Hz, JBX=8,6Hz, H-6’); 6,78 (2H, dd,sistema ABCX, JCA=8,9Hz, JCX=4,8Hz,H-3’); 6,88 (2H, dd, sistema ABX, JAX= 8,58Hz, JAX= 2,45Hz, H-4’). Espectro de 13C-RMN δ: 51,5 (C-4 y C-5); 57,9 (Ar-CH2); 74,6 (C-2); 114,7 (C-4’, 2JCF= 23,5); 115,4 (C-6’, 2JCF = 22,5); 117,0 (C-3’, 3JCF = 7,8); 122,1 (C-1’, 3JCF = 6,9); 153,5(C-2’, 4JCF = 2,1); 156,1(C-6’,1JCF = 237,0). EM(IE)20 eV, iones m/z(int. rel.): 320 [M]+(29,1); 319[M-1]+(40,2); 166 [M-C8H9NFO]+(34,3); 154 [M-C9H9NFO]+(39,0); 125 [M-C10H12N2 FO]+(100).
1,3-bis[2’-hidroxi-5’-bromobencil]imidazolidina 3f.(C17H18N2O2Br2) Sólido blanco, p.f. 137-138 °C, rend. 18,6%. Espectro de 1H-RMN δ: 2,97 (4H, s, H-4 y H-5); 3,53 (2H, s, H-2); 3,86 (4H, s, Ar-CH2); 6,74 (2H, d, sistema ABX, JAX = 8,58Hz, H-3’); 7,10 (2H, d, sistema ABX, JAB = 2,45Hz, H-6’); 7,28 (2H,dd, sistema ABX, JAX = 8,58Hz, JAB = 2,45Hz, H-4’). Espectro de 13C-RMN δ:51,5 (C-4 y C-5); 57,6 (Ar-CH2); 74,5 (C-2); 111,1 (C-5’); 118,2 (C-3’); 123,2 (C-1’); 130,9 (C-4’); 132,0 (C-6’); 156,7 (C-2’). EM(IE)20 eV, iones m/z(int.rel.): 444[M+4]+(39,2); 443(47,2);442[M+2]+(78,5); 441(84,6); 440[M]+(39,8); 258(15,5); 257[M-C7H6BrO+2]+ (74,8); 256(16,9); 255[M-C7H6BrO]+(72,8); 229[M-C8H8NBrO+2]+(88,7); 228(100); 227[M-C8H8NBrO]+(83,8).
1,3-bis[2’-hidroxi-5’-yodobencil]imidazolidina 3g.(C17H18N2O2I2) Sólido blanco,p.f. 134-135 °C, rend. 15,3%. Espectro de 1H-RMN δ: 2,97 (4H, s, H-4 y H-5); 3,53 (2H, s, H-2); 3,84 (4H, s, Ar-CH2);6,64 (2H, d, sistema ABX, JAX = 8,54Hz,H-3’); 7,28 (2H, d, sistema ABX, JAB = 2,19 Hz, H-6’); 7,46 (2H, dd, sistema ABX, JAX=8,54Hz, JAB=2,19Hz, H-4’). Espectro de 13C-RMN δ: 51,5 (C-4 y C-5);57,5 (Ar-CH2); 74,5 (C-2); 80,7 (C-5’);118,8 (C-1’); 123,8 (C-1’); 136,7 (C-4’);138,0 (C-6’); 157,5 (C-2’). EM(IE)20 eV,iones m/z(int. rel.): 536[M]+ (42,0); 535[M-H]+ (39,7); 303[M-C7H6IO]+ (53,6); 276 (37,0); 275[M-C8H8NIO]+ (44,4);233[M-C10H12N2IO]+ (100); 232[M-C10H12N2IO-H]+ (18,0).
1,3-bis[2’-hidroxi-3’-metilbencil]imidazolidina 3h. (C19H24N2O2) Sólido blanco, p.f. 118-120 °C, rend. 37%. Espectro de 1H-RMN δ: 2,23 (6H, s,CH3); 2,96 (4H, s, H-4 y H-5); 3,54 (2H,s, H-2); 3,88 (4H, s, Ar-CH2); 6,69 (2H,t, sistema AMX, JAX = JMX = 7,32 Hz,H-5’); 6,83 (2H, d, sistema AMX, JMX= 7,32 Hz, H-6’); 7,05 (2H, d, sistema AMX, JAX=7,32 Hz, H-4’). Espectro de 13C-RMN δ: 15,6 (CH3); 51,5 (C-4 y C-5); 58,2 (Ar-CH2); 74,5 (C-2); 118,8(C-5’); 120,7 (C-1’); 125,1 (C-3’); 125,9 (C-6’); 130,2 (C-4’); 155,7 (C-2’). Análisis elemental calculado para C19H24N2O2: C 73,05; H 7,74; N 8,97. Experimental:C 73,02; H 7,88; N 9,19.
1,3-bis[2’-hidroxi-4’-metilbencil]imidazolidina 3i. (C19H24N2O2) Sólido blanco, p.f. 115-118 °C, rend. 38%. Espectro de 1H-RMN δ: 2,27 (6H, s,CH3); 2,95 (4H, s, H-4 y H-5); 3,53 (2H,s, H-2); 3,85 (4H, s, Ar-CH2); 6,57 (2H,dd, sistema AMX, JXA = 7,82Hz, JXM = 0,98 Hz, H-5’); 6,67 (2H, d, sistema AMX, JMX= 0,98 Hz, H-3’); 6,85 (2H,d, sistema AMX, JAX= 7,82 Hz, H-6’).Espectro de 13C-RMN δ: 21,3 (CH3);51,6 (C-4 y C-5); 58,1 (Ar-CH2); 74,6 (C-2); 116,8 (C-3’); 118,3 (C-1’); 120,0(C-5’); 128,0 (C-6’); 139,1 (C-4’); 157,2 (C-2’). Análisis elemental calculado para C19H24N2O2: C 73,05; H 7,74; N 8,97. Experimental: C 73,01;H7,68;N9,18.
1,3-bis[2’-hidroxi-5’-cloro-4’-metilbencil]imidazolidina 3j.(C19H22Cl2N2O2) Sólido blanco, p.f. 134-135 °C, rend. 41%. Espectro de 1H-RMN δ: 2,28 (6H,s, CH3); 2,98 (4H, s, H-4 y H-5); 3,53 (2H, s, H-2); 3,84 (4H, s, Ar-CH2); 6,72 (2H, s, H-3’); 6,93 (2H, s, H-6’). Espectro de 13C-RMN δ: 19,8 (CH3); 51,5 (C-4 y C-5); 57,4 (Ar-CH2); 74,5 (C-2); 118,6 (C-3’); 120,2 (C-1’); 124,1 (C-5’); 128,2 (C-6’); 136,7 (C-4’); 155,9 (C-2’). Análisis elemental calculado para C
1,3-bis[2’-hidroxi-3’-tert-butil-5’- metoxibencil]imidazolidina 3k.(C27H40N2O4).Sólido blanco, p.f. 125-127° C, rend.47%. Espectro de 1H-RMN δ: 1,70 (18H, s, CH3); 2,96 (4H, s, H-4 y H-5);3,43 (2H, s, H-2); 3,70 (6H, s, O-CH3);3,83 (4H, s, Ar-CH2); 6,37 (2H, s, H-6’);6,78 (2H, s, H-4’). Análisis elemental calculado para C27H40N2O4: C 71,02; H8,83; N 6,13. Experimental: C 71,55; H8,42; N 5,99.
1,3-bis[4’-hidroxi-3’,5’-dimetilbencil]imidazolidina 3l. (C21H28N2O2) Sólido blanco, p.f. 112-113 °C, rend. 47%. Espectro de 1H-RMN δ: 2,18 (12H, s,CH3); 2,78 (4H, s, H-4 y H-5); 3,32 (2H,s, H-2); 3,51 (4H, s, Ar-CH2); 6,85 (4H,s, H-2’ y H-6’). Espectro de 13C-RMN δ:16,7 (CH3); 52,5 (C-4 y C-5); 59,3 (Ar-CH2); 75,9 (C-2); 124,1 (C-1’);129,6 (C-2’); 129,7 (C-6’); 129,9 (C-3’);130,0 (C-5’); 152,4 (C-4’).
2,6-di[3’-(2’’-hidroxi-5’’-metilbencil)-1’-metilenimidazolidin]-4-metilfenol 4c. (C31H40N4O3) Sólido amarillo, p.f.61-63°C, rend. 14%. Espectro de 1H-RMN δ: 2,21 (9H, s, CH3-C5’’ y CH3-C4); 2,93 (8H, s, H-4’ y H-5’); 3,53 (4H, s, H-2’); 3,78 (4H, s, H-6’); 3,85 (4H, s, H-7’); 6,73 (2H, d, sistema AMX, JXA= 8,11 Hz, H-3’’); 6,77 (2H,d, sistema AMX, JMA= 1,52 Hz, H-6’’);6,87 (2H, s, H-3 y H-5); 6,95 (2H, dd,sistema AMX, JAX= 8,12 Hz, JAM= 1,8Hz, H-4’’). Espectro de 13C-RMN δ:20,4 (Ar’’-CH3); 20,5 (Ar-CH3); 51,6 (C-4’); 51,9 (C-5’); 55,5 (C-6’); 58,3 (C-7’); 74,9 (C-2’); 115,9 (C-3’’); 121,4 (C-1’’); 122,8 (C-2 y C-6); 127,9 (C-4);128,1 (C-5’); 128,8 (C-6’’); 129,3 (C-3 yC-5); 129,4 (C-4’’); 153,4 (C-1); 155,4 (C-2’’).
2,6-di[3’-(2’’-hidroxi-5’’-clorobencil)-1’-metilenimidazolidin]-4-clorofenol 4d. (C28H31Cl3N4O3) Sólido amarillo, p.f. 67-68 °C, rend. 9%. Espectro de 1H-RMN δ: 2,96 (8H, s, H-4’ y H-5’);3,53 (4H, s, H-2’); 3,78 (4H, s, H-6’);3,85 (4H, s, H-7’); 6,77 (2H, d, sistema AMX, JXA= 8,60 Hz, H-C3’’); 6,97 (2H, d, sistema AMX, JMA= 2,86 Hz,H-6’’); 7,06 (2H, s, H-3 y H-5); 7,12 (2H, dd, sistema AMX, JAX= 8,54 Hz, JAM = 2,14 Hz, H-4’’). Espectro de 13C-RMN δ: 51,5 (C-4’); 51,8 (C-5’); 54,9 (C-6’); 57,8 (C-7’); 74,8 (C-2’);117,5 (C-3’’); 123,0 (C-4’’); 123,7 (C-2 y C-6); 127,9 (C-6’’); 128,2 (C-3 y C-5);128,7 (C-4); 128,8 (C-4’’); 129,7 (C-5’’); 154,2 (C-1); 156,3 (C-2’’).
3,3-etilen-bis(3,4-dihidro-6-cloro-5,7-dimetil-2H-1,3-benzoxazina) 5m.(C22H26Cl2N2O2) Sólido blanco, p.f. 162-164 °C, rend. 56%. Espectro de 1H-RMN δ: 2,14 (6H, s, CH3-C5); 2,33 (6H, s, CH3-C7); 3,02 (4H, s, N-CH2- CH2-N); 3,91 (4H, s, H-4); 4,84 (4H, s, H-2); 6,62 (2H, s, H-8). Espectro de 13C-RMN δ: 16,1 (CH3-C5); 21,5 (CH3- C7); 50,1 (N-CH2-CH2-N); 82,5 (C-2);50,6 (C-4); 127,2 (C-6); 116,9 (C-8);118,0 (C10); 134,4 (C-5); 136,0 (C-7);152,9 (C-9). Análisis elemental calculado para C22H26Cl2N2O2: C 62,71; H 6,22;N 6,65. Experimental: C 62,83; H 6,26;N 6,81.
3,3’-etilen-bis(3,4-dihidro-5,7-dimetil-2H-1,3-benzoxazina) 5n. (C22H28N2O2) Sólido blanco, p.f. 140-142 °C, rend. 44%. Espectro de 1H-RMN δ: 2,12 (6H,s, CH3-C5); 2,35 (6H, s, CH3-C7); 3,07 (4H, s, N-CH2-CH2-N); 3,91 (4H, s,H-4); 4,93 (4H, s, H-2); 6,13 (2H, s,H-8); 6,45 (2H, s, H-6). Espectro de 13C-RMN δ: 18,8 (CH3-C5); 21,7 (CH3-C7); 49,3 (N-CH2-CH2-N); 50,6 (C-4); 82,7 (C-2); 115,2 (C-6); 116,2 (C-10); 123,8 (C-8); 136,7 (C-7); 137,7 (C-5); 154,7 (C-9). Análisis elemental calculado para C22H28N2O2: C 74,97; H8,01; N 7,95. Experimental: C 74,77; H8,06; N 7,82.
3,3’-etilen-bis(3,4-dihidro-5,6,8-tricloro-2H-1,3-benzoxazina) 5o. (C18H14Cl6N2O2) Sólido blanco, p.f. 178-180 °C, rend. 23%. Espectro de 1H-RMN δ: 2,92 (4H, s,N-CH2-CH2-N); 4,04 (4H, s, H-4); 4,94 (4H, s, H-2); 7,42 (2H, s, H-7). Espectro de 13C-RMN δ: 50,4 (N-CH2-CH2-N); 50,9 (C-4); 84,0 (C-2); 121,0(C-8); 121,8 (C-6);124,6 (C-7); 129,4 (C-10); 130,2 (C-5);150,2 (C-9).
RESULTADOS Y DISCUSIÓN
Con el objetivo de estudiar la influencia de los sustituyentes en la reacción de TATD con fenoles, se decidió realizar diversas reacciones mediante el procedimiento desarrollado en trabajos previos (2) empleando los fenoles 2c-o que tienen diferente grado de sustitución. A diferencia de los anteriores fenoles, tres fenoles (Tabla 1) 2m-o produjeron 3,3’-etilen-bis (3,4-dihidro-2H-1,3-benzoxazinas)(BISBOAs) 5m-o (Figura 2) y no las correspondientes 1,3-bis[2’-hidroxi-5’-(sustituido) bencil]imidazolidinas (BISBIAs) esperadas. Los demás fenoles estudiados 2e-l reaccionaron normalmente y generaron las BISBIAs nuevas 3e-l. Los fenoles p-sustituidos 2c y 2d produjeron, además de las BISBIAs 3c y 3d ya conocidas (2), los dímeros 4c-d que son producto de la diaminometilación en orto deno de los anillos fenólicos de las respectivas BISBIAs 3c y 3d, reacción promovida posiblemente por la presencia del grupo metileno bencílico que activa el anillo haciéndolo más reactivo que el del fenol en cuestión. La dimerización no ocurre con fenoles sustituidos en una de las posiciones meta, debido al impedimento estérico. La formación de dímeros de bencilimidazolidina es un claro ejemplo de la posibilidad de generar con esta reacción compuestos de elevado peso molecular. Una posible explicación de esta reacción se plantea en la Figura 3.
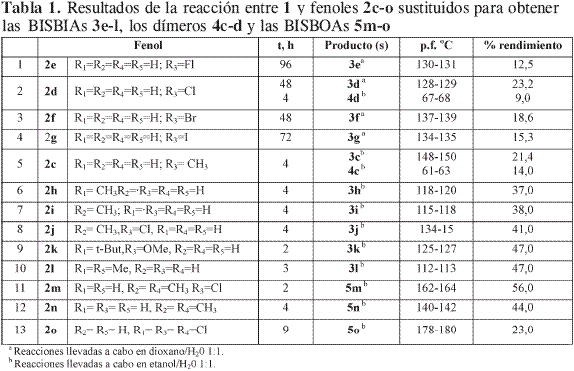
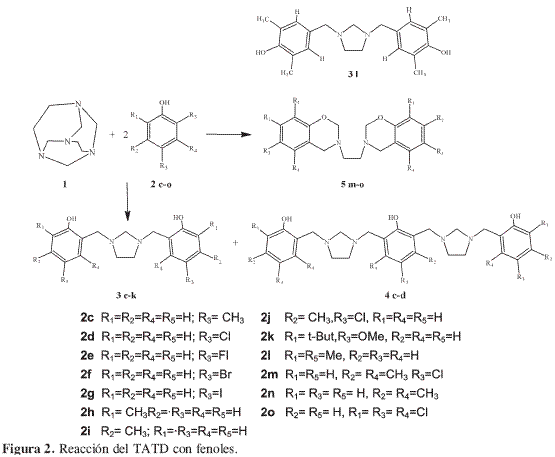
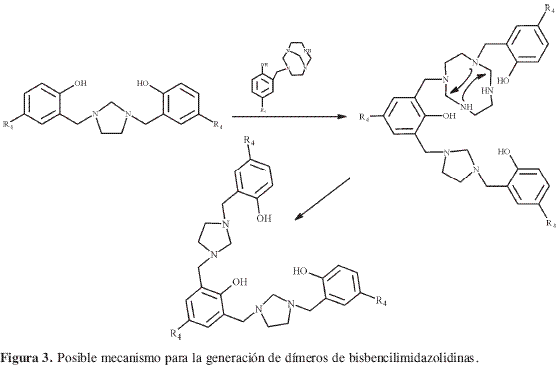
La obtención de 3h-i permitió comprobar que la aminometilación es o-regioselectiva también en medio básico, aunque esté libre la posición para. Esta posición solamente se aminometiló cuando se empleó 2l un fenol orto-disustituido,produciendo la correspondiente 1,3-bis [4´-hidroxi-3,5´-dimetilbencil]imidazolidina 3l.
De otra parte, según Nobles y Potti(17), si el fenol es orto-disustituido y tienela posición para libre, la aminometilación en medio ácido ocurrirá en esa posición, aunque con formación de subproductos de aspecto resinoso de gran complejidad. En este trabajo se comprobó que la aminometilación en medio básico de fenoles orto-disustituidos igualmente ocurre en esa posición, pero con mejores rendimientos y menor formación de subproductos resinosos. La obtención de 3h-3k indicó que la reacción presenta una alta regioselectividad, dado que en el caso de 2i-j, a pesar de que las dos posiciones orto están libres, sólo se produjo aminometilación en una de ellas, específicamente en la posición orto menos impedida, haciendo evidente la influencia de un fuerte efecto estérico del sustituyente en la posición meta, aunque en ningún caso era muy voluminoso. Este efecto fue al parecer lo que impidió la formación de dímeros con estos fenoles. De otro lado, el fenol 2k, con posibilidad de sufrir sustitución lectrofílica en tres de sus posiciones (3, 5 y 6) que se hallan fuertemente activadas, la aminometilación ocurrió únicamente en la posición 6 orto al grupo hidroxilo, contrario a lo indicado en la literatura (14) para reacciones de sustitución electrofílica de anillos aromáticos polisustituidos con grupos que refuerzan su orientación.
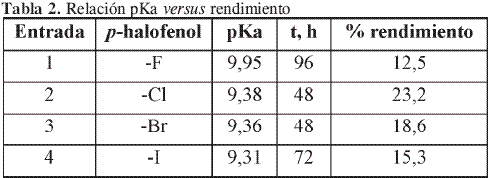
La influencia del sustituyente en el anillo (componente intrínseco) se evaluó teniendo en cuenta los efectos inductivos generados por los sustituyentes en el anillo, comparando los rendimientos y tiempos de reacción obtenidos para las BISBIAs 4d-g. Los rendimientos obtenidos para los cuatro p-halofenoles permitieron establecer que los efectos inductivos en el anillo de los cuatro halógenos estudiados y el pKa del respectivo fenol no presentan una relación directa con los rendimientos de la reacción (Tabla 2).
Con el fin de evaluar el posible efecto estérico de los grupos ubicados en las posiciones meta al hidroxilo, se eligieron 2m-o tres fenoles con sustituyentes en ambas posiciones meta. La reacción de TATD con estos fenoles en que existe impedimento estérico sobre las posiciones orto al hidroxilo no condujo a las esperadas 1,3-bis[2´-hidroxi-4,6´-disustituidobencil] imidazolidina (BISBIAs), sino que se obtuvieron las respectivas 3,3’-etilenbis(3,4-dihidro-2H-1,3-benzoxazinas) 5m-o sin estar presente exceso de formaldehído (3, 12), pues, como se indicó anteriormente, las BISBOAs se pueden generar in situ por la reacción de las respectivas BISBIAs con formaldehído (3).
La generación de BISBOAs, ocurrida únicamente cuando se utilizaron fenoles con posiciones orto libres pero estéricamente impedidas, por efecto del sustituyente en las posiciones meta, como ocurre en los fenoles 2m-o, es una clara demostración de que las BISBOAs 5m-o se formaron mediante un mecanismo diferente al conocido (2), pues, de ser así, en ninguno de los experimentos se hubieran aislado BISBIAs, sino BISBOAs en su lugar, formadas a expensas de las primeras.
CONCLUSIÓN
La reacción de aminometilación en medio básico de TATD con fenoles con diverso grado de sustitución en el anillo es orto-regioselectiva y permite obtener estas bases de Mannich con un alto grado de predicción. Sin embargo, cuando los fenoles son meta-disustituidos, la reacción produce preferencialmente BISBOAs orto-regioselectivamente.
Agradecimientos: Los autores agradecen a la Dirección Nacional de Investigaciones (DINAIN) de la Universidad Nacional de Colombia, al Departamento de Química de la Universidad Nacional de Colombia y al CONACYT de México (Grant G-32631-N) por el apoyo económico recibido.
BIBLIOGRAFÍA
1. Ito, M.; Clark, C. W.; Mortimore,M.; Goh, J. B.; Martin, S. F. (2001).Biogenetically Inspired Approach to the Strychnos Alkaloids. Concise Syntheses of (±)-Akuammicine and (±)-Strychnine. J. Am. Chem. Soc. 123 (33) 8003. [ Links ]
2. Rivera, A.; Gallo, G. I.; Gayón, M.E.; Joseph-Nathan, P. (1993). A novel Mannich-type reaction using aminals in alkaline medium. Synth. Commun. 23 (20) 2921. [ Links ]
3. Rivera, A.; Gallo, G. I.; Gayón, M.E.; Joseph-Nathan, P. (1994). 1,3-bis (2`-hydroxybenzyl)imidazolidines as novelprecursors of 3,3`-ethylene-bis (3,4-dihydro-2H-1,3-benzoxazine). Synth. Commun. 24(14) 2081. [ Links ]
4. Rivera, A.; León, J. F.; Rivera, J.; Parra, E.; Purmova, J.; Burgueño-Tapia, E.; Joseph-Nathan, P. (2000).Synthesis of 2t-substituted-1r-3c-bis (2`-hydroxy-5`-substituted-benzyl) imidazolidines by reaction of 1,3-bis (2´-hydroxy-5`-substituted-benzyl) imidazolidines with Aromatic Aldehydes. Synth. Commun. 30 (11) 2029. [ Links ]
5. Rivera, A.; Quevedo, R.; Navarro, M. A.; Maldonado, M. (2004). Efficient tetrahydosalen synthesis from Mannich-type bases. Synth. Commun. 34 (13) 2479. [ Links ]
6. Rivera, A.; Quevedo, R. (2004). Solvent-Free Mannich Reaction as a Strategy for Synthesizing Novel Heterocalixarenes. Tetrahedron Lett. 45 (45) 8335. [ Links ]
7. Balsells, J.; Walsh, P. J. (2000). The Use of Achiral Ligands to Convey Asymmetry: Chiral Environment Amplification J. Am. Chem. Soc. 122 (8) 1802. [ Links ]
8. Balsells, J.; Carroll, P. J.; Walsh, P. J. (2001). Achiral Tetrahydrosalen Ligands for the Synthesis of C2-Symmetric Titanium Complexes: A Structure and Diastereoselectivity Study. Inorg. Chem. 40 (22) 5568. [ Links ]
9. Weber, E.; Trepte, J.; Piel, M.; Czugler, M.; Kravtsov, V. Ch.; Somonov, Y. A.; Lipkowski, J.; Ganin, E. V. (1996).Heterocalix(8)arenes Featuring the Benzimidazol- 2-one Subunit. Synthesis and XStructural Studies of the Solvent Inclusion. J. Chem. Soc. Perkin Trans 2. (11) 2359. [ Links ]
10. Burke, W.; Lau, H.; Van Leaer, G.; Goken, G. (1963). Mono-1,3-benzoxazines from Hydroquinone. J. Org. Chem. 28 (4) 1098. [ Links ]
11. Burckhalter, J. H.; Leib, R. I. (1961). Amino- and Chloromethylation of 8- Quinolinol. Mechanism of Preponderant ortho Substitution in Phenols under Mannich Conditions. J. Org. Chem. 26 (10) 4078. [ Links ]
12. Omura, Y.; Taruno, Y.; Irisa, Y.; Morimoto, M.; Saimoto, H.; Shigemasa, Y. (2001). Regioselective Mannich Reaction of Phenolic Compounds and its Application to the Synthesis of New Chitosan Derivatives. Tetrahedron Lett. 42 (41) 7273. [ Links ]
13. Burckhalter, J. H. (1950). The Mannich Reaction with o-Phenylphenol. J. Am. Chem. Soc. 72 (11) 5309. [ Links ]
14. Chotana, G. A.; Rak, M. A.; Smith, M. R. (2005). Sterically Directed Functionalization of Aromatic C-H Bonds: Selective Borylation Ortho to Cyano Groups in Arenes and Heterocycles. J. Am. Chem. Soc. 127 (30) 10539. [ Links ]
15. Simkins, R. J.; Wright, G. F. (1955). Nitrolysis of 1,3-6,8-Diendomethylene-1,3,6,8-tetraazacyclodecane. J. Am. Chem. Soc. 77 (11) 3157. [ Links ]
16. Vogel, A. I. (1976). Vogel`s textbook of practical organic chemistry 3th ed. Nueva York: Longman Scientific & Technical, pp. 606, 707. [ Links ]
17. Nobles, W. L.; Potti, N. D. (1968).Studies on the Mechanism of the Mannich Reaction. J. Pharm. Sci. 57 (7) 1097. [ Links ]














