Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804On-line version ISSN 2357-3791
Rev.Colomb.Quim. vol.34 no.2 Bogotá Dec. 2005
Augusto Rivera1Cilia Marilu Laverde1Jaime Ríos-Motta1Ivonne J. Nieto1Héctor Jairo Osorio2
1Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia. Ciudad Universitaria. Bogotá,D. C., Colombia. Correo electrónico: ariverau@unal.edu.co
2 Departamento de Física y Química, Universidad Nacional de Colombia, sede Manizales. Manizales, Colombia.
RESUMEN
Durante el estudio químico de la fracción esterólica del hongo Pleurotus sajor-caju se estableció que el dehidroergosterol (ergosta-5,7,9(11),22-tetraen-3-ol) presente en el extracto posiblemente no es un producto natural sino un artefacto producido durante el proceso de extracción de los esteroles con cloroformo. Este hecho se atribuyó a la presencia de sustancias fenólicas en el extracto.
Palabras Clave: Pleurotus sajor-caju,cultivo de hongos, esteroles, dehidroergosterol,ergosterol.
ABSTRACT
During the extraction of sterolic fraction of Pleurotus sajor-caju was established that dehydroergosterol (ergosta-5,7,9 (11), 22-tetraen-3-ol) present in the extract is possibly not a natural product but an artifact produced during the process of extraction of sterols with chloroform. This was attributed to the presence of phenolic substances in the extract.
Key words: Pleurotus sajor-caju, culture of fungi, sterols, dehydroergosterol, ergosterol.
INTRODUCCIÓN
Durante los continuos estudios de cuantificación de la fracción de esteroles en hongos macromicetos medicinales y/o alimenticios colombianos como posibles fuentes de vitamina D2, y teniendo en cuenta que en el proceso de beneficio del café, la principal agroindustria colombiana,existe un problema medioambiental ocasionado por las aproximadamente 2 ton/ha de pulpa de café y de madera seca proveniente del zoqueo de los cultivos de cafeto que se generan anualmente en las cerca de 8x105 ha que abarcan los cultivos (1), algunas soluciones propuestas para reducir el impacto ambiental de estos desechos contemplan considerarlos como sustratos en el cultivo de varios hongos, entre los cuales se han ensayado con éxito algunos del género Pleurotus, por ejemplo P. ostreatus y P. sajor-caju, hongos comestibles con un valor nutricional similar a la leche y la carne (2).
Algunas investigaciones relacionadas con el cultivo de P. sajor-caju han permitido establecer que se desarrolla muy bien en sustratos de pulpa de café, aserrín del tallo de cafeto (1, 3), paja de cebada, rastrojos de fríjol, de haba y sus mezclas (5-7); igualmente, que el contenido de ergosterol varía de acuerdo con el medio de cultivo empleado y sus condiciones. En este sentido, se decidió cuantificar el contenido de ergosterol presente en la fracción esterólica de P. sajor-caju cultivado en tres sustratos provenientes de la agroindustria del café: pulpa de café, aserrín de tallo y su mezcla 1:1, para establecer su potencialidad de uso como materia prima en la industria o como fuente no tradicional de alimentación. La elección el mejor medio de cultivo se realizó con base en los resultados de eficiencia biológica, definida como la relación entre el peso de los cuerpos fructíferos y el peso inicial del sustrato seco.
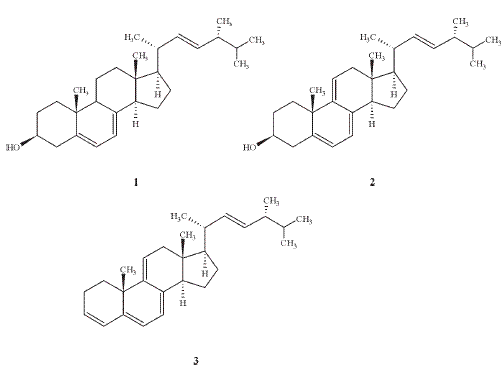
Mediante los análisis por CG-EM se determinó que las respectivas fracciones esterólicas son pobres en esteroles, pues sólo contienen tres de estos compuestos en cantidades aceptablemente buenas: ergosterol (ergosta-5,7,22-trien-3-ol) 1, dehidroergosterol (ergosta-5,7,9(11),22- tetraen-3-ol) 2 y un triterpeno que se identificó como ergosta-3,5,7,9(11),22- pentaeno 3. Aunque es conocido que el ergosterol es el constituyente principal de los hongos superiores (4), la presencia de dehidroergosterol no es común y sólo se ha aislado en la fracción esterólica de algunos hongos como Suillus luteus (8), Panellus serotinus (9), Saccharomyces cerevisiae (10), Grifola frondosa (11), Scleroderma aurantium (12) y Chlorella vulgaris (13), un alga en la cual también se comprobó la presencia de ergosterol. De otra parte, mediante experimentos de CG-EM en P. sajor-caju se pudo establecer que la concentración de 1 en los extractos clorofórmicos de la fracción esterólica experimentaba cambios con el tiempo.
Este hecho experimental llevó a reenfocar los estudios para establecer las causas de estas variaciones en el contenido de 1 y 2 presentes en los extractos clorofórmicos de los cuerpos fructíferos del hongo Pleurotus sajor-caju cultivados en los sustratos antes mencionados. Se pudo comprobar que el ergosterol 1 se transforma en dehidroergosterol 2 y que esto lo ocasionan, muy seguramente, los compuestos fenólicos presentes en el extracto clorofórmico de los esteroles.
MATERIALES Y MÉTODOS
Material de estudio
Para el cultivo del hongo Pleurotus sajor-caju en los distintos sustratos se siguió la metodología desarrollada en el Centro Nacional de Investigaciones del Café (Cenicafé) (14) y el cultivo se llevó a cabo allí mismo. Cenicafé se ubica en el municipio de Chinchiná, Caldas, Colombia, a 500" de latitud norte y 7536" de longitud oeste, a una altitud de 1.310 m.s.n.m., temperatura promedio anual de 21,4 °C, humedad relativa media de 81,0% y precipitación anual de 2.399,9 mm.
La pulpa seca de café, el aserrín de tallo del cafeto (Coffe arabiga, var. Colombia) y una mezcla 1:1 de éstos, se usaron como sustratos para el cultivo del hongo. A cada sustrato se le agregó 0,1% de carbonato de calcio y, tras homogenizar íntimamente, se empacaron en sendos costales de fibra sintética, que se mantuvieron durante 10 días en canecas de plástico, al término de los cuales se sacaron, se dejó escurrir por gravedad el exceso de agua de los sustratos, y se procedió al cultivo del hongo P. sajor-caju siguiendo la metodología desarrollada por Cenicafé (14).
Una vez desarrollados los cuerpos fructíferos, lo que ocurrió 20 días después de inocular la semilla del hongo, se cosecharon periódicamente teniendo en cuenta su madurez (calculada por el diámetro del pileo) mediante el método de torsión en el estípite. El material fúngico cosechado se secó en estufa de convección a 40 °C y después se dividió finamente empleando un molino con cuchillas plásticas y se envasó y almacenó adecuadamente para su análisis posterior.
Extracción y separación de la fracción esterólica
Simultáneamente, una muestra seca y molida (5 g) de cada uno de los hongos cosechados en los diferentes sustratos se sometió a maceración con cloroformo (6x10 mL). Cada extracto se concentró a presión reducida hasta sequedad, y de esta manera se obtuvieron los extractos clorofórmicos (EC) de los hongos cultivados: en pulpa de café (86,7 mg), en aserrín de tallo del cafeto (97,1 mg) y en su mezcla 1:1 (65,0 mg).
A cada uno de los EC se adicionaron 0,505 mg de estigmasterol como estándar interno y se redisolvieron con 3mL de éter de petróleo 40-60. A continuación, en sendas columnas de cromatografía se sometieron a partición usando como fase estacionaria silica gel para columna (Merck) de 0,062-0,200 mm y como fase móvil éter de petróleo 40-60 (EP) y acetato de etilo desde EP=100 hasta EP=70. Para cada columna se reunieron las fracciones esterólicas y se eliminó el disolvente a presión reducida. Así se obtuvieron las mezclas de esteroles totales que pesaron: pulpa de café, 46,0 mg; aserrín de tallo del cafeto, 41,8 mg, y su mezcla 1:1, 39,3 mg, que se analizaron y cuantificaron por la técnica combinada CG-EM.
Equipos, métodos y análisis
Los análisis por cromatografía de gases acoplada a espectrometría de masas CG-EM se realizaron en un cromatógrafo de gases Hewlett-Packard, modelo 6890, con un detector selectivo de masas Hewlett- Packard, modelo 5973, y una columna HP5-MS (30 m de largo y 0,33 mm de diámetro interno) y con una velocidad de flujo de gas de arrastre (He) de 1,2 mL/min. Una alícuota de 2 µL de la respectiva fracción esterólica se inyectó con división (1:4,9). El programa de temperatura se mantuvo durante 1 min en 200 °C, con una rata de 4 °C/min hasta 300 °C, durante 10 min, y el tiempo total de análisis fue de 24,79 min. Las condiciones para el detector fueron: 70 eV, impacto electrónico, rango de masas entre 33 y 550 m/z: EM voltaje (A-tune 200V), frecuencia de barrido 20 Hz y temperatura 230 °C; patrón estigmasterol con tiempo de retención promedio de 21,68 min.
Los compuestos presentes en las fracciones esterólicas se cuantificaron por CG-EM empleando el método de adición de estándar interno (8). La pureza se registró por el programa HPCHEM y el área de cada uno de los picos fue autointegrada mediante el mismo programa. La cuantificación se realizó por comparación y usando l método de áreas normalizadas.
En las tres fracciones esterólicas se hallaron los mismos tres compuestos 1-3 que se identificaron con base en el análisis de sus espectros de masas corroborado con la base de datos de la biblioteca Wiley Registry of Mass Spectral Data (15).
Ergosterol (ergosta-5,7,22-trien-3-ol)1, C28H44O, 1 tR=20,94 min. EM(IE) 70 eV, m/z (int. rel.):396[M+(55,2)]; 337[M+-59 (37,9)]; 363[M+-CH3-H2O (100)]; 271[M+-cadena lateral (16,1)]; 253[M+-cadena lateral-H2O (43,7)].
Dehidroergosterol (ergosta-5,7,9 (11),22-tetraen-3-ol) 2, C28H42O, tR = 20,33 min EM(IE) 70 eV, m/z (int. rel.): 394[M+ (21,8)]; 376[M+ - H2O (62,8)];361[M+ - CH3- H2O (8,4)]; 267[M+ -cadena lateral-2H (5,7)]; 251[M+ -cadena lateral-H2O (100)].
Ergosta-3,5,7,9(11),22-pentaeno 3 C28H40, tR = 17,21 min EM(IE) 70 eV, m/z (int. rel.): 376[M+(62,8)]; 251[M+-cadena lateral (100)]; 236[M+-cadena lateral-CH3 (17,4)]; 209 [fisión anilloD(18,0)]; 155[fisión anillo C (25,6)].
RESULTADOS Y DISCUSIÓN
La producción del sustrato siguiendo el método y la formulación descritos (14) permitió disponer de un medio adecuado para el crecimiento del micelio y el desarrollo de las fructificaciones en condiciones ambientales de P. sajor-caju, y se obtuvo la mayor eficiencia biológica, en porcentaje, para el hongo cultivado en la mezcla pulpa de café:aserrín de tallo (88,4%), seguido del cultivado en pulpa de café con un 69,5%, valores que concuerdan con los obtenidos para otros cultivos del mismo hongo tanto en residuos del café como en otros subproductos agroindustriales, pero son muy superiores a los obtenidos cuando el cultivo de P. sajor-caju se efectuó en desechos de cultivo de algodón, o sorgo, solos o mezclados (41,4%, 6,8% y 35,2%, respectivamente) (6). En el cultivo en aserrín del tallo la eficiencia biológica sólo alcanzó 29,8%, valor similar al obtenido (27,3%) en cultivos empleando los desechos fibrosos de la cáscara de coco (6).
Al efectuar el triplicado de los análisis 6h después del duplicado, se observó que las cantidades de ergosterol 1 y dehidroergosterol 2 habían sufrido variaciones: disminuyó la de 1 y aumentó la de 2, sin que se observara ningún cambio en el área relativa de 3. En la Figura 1 se presenta la variación en el tiempo de la relación de áreas entre ergosterol y dehidroergosterol.
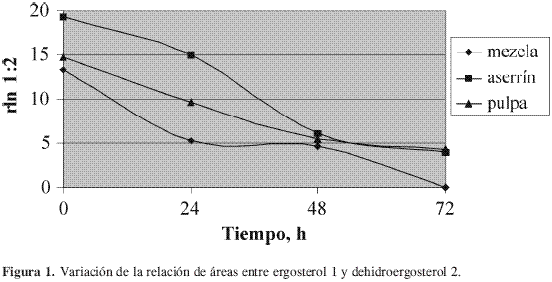
Como se puede deducir de los datos graficados, se presentó un notorio aumento en la concentración relativa de 2 con respecto a 1. Aunque la transformación fotoquímica de 1 hasta vitamina D2 5 pasando por precalciferol 4 (Esquema 1) (16) es conocida desde mucho tiempo atrás, la oxidación de 1 hasta 2 en un extracto clorofórmico de los cuerpos fructíferos de un hongo no fue hallada en la literatura revisada.
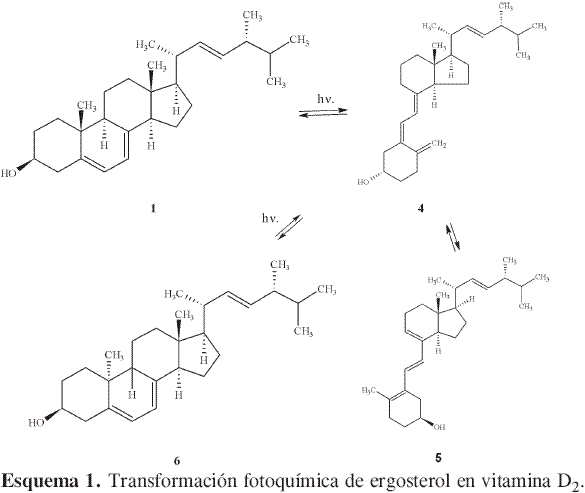
Para verificar si esta oxidación era generada o no por sustancias presentes en el medio, se realizaron las mismas mediciones para una solución clorofórmica de una muestra patrón de ergosterol. En ningún caso se observó la presencia del dehidroergosterol 2, lo que permite concluir que la transformación a dehidroergosterol es consecuencia de sustancias presentes en los extractos.
Salmones y col. (17), en un trabajo reciente sobre hongos del género Pleurotus,evidenciaron la capacidad de estos Basidiomicetos para biodegradar cafeína y compuestos fenólicos, durante sus estudios en muestras de Pleurotus {P. djamor, P. ostreatus y P. pulmonarius} que fueron cultivadas en pulpa de café y paja de trigo. En ese trabajo, los autores comprobaron la disminución de la concentración de ese tipo de sustancias en los medios de cultivo, durante la maduración de los cuerpos fructíferos. Adicionalmente, se ha demostrado la existencia de compuestos fenólicos en extractos de hongos tanto comerciales como silvestres (18, 19, 20) y, además, que la concentración de fenoles depende del disolvente usado. En estos trabajos (18, 19) también se evaluaron las propiedades antioxidantes de los hongos estudiados, mismas que están estrechamente relacionadas con el contenido de fenoles totales. Osorio (21) en sus estudios de la composición química del hongo P. sajor-caju demostró que este hongo incorpora cafeína desde el medio de cultivo, lo cual demostró la capacidad de este hongo para incorporar nutrientes del medio.
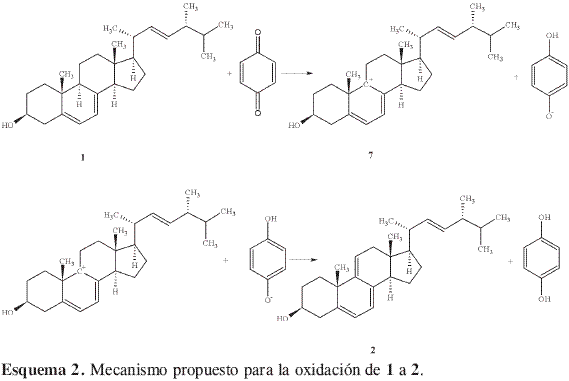
Con base en lo anterior, se planteó la hipótesis de que en el proceso de extracción de los esteroles algunos o todos los compuestos fenólicos también podrían ser extraídos y, en consecuencia, ser los responsables de la transformación de 1 en 2. Para verificar esta hipótesis se efectuó una serie de experimentos consistentes en adicionar pequeñas cantidades de hidroquinona a soluciones de concentración variable de un patrón de ergosterol. El efecto fue la aparición de 2 al cabo de 6 h de agregado el fenol. Esto demostró que muy probablemente 2 no es un producto natural proveniente del metabolismo de P. sajor-caju, sino un artefacto. Ahora bien, estos resultados no son de ninguna manera extraños pues los esteroles son susceptibles de oxidarse y en la literatura se encuentran varios ejemplos de oxidación de esta clase de compuestos con agentes fácilmente reducibles. Por ejemplo, Brown y Turner (22) informaron sobre el uso de quinonas para la dehidrogenación de neoergosteroles. Esta dehidrogenación ocurre por la abstracción de iones hidruros, lo que genera un carbocatión. En el ergosterol, las posiciones alílicas más activas para que ocurra esta abstracción serían H-4, H-9 o H-14; las más favorecidas son H-9 y H-14 dado el carácter terciario frente al secundario de H-4; además el producto final de esta oxidación sería el 3-ceto derivado, pasando por un intermediario tipo enol, que no estáde acuerdo con los resultados obtenidos en este trabajo. La mayor estabilidad del sistema trieno conjugado Δ5,7,9(11) frente al sistema Δ5,7,14 favorece la generación del dehidroergosterol frente a su isómero, pasando por un intermediario iónico tipo carbocatión 7, el cual sufre luego la eliminación de H+ y produce el doble enlace entre los carbonos 9 y 11. En el Esquema 2 se presenta un posible mecanismo para la conversión de ergosterol 1 en dehidroergosterol 2.
CONCLUSIONES
El valor nutricional de los hongos cultivados en desechos agroindustriales del café puede verse afectado por la presencia de polifenoles, ya que éstos pueden generar una disminución del contenido de ergosterol, lo cual hace necesario que se determine el contenido de estas sustancias en el medio y que se prevea la posible disminución del contenido de ergosterol, ya que la degradación hasta dehidroergosterol hace que el hongo sea descartado como una posible fuente de vitamina D2.
BIBLIOGRAFÍA
1. Rodríguez, V. N. (2000). Investigación básica sobre el cultivo de hongos tropicales en residuos agroindustriales de la zona cafetera colombiana. Chinchiná, Cenicafé (experimento QIN-6-01), disciplina de Química Industrial, p. 90. [ Links ]
2. Soto, O.; Saucedo, G.; Pablos-Hack, J. L.; Gutiérrez M.; Favela T. E. (1999). Effect of substrate composition on the mycelial growth of Pleurotus ostreatus. An analysis by mixture and response surface methodologies. Process Biochem. 35, 127. [ Links ]
3. Trigos, A.; Martínez, D.; Hernández,R.; Sobal, M. (1997). Ergosterol content in fruit bodies of Pleurotus is variable. Micol. Apl. Int. 10, 93. [ Links ]
4. Trigos L. A.; Matínez, C. D. Hongos comestibles cultivados como fuentes potenciales de ergosterol. En: Rivera, A. (1998). Producción de Vitamina D2 a partir de hongos macromicetos: aspectos científicos, técnicos y económicos. CYTEDCOLCIENCIAS, Ed. Guadalupe,Bogotá, p. 75. [ Links ]
5. Bonatti, M.; Karnopp, P.; Soares, H. M.; Furlan, S. A. (2004). Eva-luation of Pleurotus ostreatus and Pleurotus sajor-caju nutritional characteristics when cultivated in different lignocellulosic wastes. Food Chemistry 88 (3) 425. [ Links ]
6. Ragunathan, R.; Swaminathan, K. (2003). Nutritional status of Pleurotus spp. grown on various agro-wastes. 80 (3) 371. [ Links ]
7. Ragunathan, R.; Gurusamy, R.; Palaniswamy,M.; Seetharaman, K. (1996). Cultivation of Pleurotus spp on various agro-residues. Food Chemistry 55, 139. [ Links ]
8. Rivera, A.; Nieto, I. J.; Valencia,M. A. (2002). Composición y cuantificación por cromatografía de gases acoplada a espectrometría de masas de la fracción esterólica de once hongos colombianos. Rev. Col. Quím. 31, 95. [ Links ]
9. Yaoita, Y.; Matsuki, K.; Iijima, T.; Nakano, S.; Kakuda, R.; Machida, K.; K.; Kikuchi, M. (2001). New sterols and triterpenoids from four edible mushrooms. Chem. Pharm. Bull. 49 (5) 589. [ Links ]
10. Le Fur, Y.; Maume, G.; Feuillat,M.; Maume, B. F. (1999). Characterization by gas chromatography/ mass spectrometry of sterols in Saccharomyces cerevisiae during autolysis 47 (7) 2860. [ Links ]
11. Ishizuka, T.; Yaoita, Y.; Kikuchi,M. (1998). Sterols from fruit bodies of Grifola frondosa. Natural Medicines 52 (3) 276. [ Links ]
12. Vrkoc, J.; Budesinský, M.; Dolejs,L. (1976). Constituents of the basidiomycete Scleroderma aurantium. Phytochemistry 15 (11), 1782. [ Links ]
13. Akihisa, T.; Hori, T.; Suzuki, H.; Sakoh, T.; Yokota, T.; Tamura, T. (1992). 24β-methyl-5α-cholest-9(11)-en-3β-ol, two 24β-alkyl-Δ5,7,9(11)-sterols and other 24β-alkylsterol from Chlorella vulgaris.Phytochemistry 31 (5) 1769. [ Links ]
14. Rodríguez, V. N. (2002). Informe anual de actividades 2001-2002. Cenicafé, disciplina de Química Industrial, Chinchiná, Colombia, p. 113. [ Links ]
15. Wiley Registry of Mass Spectral Data. 6th ed. (1944). Wiley: New York. [ Links ]
16. Rauter A. P.; Prata, C.; Bermejo, J.Transformaciones fotoquímicas del ergosterol. En: Rivera, A. (1998). Producción de vitamina D2 a partir de hongos macromicetos: aspectos científicos, técnicos y económicos. CYTED-COLCIENCIAS, Ed. Guadalupe, Bogotá, p. 125. [ Links ]
17. Salmones, D.; Mata, G.; Walizewski,K. N. (2004). Comparative culturing of Pleurotus spp on coffee pulp and wheat straw: biomass production and substrate biodegradation. Biores. Technol. 96 (5) 537. [ Links ]
18. Cheung, L. M.; Cheung, P. C. K.;Ooi, V. E. C. (2003). Antioxidant activity and total phenolics of edible mushroom extracts. Food Chemistry 80 (2) 249. [ Links ]
19. Yang, J. H.; Lin, H. C.; Mau, J. L. (2002). Antioxidant properties of several commercial mushrooms. Food Chemistry 77 (2) 229. [ Links ]
20. Lorenzen, K.; Anke, T. (1998). Basidiomycetes as a source for new bioactive natural products. Current Organic Chemistry 2 (4) 329. [ Links ]
21. Osorio, H. J. Estudio comparativo por CG-EM de las fracciones esterólicas del hongo Pleurotus sajor-caju cultivado en desechos del café (pulpa,aserrín de tallo y su mezcla). Maestría en Ciencias-Química, Tesis, Universidad Nacional de Colombia, Bogotá, 2004, p. 22. [ Links ]
22. Brown, W.; Turner, A. B. (1971).Applications of High-potential Quinones. Part. VI. Stereoelectronic Effects in the Dehydrogenation of Neoergosterols. J. Chem. Soc. (C), 2057. [ Links ]




![NOVEL ASPECTS OF THE MANNICH-TYPE REACTION IN BASIC MEDIUM BETWEEN 1,3,6,8-TETRAAZATRICYCLO [4.4.1.1(3,8)] DODECANE (TATD) AND PHENOLS](/img/en/prev.gif)









