Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Colombiana de Química
versión impresa ISSN 0120-2804versión On-line ISSN 2357-3791
Rev.Colomb.Quim. v.34 n.2 Bogotá dic. 2005
Hugo Alfonso Rojas Sarmiento1Gloria Borda Guerra1Jesús Sigifredo Valencia Ríos2José Jobanny Martínez Zambrano2Patricio Alberto Reyes Núñez3
1 Grupo de Catálisis (GC-UPTC), Escuela de Química, Facultad de Ciencias, Universidad Pedagógica y Tecnológica de Colombia, Tunja, Colombia. Correo electrónico:hrojas@tunja.uptc.edu.co
2 Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia, Bogotá D.C., Colombia.
3 Laboratorio de Catálisis III, Departamento de Físico-Química, Facultad de Ciencias Químicas, Universidad de Concepción,Concepción, Chile.
RESUMEN
En este trabajo se muestra la hidrogenación del citral sobre catalizadores de Ir e Ir-Fe/TiO2 reducidos a 773 K (HTR). La preparación de los catalizadores se realizó con soluciones acuosas de H2IrCl6 para obtener una carga de metal al 1% y por impregnación de FeCl3, lo cual permitió obtener los correspondientes sistemas bimetálicos. Todos los catalizadores presentaron una selectividad del 100% hacia los alcoholes insaturados (geraniol y nerol). La caracterización de los sólidos se efectuó mediante quimisorción selectiva de hidrógeno a 298 K, DRX, TPR y XPS. Los resultados de actividad intrínseca y selectividad se explican con base en los datos de caracterización que ponen en evidencia el efecto de una fuerte interacción metal-soporte (SMSI). También se muestra la descripción de un reactor tipo STR donde se efectuó la evaluación de la actividad intrínseca del catalizador.
Palabras clave: hidrogenación de citral,catalizadores de Ir, catalizadores IrFe, soporte de TiO2, interacción meta-soporte.
ABSTRACT
The citral hydrogenation was studied over Ir-Fe/TiO2 catalysts reduced at 773 K (HTR: high temperature reduction). The catalysts synthesis was made using H2IrCl6 aqueous solution to get ca. 1% wt Ir load and by impregnating FeCl3 solution to obtain bimetallic catalysts. The results showed that all of the studied Ir/TiO2 and Fe–Ir/TiO2 catalysts display high selectivities (ca. 100%) towards the unsaturated alcohols (geraniol and nerol) during citral hydrogenation. Solids were charac-terized by selective H2 chemisorption, XRD, TPR and XPS. Intrinsic activity and selectivity data are explained in agreement to the characterization results showing the metal support interaction effect (SMSI). Also is showed the description of a reactor STR (stirred tank reactor) for the evaluation of the intrinsic catalytic activity.
Key words: Citral hydrogenation, Ir catalyst, Ir Fe catalysts, TiO2 support, SMSI.
INTRODUCCIÓN
Las reacciones de hidrogenación catalítica son fundamentales para la síntesis y fabricación de sustancias de alto valor agregado, generalmente con catalizadores soportados (1) y el uso de reactores apropiados a las condiciones de reacción (2, 3, 4, 5, 6, 7), toda vez que las variables operacionales y características del reactor empleado pueden afectar la reacción.
En la evaluación experimental de catalizadores,además de los reactores PFR (plug flow reactor), los reactores tipo STR (stirred tank reactor) son muy utilizados (8), tanto en investigación básica como en muchos procesos industriales de la química fina (9). La producción en STR se lleva a cabo en equipos tipo estándar que pueden adaptarse de acuerdo con una reacción en particular. Las limitaciones de transporte de masa y de calor pueden superarse con la agitación y el tamaño de partícula; existen algunos criterios como el de Weisz-Prater (10) y el ensayo de Madon-Boudart (11) que permiten evaluar la incidencia de estos fenómenos.
En este trabajo se presenta el uso de un reactor tipo STR, diseñado y construido en la UPTC, para la reacción de hidrogenación de citral usando catalizadores de iridio-hierro soportados sobre TiO2, reducidos a 773 K (HTR: alta temperatura de reducción).
La reacción de hidrogenación de citral se eligió con base en el interés creciente por la hidrogenación selectiva de aldehídos α, β-insaturados, especialmente importantes en el campo de la química fina (12). El citral tiene tres sitios de hidrogenación; el doble enlace conjugado, el grupo carbonilo y el doble enlace aislado. Las distintas posibilidades de hidrogenación del citral se muestran en la Figura 1. La hidrogenación del grupo carbonilo de los dos isómeros del citral E y Z produce los isómeros cis y trans de alcoholes insaturados, 3,7-dimetil-6-octen-1-ol; nerol y geraniol, respectivamente. La hidrogenación del doble enlace conjugado produce 3,7-dimetil-6-octenal (citronelal). La posterior hidrogenación del grupo carbonilo del citronelal produce 3,7-dimetil-6- octen-1-ol (citronelol), y al hidrogenarse el doble enlace aislado la molécula queda completamente saturada (3,7-dimetil octanol).
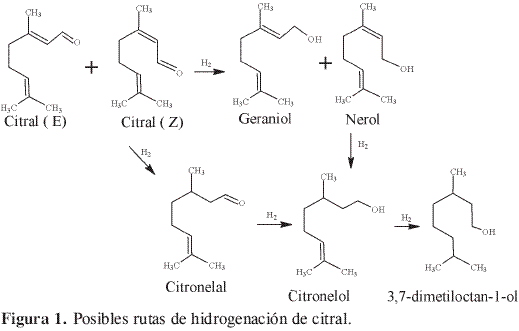
El propósito principal de este trabajo es la obtención del alcohol insaturado, para lo cual se requiere controlar la selectividad, permitiendo la hidrogenación del grupo carbonilo sin alterar los enlaces C=C. Se ha planteado que los catalizadores de metales nobles soportados en TiO2 pueden ser muy activos y selectivos en la hidrogenación del citral (13) y que las condiciones de reducción y el uso de precursores catiónicos como iones Fe3+ y Ge4+ pueden tener un efecto favorable sobre la actividad y la selectividad en este tipo de reacciones (14).
En la literatura se menciona que el uso de soportes parcialmente reducibles como TiO2, CeO2, Nb2O5 (13, 15) puede contribuir al control de la selectividad en reacciones de hidrogenación; este control puede explicarse por la migración de especies sobre los cristales del metal que originan la polarización de la molécula de aldehído α, β-insaturado; en consecuencia, la hidrogenación ocurrirá preferencialmente sobre el grupo carbonilo, con lo cual los enlaces C=C (16) se mantienen intactos.
PARTE EXPERIMENTAL
Descripción del reactor usado
Se construyó un reactor tipo STR para la evaluación catalítica (17) en acero 304 SS, compuesto por tres partes: cuerpo cilíndrico, tapa y anillos de seguridad, como se observa en la vista longitudinal de la Figura 2a. El cilindro tiene una capacidad aproximada de 300 cm3, un espesor de pared de 0,60 cm y una longitud de 25 cm; en el interior se inserta un vaso construido en Teflón®, con pared de 1 m, que garantiza inercia frente a las reacciones y es capaz de soportar temperaturas del orden de 230 °C. En la tapa (Figura 2b) se encuentran dos llaves, una para alimentación de gases y reactivos y otra para toma de muestras; la parte superior de este aditamento se une a un manómetro de aceite y permite la introducción de un sensor de temperatura (termocupla tipo K) que está conectada a un control de temperatura Watlow Instruments.
Para la introducción del reactivo líquido se usa una válvula de dos vías (1/4" de diámetro interno), que además sirve para aliviar la presión en el momento de terminar la reacción. Para la alimentación de gases y toma de muestras se utiliza una válvula de 3 vías, conectada mediante un tubo de 1/8 a un filtro de 100 mallas (0,15 mm) que evita la pérdida de catalizador en el momento del muestreo, permaneciendo en el lecho catalítico. El cilindro y la tapa del reactor se ajustan a través de un flanche que se sujeta con un anillo de seguridad para garantizar la hermeticidad del reactor. El reactor se soporta sobre una plancha que permite la agitación a través de una barra imantada, como se ilustra en la Figura 2c. La temperatura del medio de reacción se alcanza a través de una camisa calefactora que rodea el cilindro del reactor y que permite obtener una deriva uniforme, la cual se regula utilizando un control Watlow Instruments serie 901 tipo PID que garantiza una inercia menor del 1%.

Preparación de los catalizadores
Los catalizadores de Ir soportados se prepararon por impregnación de TiO2 cristalino (P25-Degussa, SBET = 72 m2 g–1) a 313 K, con una cantidad adecuada de solución acuosa de H2IrCl6 (Aldrich>99%) para obtener un 1% en peso de metal. Luego de la impregnación, las muestras se secaron a 373 K por 24 h y se calcinaron a 673 K por 4 h; la reducción de los sólidos se llevó a cabo a 773 K durante 2 h. Los catalizadores reducidos se pusieron en contacto con soluciones de FeCl3 en la cantidad requerida para obtener relaciones atómicas Fe/Ir entre 0,5 y 3,0.
Caracterización
Los estudios de quimiadsorción de H2 se efectuaron a 298 K en un sortómetro Micromeritics ASAP 2010. Los experimentos de reducción térmica programada se realizaron en un analizador TPD/TPR Micromeritics 2900, empleando una mezcla 5%H2/Ar (50 cm3min–1) y una velocidad de calentamiento de 10 K min–1. El análisis de DRX se efectuó en un difractómetro Rigaku, para lo cual la muestra en polvo se colocó en un soporte de vidrio y se llevó al portamuestras, efectuando un barrido de 2θ de 0 a 70,0°. Los análisis de XPS se efectuaron en un espectrómetro Escalab 200R provisto de un analizador hemiesférico, utilizando un ánodo de Mg (radiación Ka, hv = 1253,6 eV) operado a 10 mA y 120 kV; el equipo está provisto de una celda de reacción que permite efectuar tratamientos de reducción in situ.
Evaluación catalítica
Para realizar los ensayos catalíticos de hidrogenación del citral, el catalizador se somete a reducción, en presencia de hidrógeno, a 773 K (HTR). En cada estudio se utilizaron aproximadamente 300 mg de catalizador, se efectuó una reducción in situ, a las condiciones de reacción, para lo cual se hizo pasar hidrógeno en flujo continuo durante dos horas después de alcanzar la temperatura de reacción con el propósito de eliminar cualquier posible oxidación superficial. Posteriormente el sistema de reacción se purgó con nitrógeno, se inyectó citral (Merck > 98%, mezcla de isómeros E y Z) a la concentración requerida; 0,1 M en heptano (Aldrich>98%) y se calentó en atmósfera de nitrógeno hasta la temperatura de reacción (363 K); luego se hizo pasar un flujo de hidrógeno durante 5 min, se cerró la salida del reactor y se permitió la entrada de hidrógeno hasta alcanzar la presiónde trabajo (0,62 MPa).
Una vez alcanzada la presión de trabajo, se permitió la estabilización del sistema, se puso en marcha el sistema de agitación (1000 rpm) y se dio inicio a la reacción. Las muestras tomadas sistemáticamente del reactor permitieron analizar la composición de reactivos y productos mediante cromatografía de gases, previa estandarización con el uso de patrones comerciales de los productos hidrogenados de citral (Merck>98%) en una concentración de 0,05Ma 0,5 M. El seguimiento de la conversión del citral se efectuó en un cromatógrafo de gases Varian 3400, equipado con un detector FID. Se utilizó una columna HPwax (30 m x 0,53 mm x 1,0 µm), la cual se mantuvo isotérmicamente a 150 °C. Las temperaturas del inyector y del detector fueron de 200 °C. Como gas de arrastre se empleó helio a un flujo de 1,0 cm3min–1. Bajo estas condiciones cromatográficas los tiempos de retención de citral y sus productos hidrogenados fueron: citral (E): 21,2 min; citral (Z): 23,7 min; nerol: 31,2 min; geraniol: 36,5 min; citronelal: 10,4 min. La conversión se definió como el número de moles de producto formado respecto del número de moles de reactivo alimentado por 100 y la selectividad se definió como la cantidad molar de producto de interés formado respecto de la cantidad total de moles de productos por 100.
RESULTADOS Y DISCUSIÓN
Condiciones de operación del reactor
Antes de usar el reactor para las pruebas catalíticas, se confirmó su hermeticidad y se establecieron las condiciones de trabajo necesarias para verificar que la hidrogenación del citral no estuviese gobernada por efectos difusionales. En este propósito, el reactor se selló y se mantuvo con una carga de gas de 1,38MPa durante 48 h. No se observó reducción en la presión.
Para determinar el rango de velocidad de agitación se cargó una solución de citral 0,5 M en heptano a 363 K y 0,62 MPa; se utilizó catalizador con tamaño promedio de partícula de 150 µm; se tomaron medidas de la velocidad de reacción a diferentes velocidades de agitación (100, 200, 400, 500, 1000 rpm). Los experimentos permitieron establecer que se requieren velocidades de agitación superiores de 500 rpm para evitar problemas difusionales externos. En este trabajo la velocidad de agitación se fijó en 1000 rpm.
Una segunda serie de experimentos consistió en determinar el tamaño más adecuado de partícula para minimizar los efectos difusionales intrapartícula, por lo cual se utilizó como criterio el parámetro Weisz-Prater (7), escrito en la forma:
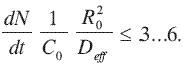
donde:
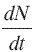 es la velocidad de reacción (moles s–1 cm–3).
es la velocidad de reacción (moles s–1 cm–3).
C0 es la concentración externa del reactante hacia la partícula de la superficie interna del catalizador.
R0 es el radio efectivo de la partícula (cm).
Deff es el coeficiente de difusión (cm-2 s-1).
Las pruebas consistieron en tomar diferentes tamaños de partícula usando diferentes mallas US Standard, en el rango de 20 a 140. Se efectuaron medidas de velocidad de reacción a 1000 rpm; se encontró un comportamiento lineal que luego tiende a curvarse con pendiente negativa. En la parte lineal se aplicó el parámetro de Weisz-Prater y se estimó como tamaño promedio de partícula 150 µm para efectuar las pruebas catalíticas en ausencia de efectos difusionales.
Una vez seleccionadas las condiciones de agitación y de tamaño de partícula de catalizador, se confirmó que la transferencia de masa no es una etapa limitante en la conversión del citral; así, se midió la conversión sobre diferentes masas de catalizadores, en una hora de reacción, bajo las condiciones de operación antes mencionadas: la ausencia de limitaciones de transporte de masa se verificó dada la tendencia lineal de una gráfica de conversión en función de la masa de catalizador, como se destaca en la Figura 3.
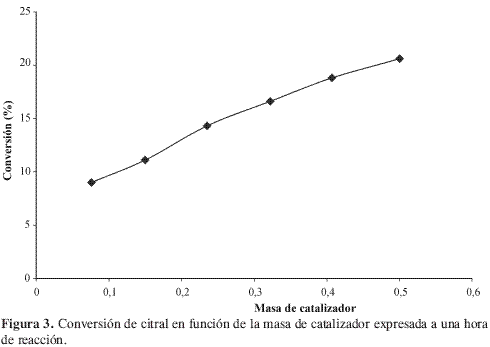
Si bien los ensayos de Madon-Boudart no se realizaron en este estudio, los trabajos de Sighn en catalizadores monometálicos de Pt soportado en SiO2 o en TiO2 (13) verifican que bajo condiciones de trabajo similares a las establecidas (agitación de 1000 rpm, tamaño de partícula de 100 mallas US Standard y 0,1 mg de catalizador) garantizan ausencia de limitaciones de transferencia interna y externa de masa y de calor en reacciones este tipo.
Caracterización de los catalizadores
En la Tabla 1 se presentan los resultados obtenidos en el estudio de quimiadsorción de H2, donde se revela que los catalizadores Fe-Ir/TiO2 (HTR) prácticamente no presentan variación en la razón H/Ir comparada con el sistema monometálico. Esto se explica considerando el bajo valor mostrado por los catalizadores Ir/TiO2 HTR, debido a la migración superficial de especies parcialmente reducidas de TiOx sobre los cristales de Ir generadas por el efecto SMSI; por tal motivo es más adecuado indicar estos valores como relación H/Ir.
Como era de esperarse, la difracción de rayos X mostró sólo las reflexiones correspondientes al soporte, indicativo del alto grado de distribución de las especies metálicas involucradas.
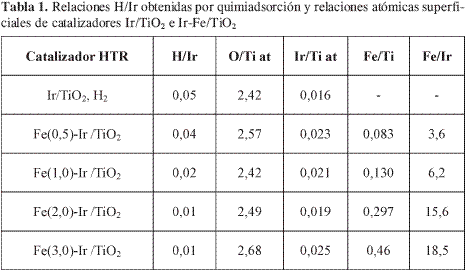
La Figura 4 muestra los perfiles de reducción de los catalizadores Fe-Ir/TiO2 HTR. En trabajos previos se ha mostrado que la reducción de óxido de iridio soportado tiene lugar en una transición cuya señal emerge entre 390 y 400 K; por el contrario, el Fe2O3 soportado se reduce en dos etapas centradas a 573 y 840 K, respectivamente, que se atribuyen a los siguientes pasos: i) Fea2O3(s) + H2(g) Fe2O4(s) + H2O(g) y ii) Fe2O4(s) + H2(g) Fe(s) + H2O(g).
La Figura 4 resalta el termograma de reducción del óxido inicial donde se observan dos picos de reducción: el primero, muy pequeño, centrado a 483 K, que se asigna a la reducción de especies oxidadas de hierro, situadas en las proximidades de iridio, mientras que el segundo, ubicado en cercanías de 610 K, se atribuye a la reducción de partículas aisladas de óxido de hierro. Al aumentar la carga de hierro, se produce un ligero aumento de intensidad en ambos picos de reducción y, en alguna medida, desplazamientos hacia menores temperaturas del primero de los óxidos (Fe2O3) que puede encontrar una posible explicación en un fenómeno de spillover de hidrógeno desde los cristales de iridio (18), con lo que se promueve la reducción del óxido de hierro.
Adicionalmente, los resultados de TPR permiten concluir que bajo las condiciones de la reacción el iridio se encuentra en estado reducido, debido a que el consumo de hidrógeno se verifica desde los 473 K, una temperatura muy superior a la empleada en la reacción (363 K). Ocurrido el tratamiento de los sólidos con hidrógeno en el modo programado y reoxidados a 673 K, se efectuó una nueva reducción, que se ilustra en la Figura 4, donde se observan cambios muy drásticos en los perfiles de reducción, reflejados básicamente en la aparición de un pico agudo en las vecindades de 383 K debido a la reducción de óxidos de iridio (19). Este pico experimenta un ligero desplazamiento hacia temperaturas superiores al aumentar el contenido de hierro y al mismo tiempo un pequeño ensanchamiento. Este comportamiento puede explicarse en función de una redistribución del óxido de hierro, en virtud de una migración hacia las cercanías de las partículas de iridio, que a través de un probable fenómeno de spillover de hidrógeno hace más fácil la reducción de los óxidos correspondientes. Bukur y Sivaraj han encontrado patrones de reducción sustancialmente distintos para catalizadores de Fe2O3 soportados sobre silica (20), evento que hace suponer el concurso de la migración de hidrógeno en la reducción de sistemas Fe-Ir/TiOz2. En todos los casos estudiados se logró la completa reducción de ambos componentes metálicos.
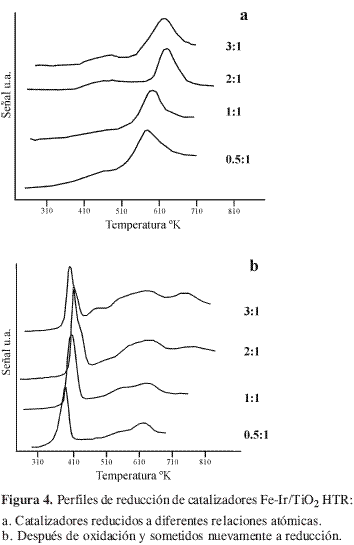
Las energías de enlace, correspondientes al fotón 4f7/2, exhibidas por el iridio en todos los catalizadores fueron de 61,0 ± 0,1 eV, sugiriendo la presencia de especies de iridio elemental (21) tanto en catalizadores monometálicos como en bimetálicos (Figura 5a). Los espectros de Fe2p3/2 son algo más complejos y van acompañados de la presencia de un pico satélite (Figura 5b). El valor de la energía de enlace, 709,9 ± 0,1 eV, corresponde con la transición esperada para las especies Fe3+, lo cual está en completo acuerdo con los resultados de TPR. Los niveles de energía del O1s aparecen desdoblados a 530 ± 0,1 eV y 530,9 ± 0,1 eV. El primero de ellos corresponde a oxígeno de la red Ti-O-Ti y el segundo a grupos Ti-OH superficiales. La proporción de estos últimos es menor en los catalizadores que en el soporte (relación O/Ti para TiO2 en el catalizador HTR =2,88), al estar involucrados los hidroxilos superficiales en sitios de anclaje del metal. La razón superficial Ir/Ti es aproximadamente constante, en cambio la razón Fe/Ti de superficie crece al aumentar el contenido de hierro. El incremento de la razón atómica superficial Fe/Ti es proporcional al aumento del contenido de Fe, lo que indica que las especies oxidadas de hierro tienen un grado de dispersión similar. La última columna de la Tabla 1 revela que los catalizadores Fe-Ir/TiO2 presentan un significativo enriquecimiento superficial en hierro.
Evaluación catalítica
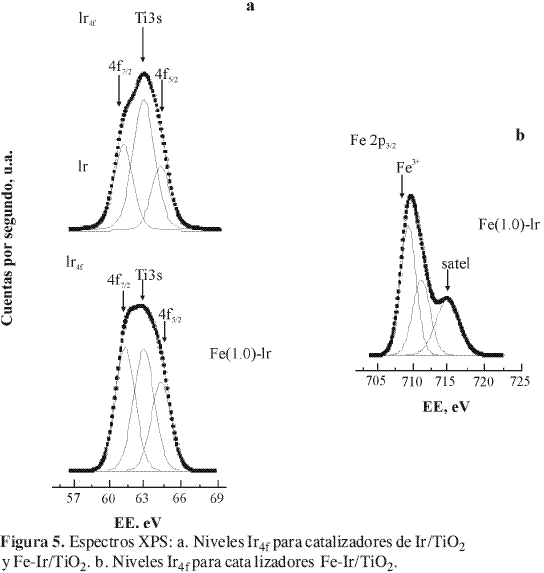
Bajo las condiciones de reacción estudiadas,los únicos productos observados de la hidrogenación del citral fueron geraniol y nerol, que corresponde a la hidrogenación selectiva del grupo carbonilo. En la Figura 6 se representa la evolución de la conversión en función del tiempo de reacción para la serie de catalizadores estudiada. Se muestra que la velocidad de conversión es mayor dentro de las tres primeras horas de reacción, para luego decaer considerablemente a medida que avanza el proceso.
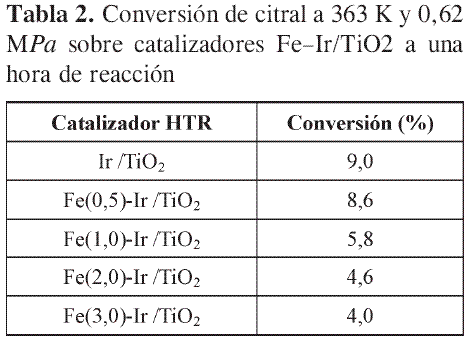
La serie de catalizadores Fe-Ir/TiO2 HTR muestra que los niveles de conversión son menores a medida que aumenta el contenido de hierro. Esto se atribuye a que en los catalizadores monometálicos HTR (Ir/TiO2) se crean sitios interfaciales muy activos. La adición de hierro a los catalizadores HTR destruye sitios interfaciales, lo que ocasiona un descenso en la actividad. En procesos de hidrogenación selectiva es fundamental comparar las actividades al mismo nivel de conversión (análisis en condiciones de isoconversión), debido a que la selectividad se ve fuertemente afectada por estos niveles. Bajo las condiciones de este estudio, todos los catalizadores exhiben una selectividad del 100% selectivos hacia la hidrogenación del C=O; luego, es posible comparar la conversión a un determinado tiempo de reacción, como se indica en la Tabla 2.
CONCLUSIONES
Las pruebas de caracterización indican que el iridio se encuentra en estado reducido (Ir0) y el hierro oxidado (Fe3+) a las condiciones de reacción.
Los resultados muestran que los catalizadores de Ir/TiO2 presentan una elevada selectividad hacia la obtención de alcoholes insaturados durante la hidrogenación de citral, debido a la formación de especies reducidas TiOx que originan el fenómeno SMSI. Para catalizadores bimetálicos, a medida que aumenta el contenido de hierro, se observa una reducción en la actividad ocasionada por la destrucción de sitios interfaciales.
Agradecimientos: Al Laboratorio de Catálisis III de la Facultad de Química de la Universidad de Concepción, Chile, por su colaboración en las pruebas de caracterización.
A la Dirección de Investigaciones (DIN) de la UPTC, Tunja, Colombia, por el apoyo otorgado al proyecto interno DIN-9002.139
BIBLIOGRAFÍA
1. Chen, B.; Dingerdissen, U.; Krauter, J. G. E.; Lansink Rotgerink, H. G. J.; Möbus, K.; Ostgard, D. J.; Panster, P.; Riermeier, T. H.; Seebald, S.; Tacke, T.; Trauthwein, H. (2005). New developments in hydrogenation catalysis particularly in synthesis of fine and intermediate chemicals. Appl. Catal. A: General. 280:1, 17. [ Links ]
2. Louleh, Z.; Cabassud, M.; Le Lann,M.-V. (1999). A new strategy for temperature control of batch reactors: experimental application. Chem. Eng. J. 75: 11. [ Links ]
3. Stitt, E. H. (2002). Alternative multiphase reactors for fine chemicals. A world beyond stirred tanks? Chem. Eng. J. 90: 47. [ Links ]
4. Westerterp, K. R.; Molgal, E. J.; van Gelder, K. B. (1997). Catalytic hydrogenation reactors for the fine chemicals industries. Their design and operation. Chem. Eng. Process. 36:17. [ Links ]
5. Carpenter, K. J. (2001). Chemical reaction engineering aspects of fine chemicals manufacture. Chem. Eng. Sci. 56: 305. [ Links ]
6. Thomson, S.; Hoffmann, C.; Ruthe,S.; Schmidt, H.-W.; Schüth, F. (2001). The development of a high throughput reactor for the catalytic screening of three phase reactions. Appl. Catal. A: General. 220: 253. [ Links ]
7. Kapteijn, F.; Moulijn, J. A. (1997). Laboratory catalytic reactors: aspects of catalyst testing. In: Handbook of Heterogeneous Catalysis, eds. G. Ertl et al., Wiley-VCH, 3, 1359. [ Links ]
8. Augustine, R.; Tanielyan, S. (2003). Small scale reactors for catalyst evaluation and process optimization. In: Catalysis of organic reactions. USA: Ed. Dupont Co., Delaware, 275. [ Links ]
9. Fogler, H. S. (1992). Elements of Chemical Reaction Engineering, 2nd ed. Englewood Cliffs, N.J.: Prentice- Hall, 352. [ Links ]
10. Weisz, P. B. (1957). Diffusity of Porous Particles. Z. Phys. Chem. 11: 1. [ Links ]
11. Madon, R. J.; Boudart, M. (1982). Experimental criterion for the absence of artifacts in the measurement of rates of heterogeneous catalytic reactions. Ind. Eng. Chem. Fundam. 21: 438. [ Links ]
12. Singh, U. K.; Vannice, M. A. (2001). Liquid phase citral hydrogenation over SiO2–supported group VIII metals. J. Catal. 199: 79. [ Links ]
13. Singh, U. K.; Vannice, M. A. (2001). Kinetics of liquid phase hydrogenation reactions over supported metal catalysts, a review. Appl. Catal. A: General. 213. [ Links ]
14. Galvano, S.; Donato, A.; Neri, G. (1989). Hydrogenation of cinnamaldehyde over platinum catalysts: influence of addition of metal chlorides J. Mol. Catal. 49: 223. [ Links ]
15. da Silva, A. B.; Jordao, E.; Méndez, M. J.; Fouilloux, P. (1997). Effect of metal support interaction during selective hydrogenation of cinnamaldehyde to cynnamyl alcohol with platinum based bimetallic catalysts. Appl. Catal. A: General. 148: 253. [ Links ]
16. Dandekar, A.; Vannice, M. A. (1999). Crotonaldehyde hydrogenation on Pt/TiO2 and Ni/TiO2 SMSI catalysts. J. Catal. 183: 344. [ Links ]
17. Zhang, J.; Smith, R. (2004). Design and optimization of batch and semi- batch reactors.Chem. Eng. Sci. 59: 459. [ Links ]
18. Guil, J. M.; Pérez Masiá, A.; Ruiz Paniego, A.; Trejo Menado, J. M. (1998). Energetics of H2 and O2 adsorption on Ir/γ–Al2O3 and Ir/SiO2 catalysts. Dependence on support and on metal particle size. Thermochim. Acta. 312(1-2): 115. [ Links ]
19. Gomes, H. T.; Figueiredo, J. L.; Faria,J. L.; Serp, Ph.; Kalck, Ph. (2002). Carbon-supported iridium catalysts in the catalytic wet air oxidation of carboxylic acids: kinetics and mechanistic interpretation. J. Mol. Catal. 47: 182. [ Links ]
20. Bukur, D. B.; Sivaraj, Ch. (2002). Supported iron catalysts for slurry phase Fischer-Tropsch synthesis. Appl. Catal. A: General. 231: 201. [ Links ]
21. Chen, R. S.; Huang, Y. S.; Liang,Y. M.; Tsai, D. S.; Tiong, K. K. (2004). Growth and characterization of iridium dioxide nanorods. J. Alloys and Comp. 383 (1-2): 273. [ Links ]














