Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804On-line version ISSN 2357-3791
Rev.Colomb.Quim. vol.34 no.2 Bogotá Dec. 2005
Lizeth Manuela Avellaneda1Amanda Lozano de Yunda1Adriana Mireya Zamudio2
1Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia, sede Bogotá. Correo electrónico: alozanod@unal.edu.co
2Laboratorio Nacional de Suelos, Subdirección de Agrología, Instituto Geográfico Agustín Codazzi, Bogotá. Correo electrónico: amzamudi@igac.gov.co
RESUMEN
Con el objeto de conocer el posible efecto del uso y la cobertura del suelo, sobre el perfil de polidispersidadde los ácidos húmicos, se analizaron los horizontes A de tres muestras de suelo de un andisol (Melanudands) del departamento de Caldas, Colombia, con diferentes condiciones de manejo y cobertura: bajo bosque de guadua, bajo café con sombrío de guamo y bajo café de libre exposición. Para ello, en la fracción inferior a 50 µm, se realizó la extracción secuencial de las sustancias húmicas con soluciones de tetraborato (Na2B4O7 0,05 M), pirofosfato (Na4P2O7 0,025 M) e hidróxido de sodio (NaOH 0,1M) y la separación y purificación de los respectivos ácidos húmicos. Para obtener los perfiles se acoplaron las técnicas de separación de cromatografía de exclusión por tamaño utilizando Sephadex G-75 y ultracentrifugación por gradiente de densidad con sacarosa y se elaboraron gráficas de distribución por tamaño (absorbancia (450 nm) vs. volumen eluido). Se encontró que los ácidos húmicos extraídos con hidróxido de sodio presentaron en todas las muestras menor polidispersidad, mayor tamaño, peso y aromaticidad evaluada por la relación E4/E6. Los resultados no mostraron, en general, efecto drástico del uso y la cobertura del suelo, sobre el perfil de polidispersidad y el coeficiente de sedimentación de los ácidos húmicos, lo cual está relacionado con el tamaño, peso y densidad molecular de los mismos. Sin embargo, se encontró que los ácidos húmicos de las muestras de suelo bajo café con sombrío de guamo y café de libre exposición son muy similares entre sí y diferentes de la muestra bajo bosque de guadua, lo que se asoció con un inicio del efecto del uso y la cobertura del suelo sobre el tamaño de los ácidos húmicos del suelo; se presume que a largo término este efecto podría acentuarse y eventualmente ser considerado como indicador de degradación del componente orgánico del suelo.
Palabras Clave: andisol, ácidos húmicos, cromatografía de exclusión por tamaño (SEC), ultracentrifugación (GDU), cobertura del suelo.
ABSTRACT
In order to know the possible effect of the use and the cover of soil, on the polydispersity profile of humic acids were analyzed the A horizon of three samples of an andisol (Melanudand) from the Department of Caldas, Colombia, that have presented different management and coverland as soils under forest of bamboo, coffee with somber of guamo and under free exposition coffee. For this in the lower fraction to 50 µm, the sequential extraction of humic substances was carried out with solutions of sodium tetraborate (Na2B4O7 0.05 M), sodium pyrophosphate (Na4P2O7 0.025 M) and sodium hydroxide (NaOH 0.1M) and the later separation and purification of the respective humic acids. To obtain the polydispersity profiles was applied the exclusion chromatography separation by size technique utilizing Sephadex G-75 and ultracentrifugation by gradient of density with sucrose and they devised graphics of distribution by size (absorbance (450 nm) vs. volume eluted). It was found that the humic acids extracted with sodium hydroxide presented smaller polydispersity, bigger size and molecular weight, as well as, degree of aromatic condensation. The results did not show drastic effect of the use and the coverland , on the polidispersity profile and the coefficient of sedimentation of the humic acids, which is related to the size, weight and molecular density of the same ones. Nevertheless, it was found that the húmic acids of the samples of soil under coffee with somber of guamo and free exposition coffee are very similar among it and different from the sample under forest of bamboo. This fact was associated with a beginning of the effect of the use and the cover of the soil on the size of the humic acids. It presumed that in the long term the effect is accentuated and eventually could be considered as indicator of degradation of the organic component of the soil.
Key words: andisol, humic acids, size exclusion chromatography (SEC), gradient density centrifugation (GDU), coverland.
INTRODUCCIÓN
Las sustancias húmicas son macromoléculas complejas cuya estructura no está aún completamente definida. Constituyen el mayor componente de la materia orgánica de los suelos y en términos prácticos se clasifican en tres fracciones: ácidos fúlvicos solubles en agua a todos los pH, ácidos húmicos solubles a pH >2 y huminas insolubles a todos los pH. Su caracterización ha sido un reto para los químicos debido a la heterogeneidad de su estructura y tamaño así como a su interacción con el componente inorgánico de los suelos (1).
La reactividad de las sustancias húmicas se debe especialmente a su alta superficie específica, al tamaño molecular, acidez y grado de condensación de las moléculas, las cuales, en asocio con cationes como aluminio, hierro, sílice, calcio y magnesio, entre otros, presentes en el suelo, permiten la formación de sales, complejos y quelatos, e influyen en su estabilidad física, química y biológica, en la fertilidad y en los procesos genéticos (2).
Aunque la comunidad científica ha logrado importantes avances en el conocimiento de las propiedades de las sustancias húmicas, su origen y su relación con el sistema suelo-planta, aún no existe una propuesta unificada respecto a la estructura real, polidispersidad, peso y tamaño molecular de las sustancias húmicas. Para el análisis del tamaño y peso molecular se han utilizado diferentes métodos, entre los que se incluyen la cromatografía de exclusión molecular y la ultracentrifugación por gradiente de densidad (3). La primera de ellas separa las sustancias con base en su tamaño efectivo en solución (4) y en la segunda las moléculas se sedimentan de acuerdo con su tamaño, peso y densidad con ayuda de un gradiente elaborado con sacarosa (5-7). Herrera y col. acoplando estas dos técnicas encontraron que los perfiles de polidispersidad ponen en evidencia las diferencias entre dos suelos de Colombia acordes con su clasificación, puesto que en un suelo Typic Melanudand predominaron los ácidos húmicos sobre los ácidos fúlvicos y se presentó un mayor porcentaje de sustancias húmicas con tamaños moleculares superiores a 80.000 daltons, mientras que en otro suelo clasificado como Acrudoxic Fulvudand los ácidos fúlvicos predominaron sobre los AH y más del 90% corresponde a moléculas de menos de 80.000 daltons (3).
El presente trabajo se propone explorar la posibilidad de utilizar estas técnicas en el esclarecimiento del posible efecto del uso y la cobertura del suelo, sobre el perfil de polidispersidad de los ácidos húmicos del horizonte A de un andisol (Melanudand) del departamento de Caldas, Colombia.
MATERIALES Y MÉTODOS
Materiales
Se seleccionaron tres muestras de suelo correspondientes al horizonte A de tres perfiles de un andisol (Melanudand) de la granja el Naranjal en el municipio de Chinchiná, departamento de Caldas, las cuales han presentado diferente uso y cobertura, como se describe a continuación.
1. Bajo bosque (B): este suelo ha estado bajo bosque nativo de guadua sin que se presente intervención del hombre. En este caso la muestra de suelo analizada correspondió al horizonte A.
2. Bajo café con sombrío de guamo (CG): este suelo estuvo por un periodo de 30 a 40 años bajo café de libre exposición y en aproximadamente los siete años anteriores al muestreo bajo café con sombrío de guamo. En este caso la muestra de suelo analizada correspondió al horizonte Ap.
3. Bajo café de libre exposición (CL): este suelo estuvo por un periodo de 30 a 40 años bajo condiciones de pastoreo de ganado y en aproximadamente los dos años anteriores al muestreo bajo café de libre exposición. En este caso la muestra de suelo analizada correspondió al horizonte Ap.
En los tres casos el manejo del suelo ha mantenido la cobertura vegetal.
Métodos
Fraccionamiento granulométrico
Se pesaron 35,00 g de suelo, los cuales habían sido previamente secados y tamizados en malla de 2 mm, se añadieron 200 mL de H2O, seis bolas de vidrio de 1 cm de diámetro y se llevó a agitación en un agitador rotatorio durante 16 horas. A continuación se tamizó con ayuda de agua en una malla de 50 µm, se obtuvieron así dos fracciones, la menor y la mayor de 50 µm en agua, las cuales se secaron en estufa a temperatura menor de 40 °C. Las fracciones se pesaron en seco y se determinó el % de carbono orgánico (% CO) por el método de Walkley Blacky % C, H y N en un analizador elemental LECO 1000.
Extracción secuencial
Se pesaron 2,00 g de fracción menor de 50 µm, se adicionaron 200 mL de Na2B4O7 0,05M, pH 9,7, se agitó durante una hora y se centrifugó a 5.500 rpm durante 20 min y se recogió el sobrenadante (fracción extractable con tetraborato). Este procedimiento se repitió tres veces más sobre el precipitado (fracción no extractable). Se agregaron 200 mL de Na4P2O7 0,025M, pH entre 9,8 y 10,0, a la fracción no extractable y el procedimiento se repitió dos veces. A la fracción no extractable se le agregaron 200 mL de NaOH 0,1M, pH 12, y el procedimiento se repitió dos veces. Para optimizar el proceso se definió el número de extracciones hasta lograr una cantidad de carbono extraído que permitiera obtener sustancias húmicas suficientes en el menor tiempo y con el menor costo. Para ello se realizó un ensayo con 1,00 g de cada una de las tres muestras de suelo que se sometieron al procedimiento de extracción el número de veces necesario hasta obtener el extracto sin coloración. En una de las muestras se determinó el % CO después de cada extracción con 100 mL de extractante y en la otra se determinó el % CO del extracto total con cada uno de los extractantes. Los resultados permitieron determinar que después de la cuarta extracción con tetraborato y la segunda con pirofosfato y con hidróxido se obtenían el 88, 68 y 66% de carbono respectivamente, lo cual se consideró adecuado.
Precipitación de arcillas
A cada uno de los extractos obtenidos con tetraborato, pirofosfato e hidróxido se le adicionó Na2SO4 anhidro al 2% P/V, se agitó y se dejó en reposo durante una noche; posteriormente las arcillas precipitadas se separaron por medio de filtración y los extractos se conservaron.
Separación de ácidos húmicos y ácidos fúlvicos y purificación de ácidos húmicos
Una vez eliminadas las arcillas de los extractos, se les adicionó H2SO4 concentrado, manteniendo la agitación, hasta alcanzar pH 1,5; se dejó en reposo una noche hasta alcanzar la precipitación completa de los ácidos húmicos y se centrifugó a 5.500 rpm durante 20 min. El precipitado correspondió a los ácidos húmicos y el sobrenadante a los ácidos fúlvicos. Una vez obtenidos los ácidos húmicos se les adicionó HCl-HF al 1%, en una proporción aproximada de 100 mL/g de ácido húmico, se agitó por 24 horas y posteriormente se centrifugó a 5.500 rpm durante 20 min, se eliminó el sobrenadante, se hicieron dos lavados con 20 mL de la solución de HCl-HF y dos lavados con 20 mL de agua destilada; después, se suspendieron los ácidos húmicos en la menor cantidad de agua destilada y se dializaron contra agua destilada, bajo agitación y cambiando el agua constantemente hasta conseguir que la conductividad del agua que rodeaba las membranas fuese igual o muy similar a la del agua destilada. Finalmente, se liofilizaron y caracterizaron los ácidos húmicos.
Para la realización del procedimiento anterior se utilizaron como base las técnicas descritas en el manual de métodos del laboratorio de suelos del Instituto Geográfico Agustín Codazzi (8-12), y finalmente se obtuvieron nueve ácidos húmicos puros a los cuales se les aplicaron las técnicas de cromatografía de exclusión por tamaño (SEC) acoplada a ultracentrifugación (GDU) mediante el siguiente procedimiento:
Cromatografía de exclusión por tamaño (SEC) acoplada a ultracentrifugación (GDU)
Para la SEC se empleó como fase estacionaria Sephadex G-75 y como fase móvil agua destilada libre de CO2. La muestra se preparó disolviendo 0,272 mg de C de AH/mL de solución de NaOH 0,1M y se aplicaron 2 mL sobre la columna previamente empacada. Se recogió el eluido cada 3 mL, manteniendo un flujo de 1,5 mL/min; a cada fracción se le determinó la absorbancia a una longitud de onda de 450 nm y se graficó el volumen eluido vs. absorbancia para obtener el respectivo perfil de elusión. Las fracciones correspondientes a cada una de las bandas se reunieron y conservaron para el posterior análisis por ultracentrifugación por gradiente de densidad en una ultracentrífuga preparativa Beckman modelo L7. Cada una de las fracciones se concentró a una temperatura no mayor de 25 °C hasta alcanzar un volumen de 5 mL; se sembraron en la parte superior de un gradiente de densidad preparado con soluciones de sacarosa del 5, 10, 15 y 20%, en los tubos de la centrífuga. Se centrifugó a una velocidad de 35.000 rpm, durante 1,5 0 horas a una temperatura de 4 °C. Finalizada la ultracentrifugación se extrajeron por la parte superior del tubo fracciones sucesivas de 4 mL, a las cuales se les midió su absorbancia a 450 nm. Con estos valores se graficó el perfil de polidispersidad. A las muestras que presentaron la mayor absorbancia se les determinó la relación E4/E6 midiendo su absorbancia a 465 y 665 nm.
RESULTADOS Y DISCUSIÓN
La cromatografía de exclusión por tamaño separa los ácidos húmicos de acuerdo principalmente con su tamaño molecular hidrodinámico, el cual está relacionado con su peso molecular (13-16). El soporte Sephadex G-75 se utiliza para moléculas entre 5.000 y 80.000 D. Los perfiles de elusión presentan dos bandas, la primera corresponde a los ácidos húmicos con mayor tamaño molecular hidrodinámico, los cuales no penetran en los poros del gel, sino que son excluidos, y la segunda banda representa los ácidos húmicos de menor tamaño molecular hidrodinámico, los cuales entran en los poros y eluyen de acuerdo con lo que su tamaño les permite. Los porcentajes de los ácidos húmicos obtenidos en cada una de las bandas confirmaron la información que se consiguió mediante E4/E6; de esta manera, en los ácidos húmicos obtenidos con tetraborato predominan los de menor tamaño molecular, ya que los mayores porcentajes de ácidos húmicos, 55, 65 y 51%, se encuentran en la banda de menor tamaño (Tabla 1). Así mismo, los ácidos húmicos extraídos con hidróxido de sodio presentaron mayor porcentaje en la banda de mayor tamaño molecular. Los ácidos extraídos con pirofosfato en la muestra bajo café de libre exposición presentan un perfil con distribución diferente a la de las demás muestras. En general, no se encontró efecto drástico del uso y la cobertura sobre el tamaño molecular hidrodinámico obtenido mediante esta técnica.
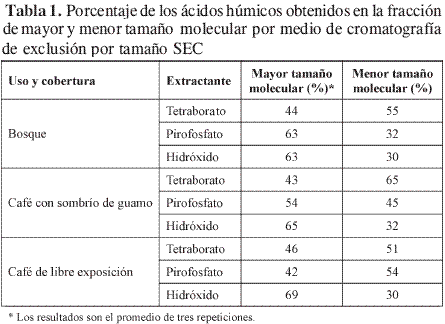
En el análisis de este tamaño molecular hidrodinámico se debe tener en cuenta que los ácidos húmicos pueden estar afectados por fenómenos de repulsión de los grupos ácidos cargados cuando son disueltos en una solución de pH alcalino (NaOH, 1M) (17).
A las fracciones correspondientes a cada una de las dos bandas obtenidas por cromatografía se les realizó la ultracentrifugación por gradiente de densidad (GDU) para obtener los perfiles de polidispersidad; se determinó, igualmente, la relación E4/E6 en cada uno de los picos obtenidos para cada muestra. En el gradiente, cada 20 mL corresponden a una concentración y por tanto densidad diferente para cada gradiente; los primeros 20 mL corresponden a una solución de sacarosa del 5%, los siguientes 20 mL a una de 10%, así hasta una solución del 20% de sacarosa, con densidad de 1,02, 1,04, 1,06 y 1,08 g/100 g, respectivamente.
En todos los perfiles de polidispersidad de los ácidos húmicos que se presentan en la Figura 1, Figura 2 y Figura 3, tanto los de la fracción de mayor tamaño molecular hidrodinámico como los de menor tamaño, extraídos con tetraborato y pirofosfato, presentan dos bandas; caso contrario ocurre con los extraídos con hidróxido, los cuales presentan una banda, lo que indica menor polidispersidad; esto puede atribuirse a un mayor proceso de humificación que ha generado un equilibrio entre ácidos húmicos de composición más estable en cuanto a tamaño, peso y densidad molecular.
El mayor porcentaje de todas las fracciones de ácidos húmicos de mayor tamaño molecular, obtenidas por cromatografía de exclusión por tamaño, se ubicaron en el gradiente de mayor densidad, 20% de sacarosa, lo que indica que estos ácidos tienen un mayor coeficiente de sedimentación, lo cual está dado por un tamaño, peso y densidad molecular mayores (Tabla 2). Las bajas relaciones E4/E6 (menores de 2,8) halladas en estas fracciones lo confirmaron.
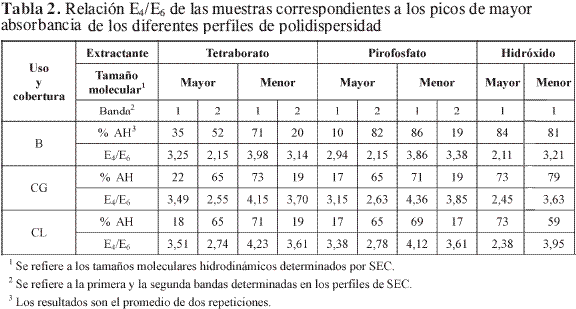
El menor porcentaje de la fracción de mayor tamaño molecular obtenido por SEC se ubica en la solución del 10% de sacarosa, lo cual implica un tamaño, peso y densidad molecular menores; esto se confirma con sus relaciones E4/E6, las cuales son mayores que las obtenidas en la banda anteriormente nombrada.
Una tendencia inversa, pero así mismo coherente con la cromatografía y las relaciones E4/E6, se encontró para las fracciones de menor tamaño molecular obtenidas en SEC, puesto que éstas se ubicaron en un gradiente de menor concentración, por tanto, menor densidad, y presentaron mayores valores de E4/E6, los cuales indican menores tamaño molecular, peso y grado de condensación de los ácidos.
No se encontró ningún efecto drástico del uso y la cobertura sobre el tamaño, peso, densidad molecular y afinidad con el gradiente, mediante esta técnica; esto confirma lo obtenido con cromatografía de exclusión por tamaño y E4/E6, pues los resultados entre las tres muestras de suelo son similares. Sin embargo, en este caso, las relaciones en cuanto a tamaño, peso y polidispersidad para las muestras de suelo bajo café con sombrío de guamo y bajo café de libre exposición tienen valores más cercanos entre sí (Tabla 2) con respecto a la muestra bajo bosque, lo cual implica un cambio incipiente que indicaría que a más largo plazo este efecto podría ser más notorio. Se debe tener en cuenta el hecho de que las muestras de suelo hayan mantenido siempre cobertura vegetal, lo cual podría explicar que no se hubieran observado efectos drásticos del uso y la cobertura sobre las sustancias húmicas. Sin embargo, los resultados permiten inferir que los métodos empleados eventualmente puedan utilizarse para evaluar los cambios en la evolución del componente orgánico del suelo.
Agradecimientos: El trabajo se realizó en el Laboratorio Nacional de Suelos del Instituto Geográfico Agustín Codazzi con el apoyo financiero de COLCIENCIAS a través del proyecto Estudio de las sustancias húmicas de dos suelos colombianos andisoles y mollisoles desarrollados bajo ambientes ecológicos diferentes.
BIBLIOGRAFÍA
1. Jones, M. N.; Bryan, N. D. (1998). Colloidal properties of humic substances. Ad. Colloid Interface Sci. 78, 1-48. [ Links ]
2. Correa, A. (2003). Estudio de las sustancias húmicas en andisoles y mollisoles de Colombia desarrollados bajo ambientes ecológicos diferentes. Documento de la propuesta del proyecto presentado por el Instituto Geográfico Agustín Codazzi a COLCIENCIAS. Bogotá. [ Links ]
3. Herrera, A.; Correa, A.; Lozano de Yunda, A. (2003). Distribución de fracciones de tamaños moleculares de ácidos húmicos y fúlvicos extraídos de andisoles de Colombia. Rev. Colomb. Quim. 32 (1) 29-43. [ Links ]
4. Quattrocchi, O. A. (1992). Introducción a la HPLC. Aplicación y práctica. En: Cromatografía de exclusión molecular. Buenos Aires: Artes Gráficas Farro, pp. 175-202. [ Links ]
5. Van Holde, K. (1971). Physical Biochemistry. En: Sedimentation. New Jersey: Prentice-Hall, pp. 98-115. [ Links ]
6. Katime, I. (1994). Química Física. Macromolecular. En: Ultracentrífuga. Servicio Editorial Universidad del País Vasco, pp. 281-299. [ Links ]
7. Sheeler, P. (1981). Centrifugation in Biology and Medical Science. U.S.: John Wiley & Sons. 269 p. [ Links ]
8. González, F. A.; Malagón, D. (1990). Métodos analíticos del laboratorio de suelos. Bogotá: Instituto Geográfico Agustín Codazzi, p. 464. [ Links ]
9. Ballesteros, Y.; Bernal, J. Caracterización de las sustancias húmicas de un andisol (Acrudoxic Melanudands) del municipio de Chinchiná. Trabajo de grado, proyecto curricular de Licenciatura en Química. Universidad Distrital Francisco José de Caldas, Bogotá, 2001, p. 25. [ Links ]
10. Dávila, J. Caracterización preliminar de ácidos fúlvicos de dos suelos colombianos (andisol de Cauca y oxisol del Amazonas). Trabajo de grado, Departamento de Química, Universidad del Cauca, Popayán, 2002, p. 16. [ Links ]
11. Herrera, A. Determinación del tamaño molecular y el área superficial del componente humico de andisoles de Colombia. Trabajo de grado, Departamento de Química, Universidad Nacional de Colombia, Bogotá, 2002, pp. 31, 38, 62, 63. [ Links ]
12. Barragán, B.; Uribe, M. Selectividad y eficiencia de tres agentes extractantes: tetraborato de sodio, pirofosfato de sodio e hidróxido de sodio en la extracción de sustancias húmicas en suelos de la Amazonia. Trabajo de grado, proyecto curricular de Licenciatura en Química, Universidad Distrital Francisco José de Caldas, Bogotá, 1999, p. 117. [ Links ]
13. Clapp, C. E.; Hayes, M. H. (1999). Sizes and shapes of humic substances. Soil Sci. 164 (11) 777-789. [ Links ]
14. Wershaw, R. L. (1999). Molecular aggregation of humic substances. Soil Sci. 166 (11) 803-813. [ Links ]
15. Tombacz, E. (1999). Colloidal properties of humic acids and spontaneous changes of their colloidal state under variable solution conditions. Soil Sci. 166 (11) 814-824. [ Links ]
16. Orlov, D. S. (1985). Humus acids of soils. En: Size and shape of particles, molecular weight of humus acids. Moscu: Balkema-Rotterdam, pp. 94-124. [ Links ]
17. Zamudio, A., (1999). Caracterización físico-química de los ácidos húmicos en suelos representativos de las zonas de Puerto Nariño y Tarapacá. Bogotá: Instituto Geográfico Agustín Codazzi. Subdirección de Agrología, p. 29. [ Links ]














