Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO  Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804On-line version ISSN 2357-3791
Rev.Colomb.Quim. vol.35 no.1 Bogotá June 2006
Liliana Girado 1 Juan Carlos Moreno2
1Departamento de Química. Facultad de Ciencias. Universidad Nacional de Colombia. Correo electrónico: lgiraldogu@unal.edu.co
2Departamento de Química. Facultad de Ciencias. Universidad de los Andes. Colombia. Correo electrónico: jumoreno@uniandes.edu.co
RESUMEN
Se prepara un carbón activado a partir de carbón mineral por impregnación con solución al 50% de ácido fosfórico, el cual presenta un área superficial de 586 m2.g-1 y un volumen total de poro de 0,37 cm3g-1; en lo que respecta a características químicas el carbón activado presenta un mayor contenido de sitios ácidos, 0,92 meq g-1, que de sitios básicos, 0,63 meq g-1, que le proporcionan una característica aproximadamente neutra con un pHpzc de 7,4.
La cantidad adsorbida de Pb2+ y la entalpía de inmersión en soluciones de a diferentes valores de pH, muestran que estos valores son máximos para pH 4 con valores de 15,7 mgg-1 y 27,6 Jg-1 respectivamente.
Se establecen comportamientos semejantes de la entalpía de inmersión y la cantidad adsorbida en función del pH; y se obtienen relaciones del tipo función de segundo grado entre la constante de adsorción y la entalpía de inmersión y entre dicha constante y el pH de la solución.
Palabras clave:entalpía de inmersión, adsorción de Pb2+, isoterma de Langmuir, pH.
ABSTRACT
We report the preparation of an activated carbon obtained by impregnation of mineral carbon samples with phosphoric acid solution (50%). The obtained material, exhibits a superficial area of 586 m2.g-1 and a total pore volume of 0,37 cm3g-1. With respect to the chemical properties, the activated carbon shows an increased number of acidic sites (0,92 meq g-1) compared to basic sites (0,63 meq g-1 ) which yields a material with almost neutral characteristics (pHpzc: 7,4).
At a pH: 4.0 the amount of Pb2+ absorbed and the immersion enthalpy values for the activated carbon reached maxima with values of 15.7 mg-1 y 27,6 Jg-1 respectively. It was established that similar behaviour occurs for the two properties, absorption and immersion enthalpy, as a function of pH. In addition, a second order function that relates the adsorption constant and immersion enthalpy, and the adsorption constant and pH of the solution are presented.
Key words: immersion enthalpy, adsorption of Pb2+, Langmuir isotherm, pH.
INTRODUCCION
Buena parte de la investigación en la producción de nuevos materiales adsorbentes está encaminada a la protección ambiental y en especial a la conservación del agua. Debido a sus efectos nocivos la contaminación del agua por metales pesados se considera un serio peligro para el medio ambiente en general y particularmente, para la salud humana. Las aguas naturales pueden ser contaminadas por iones metálicos como resultado de descargas de aguas residuales de industrias o de actividades mineras (1). Los metales tóxicos más comunes que se encuentran en aguas residuales son el cobre, el cadmio, el níquel, el cinc, el plomo y el cromo (2).
La adsorción de iones desde soluciones acuosas sobre carbón activado se debe a las interacciones entre los iones en solución y los grupos funcionales presentes en la superficie del carbón; la concentración de estos grupos en la superficie depende del pH de la solución. El proceso de adsorción se relaciona, principalmente, con dos factores: el primero, las interacciones electrostáticas entre los iones y la superficie del carbón activado y el segundo, las interacciones químicas específicas entre los iones y los complejos superficiales (3).
Una amplia aplicación del carbón activado es la purificación de productos y la protección ambiental; su principal uso se ubica en la eliminación de impurezas de gases y líquidos mediante la adsorción. El tratamiento de agua es un sector en el que se emplea casi el 50% del total del consumo del carbón activado, ya que por sus características físicas y químicas permite retener de las aguas compuestos orgánicos e inorgánicos de diferente naturaleza (4).
La preparación del carbón activado se realiza a partir de materiales que enriquezcan su contenido de carbono cuando se someten a un tratamiento térmico, y se puede llevar a cabo por dos vías: activación física o térmica y activación química. En la activación química, un compuesto químico se mezcla con el precursor para obtener la modificación superficial de éste; se emplean con frecuencia compuestos como cloruro de zinc, ácido fosfórico e hidróxido de potasio, los cuales se incorporan al material de partida de forma homogénea y después se realiza la carbonización (5).
En este trabajo, se prepara un carbón activado a partir de carbón mineral extraído de la región del César, que se activa químicamente con ácido fosfórico. Una vez preparado y caracterizado, al carbón activado se le determinan las isotermas de adsorción de Pb2+ desde soluciones acuosas a diferentes valores de pH, e igualmente se determinan las entalpías de inmersión con el propósito de relacionar los parámetros de adsorción, obtenidos por el modelo de Langmuir, con la interacción entálpica.
METODOLOGIA
Tratamiento previo del material de partida
El carbón mineral original, se muele y se tamizan a un tamaño promedio de partícula de 0,551 mm, con el propósito de obtener carbones activados granulares. El material particulado se lava con agua destilada, se seca por 24 horas en un horno a 363 K y se almacenan en envases plásticos secos y cerrados. A cada muestra se le determina el contenido de humedad, carbono fijo, materia volátil y cenizas, de acuerdo a métodos establecidos (6).
Obtención del carbón activado por activación química.
Para la activación química se toma el carbón mineral y se impregnan con una solución de H3PO4 al 50% v/v, durante 1 hora, después de este tiempo las muestras impregnadas se secan en contacto con aire a una temperatura de 383 K por 4 horas. El proceso de activación se lleva a cabo durante 2 horas a una temperatura de 723 K, a una rampa de calentamiento de 10 Kmin-1 y se mantiene un flujo de 200 mLmin-1 de N2. Posteriormente se lavan con agua destilada hasta obtener en las aguas de lavado una conductividad de 5 µS cm-1.
Caracterización textural del carbón activado obtenido
Las características texturales se establecen determinando las isotermas de adsorción de N2 a 77 K en un equipo convencional volumétrico, Autosorb 3B, Quantachrome.
Determinación de sitios activos
Para determinar los sitios ácidos y básicos en los carbones activados se utiliza el método de titulación propuesto por Boehm (7). El total de sitios ácidos, se neutraliza usando una solución 0,1 N NaOH y los sitios básicos se neutralizan con una solución 0,1 M de HCl. Los sitios carboxílicos y lactónicos se titulan con una solución 0,1 M de Na2CO3, los sitios carboxílicos se titulan con una solución 0,1 M de NaHCO3 y los sitios fenólicos se estiman por diferencia (8). Para las determinaciones se ponen en contacto 50 mL de la solución y 1,000 g de carbón activado en un frasco de vidrio, a una temperatura constante de 298 K, durante 5 días. Una muestra de 10 mL se titula con solución 0,1 M de solución correspondiente. La titulación se lleva a cabo utilizando un potenciómetro CG 840B Shott.
Determinación del Punto de Carga Cero, PCZ. Método de Titulación de Masas.
Se pesan cantidades de carbón activado en un rango de 10 a 600 mg, cada una de las cuales se coloca en un frasco de vidrio de 50,0 mL y se le agrega 10,0 mL de cloruro de sodio, NaCl, 0,1 M. Los frascos se tapan y se dejan en agitación a temperatura constante de 298 K durante 48 horas, para que las cargas del carbón se equilibren. Pasadas las 48 horas se mide el pH de cada una de las soluciones con un pH meter CG 840B Schott (9,10).
Datos de equilibrio de la adsorción de Pb2+
Las soluciones de Pb2+ se preparan a partir de Pb(NO)3, en un rango de concentración de 20 a 100 mgL-1 y se ajusta el valor de pH en 2, 4, 6 y 8, según el caso, con soluciones de 0.01M HCl y NaOH 0.01M. En frascos de vidrio se colocan entre 0,100 a 0,250 g de carbón activado y 250 mL de la solución de Pb2+ correspondiente; la solución se agita y se mantiene a una temperatura de 298 K hasta alcanzar el equilibrio.
La concentración de Pb2 en la solución acuosa fue determinada por espectroscopía de absorción atómica usando un equipo Perkin-Elmer AAnalyst 300; y se evalúa utilizando una curva de calibración (10). Las curvas de calibración se preparan para cada uno de los valores de pH ensayados en este trabajo.
Determinación del calor de inmersión
Para determinar la entalpía de inmersión se usa un microcalorímetro de conducción de calor con una celda calorimétrica en acero inoxidable (11). Se colocan en la celda 30 mL de la solución a utilizar, 100 mgL-1 de Pb2+ a un pH fijo, que se han mantenido en un termostato a 298 K; se pesa una muestra de carbón activado del orden de 0,250 g y se coloca dentro de la celda calorimétrica en una ampolleta de vidrio, se ensambla el microcalorímetro. Cuando el equipo alcanza una temperatura 298 K, se inicia el registro de potencial de salida por un periodo de aproximadamente 15 minutos tomando lecturas de potencial cada 20 segundos, se procede a realizar el rompimiento de la ampolleta de vidrio, se registra el efecto térmico generado y se continua con las lecturas de potencial por aproximadamente 15 minutos más, finalmente se calibra eléctricamente.
RESULTADOS Y DISCUSIÓN
Los resultados del análisis próximo para el carbón mineral que se usa como precursor del carbón activado,se muestran en la Tabla 1, en la que se presentan los porcentajes de: humedad, carbono fijo, materia volátil y cenizas.

Se observa que el contenido de carbono fijo es de 58%; adecuado en la escogencia de un material precursor para un carbón activado, ya que una vez se realice el tratamiento térmico los carbones activados finales aumentarán su contenido en carbono fijo (12). La materia volátil, 29%, y el contenido de cenizas del 5,5%, son valores que están de acuerdo con la literatura cuando se tiene como precursor un carbón mineral, estos contenidos tienen una influencia posterior en el desarrollo de la porosidad del carbón activado obtenido (13).
En la Tabla 2 , se presentan los resultados obtenidos al realizar la caracterización textural del carbón activado que se ha preparado, que son: el porcentaje de quemado, el área superficial determinada por el modelo BET, SBET, en m2.g-1; el volumen total de poros, VT, en cm3g-1 y el volumen de microporos, Vµp, en cm3g-1.

Los resultados de la Tabla 2 muestran que el proceso de activación química es eficiente dado que se activa por un periodo de 2 horas a una temperatura moderada de de 723 K y se obtiene un porcentaje de quemado superior al que se produce en estas condiciones en la activación física; de igual forma el área superficial, 586 m2.g-1, y el volumen de poro presentan valores superiores a los que se observan en literatura para la activación de materiales carbonosos por el método de activación física (14).
La Tabla 3 contiene los resultados del contenido de grupos funcionales de la superficie del carbón activado, con la cantidad de sitios ácidos totales en meq g-1; se especifican para dicho contenido total la cantidad de grupos fenólicos, grupos carboxílicos, grupos lactónicos; se muestra el contenido total de sitios básicos en meq g-1 y el pH en el punto de carga cero, pHPZC. Como se puede observar el contenido de sitios ácidos es mayor que el contenido de sitios básicos en una cantidad de 0,29 meq g-1, y de éstos los grupos del tipo ácido carboxílico son mayoritarios, esta característica favorece la adsorción de solutos cargados desde solución acuosa. El pHPZC tiene un valor de 7,4 lo que indica, en términos generales un comportamiento neutro del carbón activado y por tanto para los pH de la solución menores a 7,4 la carga del carbón activado será positiva, que para el caso específico de este trabajo corresponde a los pH 2, 4 y 6; mientras que para el pH 8 la carga del carbón activado es negativa.

Una vez se ha caracterizado el carbón activado, se realizan las isotermas de adsorción a los diferentes valores de pH. Los resultados obtenidos se muestran en la Figura 1, en la que se grafica la cantidad de Pb2+ adsorbido por gramo de carbón activado en función de la concentración de equilibrio.
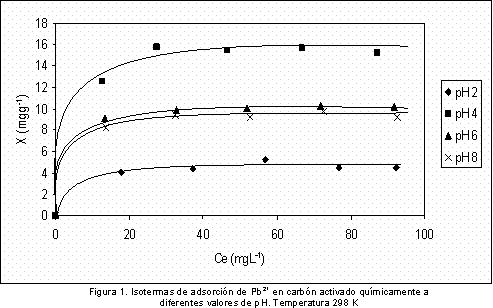
Se observa que la adsorción del ión Pb2+ es mayor para el pH 4, intermedia para los pH 6 y 8 y la más baja se presenta al pH de 2; estas isotermas en fase líquida son del tipo Langmuir que son frecuentes cuando se estudia la adsorción de un soluto en soluciones diluidas (15). En la Figura 2 se presentan las líneas que se obtienen al aplicar a los resultados de las isotermas el modelo de Langmuir, el buen ajuste permite el cálculo de la cantidad adsorbida en la monocapa, Xm y la constante k.
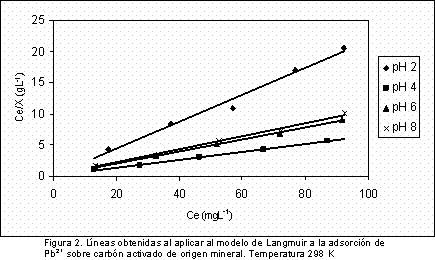
En la Tabla 4 se muestran los resultados, a diferentes valores de pH, para la cantidad de Pb2+ adsorbida en la monocapa, Xm, en mgg-1; la constante de adsorción, k, en Lmg-1 y la entalpía de inmersión del carbón activado en una solución de 100 mgL-1, 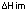 , en Jg-1.
, en Jg-1.
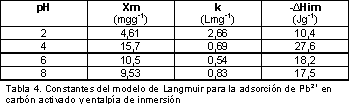
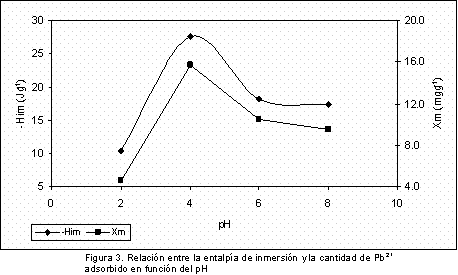
Se observan valores máximos para la adsorción y la entalpía de inmersión para el pH de 4, lo que indica que en estas condiciones experimentales la interacción entre el carbón activado y la solución acuosa es mayor, y que disminuye a pH más bajos y más altos, presentando la menor interacción cuando el pH es de 2, comportamiento que es similar al de materiales carbonosos que se muestra en la literatura (16). De acuerdo al diagrama de especiación para el Pb2+ las especies dominantes a pH por encima de 4 son Pb(OH)+, Pb(OH)2, Pb(OH)42 y Pb(OH)3-; en medios ácidos la superficie del sólido se encuentra protonada y se favorece la adsorción de las formas hidroxiladas del plomo; con el incremento del pH, el grado de protonación de las superficies de los carbones se reduce gradualmente y se observa una disminución en la adsorción.
Si se tiene en cuenta que la adsorción del ión metálico sobre el carbón activado depende tanto de las características superficiales, como área superficial, estructura de poro y acidez superficial, como de las propiedades de la solución; se observa que para el sistema estudiado en el que el carbón activado presenta un área superficial de alrededor de 580 m2g-1 y un contenido de grupos ácidos de 0.90 meqg-1, la capacidad de adsorción de Pb2+ es menor que cuando se usan carbones activados con mayor área superficial (4, 10).
En la Figura 3 se presentan la relación entre el valor obtenido para la entalpía de inmersión y la monocapa en función del pH, que como se puede apreciar presentan la misma tendencia y establece la proporcionalidad entre la adsorción y la generación de calor en el sistema.
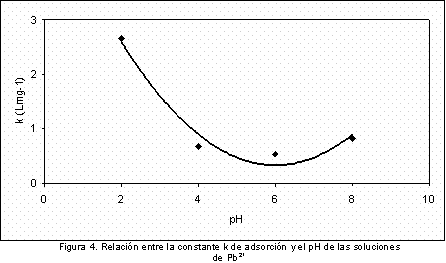
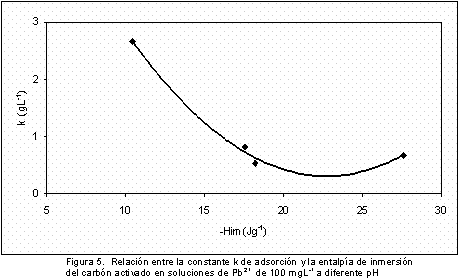
La Figura 4 y la Figura 5 presentan relaciones de la constante k, del modelo de Langmuir, en función del pH de la solución y del calor de inmersión. En las gráficas se aprecia una tendencia semejante, con buen ajuste a una función de segundo grado, que indica que el pH de la solución modifica la adsorción del ión sobre el carbón activado y a la vez la intensidad de las interacciones entre el sólido y la solución, que se manifiesta en la intensidad de la entalpía de inmersión.
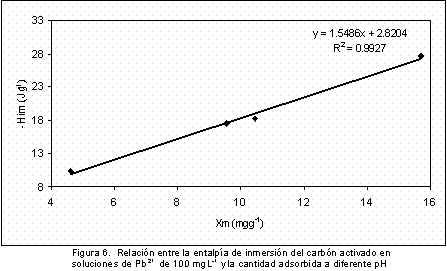
Finalmente, en la Figura 6 se presenta la relación entre la entalpía de inmersión en la solución de 100 mgL-1 a diferentes pH en función de la cantidad de Pb2+ adsorbido, se observa que los puntos experimentales se ajustan a una línea recta con un coeficiente de correlación r2 de 0,9927; la proporcionalidad que existe entre las variables indica que a medida que el ión Pb2+ se adsorbe en el carbón activado se genera una cierta cantidad de calor que a su vez se relaciona con la estructura fisicoquímica de la superficie, que cambia con condiciones de la solución y que afectan la interacción del sistema total.
CONCLUSIONES
Se obtiene un carbon activado a partir de carbon mineral preparado mediante activacion quimica con area superficial de 586 m2.g-1 y volumen de poro de 0,37 cm3g-1. El contenido de sitios acidos, 0,92 meq g-1, es mayor que el de sitios basicos, 0,63 meq g-1, y presenta un pH en el punto de carga cero de 7,4 ligeramente basico.
La adsorcion de Pb2+ en funcion del pH de la solucion muestra que tanto la cantidad adsorbida como la entalpia de inmersion son maximas a pH 4, con valores de 15,7 mgg-1 y 27,6 Jg-1 respectivamente.
Los parametros del modelo de Lagmuir, cantidad adsorbida en la monocapa Xm y constante k, presentan correlaciones con la entalpia de inmersion que indican las variaciones en la interaccion con la modificacion del pH.
Agradecimientos:Los autores agradecen al Convenio Marco entre la Universidad de los Andes y la Universidad Nacional de Colombia y al Acta de Acuerdo entre los Departamentos de Química de las dos Universidades.
BIBLIOGRAFÍA
1. Le Cloirec P. (2001). Adsorption in water and wastewater treatments. En Handbook of porous solids. Editores Schuth ., Sing K.S.W., Weitkamp J. V. 5. Cp. 1. Wiley-VCH Verlag. Weinheim. p 2746-2754. [ Links ]
2. Giraldo L. (2005). Adsorción de metales pesados desde soluciones acuosas en carbones activados. En Descontaminación ambiental mediante adsorbentes. Editor Rodríguez-Reinoso F. Cp 9. Red Temática V.F. CYTED. Madrid. p 189. [ Links ]
3. Macias-García A., Valenzuela-Calahorro C., Espinosa-Mansilla A., Bernalte-Garcia A., Gómez-Serrano V. (2004). Adsorption of Pb2+ in aqueous solution by SO2 treated activated carbon. Carbon, 42, 1755-1764. [ Links ]
4. Li Y.H., Ding J., Luan Z., Di Z., Zhu Y., Xu C., Wu D., Wei B. (2003). Competitive adsorption of Pb2+, Cu2+ and Cd 2+ ions from aqueous solutions by multiwalled carbon nanotubes. Carbon, 41, 2787-2792. [ Links ]
5. Rodríguez-Reinoso F. (2002). Production and applications of activated carbons. Eds. Schuth F.,Sing KSW, Weitkamp J. Handbook of Porous Solids, Vol. 3, Weinheim Wiley VCH. p 1766-1770. [ Links ]
6. ASTM. (2000). Standards on activated carbon. Sponsored by ASTM Committee D-28 on activated carbon. Second edition. p 11-17. [ Links ]
7. Boehm H.P. (1.966). Advances in Catalysis. Eley, D.D.H.Pines., P.B.Weisz, Eds. Academic Press. New York. P. 192. [ Links ]
8. Mohamed F.S., Khater W.A., Mostafa M.R. (2006). Characterization and phenols sortive properties of carbons activated by sulphuric acid. Chem. Eng. Journal, 116, 47-52. [ Links ]
9. Kosmulski M. (2004). pH dependent surface charging and point of zero change. J. Colloi.d. Inter. Scien. 275, 214-224. [ Links ]
10. Giraldo L., Moreno J.C. (2004). Determinación de la entalpía de inmersión y capacidad de adsorción de un carbón activado en soluciones acuosas de plomo. Revista Colombiana de Química, 33 (2), 87-97. [ Links ]
11. Giraldo L., Moreno J.C. and Huertas J.I. (2002). Heats Conduction Micro-Calorimeter With Metallic Reaction Cells. Instrumentation Science & Technology. 30 (2) , 177-186. [ Links ]
12. Rodríguez-Reinoso, F. (1997). Activated carbon: structure,characterization, preparation and applications. En: Introduction to carbon technologies. Universidad de Alicante (Publicaciones). Alicante, España. p 60. [ Links ]
13. Linares-Solano, A.; Martín-Gullon, J.; Salinas- Martínez de Lecea, C.; Serreno-Talavera, B. (2000). Activated carbons from bituminous coal: effect of mineral matter content. Fuel, 79, 635-643. [ Links ]
14. Lillo-Ródano M.A., Lozano-Castelló D., Cazorla-Amorós D., Linares-Solano A. (2001) Preparation of activaed carbons from Spanish antracita: II activation by NaOH. Carbon, 39, 751-759. [ Links ]
15. Moreno-Castilla C. (2004). Adsorption of organic molecules from aqueous solutions on carbon materials. Carbon. 42, 83-94. [ Links ]
16. Radovic L.R., Moreno-Castilla C., Rivera-Utrilla J. (2000). Carbon Materials as Adsorbents in Aqueous Solutions. In Chemistry and Physics of Carbon. A Serie of Advances. Ed Marcel Dekker. New York. p 293-297. [ Links ]














