Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO  Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804On-line version ISSN 2357-3791
Rev.Colomb.Quim. vol.35 no.1 Bogotá June 2006
Luis Blanco1Fabián Pamplona1
1Departamento de Química. Universidad Nacional de Colombia. Bogotá, Colombia. E-mail:Lhblancoc@unal.edu.co
RESUMEN
En el presente trabajo se midió la solubilidad y la difusividad de Argón en agua y en soluciones acuosas de yoduro de tetrabutil amonio, a concentraciones de 0,02 m y 0,04 m y a temperaturas de 288.15 K y 298.15 K. Se describe el diseño, construcción y calibración de un equipo para contacto gas-líquido, el cual cuenta con la instrumentación necesaria para el control de la temperatura, y la medida de la presión. El equipo construido permite evaluar la solubilidad y la difusividad a través del método de descenso de presión en celdas de diafragma. Las propiedades medidas permitieron comprobar el carácter hidrofóbico del catión [Bu]4N+.
Palabras Clave:Solubilidad, difusividad, yoduro de tetrabutil amonio, constante de Setchenov.
ABSTRACT
In this work the solubility and the diffusivity of argon in water and in aqueous solutions of tetrabutyl ammonium iodide, at concentrations in the range 0.02 m to 0.04 m, were measured. Measurements were made at two temperatures: 288.15K and 298.15K. The design, construction and the calibration of a gas - liquid contact equipment is described. It uses auxiliary equipment for the measurement of pressure and the control of temperature. This apparatus allows the measurement of diffusivity and of solubility in diaphragm cells by the pressure decline method. The measured values of the properties confirm the hydrophobic character of the [Bu]4N+ cation.
Keywords:Solubility, diffusivity, tetrabutyl ammonium iodide, Setchenov's constant.
INTRODUCCIÓN
Es bien conocido que las sales de amonio cuaternario poseen propiedades que afectan la estructura, e interactúan con el agua, lo que permite clasificarlas como formadores o como disruptores de estructura. La evaluación de propiedades de transporte en este trabajo da información de la manera como a nivel molecular se difunde un soluto gaseoso en soluciones acuosas de yoduro de tetrabutil amonio, en donde la estructura juega un papel importante. Para los procesos de difusión en soluciones acuosas, la información de solubilidades y coeficientes de difusión permite cualificar el carácter hidrofóbico o hidrofílico de los componentes en solución (1-4).
En el presente trabajo se describe el equipo construido, sus características de diseño, la calibración y la metodología para la evaluación de la difusividad y la solubilidad de Argón en agua y en soluciones acuosas de yoduro de tetrabutil amonio a 288,15K y 298,15 K.
MATERIALES Y EQUIPOS
Las soluciones se prepararon con agua destilada y desionizada, el gas es argón con un 99,999% de pureza suministrado por la empresa Oxígenos de Colombia y yoduro de tetrabutil amonio (Bu4NI) marca Sigma, con una pureza superior a 99%.
El equipo utilizado para el desarrollo experimental se fundamentó en los trabajos realizados en los laboratorios de Hildebrand(5,6) y Versteeg(7). Durante el desarrollo del presente trabajo se construyó el equipo de difusión, el cual tiene un sistema de control de temperatura (8) e instrumentos para medir la presión. Un esquema detallado del equipo se muestra en la Figura 1 y se explica a continuación.
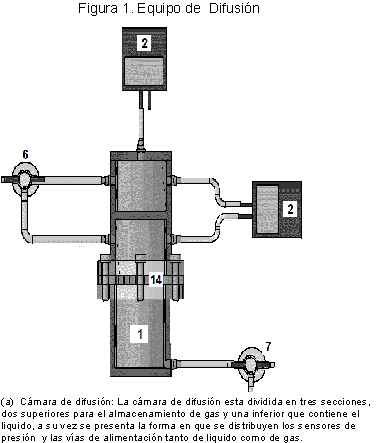
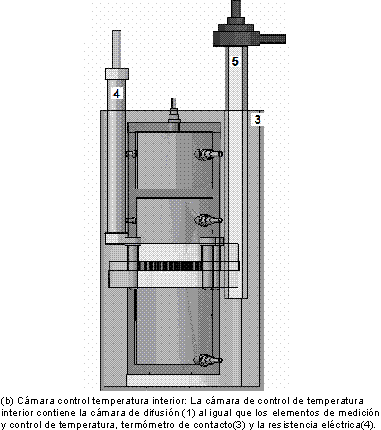
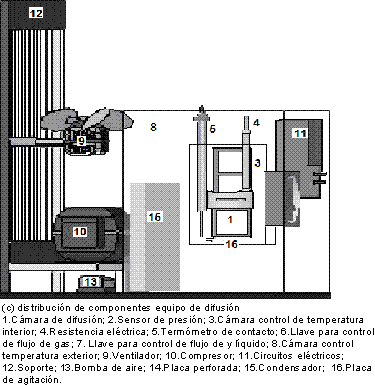
La cámara de difusión(1) fue construida en plexiglás (polímero transparente), y tiene 6,50 cm de diámetro, 19,28 cm altura, 0,70 cm de calibre. La placa perforada(14) tiene 8,50 cm de diámetro y 9,5 cm de espesor. La cámara para el contacto líquido-gas está dividida en tres secciones: la sección inferior tiene 282,50 cm3 de volumen, la cual contendrá la fase líquida; la parte superior se encuentra dividida en dos secciones, una contiene el gas para difusión cuyo volumen es 187,5 cm3; y la otra actúa como cámara referencia con un volumen de gas de 170,5 cm3. Los sensores de presión(2) miden con una precisión de ±0,13kpa, el control de temperatura(11) opera entre 273,15K y 373,15 K a través de un sistema de relevo y termocontacto con una precisión de ±1,04K y tiene como elemento final de control una resistencia eléctrica(4) de 70 vatios, el agitador magnético(16) funciona por flujo de agua el cual provee agitación al líquido dentro de la cámara. La figura 1 muestra los componentes y la distribución del equipo utilizado.
METODOLOGÍA
Para el desarrollo experimental se utilizó argón-agua y argón-solución (solución acuosa de yoduro de tetrabutil amonio). Se realizaron tres mediciones por cada concentración (0,0; 0,02 m; 0,04 m), a dos temperaturas (288,15K y 298,15 K). Las soluciones se prepararon por pesada en una balanza analítica de cuatro cifras decimales con una precisión de ±0,0001g.
Calibración de la cámara.
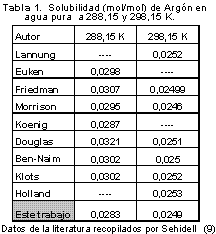
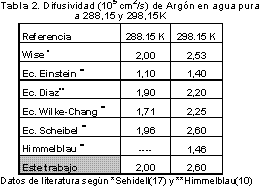
Para la medición de solubilidad y difusividad es necesario comprobar el funcionamiento de la cámara siguiendo el procedimiento propuesto por Versteeg (7) utilizando sistemas de solubilidad y difusividad conocidos, para lo cual se evaluó la solubilidad y la difusividad de argón en agua pura a temperatura constante y se comparó los resultados con datos obtenidos de literatura (ver Tabla 1 y Tabla 2 ). Los datos encontrados de presión y tiempo son reemplazados en las ecuaciones 1 y 9, en donde realizando el despeje de la constante f (factor de calibración) se encuentra que tiene un valor de 0,000094 cm con una incertidumbre de ±0,000015.
Solubilidad
Para la medición de la solubilidad en el sistema anteriormente descrito, la placa que divide la fase líquida de la gaseosa fue reemplazada por un aro circular que permite el libre contacto entre las dos fases. Siguiendo el procedimiento realizado en la sección 3.1 se mide la caída de presión en el sistema, una vez se ha llegado al equilibrio liquido-vapor indicada por valores constantes en la presión en un rango de 0,0 a 101.325 kPa. La solubilidad puede ser calculada por la siguiente ecuación de acuerdo a la ley de Henry.
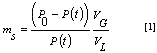
Donde ms es la solubilidad, P0 y P(t) son la presión inicial y de equilibrio, VG y VL son el volumen del gas y del líquido respectivamente.
Difusividad (11)
El coeficiente de difusión de argón en líquidos se determina usando una placa perforada que separa la fase líquida de la fase gaseosa la cual posee 424 perforaciones de 1mm de diámetro y tiene un área equivalente a la décima parte de la placa completa que posee un diámetro de 6,5 cm y 1,0 cm de espesor. La evaluación de la difusividad se realiza siguiendo el mismo procedimiento que se utilizo para la medición de la solubilidad. Utilizando los balances de masa para el sistema líquido-gas se tiene el coeficiente de difusión en función de volúmenes, presión y el factor de calibración f.
Balance global
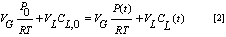
Donde CL,0: Concentración de gas en el liquido a t=0, CL(t): Concentración de gas en el liquido a t=t.
Balance de gas

Donde A: Area [m2], R: Constante universal de los gases, T: Temperatura [K], KL: Constante de transferencia de masa.
Teniendo en cuenta las condiciones iniciales T=0; P=Po; CL=CL,0=0. Despejamos C(t) de la ecuación 2:
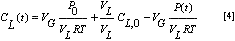
Reemplazando en la ecuación 3, reorganizando y evaluando las condiciones iniciales CL,0=0
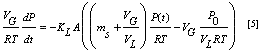
Despejando la diferencial y haciendo.
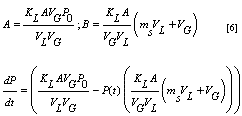
Reemplazando y separando variables.
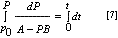
Haciendo un nuevo reemplazo de variables.
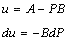
La integral queda.
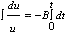
Integrando y reemplazando en función de las variables anteriores queda.
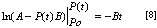
Organizando la expresión.
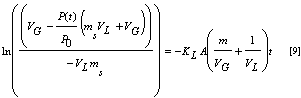
De donde despejamos y encontramos que:
KLA=Df
Donde D: Difusividad [cm2/s], f: Factor de calibración
El factor f asocia las variables de la placa a través de la cual se realiza la difusión como lo son espesor de película liquida sobre la placa, porosidad, área de transferencia y espesor de la placa.
RESULTADOS
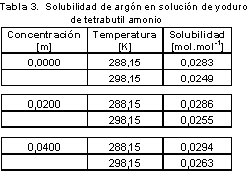
Solubilidad de Argón en soluciones acuosas de yoduro de tetrabutil amonio
La desviación de la solubilidad por adición de una sal a un solvente se conoce como desplazamiento salino(12,13) en donde normalmente las características iónicas de las sales hacen que se formen complejos a partir de las fuerzas de hidratación, dejando menos agua libre disponible para disolver el gas. La influencia del desplazamiento salino de un ión aumenta con valores crecientes de la carga iónica y decreciente del radio iónico (7).
La incertidumbre en la medida de la concentración y solubilidad se encuentra en la cuarta cifra decimal. Los resultados encontrados evidencian el efecto positivo de la sal (salting-in), en donde, la solubilidad del gas en las soluciones aumenta con la concentración de la sal, debido a la reestructuración del solvente. Los desplazamientos salinos se suelen describir mediante una ecuación empírica propuesta por Setchenov(14), en donde considera un sistema de tres fases, formado por una fase gas y dos fases acuosas; una de las fases acuosas no contiene sales, la otra fase acuosa contiene una sal con molalidad mMx, en donde además se supone que la temperatura es lo suficientemente baja como para considerar el agua no volátil. Se supone que la diferencia entre la variación de la energía libre de Gibbs estándar de disolución de un soluto en un disolvente con sal y la de una disolución sin sal se expresa por una serie de potencias, es decir:
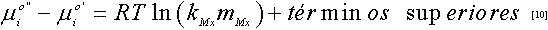
Donde kMx es una constate característica de la sal.
Como primera aproximación se considera únicamente el primer termino de la serie. Para concentraciones bajas de sal la ecuación de Setchenov es:
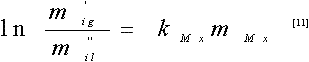
Donde m'ig y m'il solubilidades (expresada en unidades de molalidad) del gas en el agua y en la solución salina respectivamente. Para ambas temperaturas los valores de de la constante de Setchenov experimental fueron negativos ( Tabla 4 ), lo cual es característico de soluciones con carácter hidrofóbico (14). La evaluación de la constante presenta incertidumbre en la tercera cifra decimal.

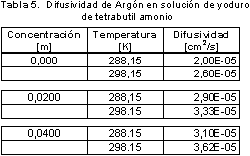
El efecto de la concentración y la temperatura en la difusividad
La mayoría de los datos y postulados teóricos para difusión en líquidos se han estudiado para temperaturas entre 288,15 K y 298,15 K, en donde la difusividad se comporta de manera lineal hasta valores un poco más altos de temperatura, como lo muestran Himmelblau (10).
El comportamiento del sistema de estudio con respecto a la temperatura sigue esta misma tendencia y acorde con la teoría los valores del coeficiente de difusión dependen de las propiedades de los componentes, como son peso molecular, diámetros moleculares, densidad de la solución, viscosidad y aún las energías de activación.
CONCLUSIONES
Se midió la solubilidad y la difusividad para el sistema argón-agua y argón-solución (solución acuosa de yoduro de tetrabutil amonio), en donde se encontró que la sal utilizada modifica el solvente, incrementando el valor de la solubilidad y la difusividad de argón en ésta solución acuosa con el aumento de su concentración. Los valores de solubilidad y difusividad se muestran en la Tabla 3 y en la Tabla 5 respectivamente.
BIBLIOGRAFÍA
1. Joosten, G. E. H.; Danckwerts, P (1972). Solubility and Diffusivity of Nitrous Oxide in Equimolar Potassium Carbonate-Potassium Bicarbonate Solutions at 25 °C and 1 atm. J. Chem. Eng. Data. 17. p.p. 452-454. [ Links ]
2. Martin, J.; Otto, F.; Mather, A. (1978). Solubility of Hydrogen Sulfide and Carbon Dioxide in a Diglycolamine Solution. J. Chem. Eng. Data. 23. p.p. 163. [ Links ]
3. Sada, E.; Kumazawa, H.; Butt, M. (1978). Solubility and Diffusivity of gases in Solutions of Amines. J. Chem. Eng. Data. 23. p.p. 161-162. [ Links ]
4. Ko, J.; Tsai, T.; Lin, Ch.; Lin, Ch.; Li, M. (2001). Diffusivity of Nitrous Oxide in Aqueous Alkanolamine Solutions. J. Chem. Eng. Data. 46. p.p. 160-165. [ Links ]
5. Ross, M.; Hildebrand, J. (1964). Diffusion of Hidrogen, Deuterium, Nitrogen, Argon, Methane, and Carbon Tetrfluoride in Carbon tetrachloride. J. Chem. Phys. Data. 40. p.p. 2397-2399. [ Links ]
6. Hildebrand, J.;Alder, B.; Haycock, E. (1953). The Diffusion of Iodine in Carbon Tetrachloride under Presure. J. Chem. Phys. Data 21. p.p 1601-1604. [ Links ]
7. Senthil Kumar, P. ; Hogendoorn, J.Feron, P. Versteeg, G.; (2001). Density, Viscosity, Solubility, and Diffusivity of N2O in Aqueous Amino Acid Salt Solutions. J. Chem. Eng. Data. 46. p.p. 1357-1361. [ Links ]
8. Shoemaker. D. P, Garland. C. W. (1968). Experimentos de Fisicoquímica., Ed. Hispano Americana., México. [ Links ]
9. Sehidell. A. (1940). Solubilities of Inorganic and Metal Organic Compounds. Vol 1, D. Van Nostrand Company. Washington. D.C. [ Links ]
10. Himmelblau, D.M. (1964). Diffusion of Dissolved Gases in Liquids. The University of Texas, Austin. pp 527-549. [ Links ]
11. Kirkwood, J. (1946). The Statistical Mechanical Theory of Transport Processes. J. Chem. Phys. Data. 14. p.p. 180-201. [ Links ]
12. Franks F. E. (1978). "Water a Comprehensive Treatise ".Plenun Press, New York. [ Links ]
13. Eisenberg D.; And Kauzmann W. (1969). "The Structure and Properties of Water", Oxford University Press, New York. [ Links ]
14. Tenne, R.; Ben-Naim, A. (1976). Effect of Tetraalkylammonium Salts on the Hydrophobic Interaction. J. Phys. Chem. Data. 80 p.p. 1120-1122. [ Links ]














