Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO  Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804On-line version ISSN 2357-3791
Rev.Colomb.Quim. vol.35 no.1 Bogotá June 2006
Luis Enrique Cuca Suarez1, Diego Ricardo Muñoz Cendales2 ,Clara Inés Orozco3
1Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia, Correo Electrónico:lecucas@unal.edu.co
2Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia, Correo electrónico:drmunoz@unal.edu.co
3Instituto de Ciencias Naturales, Universidad Nacional de Colombia.
RESUMEN
A partir del extracto etanólico de la parte aérea de la especie Solanum validinervium se aisló el compuesto 2-(4’-hidroxifenil)-etanol, las cumarinas esculetina e isoescopoletina y un nuevo glucósido de cumarina identificado como 1’-O-7-esculetina-4’-O-1’’-etilenglicol-β-D-glucopiranosa. Sus estructuras fueron elucidadas por medio de técnicas espectroscópicas (IR y RMN-1H, RMN-13C en una y dos dimensiones).
Palabras clave: Solanum validinervium, Solanaceae, Solanum sección Geminata, cumarinas.
ABSTRACT
From the ethanolic extract of the aerial part of Solanum validinervium, compounds 2-(4’-hydroxyphenyl)-ethanol, the coumarins sculetin and isoscopoletin, and a new glucoside of coumarin 1’-O-7-esculetin-4’-O-1’’-ethylenglicol-β-D-glucopiranose were isolated. Their structures were elucidated by means of spectroscopic techniques (IR and RMN-1H, RMN-13C in one and two dimensions).
Key words: Solanum validinervium, Solanaceae, Solanum section Geminata, coumarins.
INTRODUCCIÓN
Alrededor de 2300 especies hacen parte de la familia Solanaceae que proporciona al hombre artículos comerciales como el tabaco (1) y numerosos productos alimenticios: papas, berenjenas, tomates, pimientos, el árbol de tomate, pepino y aderezos como el ají (2, 3). Solanum es uno de los géneros más grandes de angiospermas, en donde se estiman entre 1000 y 2000 especies con diversos tipos de hábito, desde hierbas hasta árboles de gran porte (4). Varias especies del género se conocen por su uso ornamental pero también por el contenido de compuestos químicos, como alcaloides, saponinas esteroidales, esteroles, taninos, flavonoides, cumarinas y vitamina D (5).
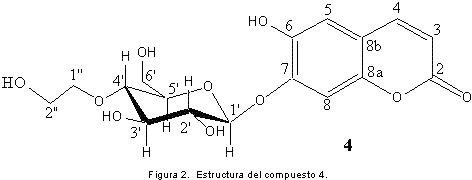
Solanum sección Geminata, pertenece al subgénero Solanum siendo una de las más grandes dentro del género; es de distribución neotropical y generalmente reconocida por su hábito arbóreo. Las especies crecen generalmente en bosques húmedos, desde el nivel del mar hasta aproximadamente 3500m, con 126 especies reconocidas (6). En Colombia, se estima que cerca del 40% del material indeterminado de Solanum depositado en los principales herbarios del país corresponde a la sección Geminata (7). En este trabajo, se reporta la presencia de 2-(4’-hidroxifenil)-etanol 1, las cumarinas conocidas como esculetina 2 e isoescopoletina 3, y un glucósido de cumarina no reportado aún en la literatura, el cual fue identificado como 1’-O-7-esculetina-4’-O-1’’-etilenglicol-β-D-glucopiranosa 4.
MATERIALES Y METODOS
General
Los espectros 1H-RMN y 13C-RMN, COSY, DEPT, HMQC, HMBC, HSQC fueron registrados en un equipo Bruker Avance 400, a 400 MHz para 1H y a 100 MHz para 13C utilizando TMS como estándar interno. Los espectros IR fueron tomados en película de KBr, en un equipo Perkin Elmer FTIR Panagon 500 serie 1000. Los puntos de fusión fueron tomados en un equipo Mel-temp II Laboratory Devices. En la cromatografía en columna se utilizó sílica gel (Kieselgel 60 Merck) y para la cromatografía en capa fina sílica gel GF254 0.3 mm de espesor (Merck). Las placas de cromatografía en capa fina fueron visualizadas con luz UV 254 nm, 365 nm y vapores de I2.
Material Vegetal
La especie en estudio fue recolectada e identificada por Clara Inés Orozco en el municipio de Villa de Leyva, Santuario de Fauna y Flora Iguaque, camino de las cabañas a las lagunas a 3000 m.s.n.m, el 12 de Junio del 2002. Un espécimen reposa en el Herbario Nacional Colombiano con el N° COL. 508074.
Extracción y aislamiento
El extracto se obtuvo por percolación con etanol a partir de 708,0 g de la parte aérea del material vegetal seco y molido, obteniendo un total de 50,0 g de un residuo viscoso. Una fracción de 20,0 g se sometió a cromatografía en columna (sílica gel : C6H5CH3-EtOAc, en polaridad creciente), obteniéndose 20 fracciones (F1-F20). La fracción F15 (20,0 mg), fue sometida a lavados sucesivos con CHCl3, para obtener el compuesto 2 (6,9 mg). La fracción F17 (79,2 mg) se sometió a cromatografía en columna (sílica gel : CHCl3-CH3COCH3 en polaridad creciente 99:1 a 7:3), obteniéndose el compuesto 3 (9,2 mg). La fracción F19 (120,0 mg) fue sometida a lavados sucesivos con CHCl3 y luego con MeOH, para obtener el compuesto 4 (80,0 mg). La fracción F20 (6,1 g) (obtenida utilizando como fase móvil una mezcla de etanol : isopropanol) fue sometida a hidrólisis ácida con HCl5% a 60 °C por 45 minutos, se neutralizo (pH=7) con NaOH 20 %, y se realizó una extracción con CHCl3, obteniéndose el extracto clorofórmico A (200,0 mg), y una extracción con una mezcla de CHCl3:EtOH (3:2), obteniéndose el extracto clorofórmico B (3,0 g). En el extracto clorofórmico A se observa un precipitado el cual es recuperado y lavado varias veces con MeOH obteniéndose nuevamente el compuesto 2 (4,2 mg). El extracto clorofórmico B (3,0 g) es sometido a cromatografía en columna (sílica gel : C6H5CH3-EtOAc, en polaridad creciente), obteniéndose 10 fracciones (C1-C10), de las cuales se obtuvo el compuesto 1 en la fracción C7 (13,6 mg).
RESULTADOS Y DISCUSIÓN
Del extracto etanólico de la parte aérea de la especie Solanum validinervium, fueron aislados e identificados cuatro compuestos, 2-(4’-hidroxifenil)-etanol 1, las cumarinas conocidas como esculetina 2 e isoescopoletina 3, y un glucósido de cumarina no reportado aún en la literatura, el cual fue identificado como 1’-O-7-esculetina-4’-O-1’’-etilenglicol-β-D-glucopiranosa 4.
Los compuestos 2 y 3 han sido previamente aislados en la especie Peucedanum fraeruptorum (8).
El compuesto 1 fue identificado como 2-(4’-hidroxifenil)-etanol (Figura 1); cristales levemente amarillos (MeOH); m.p. 87 °C; RMN-1H (400 MHz, MeOD, δ): 2,6 (2H, t, J = 7,2 Hz), 3,5 (2H, t, J = 7,2 Hz), 4,5 (2H, s), 6,6 (2H, d, J = 8,5 Hz), 6,9 (2H, d, J = 8,5 Hz). RMN-13C (100 MHz, MeOD, ppm): 37,9 (C-2), 63,1 (C-1), 114,7 (C-2’, C-6’), 129,5 (C-5’, C-3’), 129,6 (C-1’), 155,2 (C-4’).
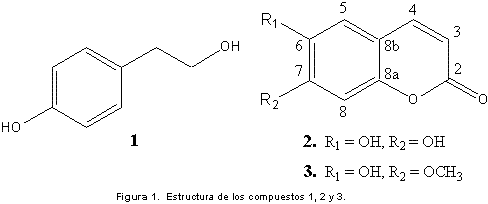
El compuesto 2 fue identificado como esculetina (Figura 1); cristales incoloros ((CH3)2CO); m.p. 270-272 °C (dec.); los resultados de RMN-1H (400 MHz, (CD3)2CO) y RMN-13C (100 MHz, (CD3)2CO) se reportaron en (9).
El compuesto 3 fue identificado como isoescopoletina (Figura 1); cristales incoloros ((CH3)2CO); m.p. 185 °C; los resultados de RMN-1H (400 MHz, CDCl3) y RMN-13C (100 MHz, CDCl3) se reportaron en (9).
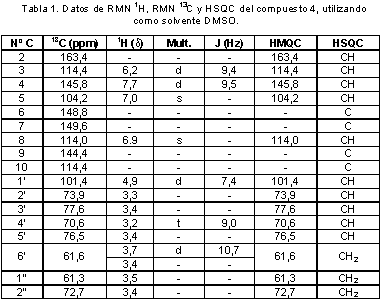
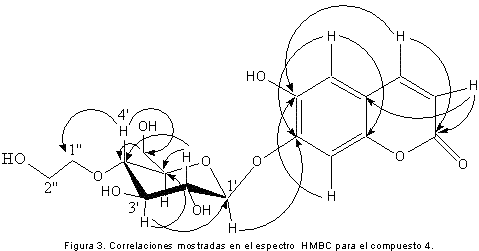
El compuesto 4 fue identificado como 1’-O-7-esculetina-4’-O-1’’-etilenglicol-β-D-glucopiranosa (Figura 2); sólido blanco (CH3CH2OH); m.p. 224-225 °C; los resultados de RMN-1H (400 MHz, DMSO) y RMN-13C (100 MHz, DMSO) se muestran en la tabla 1. Las correlaciones C-H a dos, tres y cuatro enlaces observadas en el espectro HMBC se muestran en la figura 3.
Para el compuesto 1 se muestran dos señales de hidrógenos aromáticos que están acoplando entre sí, debido a que cada uno se muestra como un doblete bien definido y con el mismo valor de constante de acoplamiento δ 6,9 (2H, d, J = 8,5 Hz) y δ:6,6 (2H, d, J = 8,5 Hz) para los cuales debido al valor de su constante de acoplamiento son hidrógenos en posición orto. Se observan también dos tripletes correspondientes a hidrógenos alifáticos δ:2,6 (2H, t, J = 7,2 Hz), δ:3,5 (2H, t, J = 7,2 Hz) los cuales debido al valor de su constante están acoplando entre ellos y una señal en δ:4,5 (2H, s), que corresponde a los hidrógenos de dos grupos funcionales hidroxilo de alcohol. En cuanto a los carbonos, se observan 6 señales en total, sin embargo, dos de ellas δ:114,7 (C-2’, C-6’), δ:129,5 (C-5’, C-3’) correspondientes a carbonos aromáticos que integran cada una para dos debido a su intensidad respecto a las otras señales, además en el espectro HMQC se observan las conectividades de dichos carbonos a los hidrógenos aromáticos δ:6,9 (2H, d, J = 8,5 Hz) y δ:6,6 (2H, d, J = 8,5 Hz), con lo cual se puede establecer que dichos carbonos se encuentran en posición orto en el sistema aromático el cual es simétrico para estos dos carbonos y sus respectivos hidrógenos. Estos resultados fueron comparados y confirmados con los reportados en la literatura (10). Dado que el compuesto 1 fue obtenido después de haber hecho una hidrólisis al extracto total, es muy posible que dicho compuesto se encuentre en la planta como un glicósido, pudiendo formar el enlace glicosídico por cualquiera de los dos grupos hidroxilo o bien por los dos.
El compuesto 4 al igual que los compuestos 2 y 3 muestra los desplazamientos correspondientes a los hidrógenos 3, 4, 5 y 8 en una estructura de cumarina sustituida en los carbonos C-6 y C-7 (11), para los cuales los hidrógenos en las posiciones 3 y 4 de cada uno de los compuestos se muestran como un doblete con una constante de acoplamiento de 9,4 Hz, y los hidrógenos en las posiciones 5 y 8 de cada uno de los compuestos se aprecian como singletes en un rango de δ: 6,7-7,5. En el espectro RMN 13C, se observa una señal correspondiente a un grupo carbonilo de una lactona α-β insaturada δ:162,3 compuesto 2, δ:161,4 compuesto 3 y δ:163,4 compuesto 4), junto con un grupo de señales aromáticas las cuales corresponden a los carbonos del anillo aromático de la cumarina y a los carbonos en las posiciones 3 y 4. Además de dichos desplazamientos típicos de cumarina, para el compuesto 4 se aprecia un doblete en δ: 4,9 (1H, d, J = 7,4 Hz), un doblete en δ: 3,7 (1H, d, J = 10,7 Hz) y una serie de multipletes en la región de δ: 3,3 a δ: 3,6 lo cual sugiere la presencia de un azúcar en la molécula, ya que el protón en δ: 4,9 (1H, d, J = 7,4 Hz) debido a su desplazamiento y su constante de acoplamiento de 7,4 Hz hace referencia al protón anomérico de un azúcar (H-1’) en posición β; el protón en δ: 3,7 (1H, d, J = 10,7 Hz) hace referencia a uno de los hidrógenos diasterotópicos de dicho azúcar (H-6’a), y la serie de multipletes hace referencia a los grupos metinos hidroxilados que están presentes en el monosacárido.
La presencia de los hidrógenos diasterotópicos del monosacárido se confirma en el espectro HSQC, mostrando dichos hidrógenos desplazamientos en δ:3,7 y δ:3,4, además se puede apreciar también en el espectro HMQC que el carbono en δ:61,6 correlaciona con dos señales diferentes en el espectro de hidrógeno (δ:3,7 y δ:3,4). El espectro COSY 1H-1H muestra acoplamiento protón-protón para los hidrógenos en δ:6,22 (H-3), δ:7,77 (H-4); δ:4,93 (H-1’), δ:3,38 (H-2’); δ:3,38 (H-2’), δ:3,45 (H-3’); δ:3,45 (H-3’), δ:3,23 (H-4’); δ:3,23 (H-4’), δ:3,40 (H-5’); δ:3,40(H-5’), δ:3,49 (H-6’(a)); δ:3,49(H-6’(a)), δ:3,72 (H-6’(b)).
El espectro de 13C muestra la presencia de 17 carbonos en la molécula los cuales por comparación entre los espectros DEP 90, DEPT 135 y 13C da como resultado la presencia de 9 metinos, dos metilenos y 5 carbonos cuaternarios; de los cuales 4 metinos y los 5 carbonos cuaternarios (tres de los cuales son carbonos oxigenados correspondientes a los carbonos 6, 7 y 8a de la cumarina) hacen parte del anillo de cumarina sustituida en los carbonos 6 y 7.
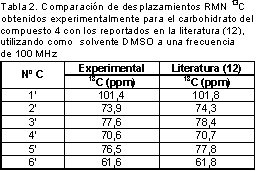
La asignación del monosacárido, se realizó por comparación de los desplazamientos obtenidos en el espectro de 13C a 100 MHz en DMSO con los reportados en la literatura en las mismas condiciones (12) (tabla 2), y el valor de las constantes de acoplamiento obtenidas experimentalmente correspondiendo el monosacárido a glucosa, quedando finalmente 2 grupos metileno por asignar, los cuales están oxigenados debido a su desplazamiento (δ:61,3 y δ:62,7). La asignación de estos grupos, se realizó con el espectro HMBC, ya que el carbono de uno de los metilenos (1’’) correlaciona a larga distancia y a través de eteroátomo con el protón 4’ del azúcar. Las correlaciones HMBC para el compuesto 4 se muestran en la figura 3.
Agradecimientos: A la DIB, por la financiación del proyecto, al profesor Luis Enrique Cuca y a mi compañero Juan David Guzmán por su gran colaboración durante el desarrollo de este trabajo, a Julio Roberto Pinzón Joya por la toma de espectros en el laboratorio de Resonancia Magnética Nuclear de la Universidad Nacional de Colombia sede Bogotá y a los demás integrantes del grupo de investigación en Productos Naturales Vegetales del departamento de Química de la Universidad Nacional de Colombia.
BIBLIOGRAFIA
1. Bruneton, J. (2001). Plantas tóxicas, vegetales peligrosos para el hombre y los animales. Ed. Technique et Documentation-Lavoisier. pp. 447 – 453. [ Links ]
2. Hawkes, J.; Lester, RN.; Nee, M.; Estrada, N. (1991). Solanaceae III: Taxonomy, chemistry, evolution. Royal Botanic Gardens, Kew, Inglaterra. [ Links ]
3. Hawkes, J. (1999). The economic importance of the family Solanaceae. (Solanaceae IV. M. Nee, D. E. Symon, R.N. Lester y .P. Jessop, eds.). Royal Botanic Gardens, Kew, Inglaterra. p. 1-7. [ Links ]
4. Granados, J.; Orozco, I. (2005). Novedades Corológicas y morfológicas en Solanum sección Geminata (Solanaceae). Caldasia, 27(S): 1-16. [ Links ]
5. Filho, B. (1989). Chemical and pharmacological investigation of Solanum species of Brazil. Simpósio Brasileño-Chino de Química farmacologia de Produtos Naturais, Rio de Janeiro. pp. 87. [ Links ]
6. Knapp, S. (2002). Solanum section Geminata. Flora Neotropica, 84:1-404. [ Links ]
7. Granados, J.C. (2002). Especies de Solanum sección Geminata (Solanaceae) de Colombia. pp. 436. Rangel-Ch., J.O., J. Aguirre-C & M.G. Andrade-C. (eds.). Libro de Resúmenes Octavo Congreso Latinoamericano de Botánica y Segundo Colombiano de Botánica, Instituto de Ciencias Naturales, Universidad Nacional de Colombia, Bogotá. [ Links ]
8. Kong, L.; Li, Y.; Li, X.; Zhu, T. (1996). Coumarins from Peucedanum fraeruptorum Phytochemistry, 41: 1423-1426. [ Links ]
9. Muñoz, D.; Cuca, L.; Orozco, C. (2005). Aislamiento y estructura de algunos metabolitos secundarios de Solanum validinervium (Solanaceae) sección Geminata. Actualidades Biológicas (27) 1; 49 – 52. [ Links ]
10. Lou, H.; Yuan, H.; Yamazaki, Y.; Sasaki, T.; Oka, S. (2001). Planta Medica, 67: 345-349. [ Links ]
11. Domínguez, A. (1979). Métodos de Investigación en Fitoquímica, pp. 111-120. Ed. Limusa, México. [ Links ]
12. Fuendjiep, V. (2002). Chalconoid and stilbenoit glycoside from cuibourpia tessmanii. Phytochemistry 60: 803-806. [ Links ]














