Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO  Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804On-line version ISSN 2357-3791
Rev.Colomb.Quim. vol.35 no.1 Bogotá June 2006
Jose Jairo Dangond Araujo1, Jairo Arturo Guerrero Dallos1
1Departamento de Química Universidad Nacional de Colombia. A.A. 14490. Bogotá D.C. Colombia. E - mail:jjdangonda@unal.edu.co jaguerrerod@unal.edu.co
RESUMEN
Los benzimidazoles son fungicidas de acción sistémica muy utilizados en la protección de cultivos de frutas y hortalizas. En este trabajo se validó una metodología para la determinación de residuos de benomyl, carbendazim y tiabendazol, en fresa y lechuga por cromatografía líquida de alta eficiencia con detector de arreglo de diodos (HPLC-DAD). Los residuos de benomyl se determinaron luego de su conversión a carbendazim. La extracción de los residuos de las muestras se realizó con acetato de etilo y la limpieza se llevó a cabo por cromatografía de permeación en gel (GPC). La determinación analítica se realizó por HPLC-DAD en fase reversa. La metodología es selectiva, específica, precisa y exacta. Las curvas de calibración son lineales en un rango de concentración de 1,24 a 6,19 mg/kg con límites de detección de 0,27 y 0,40 mg/kg y límites de cuantificación de 0,85 y 1,35 mg/kg para carbendazim y tiabendazol respectivamente. Los porcentajes de recuperación son del orden del 90%. No se encontraron residuos de estos compuestos en muestras recolectadas en algunos municipios de Cundinamaraca, Colombia.
Palabras Claves: Benzimidazoles, Fresa, Lechuga, Cromatografía Líquida, Cromatografía de permeación en gel.
ABSTRACT
Systemic fungicides like benzimidazolic compounds are used to protect several crops of fruits and vegetables. In this work a new method for analysis of benomyl, carbendazim and thiabendazol in strawberry and lettuce by High-performance liquid chromatography with diode array detector (HPLC-DAD) was validated. Benomyl residues were determined after its conversion to carbendazim. Pesticide residues were extracted from strawberry and lettuce samples with ethyl acetate and these extracts were cleaned up by gel permeation chromatography (GPC). Final determination was carried out by HPLC-DAD in reverse phase column. The method is selective, specific, precise and accuracy. The calibrate curves show linearity over concentration range of 1,24 to 6,19 mg/kg, with detection limits of 0,27 and 0,40 mg/kg and quantification limits of 0,85 and 1,35 mg/kg for carbendazim and thiabendazol respectively. The recovery experiments yielding averages of 90%. No residues of these compounds were founded in recollected samples from specific states of Cundinamarca, Colombia.
Key Words: Benzimidazolics, Strawberry, Lettuce, Liquid Chromatography, Gel permeation Chromatography
INTRODUCCIÓN
El uso inadecuado de plaguicidas, así como el desconocimiento de las buenas prácticas agrícolas por parte de los agricultores, aumentan la probabilidad de encontrar residuos de plaguicidas en los alimentos, lo cual obliga a realizar monitoreos permanentes y controles rigurosos a los tratamientos fitosanitarios. De igual forma, se ha generado la necesidad de desarrollar y validar metodologías analíticas idóneas y confiables con el fin de evaluar la presencia de estos residuos en los alimentos y valorar así el riesgo asociado al medio ambiente y a la salud de los consumidores.
Los cultivos de fresa y lechuga ocupan un lugar importante en la producción nacional y son considerados de alto riesgo debido a la cantidad de plagas que los atacan, a la variedad de plaguicidas que se utilizan para controlarlos y a la falta de control y seguimiento de las buenas prácticas agrícolas por parte de los pequeños productores a nivel local (1). Los fungicidas benzimidazólicos entre ellos benomyl, carbendazim y tiabendazol son muy utilizados por su acción fungicida en el control fitosanitario no solo de estos cultivos sino también en arroz, cebolla, aguacate, banano, café, uvas y cítricos. Por ser de acción sistémica, entran en los tejidos vasculares de la planta a través del follaje o las raíces y son trasladados por medio de la savia a las diferentes partes de la planta en donde actúan inhibiendo la biosíntesis de ergosterol (2,3).
Los primeros métodos utilizados para determinar benzimidazoles fueron los espectrofotométricos (4), los cuales identifican y cuantifican estos compuestos en soluciones acuosas y orgánicas a 286 nm con la desventaja de su baja especificidad y sensibilidad. Otros estudios se han enfocado en establecer la cinética y mecanismos de conversión del benomyl a sus productos de degradación, entre ellos su metabolito más estable, el carbendazim, concluyendo que esta degradación se da muy fácilmente en la mayoría de los solventes por medio de una reacción de catálisis intramolecular espontánea (5,6).
En los últimos años se han reportado varias metodologías para la determinación de benzimidazoles en matrices vegetales por HPLC en fase reversa con detector ultravioleta, los cuales, en su gran mayoría utilizan como solventes de extracción diclorometano y acetona y limpieza de la muestra mediante extracción en fase sólida (SPE). La determinación analítica requiere de largos tiempos de corrida y de la utilización de fases móviles con elevados valores de pH que deterioran las columnas cromatográficas (7-10). En otros estudios determinan estos fungicidas y sus metabolitos utilizando métodos más sofisticados como la extracción con fluidos supercríticos (11), y técnicas acopladas a espectrometría de masas tales como cromatografía de líquidos-espectrometría de masas (LC/MS) y cromatografía de gases-espectrometría de masas (GC/MS) lo cual implica contar con una infraestructura adecuada y equipos muy costosos (12,13).
Este estudio muestra la validación de una metodología analítica para determinar residuos de benzimidazoles en fresa y lechuga en concentraciones inferiores a sus Límites Máximos de Residuos (LMR) establecidos en el Codex Alimentarius (14) y su utilidad en el análisis de muestras recolectadas en algunos municipios de Cundinamarca. El método aprovecha la naturaleza débilmente básica del núcleo de los benzimidazoles, la baja toxicidad del acetato de etilo y la cromatografía de permeación en gel para lograr una extracción y limpieza efectiva de la muestra previa a su determinación analítica por HPLC-DAD.
MATERIALES Y MÉTODOS
Estándares y reactivos. Se utilizaron estándares de benomyl, carbendazim y tiabendazol del Dr. Ehrenstorfer (Augsburg, Alemania) todos con pureza del 99,0%. Se utilizó bicarbonato de sodio y sulfato de sodio anhidro grado residuos (J.T. Beaker), fosfato de amonio monobásico monohidrato y trietilamina grado analítico (Merck), ácido clorhídrico 37% p/v (Mallinckrodt) y acido fósfórico (J.T. Beaker, pureza del 85%) grado reactivo, acetato de etilo y ciclohexano grado residuos (J.T. Beaker), metanol grado HPLC (Mallinckrodt) y agua grado HPLC obtenida de un sistema de purificación Milli Q (Millipore).
La solución patrón de benomyl de 100 µg/mL se preparó en ácido clorhídrico 10N y las soluciones de trabajo en el mismo solvente 1N. Las soluciones patrón de carbendazim y tiabendazol de concentraciones de 200 µg/mL se prepararon en metanol y las soluciones de trabajo en este mismo solvente. Los patrones se almacenaron en el refrigerador a -20 °C.
Equipos. Para llevar a cabo el proceso de extracción se emplearon; un homogenizador Stephan Blender 2010, un homogenizador de alta velocidad Ultraturrax (IKA T25) y una licuadora industrial (Waring) y un evaporador rotatorio Buchi R-114. Para el proceso de limpieza se utilizó un cromatógrafo de permeación en gel de Redement Bt, modelo KL-SX-3, equipado con una columna de vidrio de 20 cm x 10 mm d.i. empacada con gel Biobeads® S-X3 como fase estacionaria y una mezcla de ciclohexano: acetato de etilo (1:1) como fase móvil a un flujo de 1 mL/min.
El análisis cromatográfico se llevo a cabo en un cromatógrafo líquido de alta eficiencia Agilent Technologies 1100 (Palo Alto, C.A. EUA) equipado con un detector de arreglo de diodos, bomba cuaternaria, sistema de degasificación en línea y válvula de inyección manual Rheodyne de seis puertos con Loop de 20 µL, integrador y sistema de recolección de datos HP-Chemstation. Se empleó una columna analítica LiChrospher RP-18, 125 X 4 mm., 5 µm y guardacolumna C-18 (LiChrocart).
Se mantuvo la columna a temperatura ambiente y se empleo una fase móvil compuesta por metanol y buffer de fosfato de amonio 50 mM / trietilamina ajustado a pH 6,8 (57:43) con un programa de elución isocrático a flujo de 1,0 mL/min, y detección a longitudes de onda de 285 y 305 nm para carbendazim y tiabendazol respectivamente. Para la determinación analítica de benomyl se utilizó el mismo sistema cromatográfico, la misma columna y el mismo programa de elución, con la diferencia que la fase móvil empleada fue una mezcla de acetonitrilo : agua (2:1) y detección a 280 nm.
Muestras blanco. Se utilizaron muestras de fresa y lechuga exentas de plaguicidas, obtenidas en supermercados de cadena certificados como productos orgánicos.
Procedimiento de extracción y limpieza de las muestras Se toma 1,0 kg de muestra y se homogeniza durante 6 minutos en el homogenizador con intervalos de 2 minutos, luego se toman 400 g y se transfirieren a una licuadora donde se homogeniza nuevamente por 2 minutos y se toman porciones de 200 g. A esta porción se le adicionan gotas de HCl 4 N hasta pH 3,0 y se esperan 30 minutos con el fin de llevar a cabo una hidrólisis ácida y asegurar la conversión de benomyl a carbendazim (11). Se toman porciones analíticas de 30 g en una probeta de extracción, se le adicionan en su orden; 5 g de bicarbonato de sodio, 60 mL de acetato de etilo y 30 g de sulfato de sodio anhidro (15-17).
La porción analítica se somete a extracción en un homogeneizador de alta velocidad a 10.000 rpm durante 2 minutos. Se pasa el extracto a través de un embudo de vástago corto con algodón previamente lavado con acetato de etilo y 25 g de sulfato de sodio anhidro y se recogen 30 mL. El filtrado se transfiere a un balón y se evapora el solvente a 34°C, hasta aproximadamente 0,5 mL. Se transfiere cuantitativamente a un balón de 2 mL, llevando a volumen con acetato de etilo. Luego se efectúa una dilución 1:1 con el mismo solvente.
Se inyectan 500 L del extracto diluido en el cromatógrafo de permeación en gel y se recoge la fracción en la que eluyen los compuestos (7 a 22 mL) en un balón de 20 mL. Esta fracción se concentra a 34°C, hasta aproximadamente 0,5 mL y se elimina por completo el solvente en corriente de nitrógeno. Se transfiere cuantitativamente a un balón de 2 mL y se lleva a volumen con una mezcla de metanol : ácido fosfórico pH 3,5 (3:1). El extracto limpio se pasa a través de un filtro de 0,20 µm y finalmente se inyectan 20 µL en el HPLC.
Acidificación de las muestras para hidrolizar el benomyl Debido a que el LMR para benomyl corresponde a la suma de los residuos de éste y de su forma hidrolizada activa (carbendazim) (14), fue necesario asegurar la hidrólisis de benomyl a carbendazim acidificando las muestras antes de realizar el proceso de extracción. Para confirmar esta hidrolisis, se fortificaron con estándar de benomyl cinco porciones analíticas de fresa y lechuga blanco, se acidificaron con HCl 4N y luego se llevo a cabo la extracción, limpieza y análisis, inyectando los extractos finales bajo las condiciones cromatográficas indicadas anteriormente para la determinación analítica de cada uno de ellos.
RESULTADOS Y DISCUSIÓN
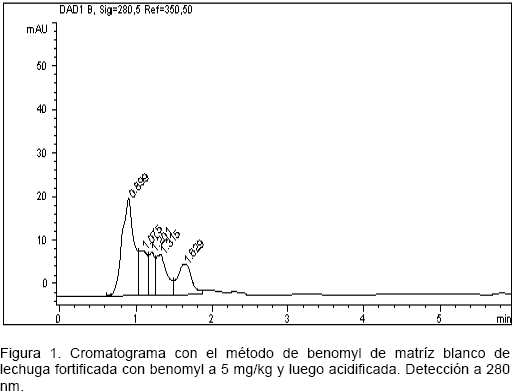
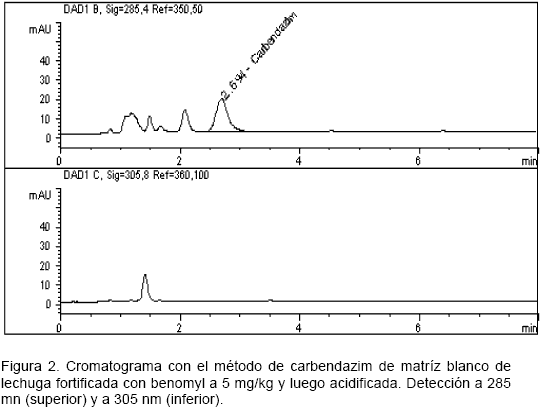
Conversión de benomyl a carbendazim. La Figura 1 muestra el cromatograma de la inyección, bajo el método indicado anteriormente para determinar el benomyl, del extracto final de matriz de lechuga blanco fortificada con este fungicida y acidificada. No se detectó benomyl ya que no se observa ninguna señal a su tiempo de retención (3,63 minutos). Para confirmar la conversión de benomyl a carbendazim mediante el proceso de acidificación, se inyectó este mismo extracto bajo el método establecido para determinar carbendazim, y como se observa en la Figura 2, se obtuvo la señal correspondiente a este compuesto a los 2,69 minutos, lo cual confirma que la hidrólisis fue efectiva.
Validación de la metodología. Una vez confirmada la hidrolisis del benomyl y establecidas las condiciones adecuadas de extracción, limpieza y separación cromatográfica, se validó la metodología para carbendazim y tiabendazol mediante la evaluación de los parámetros de especificidad-selectividad, linealidad, precisión, límite de detección, límite de cuantificación, exactitud y robustez (18-21). Se estableció un rango de concentraciones de 1,24 a 6,19 mg/kg, el cual incluye los LMRs de los plaguicidas de interés indicados en la Tabla 1.

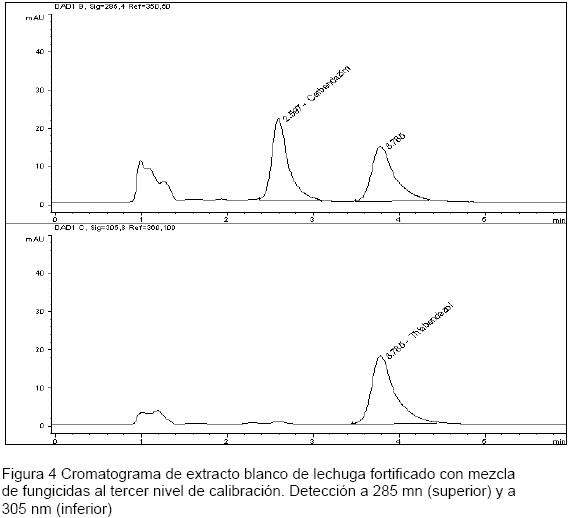
Especificidad-selectividad: Se inyectaron extractos de fresa y lechuga (matriz blanco) y no se encontraron señales que interfirieran en los tiempos de retención de los analitos tal como se ilustra en la Figura 3. De igual forma se inyectaron estos extractos fortificados con mezcla de fungicidas al tercer nivel de calibración en donde se obtuvo una señal diferenciada de cada compuesto tal como lo indica el cromatograma de la Figura 4. La metodología demuestra ser específica y selectiva, ya que permite separar adecuadamente las señales de los dos compuestos y de los demás interferentes.

Efecto matriz: Se evaluó determinando si las señales de los fungicidas obtenidas en solvente y en cada uno de los extractos son significativamente diferentes. Este efecto se evaluó por el método de regresión lineal graficando la señal de los analitos en matriz en función de la señal de los analitos en solvente (18). Se realizaron las pruebas de regresión y linealidad así como la evaluación del intercepto, pendiente y coeficiente de correlación con un nivel de confianza del 95%. No se encontró efecto inducido por las matrices por lo cual los compuestos se cuantificaron con curvas de calibración preparadas en solvente.
Linealidad: Para evaluar la linealidad se prepararon cinco curvas de calibración utilizando mezclas de los analitos preparadas a partir de los patrones y disueltas en mezcla de metanol : ácido fosfórico pH 3,5 (3:1) a concentraciones de 1,20; 2,40; 3,60; 4,80 y 6,00 µg/mL y se inyectaron 5 veces. Se determinó la normalidad de los resultados usando la prueba de normalidad de Shapiro-Wilk, y se evaluó estadísticamente la pendiente, el intercepto y el coeficiente de correlación empleando el estadístico t de Student con una confiabilidad del 95%. También se evaluó la regresión y el desvío de la linealidad mediante un análisis de varianza ANOVA con estadístico F de Fisher. En la Tabla 2 se muestra la evaluación de la pendiente, el intercepto y el coeficiente de correlación para cada fungicida, en la Tabla 3, los resultados de la regresión y el desvío de la linealidad del tiabendazol (22) y en la Figura 5, las curvas de calibración correspondientes al carbendazim con sus respectivas ecuaciones y coeficientes de determinación.
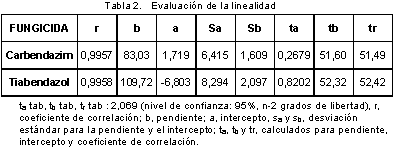
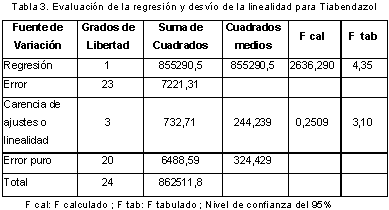
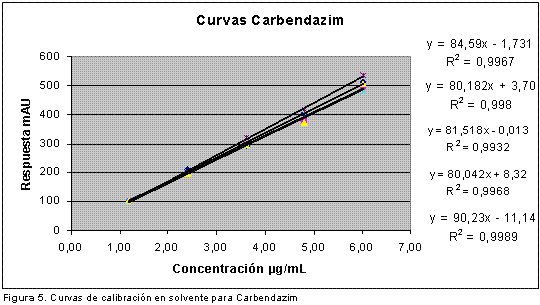
Se encontró que para ambos fungicidas, los interceptos no son significativamente diferentes de cero, las pendientes son significativamente diferentes de cero y existe correlación significativa entre la concentración y la respuesta (área). El análisis de varianza realizado demostró que hay regresión significativa entre la concentración y el área, y que no hay desvío de la linealidad.
Límite de detección y límite de cuantificación: En su orden, estos dos parámetros se calcularon teniendo en cuenta 3 y 10 veces el ruido de la matriz blanco (19-21). El límite de cuantificación se verificó experimentalmente fortificando 5 porciones analíticas y determinando su exactitud y precisión como se muestra en la Tabla 4. Los valores de estos límites críticos son menores que los LMR, demostrando que la metodología tiene la sensibilidad adecuada para el análisis de estos fungicidas en fresa y lechuga a este nivel.

Precisión y exactitud: La precisión se evaluó como repetibilidad y precisión intermedia en el rango de calibración con 5 réplicas. En la evaluación de la repetibilidad se realizaron los experimentos el mismo día bajo las mismas condiciones, mientras que para la evaluación de la precisión intermedia se realizaron los experimentos en diferentes días. Se fortificó extracto blanco de matriz a los 5 niveles de concentración, se realizó el proceso de extracción, limpieza y determinación cromatográfica. La dispersión de los resultados se expresó como porcentaje de coeficiente de variación (%CV). La exactitud se evaluó como el porcentaje de recuperación el cual se calculó para cada una de las concentraciones en el rango de calibración.
En la Tabla 5 se muestran los coeficientes de variación obtenidos en los experimentos de repetibilidad y en la Tabla 6 y la Tabla 7 los coeficientes de variación y porcentajes de recuperación obtenidos en los experimentos de precisión intermedia.
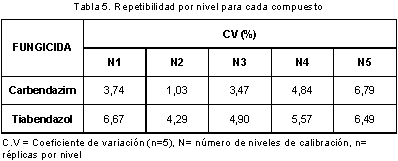

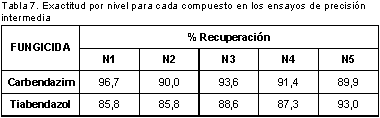
Los resultados muestran coeficientes de variación inferiores al 7% en los ensayos de repetibilidad y al 14% en los ensayos de precisión intermedia y porcentajes de recuperación entre el 70 y el 110 %, por lo cual son adecuados de acuerdo a lo establecido en los Criterios de Aceptación en la Validación Intra-Laboratorio para el Análisis de Residuos de Plaguicidas y Drogas Veterinarias para concentraciones mayores a 1,0 mg/kg (18). Mediante el test de Cochran se comprobó homogeneidad de varianzas, por lo tanto la concentración no afectó la variabilidad de los resultados.
Robustez: Para evaluar la robustez, se seleccionaron 7 factores determinantes que podrían ser críticos en el desarrollo del método y se hicieron variaciones a los valores establecidos en la validación. Se aplicó el diseño experimental de Youden-Steiner (19) y se analizó la influencia de cada factor sobre el porcentaje de recuperación de los analitos. Para evaluar si un parámetro tenia influencia significativa sobre este, se comparó la diferencia de medias obtenida en el cambio efectuado para ese parámetro y la expresión 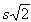 , donde S es la desviación estándar obtenida en el ensayo de repetibilidad del método. Ninguno de los factores influyó en la recuperación de los analitos. El método es robusto en los aspectos evaluados. La Tabla 8 muestra los factores evaluados en el estudio de robustez.
, donde S es la desviación estándar obtenida en el ensayo de repetibilidad del método. Ninguno de los factores influyó en la recuperación de los analitos. El método es robusto en los aspectos evaluados. La Tabla 8 muestra los factores evaluados en el estudio de robustez.

Análisis de Muestras: Siguiendo un diseño de muestreo aleatorio estratificado, se analizaron 10 muestras de lechuga del municipio de cota y 10 muestras de fresa de los municipios de Facatativá, Guasca y Sibaté, del departamento de Cundinamarca y se encontró que ninguna presentó residuos detectables de estos fungicidas. Cabe resaltar, que estos resultados no excluyen la necesidad de desarrollar programas de monitoreo de éstos y otros plaguicidas en dichos cultivos.
CONCLUSIONES
Se desarrollo y validó una metodología para la determinación de fungicidas benzimidazolicos en fresa y lechuga, la cual utiliza solventes de baja toxicidad y unas condiciones de separación adecuadas que permiten una elución rápida de los compuestos, reduciendo considerablemente el tiempo y costo de los análisis. La metodología resultó ser idónea, confiable y sensible para determinar residuos de estos compuestos a nivel de sus LMRs.
Agradecimientos: Agradecemos al departamento de Química de la Universidad Nacional de Colombia, sede Bogotá, y al Organismo Internacional de Energía Atómica (IAEA), Viena, Austria por la colaboración y financiación suministrada para la realización de este proyecto.
BIBLIOGRAFÍA
1.Montaño. M. (2001). Trabajo de grado: Evaluación de la Residualidad de Plaguicidas en Fresa (fragaria spp) en el Departamento de Cundinamarca. Director: Guerrero. J. Facultad de Ciencias. Departamento de Química. Universidad Nacional de Colombia. [ Links ]
2. Enriquez P. (1999) Evaluación de riesgo ambiental a la liberación de plaguicidas. Laboratorio de Ecotoxicología, Servicio Agrícola y Ganadero (SAG), Chile. [ Links ]
3. Valerin M. (1996). Uso de fungicidas para el combate de las enfermedades de las plantas. San José de Costa Rica. [ Links ]
4. Chiba M. (1977). A rapid spectrophotometric method for the simultaneous determination of intact benomyl and its degradation product, methyl 2-benzimidazole carbamate (MBC), in organic solvents and water. Journal Agric. Food Chemistry. 25 (2) :368-373. [ Links ]
5. Chiba M.; Cherniak E. (1978) Kinetic Study of Reversible conversion of Methyl 1- (Butylcarbamoyl)-2-benzimidazolecarbamate (benomyl) to Methyl 2-benzimidazolecarbamate (MBC) and n-Butyl Isocyanate (BIC) in organic Solvents Journal Agric. Food Chemistry. 26 (3) : 573-576. [ Links ]
6. Calmon J.; Sayag D. (1976) Kinetics and Mechanisms of conversion of Methyl 1- (Butylcarbamoyl)-2-benzimidazolecarbamate (benomyl) to Methyl 2-benzimidazolecarbamate (MBC). Journal Agric. Food Chemistry 24 (2), : 311-314. [ Links ]
7. Hiemstra M.(1995) Fully Automated Solid-Phase Extraction Cleanup and On-Line Liquid Chromatographic Determination of Benzimidazole Fungicides in Fruit and Vegetables. Journal of AOAC Int. 78 : 1267-1274. [ Links ]
8. Michel M.; Buszewski B. (2004) Optimization of a matrix solid-phase dispersion method for the determination analysis of carbendazim residue in plant material. Journal of Chromatography B, 800 : 309 - 314. [ Links ]
9. Di Muccio A. ; Girolimetti S.; Attard D.; Pelosi P.; Generali T.; Vergori L.; De Merulis G.; Leonelli A.; Stefanelli P. (1999) Selective clean-up applicable to aqueous acetone extracts for the determination of carbendazim and thiabendazole in fruits and vegetables by high-performance liquid chromatography with UV detection. Journal of Chromatography A, 883 : 61-65. [ Links ]
10. Gilvydis D.; Walters S. (1990). Ion-pairing liquid chromatographic determination of benzimidazole fungicides in foods. Journal Assoc. Off Anal. Chemistry., 75 (59), : 75341. [ Links ]
11. Anastassiades M.; Schwack W.; (1998) Analysis of carbendazim, benomyl, thiophanate methyl and 2,4- dichlorophenoxyacetic acid in fruits and vegetables after supercritical fluid extraction. Journal of Chromatography A, 825 : 45-54. [ Links ]
12. Fernandez M.; Rodriguez R.; Picó Y.; Mañes J. (2001) Liquid chromatographic-mass spectrometric determination of postharvest fungicides in citrus fruits. Journal of Chromatography A, 912 : 301-310. [ Links ]
13. Schachterle S.; Feigel C (1996) Pesticide residue analysis in fresh produce by gas chromatography-tandem mass spectrometry. Journal of Chromatography A, 754 :411 - 422. [ Links ]
14. Codex Alimentarius. (2000). FAO-OMS 2B. [ Links ]
15. Montaño, M.; Guerrero, J.A. (2001). Validación de una metodología multiresiduo para la determinación de residuos de plaguicidas en fresa (Fragraria spp.) por cromatografía de gases. Rev. Col .Quím. 30(1), : 37-46. [ Links ]
16. Moreno, M.; Guerrero, J.A. (2002). Validación de una metodología multiresiduo para la determinación de residuos de plaguicidas en repollo (Brassica Oleracea var.: Capitata.) por cromatografía de gases. Rev. Col .Quím. 31(1), : 19-32. [ Links ]
17. Guerrero, J.A. (2003). Estudio de residuos de plaguicidas en frutas y hortalizas en áreas especificas de Colombia. Agronomía Colombiana. 21 (3), : 198-209. [ Links ]
18. Ambrus, A.; Fajgelj, A. (2000). Guidelines for Single-Laboratory Validation of Analytical Methods for Trace-Level Concentrations of Organic Chemicals. En: Principles and Practices of Method Validation. Royal Society of Chemistry. UK. [ Links ]
19. Quattrocchi, O.; Abelaira de Andrizzi, S.; Laba, R. (1992). Introducción a la HPLC: Aplicación práctica. Editorial Artes Gráficas Farro. Argentina : 154-173, 301-328. [ Links ]
20. Ospina de Nigrinis, L.S. (1994) El método de análisis para los estudios de estabilidad y de biodisponibilidad de medicamentos. Parte I. Revista Colombiana de Ciencias Químico Farmacéuticas. 22 : 7-12. [ Links ]
21. Ospina de Nigrinis, L.S. (1994) El método de análisis para los estudios de estabilidad y de biodisponibilidad de medicamentos. Parte II. Revista Colombiana de Ciencias Químico Farmacéuticas. 23 : 95-100. [ Links ]
22. Miller J.C. y Miller. J. N. (1993). Estadística para Química Analítica, 2da Edición. Addison-Wesley Iberoamerican S.A. Estados Unidos de América. : 40, 87-102. [ Links ]














