Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO  Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804On-line version ISSN 2357-3791
Rev.Colomb.Quim. vol.35 no.1 Bogotá June 2006
Johnbrynner García Galvis1, María Inés Ballesteros2
1Dpto. Química, Facultad de Ciencias, Universidad Nacional de Colombia, Bogotá
2Dpto. Química, Facultad de Ciencias, Universidad Nacional de Colombia, Bogotá. E-mail:miballesterosg@unal.edu.co
RESUMEN
En la actualidad existen varios procedimientos para la determinación de fósforo disponible en suelos, en donde el fósforo es cuantificado por métodos colorimétricos por medio del desarrollo de un complejo coloreado azul (ácido fosfomolíbdico); en uno, el color se presenta al utilizar como agente reductor ácido ascórbico y en el otro al emplear cloruro estannoso; ambos métodos utilizan la misma solución extractora de Bray II, cuya importancia radica en que presenta una muy buena correlación con la respuesta de cultivos en suelos ácidos, como lo son la mayoría de suelos de Colombia. Al comparar las dos metodologías se encontró que el método más sensible y con los mejores límites de detección y cuantificación para la determinación de fósforo es el que utiliza como agente reductor ácido ascórbico y tartrato de antimonio y potasio. También se observó al evaluar la precisión del sistema y del método que, tanto los coeficientes de variación, como las desviaciones estándar, fueron menores en este método, por tanto se considera como el método más preciso para la determinación de fósforo.
Palabras clave: Fósforo Disponible, suelos, Bray II, parámetros de calidad.
ABSTRAC
There are some colorimetric procedures for determining available phosphorous in soils, and phosphorous is evaluated by means of a blue complex (phosphomolibdic acid); in one of the methods, color appear when ascorbic acid is used as reductor agent, and in the other when stannous chloride is used. Both methods use the same extractive solution Bray II due to its good response for acid soil cultures, like most Colombian soils are. When the two methodologies were compared it was found that the most sensible method and with the best limit of detection and quantification was the one that uses ascorbic acid, antimonioum and potassium tartrate. Its variation coefficients and standard deviation were lower, and for this reason it is considered as the most precise method for phosphorous determination.
Key words: Available phosphorous, soils, Bray II, Quality parameters
INTRODUCCION
Existe una gran variedad de métodos de extracción del fósforo del suelo, que no dejan de ser un reflejo de la complejidad del comportamiento del elemento (1). El método Bray II utiliza como medio de extracción del fósforo, una solución de fluoruro de amonio en ácido clorhídrico diluido, la cual conduce a la disolución de algunos fosfatos presentes en el suelo como los de calcio, hierro y aluminio; además, gracias a la presencia de fluoruro de amonio en la disolución ácida se dá la formación de complejos con iones trivalentes de hierro y aluminio, con la consecuente liberación del fósforo (2).
Una vez extraído el fósforo, éste es cuantificado por medio de la reacción del azul de molibdeno en la cual la tonalidad azul es obtenida del producto de reducción del ácido molibdofosfórico, mediante cloruro estannoso en medio acidificado con ácido clorhídrico o también se puede desarrollar el color azul al reducirse el ácido ascórbico (3). Es de acalarar, que se habla de fósforo disponible como la fracción más inmediata utilizada por la planta para su respectivo desarrollo y una variación en tal fracción será la responsable de los cambios en el crecimiento de la planta.
El problema radica en que existen diferencias en los procedimientos para la determinación de fósforo disponible en suelos, como los son aspectos tales como relación suelo-extractante, tiempo y tipo de agitación, así como diferencias relacionadas con la determinación de fósforo en el extracto, como el método del desarrollo del color, la longitud de onda de lectura espectrofotometrica, tiempo de lectura, y la periodicidad con que se realice la curva de calibración (4). En el presente trabajo, se evaluaron algunos de los parámetros de calidad de las metodologías analíticas utilizadas para la determinación de fósforo disponible en suelos, estableciendo así las características para la aplicación de los métodos, así como sus limitaciones en la cuantificación y los posibles factores que afectan la medición (5,6).
MATERIALES Y MÉTODOS
Suelos. Se evaluaron tres tipos de suelos, con contenidos altos, medios y bajos en materia orgánica. Las muestras fueron procedentes de Mondoñedo (Cundinamarca), Rosario (Antioquia) y Villa de Leyva.(Boyacá).
Método 1. El fósforo del suelo pasa a 25 mL de la solución extractora de HCl 0,1 N y NH4F 0,03 N, se agita, se filtra y se cuantifica colorimetricamente el fósforo disponible por reacción con ácido cloromolibdico y cloruro estannoso, para formar un complejo de color azul cuya intensidad es proporcional a la cantidad de fósforo presente en la muestra a una longitud de onda de 660 nm. Además se construye una curva de calibración con patrones de fosfato monobásico de potasio R.A. en un intervalo de 0 a 10 ppm siguiendo el mismo procedimiento realizado a la muestra.
Método 2. Pesar 2,85 g de suelo y agregar junto con 20 mL de solución extractora a un tubo de ensayo de 50 mL, agitar durante 40 segundos manualmente y cronometrando el tiempo. Filtrar la suspensión inmediatamente. Posteriormente se cuantifica el fósforo colorimétricamente por medio de la formación de un complejo azul producto de reducción del ácido molibdofosfórico obtenido mediante ácido ascórbico más tartrato de antimonio y potasio.
Este procedimiento se sigue con las disoluciones patrón de fósforo de manera que las soluciones finales de fósforo varían entre 0,05 y 2,0 ppm. Leer a 660 nm, después de 15 minutos.
Reactivos. Fluoruro de amonio R.A., ácido clorhídrico concentrado, molibdato de amonio G.R., tartrato de antimonio y potasio, ácido sulfúrico concentrado, ácido ascórbico, cloruro estannoso, fosfato monobásico de potasio R.A.
Metodología. Verificación de los parámetros de las metodologías analíticas para la determinación de fósforo disponible en suelos, tales como longitud de onda de máxima absorción, y del intervalo lineal de concentración mediante las curvas de Ringbom.
Evaluación de los parámetros de calidad para las dos metodologías en estudio tales como exactitud del sistema, precisión del método, cantidad mínima cuantificable y detectable.
RESULTADOS Y ANÁLISIS
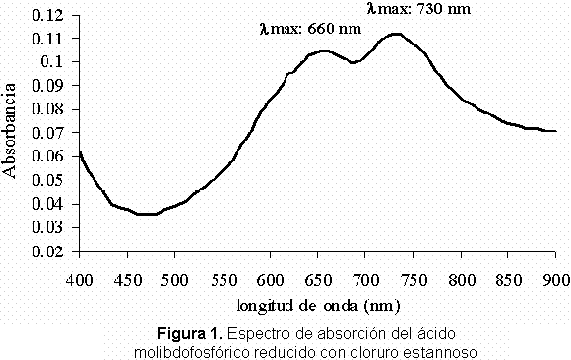
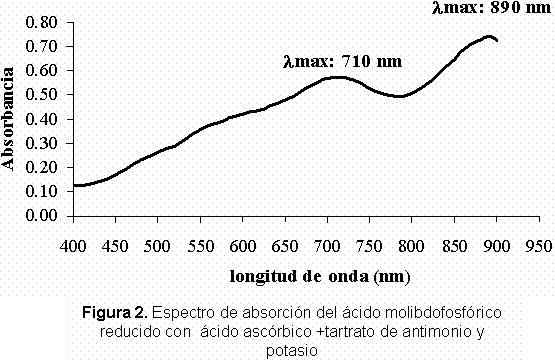
Verificación de los parámetros de las metodologías analíticas para la determinación de fósforo disponible en suelos. En la Figura 1 y 2 se puede observar el espectro de absorción correspondiente para cada método de análisis para el producto de reducción del ácido molibdofosfórico
En la Figura 1 se puede observar claramente que al emplear el método 1, el espectro muestra dos longitudes de onda de máxima absorción las cuales se dan específicamente a 660 nm y a 730 nm. En el caso de la Figura 2, es decir al utilizar el método 2 el espectro también muestra dos longitudes de onda de máxima absorción, una a 710 nm y otra 890 nm. Comparando ambos espectros obtenidos con los reportados por Murphy y Riley en 1962, se puede observar que las curvas de absorción y sus respectivas longitudes de onda de máxima absorción son muy similares.
Una vez evaluada la longitud de máxima absorción se construyeron las respectivas curvas de Ringbom (Figura 3 y Figura 4), obteniendo los siguientes intervalos lineales los cuales fueron de 0,80-3,00 ppm en fósforo para el método 1 a una longitud de máxima absorción de 730 nm y de 0,30-1,60 ppm en fósforo para el método 2 a una longitud de onda de máxima absorción de 890 nm.
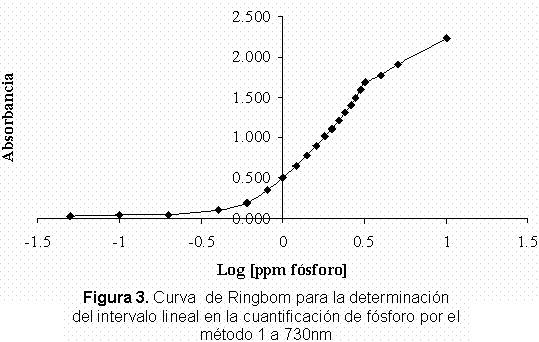
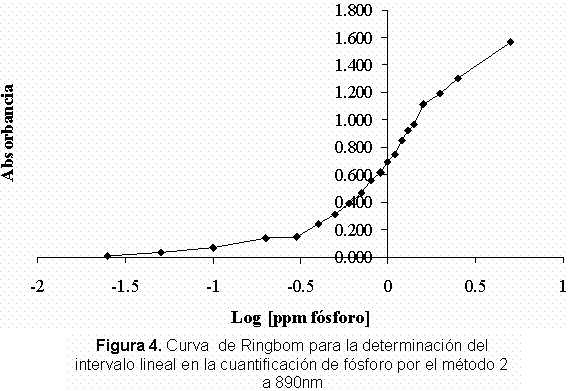
En las curvas de calibración obtenidas por el método 1 se obtuvieron coeficientes de regresión lineal inferiores a los obtenidos para el método 2 los cuales fueron mejores, siendo todos ellos superiores a 0,999 y encontrándose en un intervalo de 0,9992-0,9996. Además con el fin de saber si existían datos anómalos en la regresión, se analizaron los gráficos de residuos para cada una de las curvas de calibración realizadas por los dos métodos; en todos se comprobó que hay una distribución satisfactoria de los residuos (Figura 5 y Figura 6) en donde los residuos no tienen ninguna tendencia establecida ni ningún dato anómalo, sino valores de residuos de absorbancia con una distribución aleatoria lo que nos indica que estos resultados no están sujetos a errores sistemáticos.
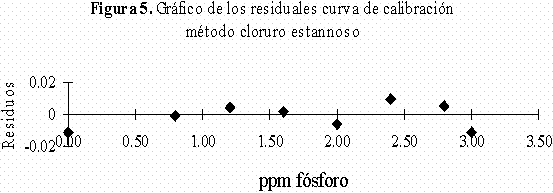
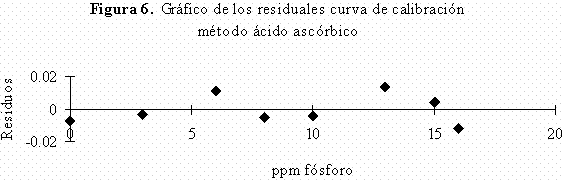
Evaluación de los parámetros de calidad.
Cantidad mínima detectable y cuantificable. Para los dos métodos de cuantificación se obtuvieron resultados muy diferentes, en el método 1 se obtuvo un límite de detección de 0,0092 ppm en fósforo con un nivel de confianza del 95%, mientras que en el método 2 el límite de detección fue menor 0,0035, siendo esta la mínima cantidad de analito que puede ser detectada (5, 10, 11)). El límite de cuantificación de fósforo en el caso del método 1 resultó de 0,031 ppm y en el método 2 fue de 0,012 ppm, valores que se encuentran por debajo del intervalo de respuesta lineal encontrado en las curvas de calibración, el cual iniciaba en 0,80 ppm en fósforo para el método 1 y en 0,30 ppm para el método 2.
Exactitud. Se encontró que al aplicar la prueba t-student para los niveles bajos de concentración en cada método (ver Tabla 1), estos son mayores comparándolos con el t tabulado (4g.l, P=0,05) el cual es de 2,776, (10) rechazando de esta forma la hipótesis nula y dando por tanto evidencia de la existencia de errores sistemáticos en la determinación de fósforo por ambos métodos de cuantificación al analizar concentraciones bajas de fósforo.
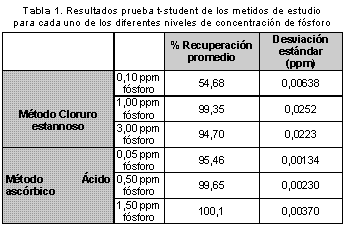
En cambio en los niveles de concentración medios y altos de fósforo todos los valores t-student calculados fueron menores al t tabulado (4g.l, P=0,05) el cual es de 2,776; indicando así que para estos niveles de concentración en fósforo analizados no hay evidencia de la existencia de errores sistemáticos y por tal la cantidad de fósforo encontrada no muestra diferencias significativas con la esperada (12).
Precisión del método. En los resultados encontrados se observa que al comparar ambos métodos, en todas las muestras de suelos es mayor el contenido en ppm de fósforo al utilizar el método 2 que en el método 1, lo cual indica que la determinación de fósforo disponible en suelos por el método Bray II utilizando cloruro estannoso está sujeta a errores de índole sistemático que no permiten cuantificar completamente la cantidad de fósforo disponible en suelos. (Tabla 2)
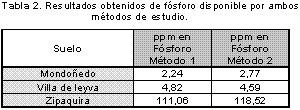
También en estos resultados se puede ver, que al implementar las metodologías por el método 2, se obtienen en todas las muestras de suelos valores de coeficiente de variación mucho menores que los obtenidos para cada tipo de suelo al utilizar el método 2. En el método 1 el intervalo de los coeficientes de variación está entre 1,92% y 16,50% mientras que por el método 2 es mucho menor encontrándose entre 0,44% y 4,64% . (Figura 7).
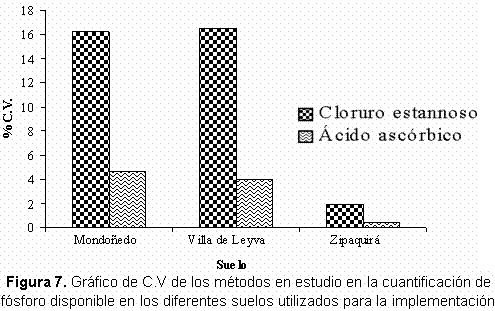
Evaluación de la metodología para lograr las mejores condiciones de análisis.
Una vez escogido el método Bray II utilizando los agentes reductores ácido ascórbico y tartrato de antimonio y potasio como la mejor opción para analizar el fósforo disponible en suelos, se realizo una evaluación más completa del método para dicha determinación, y pues debido a la gran variabilidad en los procedimientos para la determinación de fósforo disponible en suelos, fue necesario realizar ensayos con el fin de conocer si existen diferencias significativas al variar los recipientes de extracción, y mucho más al utilizar diferentes tipos de agitación: manual y mecánico, ya que al tener un mayor conocimiento de estos factores podrían solucionarse algunos problemas asociados a la interpretación del resultado del análisis del fósforo disponible puesto que las diferencias metodológicas causan incertidumbre en el resultado final.
Se encontró (Figura 8) que al agitar manualmente siempre se obtienen coeficientes de variación mayores que al realizar la agitación mecánica en los tres diferentes recipientes de extracción; esto debido a que al agitar manualmente no siempre la forma de agitar es idéntica, y además la fuerza y la forma de agitar es también muy subjetiva y depende bastante del experimentador. También se aprecia que los mayores coeficientes de variación se obtuvieron al utilizar tubos de ensayo como recipientes de extracción, en comparación a los erlenmeyer de 125 mL y a los frascos plásticos los cuales presentan una extracción similar.
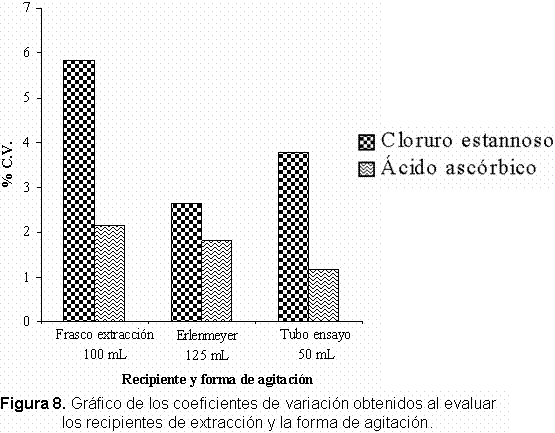
Es importante resaltar que tanto en la agitación manual como mecánica, la cantidad de fósforo extraída utilizando tubos de ensayo fue menor en comparación con la extraída en frascos y erlenmeyer los cuales presentan valores promedio muy similares.
BIBLIOGRAFÍA
1. Demolon, A. (1966). Crecimiento de Vegetales Cultivados. Ediciones Omega. Barcelona. p 199-224, 251-257. [ Links ]
2. Fassbender, H.W. (1975). Química de suelos con énfasis en suelos de América Latina. Instituto Interamericano de Ciencias Agrícolas de la OEA. p. 221-223. [ Links ]
3. Mengel, K.; Kirkby, E.A. (1982), Principles of Plant Nutrition. International Potash Institute. p. 11-24. [ Links ]
4. Boschetti, G., Quintero, C., Diaz, M., Barraco, M., (1991).Determinación del fósforo disponible en el suelo por el método Bray, II jornada Nacional del Fósforo del Suelo. Comité de Química de Asociación Argentina de la Química del Suelo, PROMAR (Programa de Métodos Analíticos de Referencia). [ Links ]
5. Kateman, G.; Buydens, L. (1993). Quality Control in Analytical Chemistry. 2nd ed. New York. Wiley. p. 79-114, 140-155. [ Links ]
6. Taylor, J.K. (1981). Quality Assurance of Chemical Measurements. Anal. Chem. 53. 1588-1596A. [ Links ]
7. Jackson, M.L.(1958). Soil Chemical Analysis. 2da Ed. Prentice may. Englewood Cliffs. N.J. p. 183-185. [ Links ]
8. Navarro, G.; Navarro, S. (2000). Química Agrícola. Ediciones Mundi Prensa. España. p. 141-146. [ Links ]
9. Harvey, D. (2002). Química Analítica Moderna. McGraw-Hill. España. p. 27-37, 41-65, 493-499. [ Links ]
10. Miller, J. C.; Miller, J.N. (1993). Statistics for Analytical Chemistry. 2nd ed. London. Ellis Horwood PTR Prentice Hall. p. 77-82, 111-115, 125-130, 189-194. [ Links ]
11. Kratochvil, B.; Taylor, J.K. (1981). Sampling for Chemical Analysis. Anal.Chem. 53. 924A-938A. [ Links ]
12. Green, J.M. (1996). A Practical guide to Analytical Method Validation. Anal. Chem. 68. 305A-309A. [ Links ]














