Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804On-line version ISSN 2357-3791
Rev.Colomb.Quim. vol.35 no.2 Bogotá Jul./Dec. 2006
Jorge E. Pinzón1 Jefferson H. Martínez1 Armando Espinosa1 Paulo C. Narváez1 Arturo Pérez2
1 Departamento de Ingeniería Química, Universidad Nacional de Colombia, sede Bogotá, Bogotá, Colombia. jepinzonri@unal.edu.co
2 Departamento de Investigación y Desarrollo Chalver Laboratorios, Bogotá Colombia.
RESUMEN
La reacción de polimerización del ácido láctico por el mecanismo de policondensación por fusión directa es de gran importancia cuando se desean obtener polímeros de bajo peso molecular, principalmente para aplicaciones médicas, debido a la facilidad del proceso y el bajo costo. Un ejemplo de esto es la elaboración de dispositivos para la liberación controlada de medicamentos. En este trabajo se estudiaron las diferentes etapas que involucra la policondensación (oligomerización y polimerización) para obtener PAL. La etapa de oligomerización se estudió en un estrecho intervalo de temperatura, 100-150 °C, donde el modelo cinético que describe la reacción es una ley de potencias de orden tres con Ea y factor preexponencial de 22,7 kcal/mol °K y 3,28x10-7 L2/mol2h respectivamente. Para la etapa de polimerización se estudiaron la influencia de la temperatura, el porcentaje de catalizador (SnCl2 2H2O) y el tiempo de reacción tomando como variable de respuesta la temperatur a de transición vítrea.
Palabras clave: oligomerización, polimerización, temperatura de transición vítrea.
ABSTRACT
The polymerization reaction of d,1-lactic acid through polycondensation by direct melting is very important when low molecular weight polymers are desired, mainly for biomedical uses due to the easiness and low cost of process. And example of this is the manufacture of controlled delivery devices for drugs. In this work the steps involved on the polycondensation (oligomerization and polymerization) to obtain PLA were studied. The oligomerization was studied in a narrow range of temperatures 100-150°C where the kinetics model that describes the reaction is a kinetic law of powers of third order, with Ea and preexponential factor at 298.15K being 22,7 kcal/molK and 3.28x10-7 L2/mol2h respectively. For the polymerization step was studied the influence of temperature, the catalyst ratio (SnCL2.2H2O) and the time of reaction at the glassy transition temperature.
Key Words: PLA, oligomerization, polymerization,glass transition temperature.
INTRODUCCIÓN
La disposición de los materiales plásticos después del uso actualmente se convierte en un problema de tipo ambiental puesto que los polímeros convencionales no se degradan en tiempos razonables, y muchos de ellos no se reciclan quedando como opción más probable la incineración, sin ser ésta la más adecuada ya que los elevados calores de combustión de los polímeros pueden ocasionar daños en los equipos (hornos), y la formación excesiva de gases genera un impacto ambiental negativo, que se traduce en fenómenos tales como el calentamiento global, la lluvia ácida y, en algunos, casos toxicidad (1).
Como consecuencia de los problemas ambientales, la importancia de los polímeros biodegradables y biocompatibles está continuamente en crecimiento, constituyéndose en una alternativa frente a los polímeros tradicionales obtenidos de fuentes no renovables como son los hidrocarburos.
El poli(ácido láctico) (PAL) es un biopolímero que ha llegado a ser muy importante en aplicaciones biomédicas como hilos de sutura quirúrgicos, reconstrucción de tejidos y medicamentos de liberación controlada (2). En esta última aplicación se requieren polímeros con bajos pesos moleculares y estados amorfos, con el fin de una rápida degradación y absorción por el organismo.
El PAL se produce principalmente a partir de la lactida por el proceso de apertura de anillo, debido a la posibilidad de un mejor control sobre el proceso y a que permite obtener polímeros con propiedades uniformes y pesos moleculares muy definidos (3). Sin embargo, las múltiples etapas del proceso y la complejidad de algunas de ellas hacen que el producto final sea costoso. Por esta razón, cuando se busca PAL de bajo peso molecular, el proceso de policondensación por fusión resulta atractivo debido a su relativa facilidad y aparente bajo costo (4, 5).
En este trabajo se estudiaron los efectos cinéticos de la etapa de oligomerización y las principales variables de la segunda etapa de policondensación (temperatura, relación de catalizador y tiempo de reacción), como parte de un desarrollo a escala industrial para la industria farmacéutica.
MATERIALES Y MÉTODOS
Reactivos
Como monómero se utilizó una mezcla racémica de ácido láctico (Sigma- Aldrich, St. Louis, MO). La pureza del ácido láctico fue determinada por HPLC (Waters Corportation Milford, MA) empleando detector de índice de refracción (IR), y como fase móvil agua eluida a 1 mL/min, con columna KC 811 y precolumna KC-G. El contenido de agua fue determinado por el método de Karl Fischer con un titulador automático Mettler Toledo KF DL 18 (Mettler Toledo GmbH, Shwerzenbach, Switzerland). La composición del ácido láctico fue: 64,0% de ácido láctico monómerico, 20,9% de anhídrido láctico (DP2) y 15,1% de agua. Como catalizador se utilizó cloruro de estaño dihidratado (Carlo Erba Reagenti, Milán, Italia).
Titulación de grupos ácidos finales
La titulación de grupos ácidos carboxílicos finales se realizó en un titulador automático Mettler Toledo DL 53 (Mettler Toledo GmbH, Schwerzenbach, Switzerland), usando un electrodo Mettler Toledo DG 111-SC (3 M KCl saturado con AgCl). Una cantidad conocida de oligómero se disolvió en 40 mL de solvente neutro (procedimiento ASTM D 1639-90) y se tituló usando una solución de 0,1 N KOH en isopropanol (JT Baker, Phillipsburg, NJ). El grado de polimerización se calculó con base en el valor ácido medido y se corrigió por el contenido de agua de la muestra.
Calorimetría diferencial de barrido (CDB)
Las propiedades calorimétricas de los polímeros se determinaron en un DSC 2910 TA Instruments (TA Instruments Co., New Castle, DE), calibrado con una muestra de Indio. Las mediciones se realizaron a una velocidad de calentamiento de 10 °C/min bajo atmósfera de nitrógeno y con una cantidad de muestra entre 4 y 6 mg. Después de corroborar el carácter amorfo de los polímeros, se realizaron las mediciones para determinar la temperatura de transición vítrea en un intervalo de –30 a 60 °C para el segundo periodo de calentamiento.
DESARROLLO EXPERIMENTAL
Oligomerización
Como parte de la investigación se desarrolló un equipo de reacción para estudiar las etapas de oligomerización y polimerización. El equipo consiste de seis balones de 50 mL conectados en serie, con agitación magnética y conectados a un sistema de vacío por medio de llaves de paso. El sistema de vacío se compone de una trampa para gases con condensador y balón colector que va unido a una bomba de vacío. Además, cuenta con un baño termostatado con controlador Shimaden SR1 capaz de controlar la temperatura entre ±1 °C con respecto al set point.
Inicialmente se deshidrataron 30 mL de la solución de D,L ácido láctico a tres temperaturas distintas (100, 125 y 150 °C) bajo condiciones de vacío. La presión del sistema se redujo gradualmente de la siguiente manera: la primera hora se mantuvo en 5 pulgadas Hg de vacío, luego se disminuyó en 5 pulgadas Hg de vacío cada hora hasta llegar a la mínima presión de vacío correspondiente a 22 pulgadas Hg de vacío1. Posteriormente la presión del sistema se mantuvo constante hasta finalizar la reacción. La oligomerización se estudió por periodos de 12 horas, en donde cada 2 horas se tomó una muestra para realizar el seguimiento de la reacción. Los ensayos se realizaron por duplicado.
Producción de PDLLA por policondensación por fusión
Las polimerizaciones se realizaron en el equipo descrito anteriormente en las mejores condiciones de reacción, de acuerdo con los resultados del estudio de la oligomerización. El oligómero obtenido se mezcló con cloruro de estaño dihidratado (SnCl2 2H2O) y se estableció el máximo vacío antes de empezar el calentamiento (22 pulgadas Hg de vacío). Se evaluaron dos temperaturas de reacción: 150 y 170 °C. La reacción se estudió por periodos de 20 horas, tomando muestras cada 4 horas para realizar el seguimiento. Los ensayos se realizaron por duplicado.
RESULTADOS Y DISCUSIÓN
En la Figura 1 y Figura 2 se muestra el seguimiento de la reacción de oligomerización del ácido láctico. De acuerdo con estos resultados la reacción parece ser irreversible.
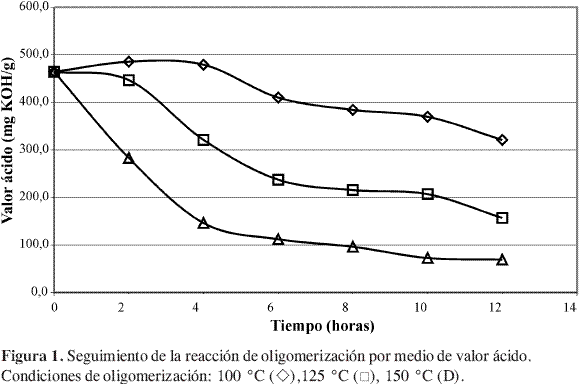
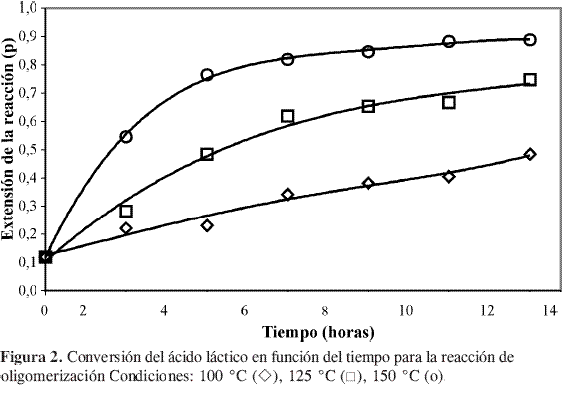
De acuerdo con Gupta y Kumar (6), la reacción de policondensación entre grupos alcohol y ácido puede asociarse con una serie de reacciones de esterificación sucesivas (poliesterificación) y, por tanto, la cinética de esta reacción corresponde a una reacción de esterificación convencional, en este caso en ausencia de catalizador. En teoría, las cinéticas de las reacciones de esterificación autocatalíticas resultan ser expresiones del tipo de ley de potencias de orden tres, en donde el grupo ácido actúa como el propio promotor de la reacción.
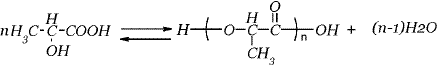
En las condiciones del proceso, la reacción de poliesterificación es irreversible porque el agua se retira continuamente del medio de reacción, con lo cual la reacción inversa no procede. Por tanto, la expresión cinética es la siguiente:
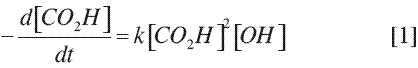
en donde [CO2H] representa la concentración de grupos ácidos y [OH] la concentración de grupo alcohol. En el caso del ácido láctico, la molécula resulta ser bifuncional y siempre cumple con el balance estequiométrico que se requiere para los procesos de polimerización por condensación. Con base en lo anterior la ecuación [1] se simplifica en la ecuación:
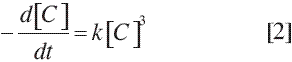
donde [C] es la concentración del grupo alcohol o el grupo ácido, y k es la constante de velocidad de reacción. La dependencia de k con la temperatura puede expresarse con el modelo de Arrhenius:
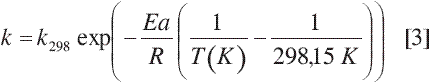
En la ecuación [3] Ea es la energía de activación y k298 es el factor preexponencial referenciado a 25 °C. Para corroborar el modelo los datos obtenidos se ajustaron a la expresión integrada de la ecuación [2]:
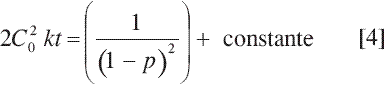
En la ecuación [4] &391;C] se reemplazó por Co(1-p) donde p corresponde al avance de la reacción. El término constante es igual a [/(1-po)2].
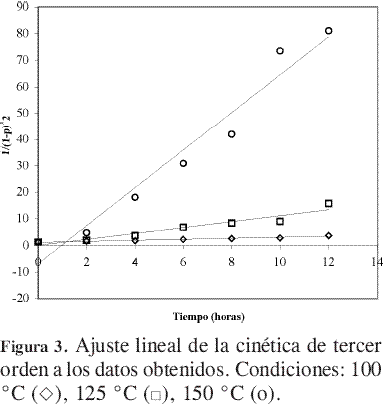
A partir de la Figura 3 se obtuvieron las constantes de velocidad de reacción a las temperaturas evaluadas. Estos valores se presentan en la Tabla 1 y se emplearon para determinar la dependencia de la constante de velocidad de reacción con la temperatura.
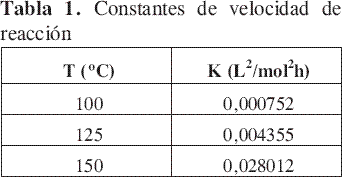
La Figura 4 demuestra que el modelo de Arrhenius describe adecuadamente la dependencia de la velocidad de reacción con la temperatura. La energía de activación y el factor preexponencial referenciado a 25 °C fueron 22,7 kcal gmol-1 K-1 y 3,28x10-7 L2mol-2h-1 respectivamente.
La siguiente etapa de reacción, la polimerización del oligómero de ácido láctico se estudió a través del cambio en la temperatura de transición vítrea (Tg), como lo plantearon Perego y Buchholz (7, 8), debido a que Tg es característica de polímeros amorfos y aumenta conforme aumenta el peso molecular para macromoléculas con bajos pesos moleculares.
Este comportamiento se puede explicar con la teoría de volumen libre para la temperatura de transición vítrea, en donde volúmenes libres mayores pueden asociarse a macromoléculas con longitud de cadena relativamente grande y, por consiguiente, tienen mayor Tg que una molécula de polímero de tamaño corto (9). Sin embargo, existe un punto en el cual incrementos en el peso molecular del polímero no tienen efecto significativo sobre ella.
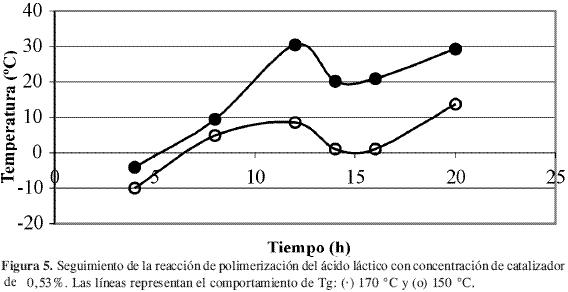
El seguimiento de la reacción de polimerización en su segunda fase se muestra en las Figuras 5 a 8, en las cuales se comparan las temperaturas y las concentraciones de catalizador.
Para los ensayos en los cuales se mantuvo la concentración de catalizador constante, Figura 5 y Figura 6, se observó que las mayores temperaturas de transición vítrea se obtuvieron a 170 °C, lo cual era de esperarse ya que la velocidad de reacción aumenta conforme aumenta la temperatura de acuerdo con la expresión de Arrhenius, ecuación [3]. En estas figuras se observó que se alcanza un máximo en Tg y después el sistema fluctúa con gran amplitud. Lo anterior puede corresponder a la dinámica de la reacción que involucraría una lenta estabilización, y la amplitud de la curva correspondería a un fenómeno de plastificación de los compuestos de bajo peso molecular sobre el polímero.
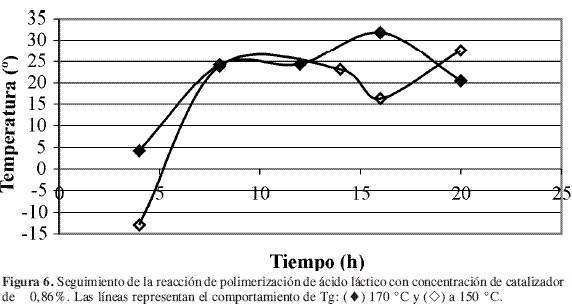
El efecto de la concentración de catalizador sobre Tg resulta más difícil de caracterizar. Al parecer, el valor de Tg depende tanto de la temperatura como del tiempo de reacción. En la Figura 7 se presenta el seguimiento de la reacción a 150 °C, se observa que los mejores resultados sobre Tg se lograron para un porcentaje de catalizador de 0,86% en peso respecto al oligómero formado. Sin embargo, este comportamiento no se mantuvo con el incremento en la temperatura de reacción, como se observa en la Figura 8 en donde prácticamente se obtuvieron las mismas temperaturas de transición vítrea pero con concentraciones de catalizador y tiempos de reacción diferentes. Éstas fueron: 30,5 °C para 12 horas y 0,53% de catalizador, y 31,5 °C para 16 horas y 0,86% de catalizador.
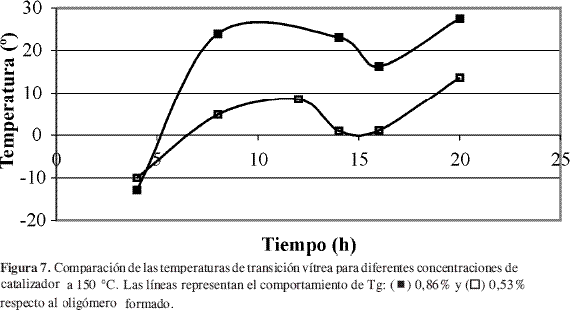
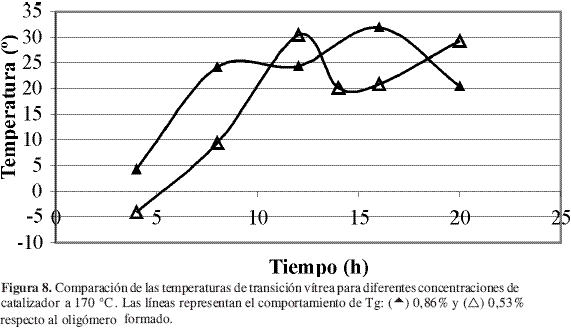
En estudios anteriores Moon y Zhao (5, 6) encontraron que las mejores condiciones en las que se desarrolla la reacción son cercanas a uno de los puntos evaluados en este estudio, en donde se obtuvo un máximo para Tg mostrado en la Figura 8. Aunque la investigación desarrollada por Moon y cols. (5) corresponde a la polimerización de L-ácido láctico con cloruro de estaño activado con ácidos protónicos, en ella se encontró que las condiciones óptimas son 0,4% de catalizador, 10-15 horas de reacción y 180 °C, semejantes a las obtenidas por Zhao y cols. 0,5% de catalizador, 10 horas y 170-180 °C. El comportamiento binodal con respecto a la concentración de catalizador parece estar por fuera del comportamiento planteado por estos autores. Sin embargo, Witzke y cols. (3) encontraron que en la polimerización por apertura de anillo de la lactida con octoato de estaño (II), pueden obtenerse conversiones y pesos moleculares semejantes con concentraciones de catalizador diferentes en distintos tiempos de reacción. Así pues, en este tipo de reacciones a menor concentración de catalizador menor es el tiempo empleado en alcanzar la mayor conversión, lo que parece representar el mismo comportamiento obtenido en este trabajo, aunque debe hacerse un estudio más completo para confirmar lo anterior, para la reacción de policondensación.
CONCLUSIONES
En este trabajo se realizó un estudio de las dos etapas de la reacción de polimerización del ácido láctico por el proceso de fusión directa (oligomerización y polimerización) en un estrecho intervalo de temperatura. Las mejores condiciones para la primera etapa fueron 150 °C y periodos de reacción entre 6 y 8 horas bajo vacío. Por otro lado, se demostró que la reacción sigue una expresión cinética del tipo ley de potencias de orden tres con Ea 22,7 kcal/mol °K y factor preexponencial de 3,28x10-7 L2/mol2h.
Para la segunda etapa de reacción se encontró que la reacción procede más rápidamente a mayor temperatura, además se observa una dependencia compleja entre la concentración de catalizador y el tiempo de reacción, encontrando que los mejores resultados se obtienen con 0,4% de catalizador, 12 horas de reacción y 170 °C, al igual que para 0,86% de catalizador, 16 horas de reacción y 170 °C.
AGRADECIMIENTOS
Los autores expresan su agradecimiento a la Universidad Nacional de Colombia; en especial al doctor Jairo Ernesto Perilla por sus aportes y colaboración en el análisis instrumental, y a Chalver Laboratorios S.A. por la financiación brindada a esta investigación.
1 Este trabajo se realizó en Bogotá D.C., Colombia en donde la presión atmosférica es en promedio 22,2 pulgadas Hg.
BIBLIOGRAFÍA
1. Terado, Y.; Suizu, H.; Takagi, M.; Ajioka, M.; Hiraoka, S.; Sakai, M.; Suzuki, H.; Shinagawa, R.; Ogawa, S.; Kotaki, Y. (Mitsui Chemicals, Inc). Process for producing aliphatic poliéster excellent in stability. U.S. Patent. 6,528,617, 2003. [ Links ]
2. Kim, S. Y.; Kanamori, T.; Noumi, Y.; Wang, P-C.; Shinbo, T. Preparation of porous poly(D,L-lactide) and poly(D,L-lactide-co-glycolide) membranes by a phase inversion process and investigation of their morphological changes as cell culture scaffolds. J Appl Polym. Sci. 2004; 92:2082-2092. [ Links ]
3. Witzke, D. R.; Narayan, R.; Kolstad, J. J. Reversible Kinetics and thermodynamics of the homopolymerization of L-lactide with 2- ethylhexanoic acid tin(II) salt. Macromolecules 1997; 30:7075-7085. [ Links ]
4. Moon, S. I.; Lee, C. W.; Miyamoto, M.; Kimura, Y. Melt polycondensation of L-lactic acid with Sn(II) catalysts activated by various protons acids:Adirect manufacturing route to high molecular weight poly(L-lactic acid). J Polym Sci: part A. 2000; 38:1673-1679. [ Links ]
5. Zhao Y.; Wang, Z.; Wang, J.; Mai, H.; Yan, B.; Yang, F. Direct synthesis of poly(D,L-lactic acid) by melt polycondensation and its applications in drug delivery. J Appl Polym Sci. 2004; 91:2143-2150. [ Links ]
6. Gupta, S. K.; Kumar, A. Reaction enginnering of step growth polymerization. New York Plenum Press, 1987. [ Links ]
7. Perego, G.; Albizzati, E. (Himont incorporated). Process for the synthesis of lactic acid polymers in the solid state and products thus obtained. U.S. Patent 5,359,027, 1994. [ Links ]
8. Buchholz, B.; Entenmann, G. (Boehringer Ingelheim KG). Semisolid mixture of amorphous oligomers and crystalline polymers based on lactic acid. U.S. Patent 5,725,881, 1998. [ Links ]
9. Vargas, S. Síntesis y caracterización de polímeros biodegradables preparados a base de ácido láctico. Tesis de grado. Universidad de los Andes, 2002. [ Links ]














