Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804On-line version ISSN 2357-3791
Rev.Colomb.Quim. vol.35 no.2 Bogotá Jul./Dec. 2006
Alexander Erazo1, Jairo A. Guerrero2
1Departamento de Química, Universidad del Cauca, Popayán,Colombia. alexerazo@unicauca.edu.co
2Departamento de Química, Universidad Nacional de Colombia, Sede Bogotá, Bogotá, Colombia. jaguerrerod@unal.edu.co
RESUMEN
En este estudio se determinó la incertidumbre durante el procesamiento de la muestra u homogeneización de diferentes matrices (tomate, lechuga y naranja), a temperatura ambiente y con hielo seco. El método se basó en la estimación de las constantes de muestreo y en la utilización de un compuesto de referencia (14C-clorpirifos). Para ello fue necesario desarrollar 5 experimentos por cada matriz y tipo de homogeneización. Realizada la homogeneización, se tomaron 5 réplicas de 150 g y 15 g (porciones analíticas) por experimento. Para cada una de las porciones analíticas se calculó su varianza y se evaluó estadísticamente si no existía diferencia significativa entre ellas. Cuando no existió diferencia significativa entre las dos varianzas se calculó el coeficiente de variación para la porción de mayor tamaño. A partir de este CV y el peso de la porción analítica de 150 g, se calculó la constante de muestreo. Obtenida la constante de muestreo, se pudo determinar la incertidumbre para cualquier porción analítica. La incertidumbre en la homogeneización con hielo seco de todas las muestras no fue significativamente diferente entre sí, porque fue reproducible sin importar la matriz, mientras que la homogeneización a temperatura ambiente demostró diferencias significativas en el procesamiento cuando se cambia el tipo de muestra. En cada matriz se demostró que no existe diferencia significativa entre la homogeneización a temperatura ambiente y la realizada con hielo seco. Se determinó que la incertidumbre de la extracción, comparada con la incertidumbre durante el procesamiento de la muestra, fue despreciable para todas las matrices; por tanto, la incertidumbre durante la homogeneización pudo determinarse directamente de los experimentos.
Palabras clave: homogeneización de la muestra, procesamiento de la muestra, incertidumbre, constantes de muestreo, residuos de plaguicidas, porción analítica.
ABSTRACT
In this study, the uncertainty during sample processing or homogenization of several different matrices (tomato, lettuce and orange) was determined at ambient temperature and with dry ice. The method was based on surface treatment of the matrix with a reference compound (14C-chlorpyrifos) and estimation of the sampling constants. The uncertainty determination was carried out developing 5 experiments for each of the different homogenizations and matrices. After homogenization, 5 replicate analytical portions of 15 g and 150 g were withdrawn for each experiment. The variance was calculated for each analytical portion. The significant difference between the variance of smaller analytical portion and the variance of larger analytical portion was evaluated. Then the coefficient of variation (CV) was calculated for the larger portion. This coefficient was used to calculate the sampling constant. Then, the uncertainty could be determined for any analytical portion size. The sample processing uncertainty obtained with dry ice for all samples was not significantly different. There was no any significant difference between homogenization at ambient temperature and homogenization with dry ice for each matrix. The extraction uncertainty was negligible for all matrices compared to the sample processing component. It allows one to quantify the sample processing uncertainty directly.
Key words: Sample homogenization, sample processing, uncertainty, sampling constant, pesticides, analytical portion.
INTRODUCCIÓN
La incertidumbre es un parámetro que describe el intervalo dentro del cual es razonablemente verosímil encontrar el valor de una medición (1). Actualmente los laboratorios de ensayo y calibración requieren determinar este parámetro para reportarlo con sus resultados, ya que la norma ISO 17025 lo exige. Sin embargo, dicha determinación se efectúa con base en los esquemas de validación, los cuales incluyen etapas posteriores a la toma de la porción analítica, tales como la extracción, concentración limpieza y análisis instrumental. Esto desconoce el efecto que otras etapas pueden tener sobre la incertidumbre total. Tal es el caso de la etapa de homogeneización o procesamiento de la muestra, la cual no se tiene en cuenta al momento de estimar la incertidumbre total. Recientemente algunos investigadores han propuesto considerar esta etapa para el cálculo de la incertidumbre total del análisis de una muestra, ya que podría tener efectos significativos sobre ella (2). Dicha homogeneización se realiza sobre la muestra de laboratorio para obtener una muestra con distribución uniforme de los analitos (muestra analítica), garantizando la toma de porciones analíticas representativas, es decir, un submuestreo representativo del material. La incertidumbre durante esta etapa se puede determinar a partir del concepto de constantes de muestreo y con la utilización de compuestos radio marcados (3-5). La estimación de la incertidumbre con las constantes de muestreo se basa en la toma de dos grupos de porciones analíticas que deben diferenciarse en al menos un factor de 10, con respecto a su peso (4). Con ello se puede establecer si no existe una diferencia significativa entre las varianzas de las porciones analíticas de menor y mayor tamaño, en cuyo caso se puede calcular la constante de muestreo a partir de los datos obtenidos para la porción analítica de mayor tamaño (6); todo esto utilizando la relación establecida por Ingamels entre las constantes de muestreo, el tamaño de la porción analítica y el coeficiente de variación, como se muestra en la ecuación 1(3).
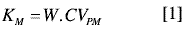
A partir de esta ecuación se deduce que un cambio en los valores de la constante de muestreo se debe al cambio de la incertidumbre en el procesamiento, cuando el peso de la porción analítica permanece constante, debido a que la dispersión generada durante el procesamiento de la muestra se ve reflejada en la variabilidad de la radioactividad promedio presente en las porciones analíticas de igual peso. Esta variabilidad dependerá, entonces, de la eficiencia en la homogeneización. Por ello, la determinación de la eficiencia de un determinado procesamiento puede efectuarse con base en las constantes de muestreo (6).
La utilización de compuestos radio marcados en los estudios de incertidumbre reviste gran importancia debido a las ventajas que presenta. Con el uso de estos compuestos es posible determinar la radioactividad directamente en los extractos sin tener que involucrar etapas adicionales como la limpieza; esto disminuye las fuentes de error (dispersión de los resultados) y permite la cuantificación del analito en cualquier etapa de la metodología (5). También hace posible una cuantificación más precisa del analito, debido a la utilización de técnicas como el conteo de centelleo líquido. Esta técnica posee coeficientes de variación muy bajos (CV =1%) con respecto a otras técnicas como la cromatografía de gases (CV = 17%), ampliamente utilizada en el análisis de residuos de plaguicidas (7).
En los estudios donde se sugiere evaluar la incertidumbre durante la homogeneización de la muestra, se evidencia que dicha incertidumbre depende de factores como la naturaleza de los analitos, el equipo y las condiciones en las cuales se realiza la homogeneización (5, 6, 2). Debido a ello, y a la exigencia establecida en la norma ISO 17025 para los laboratorios de ensayo y calibración, en este trabajo se determinó la incertidumbre durante el procesamiento de la muestra con base en la utilización de las constantes de muestreo y clorpirifos radio marcado (14C-clorpirifos) como compuesto de referencia. Todo ello con el objeto de establecer las mejores condiciones de homogeneización que disminuyan el efecto del procesamiento de la muestra sobre los resultados analíticos. El clorpirifos fue escogido como compuesto de referencia porque se ha comprobado que no sufre pérdidas durante la etapa de homogeneización (7).
MATERIALES Y MÉTODOS
Las soluciones empleadas en el estudio se prepararon a partir de un estándar de 14C-clorpirifos con una actividad de 26,8 mCi/mmol, suministrado por el Organismo Internacional de Energía Atómica, y clorpirifos frío del 99,5% de pureza, obtenido del doctor Ehrenstorfer. Las soluciones para realizar los ensayos de incertidumbre se prepararon en acetato de etilo a partir de 14C-clorpirifos y clorpirifos frío a una concentración aproximada de 0,026 mg/mL. La mezcla de éstos se efectuó con el fin de garantizar un comportamiento representativo del plaguicida a los niveles de concentración esperados en las matrices y asegurar un nivel bajo de radioactividad (8, 9). Se utilizó hielo seco comercial para realizar las homogeneizaciones. En las extracciones se utilizó acetato de etilo grado residuo, bicarbonato de sodio grado analítico y sulfato de sodio anhídro grado residuo, los cuales se obtuvieron de J. T. Beaker y Mallinckrodt. La actividad se determinó empleando cocktail de centelleo líquido Ultima Gold de Packard BioScience, y un contador de centelleo líquido Beckman LS 6500. Se empleó un procesador de alimentos Stephan UM-12 con capacidad de 5 kg y una licuadora industrial Waring con capacidad de 1 L para efectuar las diferentes homogeneizaciones. Las extracciones se realizaron con un homogeneizador de alta velocidad Ultra-Turrax T 25 de IKA. El peso de los extractos se determinó en una balanza analítica Scaltec SAC22 con exactitud de 0,00001 g y el peso de las porciones analíticas en una balanza de platillo externo Mettler-Toledo con exactitud de 0,01 g. El refrigerador que se utilizó durante los experimentos fue un congelador Frigidaire libre de escarcha, capaz de alcanzar temperaturas de -20 °C. Debido a que el experimento se basó en la lectura de la radioactividad del carbono 14 presente en la molécula de clorpirifos, las matrices utilizadas se emplearon como blanco.
METODOLOGÍA
El estudio determinó la incertidumbre generada durante la etapa de homogeneización con base en la utilización de un plaguicida de referencia (14C-clorpirifos), representativo del comportamiento de otros plaguicidas. Esto se pudo efectuar debido a que el clorpirifos es un compuesto que no sufre pérdidas durante el procesamiento. Con ello, la dispersión de los resultados (calculada a partir de la radioactividad del 14C-clorpirifos en los extractos) expresa la distribución de los plaguicidas en la matriz, independientemente de los errores sistemáticos originados por el tipo de analito presente en ella. Las matrices involucradas en el estudio (tomate, lechuga y naranja), se seleccionaron teniendo en cuenta las dificultades que se pueden presentar al homogeneizarlas, debido a la naturaleza de su cáscara o textura.
Una vez se realizó la fortificación superficial de las matrices con la mezcla, se llevó a cabo el procesamiento u homogeneización de éstas para tomar las porciones analíticas. Los extractos crudos se obtuvieron a partir de la extracción de las porciones analíticas, para luego medir su radioactividad. Con base en estos resultados se calcularon las constantes de muestreo para cada matriz y tipo de homogeneización.
Incertidumbre durante la extracción
Se realizaron ensayos de repetibilidad para cada matriz, previos al estudio de la incertidumbre durante el procesamiento, donde se determinó la incertidumbre que aportó la etapa de extracción. Para ello se tomó la matriz y se homogeneizó a temperatura ambiente. De este homogeneizado se tomaron 7 porciones analíticas de igual tamaño y, justo después, se fortificaron hasta alcanzar una actividad de 850 dpm/g de matriz. Una vez se realizó la extracción y determinación de la actividad en los extractos crudos, se estimó la incertidumbre durante la extracción con base en la matriz de datos expuesta en la Tabla 1.

Fortificación superficial de las matrices
Se pesó 1,5 kg de matriz y se le realizó la preparación de la muestra con el objeto de obtener una muestra adecuada para el análisis. Luego se procedió a cortar longitudinalmente la matriz y se colocó la cara interior del producto sobre una bandeja cubierta con papel aluminio. Posteriormente se fortificó hasta alcanzar una actividad aproximada de 3000 dpm/g de matriz. Esta fortificación se realizó con una jeringa Hamilton de 50 µL, agregando pequeñas cantidades de la solución de clorpirifos sobre un área pequeña de la superficie de la matriz para reproducir las condiciones de falta de homogeneidad que se presentan en la realidad. La fortificación se hizo evitando escurrimientos hacia el papel aluminio y dejando en reposo la matriz durante 15 minutos para permitir la evaporación del solvente. Pasado este tiempo se procedió a efectuar el procesamiento de cada matriz para obtener una matriz homogénea, lo cual se evidencia cuando el tamaño de partícula es < 2 mm (2, 5). Procesamiento
Procesamiento de tomate, lechuga y naranja a temperatura ambiente. Después de fortificar la matriz, se procedió a traspasar inmediatamente el material hacia el tazón del homogeneizador Stephan. La homogeneización se desarrolló a temperatura ambiente durante 1 minuto. Pasado este tiempo se reintegró el material adherido a las paredes del equipo. Este proceso fue realizado 3 veces más para completar el primer paso de homogeneización. Luego, se tomaron porciones de 400 g que fueron homogeneizadas nuevamente en una licuadora industrial durante 2 minutos, proceso adicional que se requirió para obtener partículas con diámetro < 2 mm, medidos teniendo en cuenta su forma irregular. De este homogeneizado se tomaron 5 porciones analíticas de 150 g y 5 porciones analíticas de 15 g, cada una de las cuales se sometió a extracción.
Procesamiento de tomate con hielo seco. Después de fortificar la matriz superficialmente, ésta se almacenó durante 30 minutos a –20 °C. Pasado este tiempo se llevó a cabo el procesamiento en el homogeneizador Stephan con hielo seco. Éste se efectuó durante 4 intervalos de 1 minuto, agregando inicialmente toda la matriz y 400 g de hielo seco. Después de cada intervalo se procedió a reintegrar el material adherido a las paredes del equipo y se adicionaron 400 g de hielo seco. Como resultado de esta homogeneización se obtuvo un polvo fino, a partir del cual se tomaron 5 porciones analíticas de 150 g y 5 porciones analíticas de 15 g, sin permitir el descongelamiento del homogeneizado y la sublimación del CO2.
Procesamiento de lechuga con hielo seco. Realizada la fortificación superficial, la lechuga se homogeneizó tal cual se efectuó el procesamiento del tomate con hielo seco. Realizada la homogeneización, fue necesario esperar un tiempo de 25 minutos para permitir el descongelamiento de la matriz y la sublimación del CO2, con el objeto de realizar un segundo paso de homogeneización, necesario para obtener partículas de < 2 mm de diámetro. Esta segunda homogeneización se efectuó a temperatura ambiente después de tomar una porción del primer homogeneizado equivalente a 400 g, la cual se procesó en una licuadora industrial por 2 minutos. A partir de esta muestra se tomaron 5 porciones analíticas de 150 g y 5 porciones analíticas de 15 g, cada una de las cuales se sometió a extracción.
Procesamiento de la naranja con hielo seco (procesamiento criogénico). Culminada la fortificación superficial, la matriz se introdujo en un refrigerador a –20 °C durante 16 horas. Luego, se sacó la bandeja con la muestra y se pesaron 500 g de hielo seco. Este último fue adicionado al homogeneizador Stephan, seguido de la mitad de la fruta y 250 g más de hielo seco. Inmediatamente, el recipiente se tapó y se realizó la homogeneización por 20 segundos a velocidad lenta en el homogeneizador Stephan. Transcurrido este tiempo se realizó el reintegro del material adherido a las paredes del equipo. De nuevo se agregaron 500 g de hielo seco, la otra mitad de la muestra y 250 g más de hielo seco. Se tapó el tazón y se realizó una homogeneización final. Ésta se efectuó a dos velocidades, lenta y alta, durante 20 y 270 segundos, respectivamente, hasta conseguir un polvo fino. La muestra homogeneizada fue empacada en bolsas dobles de polietileno y fue sometida nuevamente a refrigeración durante 20 horas para permitir la sublimación del CO2. Pasado este periodo, se tomaron las porciones analíticas, evitando cualquier parte con signos de descongelación.
Extracción
Todas las porciones analíticas fueron extraídas utilizando un método de extracción estandarizado en estudios previos (10-12). La extracción se realizó con acetato de etilo durante dos minutos en presencia de 0,17 g de bicarbonato de sodio y 1 g de sulfato de sodio anhídro, por cada gramo de matriz. El acetato de etilo adicionado por gramo de matriz fue de 2 mL y la velocidad de extracción fue de 11000 rpm.
Medición de la actividad y cálculo de las constantes de muestreo
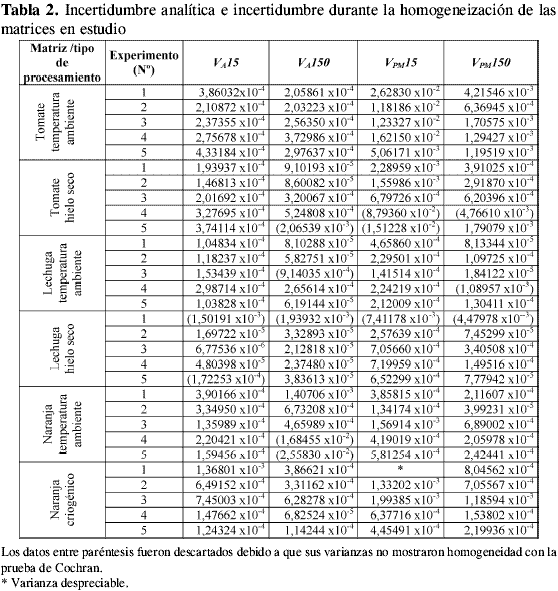
Para determinar la incertidumbre combinada del procesamiento de la muestra se efectuaron 5 experimentos por cada uno de los procesamientos realizados sobre las matrices. En cada experimento se tomaron 5 réplicas para cada tamaño de porción analítica (15 y 150 g). Por cada réplica de las porciones analíticas se obtuvieron 3 réplicas de 500 µL de sus extractos crudos, las cuales fueron recolectadas sobre 10 mL de cocktail de centelleo. A estos extractos se les determinó su actividad en el contador de centelleo líquido. De esta forma, para cada experimento y cada una de las porciones analíticas se obtuvo una matriz de datos como se muestra en la Tabla 1, donde los resultados de las mediciones se expresaron como recuperados (5).
Antes de determinar la incertidumbre combinada del procesamiento de la muestra (incertidumbre del procesamiento más la extracción) o CV’PM, fue necesario evaluar si no existía diferencia significativa entre las varianzas de las porciones analíticas de mayor y menor tamaño con base en la ecuación 2, en cuyo caso la muestra se considera homogénea. Esto se realizó mediante una prueba F a dos colas y un nivel de confianza del 90% (5).
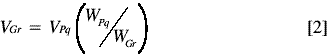
En la ecuación anterior, V hace referencia a la varianza, W al peso de la porción analítica, el subíndice Pq a la porción analítica de menor tamaño y el subíndice Gr a la porción analítica de mayor tamaño.
Si la muestra se encuentra estadísticamente homogénea, se procede a calcular la varianza del procesamiento de la muestra más la extracción (VPM) a partir de la Tabla 1, y la diferencia que se establece en la ecuación 3 (5).

donde la varianza total (VT) se calculó tomando todos los datos de la Tabla 1 como un grupo de datos con recuperado promedio 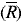 y [(h*n)-1] grados de libertad. La varianza del análisis (VA) se determinó como el promedio de las varianzas de cada porción analítica, donde VA posee [h*(n-1)] grados de libertad. Sin embargo, antes de calcular VPM se comprobó si VT era significativamente mayor que VA, aplicando una prueba F a una cola y a un nivel de confianza del 95%. Una vez se obtuvieron los valores de VPM para cada experimento, éstos fueron agrupados por matriz, tamaño de porción analítica y tipo de homogeneización, y se evaluaron mediante una prueba de Cochran. Se promediaron los valores, por grupo, para determinar una varianza promedio
y [(h*n)-1] grados de libertad. La varianza del análisis (VA) se determinó como el promedio de las varianzas de cada porción analítica, donde VA posee [h*(n-1)] grados de libertad. Sin embargo, antes de calcular VPM se comprobó si VT era significativamente mayor que VA, aplicando una prueba F a una cola y a un nivel de confianza del 95%. Una vez se obtuvieron los valores de VPM para cada experimento, éstos fueron agrupados por matriz, tamaño de porción analítica y tipo de homogeneización, y se evaluaron mediante una prueba de Cochran. Se promediaron los valores, por grupo, para determinar una varianza promedio 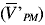 . Por medio de la ecuación 4 se calculó el CVPM representativo para cada tipo de homogeneización, matriz y tamaño de porción analítica, también denominado CVtip. A partir del CVtip obtenido para la porción analítica de 150 g y la ecuación 1, se calculó la constante de muestreo típica (Ktip) para cada tipo de homogeneización y matriz (5).
. Por medio de la ecuación 4 se calculó el CVPM representativo para cada tipo de homogeneización, matriz y tamaño de porción analítica, también denominado CVtip. A partir del CVtip obtenido para la porción analítica de 150 g y la ecuación 1, se calculó la constante de muestreo típica (Ktip) para cada tipo de homogeneización y matriz (5).
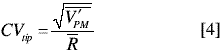
Estas constantes también contienen su propia incertidumbre, motivo por el cual deben expresarse como un intervalo. Con base en las varianzas (VPM) evaluadas mediante la prueba de Cochran, y una distribución Chi-cuadrada, se pudo establecer el intervalo al 95% de confianza, donde el valor real de VPM tiene un 95% de probabilidad de estar incluido (6).
RESULTADOS Y DISCUSIÓN
En todos los ensayos de repetibilidad se observó que VT no fue significativamente diferente de VA, por tanto la incertidumbre en la extracción fue despreciable. De esta manera se tiene que la incertidumbre combinada del procesamiento de la muestra (CVPM) fue equivalente a la incertidumbre durante el procesamiento de la muestra (CVPM).
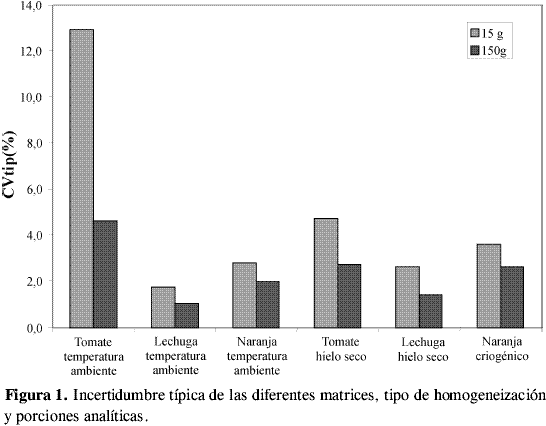
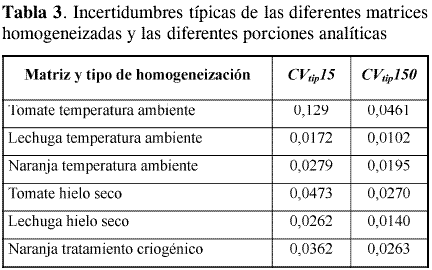
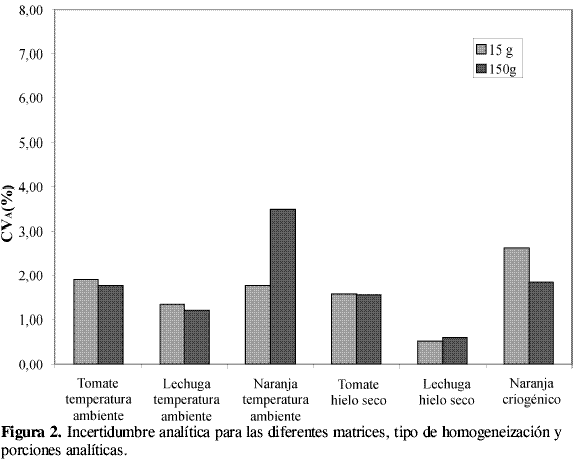
Las VPM obtenidas en cada experimento, agrupadas por matriz, tamaño de porción analítica y tipo de homogeneización, se muestran en la Tabla 2. En esta tabla se observa que algunos valores no fueron considerados, ello se debe a que en el experimento, VT no fue significativamente mayor que VA , y, por tanto, no se pudo calcular VPM. También se observan datos que no presentaron homogeneidad de varianzas con la prueba de Cochran. A partir de las varianzas promedio de cada porción analítica se obtuvo un CVtip representativo de cada porción analítica, matriz y tipo de homogeneización, como se muestra en la Tabla 3 y en la Figura 1. En esta figura se aprecia que tanto en el tratamiento a temperatura ambiente como con hielo seco, la lechuga y la naranja tienen incertidumbres de homogeneización menores a las obtenidas para tomate, sin importar el tamaño de la porción analítica. Esto puede atribuirse a la diferencia en el grado de maduración del producto durante la realización de los experimentos, lo cual afecta su homogeneización, debido a la naturaleza elástica de la cáscara de tomate. En la Figura 1 también se aprecia que las incertidumbres son menores para las porciones de 150 g en todas las matrices y en todos los procesamientos. Esto demuestra que la constante de muestreo debe ser calculada con los datos de la porción analítica de mayor tamaño para obtener un valor más preciso.
El tratamiento estadístico aplicado a las varianzas VPM también se aplicó a las varianzas VA obtenidas por experimento y reportadas en la Tabla 2, con el fin de calcular una varianza analítica promedio 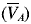 , y con este valor hallar un CVA representativo para cada tipo de homogeneización, matriz y tamaño de porción analítica. A partir de estos datos se obtiene la Figura 2, en la cual se aprecia que en la mayoría de los casos se obtuvo un CVA aproximado del 2%, valor que incluye la variabilidad producida en la manipulación de las porciones analíticas y la variabilidad del contador de centelleo líquido. Sin embargo, se encontró un valor alto para la porción analítica de 150 g en naranja a temperatura ambiente, lo cual puede atribuirse a las diferencias entre los extractos de las porciones analíticas de 15 y 150 g. Estas diferencias pueden ser causadas por la dificultad que existe al efectuar la extracción de la naranja a temperatura ambiente en el ultraturrax, ya que ésta formaba una pasta gelatinosa que tendía a adherirse a las paredes del recipiente de extracción y el equipo de extracción no fue lo suficientemente grande para lograr una extracción uniforme de la pasta gelatinosa.
, y con este valor hallar un CVA representativo para cada tipo de homogeneización, matriz y tamaño de porción analítica. A partir de estos datos se obtiene la Figura 2, en la cual se aprecia que en la mayoría de los casos se obtuvo un CVA aproximado del 2%, valor que incluye la variabilidad producida en la manipulación de las porciones analíticas y la variabilidad del contador de centelleo líquido. Sin embargo, se encontró un valor alto para la porción analítica de 150 g en naranja a temperatura ambiente, lo cual puede atribuirse a las diferencias entre los extractos de las porciones analíticas de 15 y 150 g. Estas diferencias pueden ser causadas por la dificultad que existe al efectuar la extracción de la naranja a temperatura ambiente en el ultraturrax, ya que ésta formaba una pasta gelatinosa que tendía a adherirse a las paredes del recipiente de extracción y el equipo de extracción no fue lo suficientemente grande para lograr una extracción uniforme de la pasta gelatinosa.
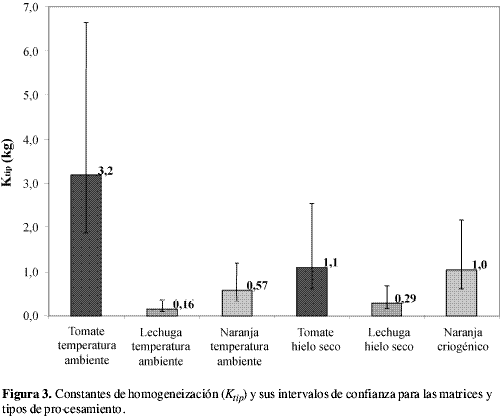
Las constantes de muestreo típicas y sus intervalos estadísticos se observan en la Figura 3. Con base en estos intervalos estadísticos, se aprecia que a temperatura ambiente, Ktip para tomate es significativamente diferente del Ktip para naranja y lechuga. Esto nos demuestra que la incertidumbre del procesamiento de la muestra depende de la matriz que se va a homogeneizar. También nos expresa la necesidad de efectuar la validación de la etapa de homogeneización, todo ello con el fin de establecer las incertidumbres adecuadas para las correspondientes matrices. En la Figura 3 también se observa que las constantes de homogeneización con hielo seco no son significativamente diferentes entre sí, lo cual indica que el hielo seco logra una homogeneización reproducible, disminuyendo las diferencias que pueden surgir al variar la matriz. Se esperaba que la homogeneización con hielo seco fuese un mejor método de procesamiento que la efectuada a temperatura ambiente; sin embargo, al comparar estos dos tipos de procesamiento en cada matriz, se aprecia que no existe diferencia significativa entre ellos. En la naranja este comportamiento se debe a dos razones: una corresponde a la poca segregación que se da en la fruta cuando es homogeneizada a temperatura ambiente, lo cual evita que existan diferencias significativas entre la distribución de los analitos homogeneizados a temperatura ambiente y con hielo seco; la otra razón se debe al tamaño de partícula muy similar (< 2 mm) que se alcanza al final de ambos procesamientos. En el caso de la lechuga, tal comportamiento se atribuye a la segregación que se presentó durante el tiempo de descongelamiento en la homogeneización con hielo seco, ya que la segregación produjo una matriz no homogénea. El resultado fue que las porciones de 400 g, tomadas para efectuar el segundo paso de homogeneización, tuvieron actividades promedio diferentes. Debido a esto se obtuvieron porciones analíticas con mayor variabilidad entre sí, de la actividad leída, lo cual condujo a intervalos de Ktip mayores en el tratamiento con hielo seco. Al incrementarse dichos intervalos, éstos se solaparon con los rangos establecidos para el Ktip de la homogeneización a temperatura ambiente. En el caso del tomate la equivalencia entre los dos tipos de homogeneización puede atribuirse a la gran dispersión de los datos que existe tanto en la doble homogeneización a temperatura ambiente como en el procesamiento con hielo seco. Esta dispersión puede atribuirse a las diferencias en el grado de maduración del producto durante los experimentos, debido a que la naturaleza elástica de la cáscara del tomate varía.
CONCLUSIONES
De los ensayos de repetibilidad se determinó que la incertidumbre durante la extracción es despreciable, con lo cual se tiene que durante el procesamiento de la muestra dicha incertidumbre se calculó directamente del diseño establecido.
El procesamiento con hielo seco optimizó las condiciones de homogeneización, evitando los efectos debidos al cambio de matriz; sin embargo, la homogeneización a temperatura ambiente fue un procesamiento menos complicado, más económico y con la misma eficiencia que el procesamiento con hielo seco para homogeneizar una determinada matriz.
La diferencia en las constantes de muestreo obtenidas para la homogeneización a temperatura ambiente demostraron la importancia de evaluar el procesamiento de la muestra al evidenciar los efectos que se presentan al cambiar de matriz, lo cual puede dar origen a dispersiones significativas en los resultados finales de los residuos de plaguicidas.
AGRADECIMIENTOS
Los autores agradecen al Organismo Internacional de Energía Atómica y a la Universidad Nacional de Colombia por su colaboración y financiación durante la ejecución de este trabajo, a la doctora M. El-Bidaoui por compartir sus conocimientos y experiencia en el área de estudio, y a todos los integrantes del Laboratorio de Análisis de Residuos de Plaguicidas de la Universidad Nacional de Colombia por su colaboración.
BIBLIOGRAFÍA
1. Ellison, S. L .R.; Roesslein, M.; Williams, A. EURACHEM/CITAC Guide CG4: Quantifying uncertainty in analytical measurement. 2000. [ Links ]
2. Hill, A.; Harris, C.; Warburton, G. Effects of sample processing on pesticides residues in fruits and vegetables. En: Principles and Practice of Method Validation. Cambridge Royal Society of Chemistry: 2000; pp. 41-48. [ Links ]
3. Ingamells, C. O. New approaches to geochemical analysis and sampling. Talanta. 1974; 21:141-155. [ Links ]
4. Wallace, D.; Kratochvil, B. Visman equations in the design of sampling plans for chemical analysis of segregated bulk materials. Anal. Chem. 1987; 59:226-232. [ Links ]
5. Maestroni, B.; Ghods, A.; El-Bidaoui, M.; Rathor, N.; Jarju, O.; Tom, T.; Ambrus, A. Testing the efficiency and uncertainty of sample processing using 14C-labeled chlorpyrifos: Part I. Descrption of methodology. En: Principles and Practice of Method Validation. Cambridge Royal Society of Chemistry: 2000; pp. 49-58. [ Links ]
6. Maestroni, B.; Ghods, A.; El-Bidaoui, M.; Rathor, N.; Jarju, O.; Tom, T. and Ambrus, A. Testing the efficiency and uncertainty of sample processing using 14C-labeled chlorpyrifos: Part II. En: Principles and Practice of Method Validation. Cambridge. Royal Society of Chemistry: 2000; pp. 59-74. [ Links ]
7. El-Bidaoui, M.; Jarju, O.; Maestroni, B.; Phakaeiw, Y.; Ambrus, A. Testing the effect of sample processing and storage on the stability of residues. En: Principles and Practice of Method Validation. Cambridge. Royal Society of Chemistry: 2000; pp. 75-88. [ Links ]
8. FAO-OMS. Codex Alimentarius. 1996. Vol 2B. [ Links ]
9. International Atomic Energy Agency. Laboratory Training Manual on the use of nuclear and associated techniques in pesticides research. Vienna: IAEA 1991; pp. 23, 63. [ Links ]
10. Guerrero, J. A. Estudio de residuos de plaguicidas en frutas y hortalizas en áreas específicas de Colombia. Revista Agronomía Colombiana. 2003; 21:198-209. [ Links ]
11. Montaño, M.; Guerrero, J. A. Validación de una metodología multiresiduo para la determinación de residuos de plaguicidas en fresa (Fragraria spp.) por cromatografía de gases. Rev. Colomb. Quim. 2001; 30:37-46. [ Links ]
12. Moreno, M. L.; Guerrero, J. A. Validación de una metodología multiresiduo para la determinación de residuos de plaguicidas en repollo (Brassica Oleracea var. Capitata) por cromatografía de gases. Rev. Colomb. Quim. 2002; 31:19-32. [ Links ]














