Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804On-line version ISSN 2357-3791
Rev.Colomb.Quim. vol.35 no.2 Bogotá Jul./Dec. 2006
Carmen M. Romero1, Luis H. Blanco1, María E. González2,María T. Dávila 2
1 Departamento de Química, Universidad Nacional de Colombia, sede Bogotá, Bogotá, Colombia. cmromeroi@unal.edu.co
2 Departamento de Ingeniería Química, Universidad Nacional de Colombia, sede Manizales, Manizales, Colombia.
RESUMEN
Se describe un equipo isopiéstico para la determinación de los coeficientes osmóticos de soluciones acuosas, usando cloruro de sodio como sustancia de referencia a temperaturas de 288,15 K, 293,15 K y 298,15 K. Los tiempos de equilibrio estuvieron entre 12 y 20 días para concentraciones de 0,1 a 0,6 m. Los coeficientes osmóticos de las soluciones acuosas de KCl obtenidos a partir del método isopiéstico y los coeficientes de actividad calculados fueron comparados con datos de literatura.
Palabras clave: Método Isopiéstico, Coeficiente de Actividad, Soluciones Acuosas, Coeficientes Osmóticos.
ABSTRACT
An isopiestic apparatus for determination of osmotic coefficients of aqueous solutions using NaCl reference solutions is described. Measurements were made at 288,15 K, 293,15 K and 298,15 K. Equilibrium times between 12 and 20 days were required for molalities between 0,1 and 0,6 m. Osmotic coefficients of aqueous KCl solutions obtained by the isopiestic method and calculated activity coefficients are compared with literature data.
Key words: Isopiestic method, activity coefficients, aqueous solutions, osmotic coefficients.
INTRODUCCIÓN
Las propiedades de equilibrio de las soluciones pueden ser estudiadas a partir de la determinación de la actividad del solvente por métodos como depresión del punto de congelación, elevación del punto de ebullición, método isopiéstico y determinación de solubilidades y presiones de vapor; o por medidas directas de la actividad del soluto como el método electroquímico.
La determinación de actividades por el método isopiéstico es uno de los métodos más sencillos para obtener actividades de solutos no volátiles. El término isopiéstico significa igual compresibilidad o igual presión y el método se basa en la comparación de presiones de vapor. Si se colocan en un espacio vacío dos o más soluciones de solutos diferentes en el mismo solvente, la solución de mayor presión de vapor, esto es, la de actividad de solvente más elevada, destilará sobre la de menor presión de vapor hasta que se haya alcanzado el equilibrio y todas tengan la misma presión de vapor y fugacidad. En la práctica, una de las soluciones contiene una sustancia de referencia, a la cual se le han determinado previamente los coeficientes de actividad en función de la concentración por un método apropiado, siendo posible calcular los coeficientes de actividad en solución de otros solutos. Este método proporciona datos directos de actividad del solvente e indirectamente se calculan los valores de coeficientes de actividad del soluto (1).
Son varios los métodos experimentales que han sido utilizados para medir la actividad del solvente. Bousfield (2) en 1917, fue el primero en describir el método isopiéstico que usaba una serie de cilindros de vidrio que contenían las sales secas sobre una lámina de estaño, posteriormente añadía agua y desgasificaba en un desecador a 291 K. Midió la relación isopiéstica a intervalos de 2 a 4 días y concluyó que el equilibrio se había alcanzado. Sin embargo, D. A. Sinclair (3), encontró que al usar cilindros de vidrio con muy baja conductividad térmica y en ausencia de un medio que facilite la homogenización de la temperatura, el equilibrio se alcanzaba muy lentamente y con un margen de error muy elevado, de aproximadamente el 10% debido a que al instalar el desecador con las celdas dentro del termostato y hacer vacío era muy posible que se generaran pequeños gradientes de temperatura que deberían ser eliminados para obtener unas condiciones de equilibrio.
Mason (4) introdujo el uso de cámaras de equilibrio metálicas plata-cobre logrando mejorar la transferencia de calor entre el portamuestra y la solución, y disminuyendo los tiempos de equilibrio en un 50%. Sin embargo, algunas soluciones de electrolitos producían corrosión de los metales utilizados.
Scatchard y cols. (5) realizaron varias modificaciones a la técnica isopiéstica; usaron portamuestras de platino, los cuales son más resistentes químicamente pero de más baja conductividad térmica. Adicionalmente, inclinaron la cámara a un ángulo de 45° en el baño a temperatura constante y la sometieron a rotación de tal forma que las soluciones se mantuvieran bien mezcladas. Puesto que la evacuación del aire en el recipiente isopiéstico puede producir la formación de burbujas de aire o producir salpicaduras, Scatchard y su grupo utilizaron un recipiente auxiliar, en el cual se hacía vacío primero; posteriormente se abría lentamente la llave con la línea al desecador para remover el aire.
El equipo utilizado por Gordon (6) en experimentos isopiésticos con soluciones de NaCl y KCl consistía en una celda de vidrio dentro de un termo, el cual estaba dentro de un desecador. Algunos de sus experimentos fueron muy exitosos, otros presentaron un error de 0,6%.
Uno de los primeros trabajos reportados en un amplio rango de temperatura es el de Robinson (7). Los datos de coeficientes de actividad reportados corresponden a los valores obtenidos por ajuste por mínimos cuadrados para valores predeterminados de molalidad. Otro trabajo en el que se ha utilizado el método isopiéstico a temperaturas distintas de 298,15 K, es el realizado en el Oak Ridge Nacional Laboratory (ORNL) (8) determinando coeficientes osmóticos de soluciones de NaCl entre 373 y 438 K.
En la literatura existe información sobre distintos modelos de celda isopiéstica construidos en vidrio como los propuestos por Thiessen, y Wilson (9), Dong- Qiang Lin y cols. (10) y L. Ochs y cols. (11). Desde el primer modelo de una celda de tres brazos en vidrio dada por Thielsen y Wilson (9) y posteriormente ampliada a un modelo de 9 celdas utilizadas para determinar actividades de solvente en soluciones de polímeros a 25 °C, se llegó a una celda de 12 terminales con agitación permanente de las soluciones debido a la rotación de celda y a la presencia de perlas de vidrio dentro de las cápsulas, descrita por Amado y Blanco (12). En todos estos trabajos se pretendió solucionar el problema de los largos tiempos necesarios para alcanzar el equilibrio isopiéstico entre las soluciones, sin que la precisión disminuyera.
El método isopiéstico es esencialmente gravimétrico, en donde a partir de concentraciones de equilibrio y el conocimiento de los coeficientes osmóticos de las soluciones de referencia se determinan los coeficientes osmóticos de las soluciones problema. El conocimiento del coeficiente osmótico de la solución lleva a la determinación de los coeficientes de actividad.
El método isopiéstico se basa en obtener el equilibrio termodinámico entre las soluciones, una de referencia y la solución problema (13):
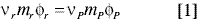
donde:
mr,mP: molalidad solución de referencia y solución problema, respectivamente.
Ør, ØP: coeficiente osmótico solución de referencia y solución problema, respectivamente.
vr vP: Número estequiométrico de iones del soluto de referencia y soluto problema, en solución, respectivamente.
El coeficiente de actividad del soluto se obtiene por la siguiente ecuación (14):
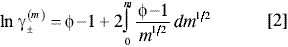
El coeficiente de actividad del soluto obtenido por este método se basa en el sistema asimétrico de referencia (el estado estándar del soluto a dilución infinita) y sobre la base de molalidad.
En este trabajo se describe un equipo isopiéstico que presenta algunas modificaciones respecto al descrito por Amado y Blanco y se determinan los coeficientes osmóticos de soluciones acuosas de KCl a temperaturas de 288,15 K, 293,15 K y 298,15 K usando NaCl como sustancia de referencia.
PARTE EXPERIMENTAL
Reactivos y preparación de soluciones
Cloruro de sodio (NaCl) y cloruro de potasio (KCl) grado analítico Carlo Erba, los cuales se secaron a 105 °C por 72 horas y luego se almacenaron en atmósfera seca.
El agua utilizada fue doblemente destilada y tratada de acuerdo con las recomendaciones de la literatura (15), para obtener un agua libre de materia orgánica, con conductividad inferior a 2µS/cm. Además se usó recién destilada para eliminar los gases disueltos.
Las soluciones se prepararon por pesada, utilizando una balanza analítica con una precisión de ± 1x10-4 g. El rango de concentración de las soluciones de todos los solutos estuvo comprendido entre 0,1 y 0,6 m, a cada una de las temperaturas seleccionadas.
Equipo isopiéstico
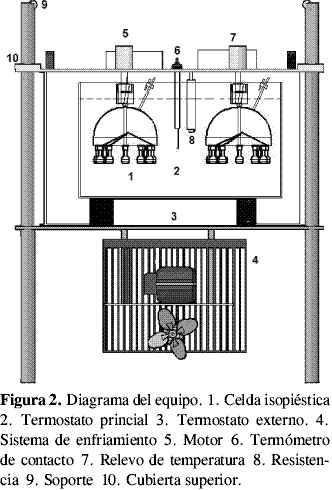
El equipo isopiéstico consta de la celda isopiéstica y el sistema de control de temperatura que se muestran en la Figura 1 y Figura 2.
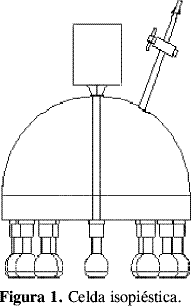
La celda isopiéstica múltiple se construyó a partir de un balón de 4000 ml, el cual se cortó en su base para colocar un fondo cóncavo y 14 terminales tipo macho para ubicar los balones portamuestra (25 ml) uniformemente distribuidos. Las uniones de todas las terminales se hicieron en vidrio esmerilado al igual que los cuellos de los balones.
Las principales modificaciones al equipo propuesto por Amado y Blanco son las siguientes. El eje de la celda se selló y se reforzó en vidrio para que funcionara como soporte y unión al eje del motor para mejorar el sistema de agitación. En la parte lateral superior de la celda se colocó una llave de paso para hacer vacío, de largo suficiente para que quedara ubicada por encima del nivel del agua del termostato, de forma que se pudiera realizar vacío tanto a la llave como a la cámara de vapor y que todo el sistema quedara termostatado. La celda isopiéstica se muestra en la Figura (1):
Dentro del termostato principal se ubicaron dos celdas isopiésticas y el sistema de control y medición de temperatura. Cada celda se une a través de su eje con un motor que gira entre 30 y 35 r.p.m. que permite una homogeneidad de la temperatura del agua dentro del termostato principal. Para que las soluciones permanecieran constantemente agitadas durante el tiempo total de equilibrio se utilizaron perlas de vidrio dentro de los balones, las cuales agitaban la solución debido al movimiento de rotación de la celda.
El control de temperatura se realizó mediante el sistema termocontacto-relevo, utilizando un termómetro de contacto marca GDR/Bestell de escala 10 a 30 °C, y una resistencia de 100 Ω permitiendo obtener un control de temperatura de ± 0,01 °C. Todas las temperaturas se midieron con termómetros calibrados contra un termómetro certificado por la NITS y sus variaciones se midieron con termistor usando un multímetro digital Hewlett Packard 34401.
El termostato principal se encuentra soportado dentro del termostato externo por medio de 5 bases cilíndricas. Dentro del termostato externo se encuentra el sistema de enfriamiento, el cual utiliza una unidad de refrigeración para mantener la temperatura de trabajo por debajo de la temperatura ambiente.
El sistema celda-termostatos está soportado sobre una estructura metálica, con una tapa en fórmica que aísla los termostatos del ambiente y sirve de desplazamiento vertical para la introducción o remoción de las celdas isopiésticas del baño termostatado. Este sistema funciona mediante un mecanismo de contrapesos que permite que las celdas permanezcan fijas en la parte superior.
Los coeficientes osmóticos de las soluciones acuosas de KCl y NaCl se determinaron a temperaturas de 288,15 K, 293,15 K y 298,15 K. A cada temperatura y concentración se realizó el proceso utilizando NaCl como solución patrón y KCl como solución problema. En cada caso se colocaron en los balones muestras de aproximadamente 2,0 g cuyo peso se midió con una precisión de ± 1x10-4 g. Una vez ensamblados los balones en la celda se realiza vacío, se introducen las celdas en el baño termostatado y se ponen a girar entre 30 y 35 revoluciones por minuto hasta alcanzar el tiempo de equilibrio previamente determinado para la temperatura de trabajo. Cuando se alcanza el equilibrio, los balones se colocan en un desecador durante dos horas aproximadamente antes de ser pesados a temperatura ambiente.
RESULTADOS Y DISCUSIÓN
Los tiempos de equilibrio encontrados en la determinación de los coeficientes osmóticos con el equipo descrito son menores que los reportados por otros autores (1, 16), debido a factores como estabilidad de temperatura, la remoción del aire de las soluciones, la cantidad y concentración óptima de solución, la agitación permanente de las celdas y de las soluciones. Para 298,15 K se obtuvo un tiempo de 11 días de equilibrio, para 293,15 K un tiempo de 15 días y para 288,15 K de 20 días para las soluciones de trabajo.
Las molalidades isopiésticas promedio de las soluciones de NaCl y KCl, el coeficiente osmótico del NaCl calculado a partir de la correlación de Archer-Pitzer y el coeficiente osmótico de KCl calculado a partir de las condiciones de equilibrio a cada temperatura se presentan en la Tabla 1, Tabla 2 y Tabla 3.
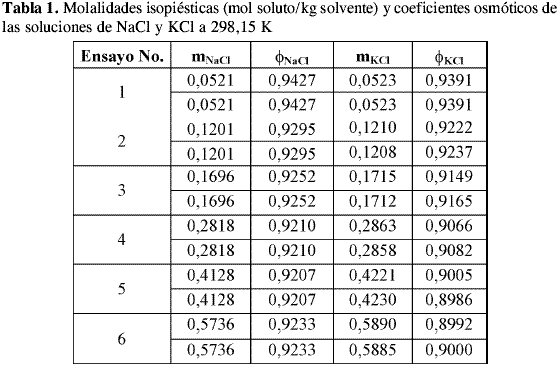
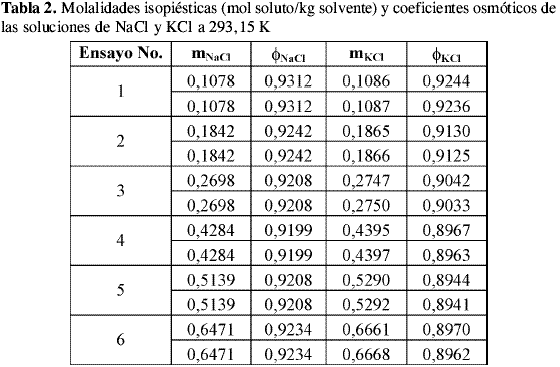
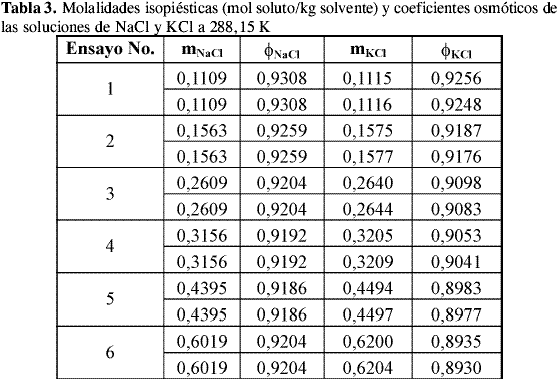
El valor de la incertidumbre en el coeficiente osmótico varía entre 0,0002 y 0,0018 a 298,15 K, entre 0,0001 y 0,0009 a 293,15 K y entre 0,0002 y 0,0008 a 288,15 K lo que sugiere que la incertidumbre debida a la pesada de las soluciones de referencia y problema afecta el valor del coeficiente osmótico de la solución problema en la cuarta cifra decimal y en las concentraciones más bajas en la tercera cifra decimal. Los datos de literatura y los datos obtenidos en la calibración de coeficientes osmóticos son reportados a valores de concentración predeterminados, para ello se ajustaron los datos encontrados experimentalmente a ecuaciones polinomiales y se realizaron las respectivas interpolaciones.
El comportamiento de los coeficientes osmóticos de las soluciones de KCl encontrados es similar a todas las temperaturas. En las Tablas 1-3 se observa que el valor del coeficiente osmótico disminuye al aumentar la concentración.
Los coeficientes osmóticos y de actividad del KCl obtenidos de la calibración se compararon contra datos de literatura a las temperaturas estudiadas. A 298,15 K se encontraron datos de literatura de Amado , Hamer y Wu , Robinson y Stokes , Scatchard, Hamer y Word y Archer por el método isopiéstico y de Harned y Cook usando un método electroquímico. La Tabla 4, Tabla 5, Tabla 6 y Tabla 7 muestran los coeficientes osmóticos y de actividad a las temperaturas de trabajo:
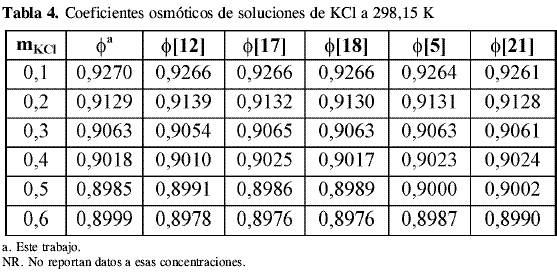
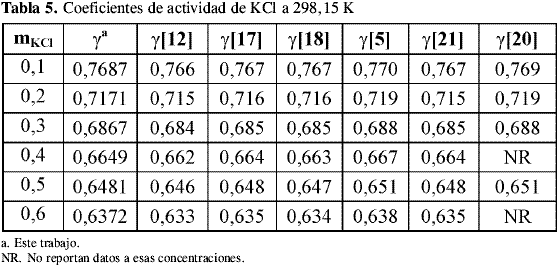
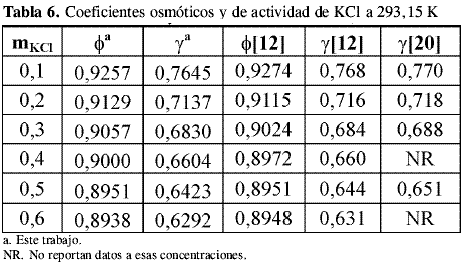
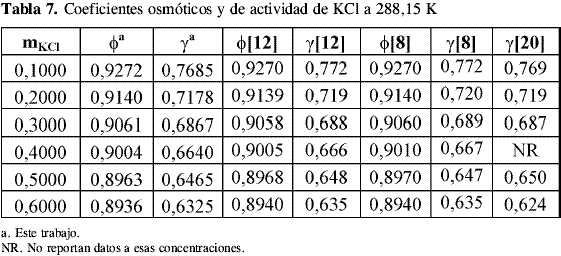
La incertidumbre en el coeficiente osmótico de las soluciones de KCl usadas como problema en este trabajo para revisar la precisión del equipo isopiéstico construido muestra que los cambios introducidos al diseño descrito por Amado y Blanco disminuyen los tiempos de equilibrio y mejoran la confiabilidad de los resultados.
Los datos de coeficientes osmóticos obtenidos para el KCl a todas las temperaturas coinciden dentro del error experimental con los datos de literatura. Los valores de coeficientes de actividad coinciden notablemente con los datos reportados por otros autores comprobando el equilibrio alcanzado en las soluciones y la precisión del método utilizado a diferentes temperaturas.
AGRADECIMIENTOS
Los autores agradecen el apoyo de las sedes de Bogotá y Manizales de la Universidad Nacional de Colombia.
BIBLIOGRAFIA
1. Pitzer, K. S. Activity coefficients in electrolyte solutions. CRC Press: Boca Raton 1991. [ Links ]
2. Bousfield, W. R. Isopiestic solutions. Trans. Faraday Soc. 1918; 13:401-410. [ Links ]
3. Sinclair, D. A. A simple method for accurate determinations of vapor pressures of solutions. J. Phys. Chem. 1933; 37(4) 495-504. [ Links ]
4. Mason, C. M. The activity and osmotic coefficients of trivalent metal chlorides in aqueous solution from vapor pressure measurements. J. Am. Chem. Soc. 1938; 60(7) 1638-1647. [ Links ]
5. Scatchard, G., Hamer, W.; Wood, S. E. Isotonic solutions. I. The chemical potential of water in aqueous solutions of sodium chloride, potassium chloride, sulfuric acid, sucrose, urea and glycerol at 25°. J. Am. Chem. Soc. 1938; 60 (12):3061- 3070. [ Links ]
6. Gordon, A. R. Isopiestic measurements in dilute solutions; the system potassium chloride-sodium chloride at 25° at concentrations from 0.03 to 0.10 molal. J. Am. Chem. Soc. 1943; 65(2):221-224. [ Links ]
7. Robinson, R. A. The heat content and heat capacity of sodium chloride solutions. Trans. Faraday Soc. 1939; 35:1222-1228. [ Links ]
8. Carthy, G.; Feakins, D.; ODuinn, C.; Waghorne, W. E. Enthalpies of transfer of formamide, N-methylformamide, N,N-dimethylformamide and urea from water to some aqueous alcohol solvent systems at 298 K. Journal of the Chemical Society, Faraday Transactions. 1991; 87(15): 2447-2452. [ Links ]
9. Thiessen, D. B.; Wilson, A. J. An isopiestic method for measurement of electrolyte activity coefficients. AIChE Journal 1987; 33(11): 1926-1929. [ Links ]
10. Lin, D.-Q.; Mei, L.-H.; Zhu, Z.-Q.; Han, Z.-X. An improved isopiestic method for measurement of water activities in aqueous polymer and salt solutions. Fluid Phase Equilibria 1996; 118(2):241-248. [ Links ]
11. Ochs, L. R.; Kabiri-Badr, M.; Cabezas, H. An improved isopiestic method to determine activity in multicomponent mixtures. AIChE Journal 1990; 36(12):1908-1912. [ Links ]
12. Amado, E. Blanco, L. H. Osmotic and activity coefficients of aqueous solutions of KCl at temperatures of 283.15, 288.15, 293.15 and 298.15 K. A new isopiestic apparatus. Fluid Phase Equilibria 2004; 226:261- 265. [ Links ]
13. Pitzer, K. S. Electrolytes. From dilute solutions to fused salts. J. Am. Chem. Soc 1980; 102(9):2902-2906. [ Links ]
14. Prausnitz, J. M.; Lichtenthaler, R. N.; Gomes, E. Termodinámica molecular de los equilibrios de fases, Madrid, prentice Hall 2000. [ Links ]
15. Weissberger, A.; Rossiter, B. Physical methods of chemistry New York. Wiley-Interscience 1957. [ Links ]
16. Albright, J. G., Rizzo, P.; Rard, J. A. Isopiestic determination of the osmotic and activity coefficients of Cu(NO3)(aq) at the temperature 298.15K. J. Chem. Thermodynamics 1998; 30(3):327-352. [ Links ]
17. Hamer, W. J.; Wu, J. C. Osmotic coefficients and mean activity coefficients of Univalent Electrolytes in Water at 25 C. J. Phys. Chem. Ref. Data 1972; 1(4):1047-1099. [ Links ]
18. Robinson, R. A.; Stokes, R. H. Electrolyte solutions London: Butterworths 1959. [ Links ]
19. Archer, D. G. Second virial coefficients of aqueous alcohols at elevated temperatures: a calorimetric study. J. Phys. Chem 1989; 93(13):5272- 5279. [ Links ]
20. Harned, H. S. Cook, M. A. The thermodynamics of aqueous potassium chloride solutions from electromotive force measurements. J. Am. Chem. Soc. 1937; 59(7):1290-1292. [ Links ]
21. Archer, D. G. Thermodynamic properties of the NaCl + H2O system: 2. Thermodynamic properties of NaCl(aq), NaCl-2H2O(cr), and phase equilibria. J. Phys. Chem. Ref. Data 1992; 21:793-829. [ Links ]














