Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804On-line version ISSN 2357-3791
Rev.Colomb.Quim. vol.35 no.2 Bogotá Jul./Dec. 2006
Luisa Fernanda Navarrete1, Liliana Giraldo1, Juan Carlos Moreno2
1 Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia, Bogotá, Colombia. lgiraldogu@unal.edu.co
2 Departamento de Química, Facultad de Ciencias, Universidad de los Andes. Bogotá, Colombia.
RESUMEN
Se estudian las interacciones de cinco muestras de carbón activado obtenidas a partir de diferentes materiales lignocelulósicos, con diferente grado de activación alrededor de 20%, con soluciones acuosas de fenol y 4-nitro fenol mediante la determinación de las entalpías de inmersión.
Se establece que los carbones activados obtenidos son de carácter básico y presentan valores para el punto de carga cero (PZC), que varían entre 7,4 y 9,7, y contenidos de basicidad total mayores en todos los casos que los valores obtenidos para la acidez total.
Se determina la entalpía de inmersión de los carbones activados en soluciones de NaOH y HCl con valores mayores para la entalpía de inmersión en HCl que se encuentran entre 32,6 y 68,3 Jg-1.
Las entalpías de inmersión en solución de fenol se hallan entre 7,6 y 13,9 Jg-1, y para el caso del 4-nitro fenol se encuentran entre 12,7 y 20,5 Jg-1; con valores mayores para todas las muestras para la inmersión en el segundo compuesto.
Palabras clave: adsorción de fenoles, acidez y basicidad, calorimetría de inmersión, pHPZC, entalpía de inmersión.
ABSTRACT
The interactions between five samples of activated carbon with different activation grades (~20%, obtained from different lignocellulose’s materials) and aqueous solutions of phenol and 4-nitrofenol were studied by determining the values of the immersion enthalpy. From this study, it is established that the activated carbons exhibit a basic character and show values
for the point of zero charge (PZC) between 7.4 and 9.7; also, the total basicity content is greater in all cases than the value obtained for the total acidity.
The immersion enthalpy values of the activated carbons in NaOH and HCl solutions were determined, yielding larger values in the case of HCl which are between 32.6 -68.3 Jg-1.
The inmersion enthalpy values in phenol solution range between 7.6 y 13.9 Jg-1 and for 4-nitro fenol between 12.7 y 20.5 Jg-1; all the samples displayed greater values after immersion in the second compound.
Key words: Adsorption of phenols, acidity and basicity, immersion calorimetry, pHPZC, immersion enthalpy
INTRODUCCIÓN
Los procesos de adsorción en fase líquida se utilizan con buena eficiencia en la purificación de aguas residuales de industrias que pueden contener colorantes, fragancias y en general contaminantes orgánicos o inorgánicos (1). El carbón activado es un adsorbente que presenta un elevado y variado grado de porosidad, una considerable superficie interna y un cierto contenido de grupos químicos superficiales; estas características son las responsables de sus propiedades adsorbentes, utilizadas en aplicaciones tanto en fase gaseosa como en fase líquida (2).
Una de las aplicaciones de los carbones activados es la de remover compuestos orgánicos de aguas, y para esta aplicación particular uno de los aspectos que tiene mayor influencia en la adsorción es la química de la superficie (3), que dependedepende del contenido de heteroátomos, principalmente grupos con oxígeno, que determinan en los carbones activados la carga de la superficie, la hidrofobicidad y la densidad electrónica de las capas grafénicas. La carga superficial depende del pH del medio y de las características de la superficie del carbón, la carga superficial negativa proviene de la disociación de los grupos superficiales de carácter ácido como los carboxílicos y fenólicos. La carga positiva no se atribuye a grupos superficiales tan específicos, y puede estar constituida por grupos de carácter básico como pironas o cromenos, o por la existencia de zonas en la superficie ricas en electrones π que se comportan como bases de Lewis (4).
La existencia de grupos químicos en la superficie de los carbones activados hace que las partículas en solución presenten una carga eléctrica que influye en los procesos de adsorción; la carga eléctrica se establece con el punto isoeléctrico (PIE), o el punto de carga cero (PZC); en el primero se cuantifica fundamentalmente la carga de la superficie más externa de las partículas, y el segundo mide la carga superficial total. Cuando el pH de la solución es menor que el PZC del sólido la carga total será positiva, mientras que si el pH de la solución es mayor que el PZC la superficie estará cargada negativamente (5).
Los estudios de adsorción sobre carbón activado de fenol presente en soluciones acuosas se han realizado desde hace tiempo (6), mostrando que dicho proceso presenta algunas complejidades y dependencias con las características de la solución, como pH, fuerza iónica, grado de dilución, entre otras, que a su vez influyen en el mecanismo de adsorción del fenol (7). La intensidad de la interacción entre la solución y el carbón activado se puede determinar por medio de la entalpía de inmersión del sólido en soluciones que contengan sustancias activas con la superficie y que permiten relacionar las propiedades fisicoquímicas del carbón activado con la capacidad de adsorción de los compuestos que están en solución (8, 9).
En este trabajo se estudian cinco muestras de carbón activado, obtenidas mediante activación física, con porcentajes de activación alrededor de 20%, a las que se les determina el punto de carga cero, el contenido total de grupos ácidos y básicos, la adsorción y entalpía de inmersión en soluciones acuosas de fenol y 4-nitro fenol.
METODOLOGÍA
Los carbones activados que se emplean en este trabajo se han obtenido por activación física de distintos materiales lignocelulósicos, en las mismas condiciones experimentales, de tal forma que las características superficiales finales de cada uno de éstos se deba a la naturaleza del material precursor (10). En la Tabla 1 se presentan la procedencia, denominación, porcentaje de activación y área superficial de los carbones activados que se estudian en este trabajo.

Determinación de los sitios ácidos y básicos
La acidez y la basicidad total de los carbones activados se determinan por el método de Boehm (11). 1,000 g de cada sólido y 50,0mLde NaOH, 0,1No HCl, 0,1 N, según el caso, se colocan en un frasco de vidrio. Los sistemas se equilibran a 25,0 °C, durante 5 días. Posteriormente se titula midiendo durante la titulación el pH de la solución con un pH meterCG840B Schott (12).
Determinación del punto de carga cero, pHPCZ. Método de titulación de masas.
Se pesan cantidades entre 10 a 600 mg de los carbones activados, se colocan en frascos y se agregan 10,0 mL NaCl, 0,1 M. El sistema se equilibra a 25,0 °C durante 48 horas, y se mide el pH de cada una de las soluciones con un pH meter CG 840B Schott (12).
Determinación de la cantidad de fenol y 4-nitro fenol adsorbido
Para determinar la cantidad que adsorbe cada muestra de fenol y de 4-nitro fenol se colocan 0,5 g de cada carbón activado en frascos de vidrio y 250 mL de las respectivas soluciones acuosas de fenol y 4-nitro fenol con una concentración de 100 mg.L-1. Las muestras se agitan mecánicamente y se mantienen a una temperatura de 25,0 °C, por un periodo de aproximadamente 72 horas que asegura el equilibrio del sistema. La concentración de equilibrio de los compuestos fenólicos en las soluciones después de la adsorción se determina, previa calibración, con un equipo espectrofotométrico uv-vis Milton Roy Co. Spectronic Genesys SN.
Determinación del calor de inmersión
En este trabajo se realizan determinaciones del calor de inmersión de los carbones activados en varias soluciones que son: solución de NaOH 0,1 M para conocer la entalpía de interacción de los grupos superficiales ácidos, solución de HCl 0,1M para conocer la entalpía de interacción de los grupos superficiales básicos y soluciones acuosas de fenol y 4-nitro fenol de 100 mg.L-1 para determinar las interacciones energéticas cuando el carbón activado está en contacto con soluciones con dichos compuestos. Para determinar los calores de inmersión se usa un microcalorímetro de conducción de calor (13) y se realiza un procedimiento descrito con anterioridad (9).
RESULTADOS Y DISCUSIÓN
Los carbones activados se han preparado mediante carbonización en atmósfera de nitrógeno y posterior activación con CO2 a 900 °C por un periodo de 2 horas, en estas condiciones se obtienen materiales con porcentajes de activación del orden de 20-30%, como es el caso de este trabajo, que corresponde a un desarrollo de área superficial moderado (14). El análisis se centra entonces en los contenidos de acidez y basicidad total de los carbones activados, que dependen en buena parte, de su contenido de heteroátomos, los cuales determinan la carga de la superficie, su hidrofobicidad, acidez total y basicidad total, tales factores intervienen en la capacidad de adsorción del carbón activado (5); por esta razón se han cuantificado el contenido de grupos superficiales, la entalpía de inmersión de los carbones activados en soluciones de ácido y base, y se ha determinado el punto de carga cero, para relacionarlos con la adsorción de fenol y 4-nitro fenol en solución acuosa. En la Tabla 2 se presentan los resultados obtenidos para las entalpías de inmersión de los carbones activados en soluciones de NaOH 0,1 M, HCl 0,1 M, fenol y 4 nitro fenol de 100 mg.L-1; en Jg-1 y el pHPZC.

Las cinco muestras de carbones activados presentan contenidos de acidez en un rango aproximado de 0,10 a 0,50 meqg-1 que permite apreciar diferencias entre éstos, que se reflejan en el calor de inmersión en solución 0,1 M de NaOH; la basicidad total varía entre 0,48 y 0,76 meqg-1 que muestra el carácter básico de los carbones activados obtenidos térmicamente en las condiciones descritas; sin embargo, las diferencias entre la acidez y la basicidad no es grande, si se compara con materiales carbonosos sobre los cuales se han realizado tratamientos de oxidación, y es un comportamiento comparable con los obtenidos en otros trabajos y también por otros autores (15, 16).
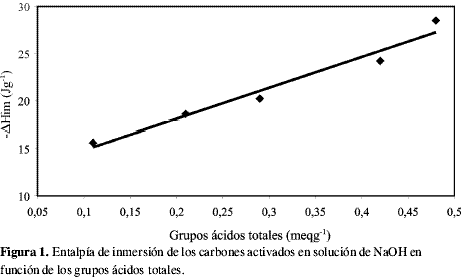
Los calores de inmersión, tanto en solución de NaOH como de HCl, son exotérmicos y mayores para la inmersión en ácido clorhídrico, confirmando nuevamente una mayor interacción con los sitios básicos de los carbones activados. En lo referente al pH en el punto de carga cero, pHPZC, para todos los carbones activados éste es básico, lo que los clasifica como carbones activados tipo H; de tal forma que si los sólidos se ponen en contacto con soluciones cuyo pH sea menor que el pHPZC, la carga de su superficie será en promedio positiva, que es lo que ocurre en este trabajo dado que las determinaciones de cantidad de adsorción y calorimetría de inmersión se hacen sin ajuste del pH. En la Figura 1 se muestra una gráfica en la que se representa la variación de la entalpía de inmersión de los carbones activados en solución 0,1 M de NaOH en función del contenido de sitios ácidos; se observa cómo a medida que aumenta la cantidad de sitios ácidos también aumenta el valor de la entalpía de inmersión en una relación lineal, en tanto que cuando se relaciona el valor del punto de carga cero con el contenido de sitios ácidos totales, éste presenta una tendencia a disminuir. En la Figura 2 se presenta la gráfica que relaciona la entalpía de inmersión de las muestras en solución 0,1Mde HCl en función del contenido de basicidad total. La relación entre la entalpía de inmersión en solución de HCl y el contenido de grupos básicos, que muestra la interacción de la solución con el sólido, indica que entre mayor contenido de sitios básicos mayor es la entalpía de inmersión; sin embargo, no ocurre igual con el valor del pHPZC, como en el caso de la acidez, dado que al relacionar el contenido de sitios básicos con el pHPZC no hay una correlación y los valores varían aunque el contenido de sitios básicos aumenta; este resultado es interesante puesto que pone de manifiesto que la basicidad total en los carbones activados es de una naturaleza más compleja y no se relaciona de forma directa con los valores básicos del pHPZC (17), igualmente se observa que el efecto entálpico de los carbones activados con solución de ácido sí se correlaciona con la basicidad total, lo que hace que dicha determinación tenga una mayor sensibilidad al cambio en el contenido básico.

Con respecto a los resultados obtenidos para la adsorción de fenol se presentan valores entre 12 a 23 mgg-1, y para la adsorción de 4 nitro fenol valores entre 21 a 42 mgg-1; se observa que la adsorción es mayor en todos los casos para el 4-nitro fenol que para el fenol y, por tanto, los calores de inmersión, de carácter exotérmico, son también mayores cuando se realiza la inmersión de los carbones activados en la solución de 100 de 4-nitro fenol; dado que las determinaciones se han realizado en condiciones experimentales similares se presenta una mayor interacción entre los carbones activados estudiados y la solución de 4-nitro fenol.
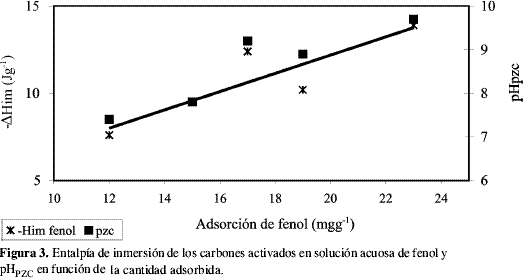
En la Figura 3 se representan el calor de inmersión de los carbones activados en solución de fenol y el valor del punto de carga cero, pHPZC, en función de la cantidad adsorbida de fenol; se observa cómo al aumentar la cantidad de fenol adsorbido, tanto la entalpía de inmersión como el pHPZC aumentan en una tendencia lineal similar, que indica que la adsorción en las condiciones experimentales del trabajo se favorece cuando los carbones activados poseen valores de pHPZC más altos, es decir, cuando las características de la superficie son básicas. Para el caso del 4-nitro fenol, la entalpía de inmersión y el valor del pHPZC poseen un comportamiento semejante, con un coeficiente de correlación lineal entre la entalpía de inmersión y la cantidad adsorbida del compuesto mayor, indicando igualmente que la adsorción es mayor en los carbones activados con carácter básico
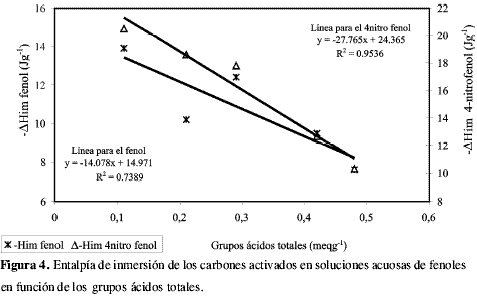
La Figura 4 muestra la relación entre la entalpía de inmersión de los carbones activados en las soluciones acuosas de fenol y 4-nitro fenol en función del contenido de grupos ácidos en la superficie, dicha gráfica muestra que al aumentar el contenido de grupos ácidos la interacción del carbón activado con la solución de los compuestos fenólicos disminuye; en este punto se debe tener en cuenta que los cinco carbones activados estarán cargados positivamente y no se ejercerá una atracción electrostática por el compuesto fenólico (5).
En contraste con el resultado de la Figura 4, en la Figura 5 se presenta la relación entre la entalpía de inmersión de los carbones activados en soluciones acuosas de los compuestos fenólicos en función del valor de pHPZC; en la gráfica se observa que amedida que aumenta el valor del pH en el punto de carga cero, la entalpía de inmersión también aumenta para los dos compuestos, lo que muestra que si la basicidad del sólido se asocia no sólo con la existencia de complejos oxigenados de carácter básico sino con la existencia de zonas que actúan como bases de Lewis, la interacción sólido solución se puede presentar debido más a fuerzas de dispersión que electrostáticas atractivas.

Finalmente, en la Figura 6 se presenta la relación entre las entalpías de inmersión de los carbones activados en las soluciones de los compuestos fenólicos y el área superficial de los carbones activados. Como uno de los factores que influyen en la adsorción es el área superficial, es de interés establecer la relación que se menciona; se observa que la entalpía de inmersión y el valor del área superficial, en los dos casos, se ajustan a una curva de segundo orden con un coeficiente de correlación mayor para las soluciones de fenol; estas curvas muestran que la entalpía de inmersión es el resultado de varias interacciones, adicionalmente la distribución de los puntos es similar para los dos compuestos, indicando que para este tipo de solutos que se disocian en solución las características químicas superficiales ejercen una mayor influencia en la adsorción.

Cuando se realizan relaciones entre la entalpía de inmersión y el porcentaje de activación se obtienen gráficas con comportamientos similares.
CONCLUSIONES
Se estudian las interacciones entre cinco muestras de carbón activado obtenidas apartir de diferentes materiales lignocelulósicos y con grado de activación moderado, y soluciones acuosas de fenol y 4-nitro fenol mediante la determinación de las entalpías de inmersión.
Se establece que los carbones activados obtenidos son de carácter básico y presentan valores para el punto de carga cero (PZC) que varían entre 7,4 y 9,7, y contenidos de basicidad total mayores en todos los casos que los valores obtenidos para la acidez total. Igualmente se determina la entalpía de inmersión de los carbones activados en soluciones de NaOH y HCl con valores mayores para la entalpía de inmersión en HCl que se encuentran entre 32,6 y 68,3 Jg-1.
Las entalpías de inmersión en solución de fenol se hallan entre 7,6 y 13,9, y para el caso del 4-nitro fenol se encuentran entre 12,7 y 20,5; con valores mayores en todas las muestras para la inmersión en el segundo compuesto.
Se observa que la cantidad de los compuestos fenólicos adsorbidos disminuye con el contenido de grupos ácidos, y que la entalpía de inmersión de los carbones activados en soluciones acuosas de los compuestos mencionados aumenta cuando se incrementa el valor del PZC.
AGRADECIMIENTOS
Los autores agradecen al Convenio Marco entre la Universidad de los Andes y la Universidad Nacional de Colombia, y al Acta de Acuerdo entre los Departamentos de Química de las dos universidades.
BIBLIOGRAFÍA
1. Tseng, R. L.; Wu, F. C.; Juang, R. S. Liquid-fase adsorption of dyes and phenols using pinewood-based activated carbons. Carbon 2003; 41:487-495. [ Links ]
2. Cartula, A.; Martín, M.; Molina, M.; Rodríguez-Reinoso, F.; Torregrosa, R. Adsorption of Substituted Phenols on Activated Carbon. J. Colloid and Interface Science 1998; 24:528-534. [ Links ]
3. McGuire, M. J. ; Suffet, I. H. Treatment of water by granular activated carbon. Washington D.C. : American Chemical Society. 1983; p. 29-33 [ Links ]
4. Moreno-Castilla, C. Adsorption of organic molecules from aqueous solutions on carbon materials. Carbon 2004; 42:83-94 [ Links ]
5. Radovic, L. R.; Moreno-Castilla, C.; Rivera-Utrilla, J. Carbon Materials as Adsorbents in Aqueous Solutions. In Chemistry and Physics of Carbon. A Serie of Advances. New York Marcel Dekker. 2000; pp. 293-297. [ Links ]
6. Mattson J.S.; Mark H.B. Jr. Activated carbon: surface chemistry and adsorption from solution. New York . Marcel Dekker. 1971; pp 64-68. [ Links ]
7. Chien-To H.; Hsisheng T. Liquid- phase adsorption of phenol onto activated carbons prepared with different activation levels. J Colloid Interface Sci. 2000; 230:171-175 [ Links ]
8. Giraldo L.; Moreno J.C. Determinación de la entalpía de inmersión de carbón activado en soluciones acuosas de fenol y su relación con la capacidad de adsorción. Rev Colomb de Quím 2003; 32(1):45-54 [ Links ]
9. Lopez-Ramon M.; Stoeckli F.; Moreno- Castilla C.; Carrasco-Marin F. On the Characterization of Acidic and Basic Surface Sites on Carbons by Various Techniques. Carbon 1999; 37:1215-1221. [ Links ]
10. Amaya B.A.; Rangel D.O. Obtención de carbón activado a partir de residuos lignocelulósicos y diseño de un adsorbedor para la remoción de Cr6+ y Pb2+ en corrientes acuosas. Trabajo de grado. Facultad de Ingeniería. Universidad de los Andes 2004. [ Links ]
11. Boehm H.P. Advances in Catalysis. Eley, D.D.H.Pines., P.B.Weisz, Eds. New York Academic Press. 1.966; pp. 192. [ Links ]
12. Giraldo L.; Moreno J.C. Determinación de la entalpía de inmersión y capacidad de adsorción de un carbón activado en soluciones acuosas de plomo. Rev Colomb de Quím 2004; 33(2):87-97 [ Links ]
13. Giraldo L.; Moreno J.C. and Huertas J.I. Heats Conduction Micro-Calorimeter With Metallic Reaction Cells. Instrumentation Science & Technology 2002; 30(2):177- 186. [ Links ]
14. Rodríguez-Reinoso, F. Activated carbon: structure, characterization, preparation and applications. En: Introduction to carbon technologies. España Universidad de Alicante (Publicaciones). Alicante, 1997; pp. 60. [ Links ]
15. Diaz C.M.; Briceño N.; Baquero M.C.; Giraldo L.; Moreno J.C. Influence of temperature in the proceses of carbonization and activation with CO2 in the obtainment of activated carbon from african palm pit. Study of the modification of characterization parameters. Internet Journal of Chemistry, 6, GMT 2003; 13:52:00 [ Links ]
16. Toles C.A.; Marshall W.E.; Johns M.M. Surface functional groups on acid-activated nutshell carbons. Carbon 1999; 37:1207-1214 [ Links ]
17. Boehm H.P. Surface oxides on carbon and their analysis: a critical assessment. Carbon 2002; 40:145-149. [ Links ]














