Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804On-line version ISSN 2357-3791
Rev.Colomb.Quim. vol.36 no.1 Bogotá Jan./June 2007
ÓXIDO DE CROMO SOPORTADO EN CARBONES ACTIVADOS COMO CATALIZADOR PARA DESHIDROGENACIÓN OXIDATIVA DE ISOBUTANO
CHROMIUM OXIDE OVER ACTIVATED CARBONS AS CATALYST FOR OXIDATIVE DEHYDROGENATION OF ISOBUTANE
ÓXIDO DE CRÓMIO SUPORTADO EM CARVÕES ACTIVADOS COMO CATALISADOR PARA A DESIDROGENAÇÃO OXIDATIVA DO ISOBUTANO
Agobardo Cárdenas 1 , Fabio N. Acero 1 y José de J. Díaz 1
1 Departamento de Química, Universidad Nacional de Colombia, Sede Bogotá, Bogotá -Colombia. Correo electrónico: jddiazv@unal.edu.co
Recibido 15/12/06 Aprobado 27/04/07
RESUMEN
A un carbón activado Norit ROX 0.8® se le modificó su química superficial mediante tratamientos en ácido nítrico, en oxígeno diluido al 8,8% en nitrógeno y en hidrógeno. Los materiales se impregnaron con una solución acuosa de CrO3 y se utilizaron en la reacción de deshidrogenación oxidativa (DHO) de isobutano a isobuteno. Se observó formación de isobuteno a 443 K, selectividades hasta del 85 % y rendimientos a isobuteno del 9 %.
Palabras Clave : Carbón activado, deshidrogenación oxidativa, isobutano, desorción con temperatura programada.
ABSTRACT
The functional groups at the surface of an activated carbon Norit ROX 0.8® were modified through reaction with nitric acid, 8.8% O2 in N2 and H2 . The modified carbons were impregnated with a CrO3 aqueous solution and used in the Oxidative Dehydrogenation of isobutane to isobutene (ODH). The formation of isobutene was observed at 443 K, with a maximum selectivity of 85% and a yield of 9%.
Key words: Activated Carbon, Oxidative Dehydrogenation, Isobutane, Thermal Programmed Desorption.
RESUMO
A química superficial de um carvão ativado Norit ROX 0.8® foi modificada por tratamentos com ácido nítrico, com oxig ê nio diluído em azoto (8,8% O2 ) e com hidrog ê nio. Os materiais foram impregnados com uma solução aquosa de CrO3 e utilizados na reacção de desidrogenação oxidativa (DHO) de isobutano e isobuteno. Observou-se a formação de isobuteno a 443 K, selectividades até 85% e rendimentos de isobuteno de 9%.
Palavras Chave : Carvão ativado, desidrogenação oxidativa, isobutano, desorpção a temperatura programada.
INTRODUCCIÓN
Los metales de transición o sus óxidos presentan actividad catalítica en muchas reacciones químicas. Para obtener alta dispersión de la fase activa y mejorar dicha actividad, el agente catalítico se soporta en sólidos como alúmina, sílica, titania y carbones activados (CA) (1, 2) . Los óxidos de cromo han sido objeto de amplio estudio (3-6) como catalizadores de la reacción de deshidrogenación (DH) y DHO de isobutano a isobuteno. Este último compuesto es de gran interés industrial por el uso que tiene en petroquímica y en la fabricación de polímeros (2, 3). Díaz y cols. (7) demostraron que los CA también presentan actividad catalítica para las reacciones de DHO de isobutano a temperaturas cercanas a los 573 K.
El proceso industrial utilizado para la obtención de alquenos ligeros es la DH directa utilizando catalizadores con metales de transición. Este proceso es endotérmico y se realiza a temperaturas entre 783 y 848 K y con un consumo de energía de 2185 kJ/kg de isobuteno producido. A estas condiciones se favorece la formación de coque sobre el catalizador y es necesaria su regeneración con aire. También pueden ocurrir reacciones colaterales como el craqueo del isobutano a moléculas más ligeras (8) . Las desventajas de la DH de alcanos, estimula la investigación de nuevos procesos como la DH en medio oxidante (O2 o CO2 ) (9) lo cual ha contribuido a la búsqueda de nuevos materiales catalíticos más activos, selectivos y estables y a nuevos soportes en donde la dispersión del catalizador sea más homogénea (10). En el presente trabajo se muestran los resultados de utilizar óxido de cromo soportado sobre carbón activado en la reacción de DHO de isobutano a isobuteno.
MATERIALES Y MÉTODOS
Preparación de Catalizadores
Para el presente trabajo se seleccionó un carbón activado Norit ROX 0,8®. Este carbón activado se obtiene a partir de turba, por activación con vapor de agua y posterior lavado con ácido y agua para obtener un material con mínimos contenidos inorgánicos. Su presentación es en forma de pellets cilíndricos de 0,8 mm de diámetro y 4,7 mm de longitud, cuya forma regular asegura un empaque óptimo con baja resistencia al flujo.
A este material se le modificaron sus características superficiales por tratamiento en oxígeno diluido al 8.8% en nitrógeno a 698 K, con hidrógeno a 1073 K y con ácido nítrico 5M a 353 K. Los procedimientos seguidos para las modificaciones se encuentran descritos en el trabajo de Briceño y cols. (11). Para los tratamientos gaseosos, las muestras se colocaron en un reactor de cuarzo dentro de un horno vertical Stanton calentado eléctricamente y se llevaron a 425 °C para el tratamiento con oxígeno diluido, temperatura en la cual permanece durante 10 horas en presencia de la mezcla gaseosa y a 800 ºC para el tratamiento con hidrógeno por 6 horas. El flujo de gases fue de 250 mL/min medido y controlado por controladores de flujo másico Brooks serie 5850E y la velocidad de calentamiento de 10°C/min, controlada por un equipo Watlow serie 96. Para la oxidación con HNO3 el material se colocó en relación 1g de muestra: 10mL de ácido en un sistema de reflujo durante 6 horas, luego del tratamiento las muestras fueron lavadas con agua destilada hasta pH constante y se secaron por 24 horas a 110°C .
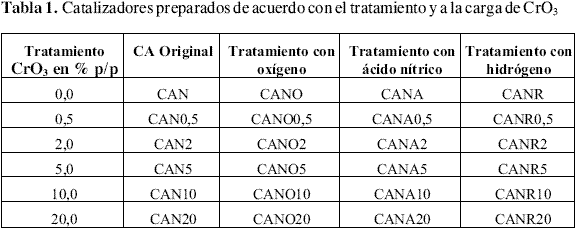
Se utilizó como material precursor CrO3 , Merck, grado analítico. Los catalizadores se prepararon por impregnación con soluciones acuosas del precursor, calculadas para cargas de CrO3 en los soportes de 0,5; 2,0; 5,0; 10,0 y 20,0 % en peso. Para la impregnación se pesan 4,0 g de CA y se colocan en un erlenmeyer con desprendimiento lateral, se deja por 1 hora en un baño de ultrasonido, al vacío y a temperatura ambiente; después con la ayuda de una bomba peristáltica se pasan 8 mL de la solución de CrO3 a un flujo de 1 mL/min. Terminada esta operación se deja 1 hora más a las condiciones iniciales, luego la muestra se seca a 383 K durante 12 horas. Los catalizadores preparados se guardan en recipientes herméticos dentro de un desecador hasta su uso en la reacción. En la tabla 1 se relacionan los nombres de los catalizadores de acuerdo con el tratamiento y la cantidad de CrO3 impregnada.
Pruebas Catalíticas
El procedimiento experimental seguido para los ensayos catalíticos fue el siguiente: en un reactor vertical de cuarzo de lecho fijo en U, de 8mm de diámetro interno, dotado con una frita porosa en uno de sus brazos para soportar la muestra, se cargaron 200 mg de catalizador. El reactor se colocó dentro de un horno National Electric, equipado con un controlador de temperatura Watlow 96 y una termocupla tipo K. Los gases se pasan a través de válvulas de flujo másico Brooks 5850E y se mezclan. Los flujos para la reacción fueron 4 mL/min de isobutano y 2 mL/min de oxígeno diluidos con 24 mL/min de helio a condiciones normales. Los flujos de reactantes corresponden a una relación molar de 2, relación estequiométrica para la deshidrogenación oxidativa. La mezcla reactante se alimenta al reactor por el brazo de la U que da por debajo de la frita y los productos de la reacción se pasan por un cromatógrafo HP 6890 Plus conectado en línea con el reactor. La temperatura inicial del reactor fue de 298 K, se inició el calentamiento a una velocidad de 5 K/min hasta 423 K y se mantuvo a esta temperatura por 1 hora. Las pruebas catalíticas se efectuaron a diferentes temperaturas entre 423 y 623 K durante 6 horas. Para cada ensayo se utilizó catalizador fresco y los datos se reportan trascurridas cinco horas de reacción, una vez se alcanza el estado estacionario. El seguimiento de la reacción se realizó por cromatografía de gases mediante un detector de conductividad térmica (DCT) a 523 K y una columna HP Plot Q con una temperatura inicial en el horno de 333 K durante 2 minutos, luego una rampa de temperatura de 25 K/min hasta 383 K y 7 minutos a esta temperatura para un tiempo total de 11 minutos por cromatograma.
El comportamiento de los catalizadores se sigue en términos de los siguientes parámetros:
Conversión:
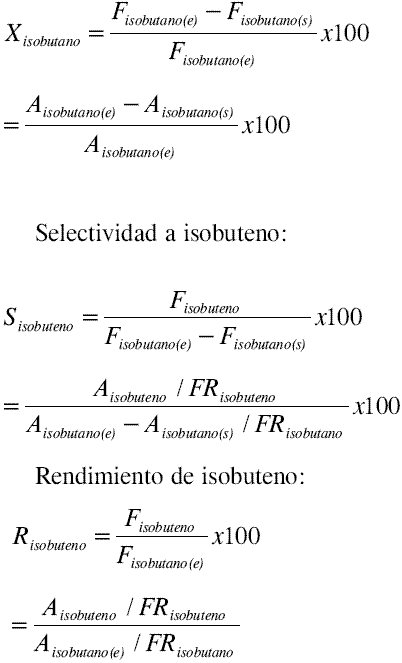
Donde: F es el flujo molar, A es el área del pico cromatográfico, FR es el factor de respuesta y los subíndices (e) y (s) indican condiciones de entrada y salida respectivamente.
Es importante mencionar que antes de iniciar los ensayos catalíticos, se realizaron pruebas con el reactor sin catalizador a las mismas condiciones de reacción para descartar posibles efectos catalíticos del reactor o reacciones en fase homogénea. Igualmente se realizaron ensayos para determinar la existencia de limitaciones difusionales externas para lo cual se hicieron ensayos de conversión en función del caudal másico, manteniendo constante la velocidad espacial (12). Para determinar las limitaciones difusionales internas, dado que se utilizó el catalizador en forma de pellets cilíndricos, el catalizador se molió a malla 150 (0,104mm) y se probó en la reacción (12) y finalmente para determinar la influencia de las impurezas minerales, al carbón activado se le realizó un tratamiento de desmineralización con HCl y HF y se probó en la reacción.
Caracterización de los Catalizadores
El material de partida, carbón Norit ROX 0,8® se caracterizó por análisis elemental mediante la determinación de los contenidos de carbono, nitrógeno e hidrógeno en un equipo LECO CHN-600, de acuerdo con la norma ASTM D 5373-02; azufre en un equipo LECO SC-132 según norma ASTM D4239-04a. El contenido de oxígeno se determinó por diferencia respecto a los resultados obtenidos en el análisis elemental.
A todos los catalizadores se les determinó antes y después de la reacción el área superficial mediante isotermas de adsorción de Nitrógeno a 77 K en un equipo Micromeritics Gemini 2375 por el método BET en el intervalo de presiones relativas de 0,05 a 0,15 y el volumen de microporo por el método t. Para cada análisis se pesaron entre 0,12 y 0,15g de muestra, la cual fue desgasificada con vacío a una presión de 90 militorr y a 623 K durante 15 horas en el equipo Micromeritics VacPrep 061. La isoterma se realizó por medida de 120 puntos, 82 de adsorción y 38 de desorción, en el modo de análisis de equilibrio.
Los grupos superficiales se caracterizaron por análisis de desorción con temperatura programada (DTP) (13); esta caracterización se hizo únicamente a los catalizadores impregnados con CrO3 al 10 %. El equipo para este análisis está conformado por un reactor de cuarzo en forma de U, con una frita porosa en uno de sus brazos para soportar la muestra (200 mg), instalado dentro de un horno vertical National, que puede operar a 1473 K y un controlador de temperatura Watlow serie 96. El flujo de helio (22,5 mL estándar/min) se regula con un controlador de flujo másico Brooks 5850E. La muestra se calienta desde 292 K hasta 1373 K a una velocidad de 5 K/min. La detección de CO y CO2 desprendido se hace por cromatografía de gases en el mismo equipo mencionado anteriormente.
RESULTADOS Y DISCUSIÓN
Pruebas catalíticas
Los catalizadores obtenidos fueron probados en la reacción de DHO de isobutano a isobuteno y para una mejor discusión se trata cada una de las series de catalizadores y luego se hace una discusión general. Es importante anotar que a las temperaturas de trabajo no se observó reacción de isobutano en fase homogénea. Igualmente no se presentaron limitaciones difusionales externas ni internas dado que, en las pruebas realizadas para su determinación, la conversión es constante (12). Al probar el material desmineralizado a las mismas condiciones de reacción y comparar su comportamiento con el material original no se encontró variación en la actividad catalítica, razón por la cual los ensayos se realizaron con el material original.
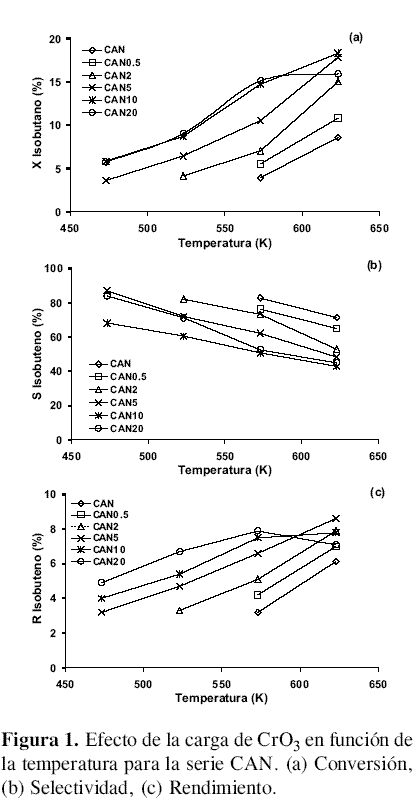
Serie CAN. La Figura 1 muestra el comportamiento de los catalizadores para la serie CAN. Se observa que para el catalizador sin CrO3 , el rendimiento hacia isobuteno es del 3,2 % a 573 K, resultado un poco menor al reportado por Díaz y cols.(7). A medida que aumenta la carga de CrO3 en el soporte, la temperatura a la cual se detecta la presencia de isobuteno es menor, observando su aparición a 473 K para los catalizadores con carga de cromo mayor al 5,0 %, lo que indica que su presencia cataliza la reacción a menor temperatura. Cuando se incrementa la temperatura de reacción, la conversión también aumenta hasta un 18 % a 623 K, que supera los datos reportados para el carbón activado sin impregnar y probado a 648 K (7). Los catalizadores con mayor contenido de cromo presentan menor selectividad hacia isobuteno, igual ocurre con el aumento de la temperatura de reacción. A bajas temperaturas, la selectividad en esta serie de catalizadores se encuentra entre un 70 y 90 % para los materiales con carga de CrO3 intermedia. A partir de 573 K, la mayor selectividad hacia isobuteno es para el catalizador sin CrO3 . A mayor cantidad de CrO3 en el catalizador y temperaturas altas se favorece la formación de otro tipo de compuestos.
Serie CANO. La figura 2 muestra el comportamiento de la serie CANO en la DHO. Los catalizadores de esta serie muestran actividad catalítica a menor temperatura. Es así como se observa conversión del 3,0 % de isobutano a 443 K para los catalizadores CANO10 y CANO20, es decir 30 K menos que en la serie CAN; sin embargo, la selectividad es menor.
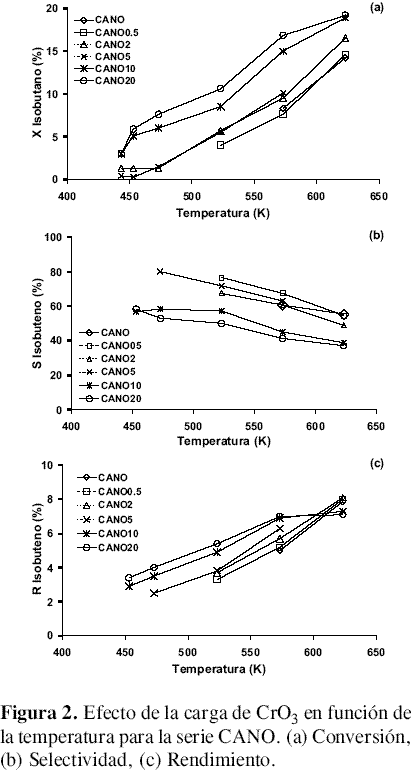
Puede verse que a mayor carga de óxido de cromo la conversión es mayor y el isobuteno aparece a temperatura menor. La selectividad disminuye con la carga de cromo para la misma temperatura. Los mejores rendimientos se encuentran alrededor del 8%.
Serie CANA. La figura 3 muestra el comportamiento catalítico de la serie CANA. A 453 K hay una conversión del 4,4 % para el catalizador CANA20, que luego llega al 13,3 % a 573 K y de ahí en adelante se estabiliza; caso contrario ocurre para los otros catalizadores de la misma serie, donde la conversión siempre tiende a aumentar en función de la temperatura y alcanza el mayor valor, 16,7 %, con el catalizador CANA5 a 623 K. El catalizador sin óxido de cromo muestra actividad a los 573 K con un porcentaje de conversión del 6,4 % y llega hasta 11,7 % a 623 K. La mejor selectividad a isobuteno (86,5 %) fue para el catalizador CANO10 a 473 K. Entre 573 y 623 K la mejor selectividad la tiene el catalizador sin cromo. El mayor rendimiento, alrededor del 8,0 %, lo dan los catalizadores con carga de CrO3 entre 0,5 y 5 %.
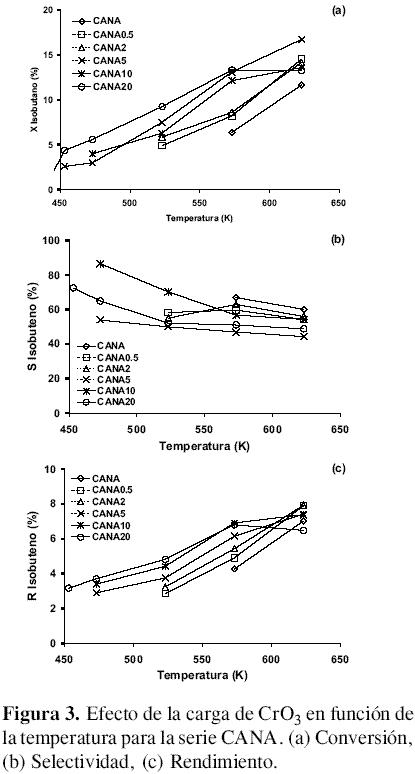
Serie CANR. La figura 4 muestra el comportamiento catalítico para la serie CANR. El CA modificado con hidrógeno y sin impregnar presenta formación de isobuteno a 593 K. A esta temperatura el medio oxidante empieza a generar grupos superficiales oxigenados que favorecen la reacción. La impregnación con CrO3 tiene un comportamiento de la reacción similar a las otras series de catalizadores. Las conversiones mayores las muestran los catalizadores con mayor carga de cromo a la temperatura más alta. La selectividad se mantiene entre valores de 52,1% para el CANR10 a 623 K y 81,9 % para el CANR0.5 a 573 K. El mejor rendimiento, 8,9%, lo muestra el catalizador CANR5 a 623 K.
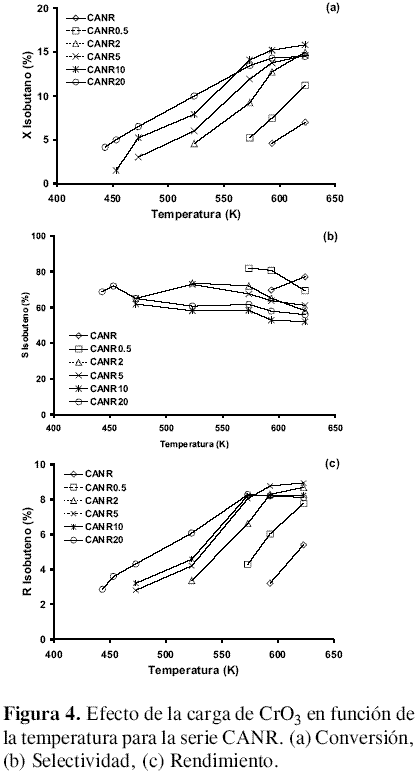
Los principales productos de la reacción del isobutano sobre los catalizadores de carbón activado tratados e impregnados con CrO3 fueron isobuteno, CO2 , CO y trazas de propeno, eteno y metano. La conversión máxima obtenida fue del 19,2 % para el CANO20 y la mejor selectividad, 86,5% para el CANA10. El rendimiento más alto, 8,9 %, lo mostró el CANR5 a 623 K. La selectividad a isobuteno aumenta con una disminución en la conversión del isobutano, lo cual podría implicar un mecanismo paralelo-consecutivo de la reacción en el que los óxidos de carbono se forman por oxidación del isobutano y de la olefina inicialmente formada [4, 14] .
La producción de isobuteno a más bajas temperaturas para los catalizadores impregnados con respecto a los catalizadores sin impregnar se presenta por la presencia del cromo que puede actuar en un ciclo redox, donde la reducción se da por la acción del CA y el hidrocarburo y la oxidación por la presencia de la atmósfera oxidante. A mayores temperaturas, además del efecto del cromo, también la actividad catalítica puede presentarse por la presencia de los grupos superficiales del CA, que empiezan a generarse como se observa para los catalizadores CAN y CANR.
De manera general, los resultados confirman que el CA sin impregnar actúa en la reacción de DHO de isobutano a isobuteno a temperaturas de 573 K y superiores como lo demostraron Díaz y cols. (7) y entre estos materiales sin impregnar, los que presentaron mejor comportamiento a 623 K fueron los materiales con tratamiento en oxígeno diluido y en ácido nítrico con rendimientos de 14,2% y 11,7% respectivamente, en tanto que el carbón original y el reducido con hidrógeno mostraron menores rendimientos (8,6% y 7,0% respectivamente). Lo anterior sugiere que la presencia de grupos superficiales del CA es importante en la reacción (7). El CrO3 en el catalizador favorece la reacción a temperaturas menores y a medida que la concentración del óxido aumenta y la temperatura es mayor, la conversión también aumenta con un descenso pronunciado en la selectividad. Las cargas de cromo entre 2 y 10 % sobre los soportes carbonosos presentan los mejores rendimientos de isobuteno, por encima o por debajo de estos límites el rendimiento decrece; resultados similares fueron reportados por Al-Zahrani y colaboradores para óxido de cromo soportado en alúmina [6] ; el comportamiento de los catalizadores está influenciado por el pretratamiento del soporte.
Los resultados obtenidos para los carbones activados impregnados con 10% de óxido de cromo y probados a 573 K y 623 K muestran mejores conversiones y rendimientos que los reportados para las mismas condiciones con catalizadores de CrO3 soportado en alúmina (6) y son similares a los reportados por Grzybowska y cols. para óxido de cromo soportado en alúmina y titania (1, 9, 15, 16).
Caracterización de los catalizadores
Los resultados de la composición elemental del material de partida se presentan en la tabla 2. Este carbón muestra un muy alto contenido de carbono y bajo contenido de heteroátomos, lo cual lo hace apto para su prueba en ensayos catalíticos. El contenido de azufre es bajo, y como se mencionó anteriormente, no afecta el comportamiento catalítico.

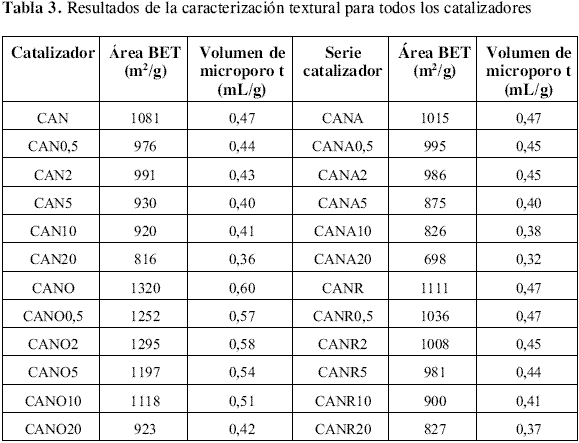
Caracterización Textural. Las isotermas de adsorción de nitrógeno a 77 K mostraron que la mayor adsorción ocurre en los microporos a presiones relativas bajas; al completarse el llenado de los microporos, la isoterma se aplana formando un codo, donde por su anchura se evidencia una amplia distribución de tamaño de microporo y la presencia de mesoporosidad bien desarrollada, siendo este un comportamiento característico de las isotermas tipo I, clase C, descritas por Rodríguez Reinoso y Linares Solano [17] . Las isotermas presentan un bucle de histéresis del tipo H4 , el cual se presenta en materiales con poros tipo rendija y amplia distribución de tamaño de microporos [17] . Como tendencia general se observó que a presiones relativas menores a 0,1 (zona de microporosidad) en todas las series de catalizadores el volumen de nitrógeno adsorbido disminuye a medida que aumenta la cantidad de cromo impregnado. En la tabla 3 se presentan los resultados de la caracterización textural. De acuerdo con estos datos, el área BET y el volumen de microporo disminuyen con la carga de cromo. El tratamiento del soporte con oxígeno diluido produjo un aumento del área superficial y del volumen de microporo, en tanto que los tratamientos en HNO3 y en hidrógeno no produjeron cambios apreciables en las características texturales. Sin embargo, cuando estos materiales se impregnan con el óxido de cromo, el tratamiento con mayor efecto sobre el área y el volumen de microporo fue el realizado con ácido nítrico, en el cual el volumen de microporo pasó de 0,47 mL/g para el soporte sin impregnar a 0,32 mL/g para el catalizador con la mayor carga de cromo (20 % de CrO3 ) y el área BET disminuyó de 1015 m2 /g a 698 m2 /g.
Desorción con Temperatura Programada (DTP). La desorción con temperatura programada es una herramienta para caracterizar la química superficial de catalizadores y de soportes carbonosos ya que los grupos superficiales oxigenados se descomponen por calentamiento a determinada temperatura liberando monóxido de carbono (CO) que proviene de grupos tipo fenol, éteres, carbonilos y quinonas, mientras que los grupos lactonas y carboxílicos liberan CO2 y los grupos anhídridos carboxílicos liberan tanto CO como CO 2 [13, 18] . La figura 5 muestra los perfiles DTP para los catalizadores impregnados con CrO3 al 10 %. Por la forma de los perfiles para cada uno de los catalizadores se deduce que el tratamiento del CA es importante en la impregnación porque, aunque todos contienen cantidad similar de CrO3 , se generan diferentes tipos de grupos oxigenados en la superficie del catalizador y son los que hacen que cada soporte carbonoso actúe de forma particular en la reacción de DHO (7, 13).
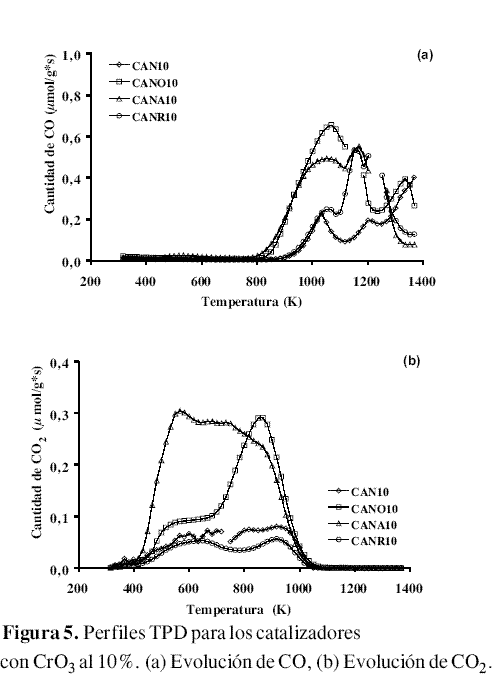
De acuerdo con los perfiles DTP mostrados en la figura 5, se observan rasgos característicos, un pico principal alrededor de 1000 K que puede asignarse grupos tipo fenol y un hombro alrededor de los 1200 K para el perfil de CO asignado a grupos tipo carbonil/quinona, figura 5(a); y en el perfil de CO2 , figura 5(b) dos picos, uno alrededor de los 600 K, para grupos tipo ácido carboxílico y otro alrededor de los 900 K para grupos tipo lactona (13, 18).
El catalizador CAN10, muestra la menor área bajo la curva en el perfil de evolución de CO, lo cual indica que tiene menos concentración de los grupos oxigenados tipo fenol y carbonil/quinonas que los otros catalizadores, en tanto que el que presenta mayor área es el CANO10, pretratado en oxígeno diluido. El CANA10 y CANR10 muestran un comportamiento intermedio. Este comportamiento está de acuerdo con lo encontrado por Figueiredo y colaboradores y Díaz y colaboradores (13, 18) para carbones activados sometidos a diversos tratamientos, aunque se observa un corrimiento de las temperaturas de los picos debido a la presencia del CrO3 . El perfil DTP de CO2 , figura 5 (b), para el catalizador CAN10, muestra el predominio de grupos tipo ácido carboxílico que evolucionan desde los 400 K y menos lactonas que aparecen por los 900 K (13).
Los otros catalizadores muestran mínima cantidad de grupos tipo ácido carboxílico y más presencia de lactonas; sin embargo, su concentración en el CANA10 y CANR10 es muy pequeña. Estas diferencias en los perfiles DTP pueden explicar la mayor variación de las áreas superficiales y volumen de microporo para el catalizador CANA10.
Caracterización de los catalizadores usados
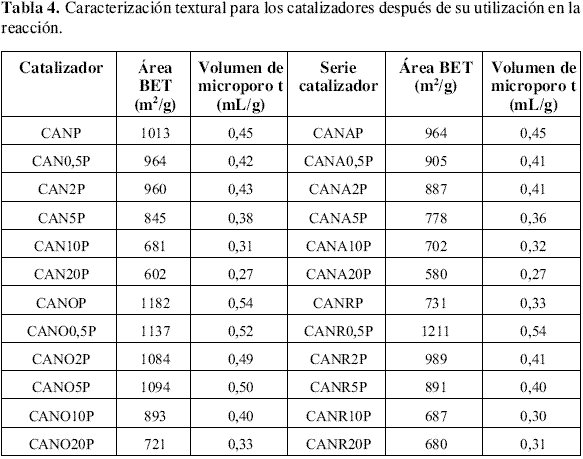
Caracterización textural posreacción. De acuerdo con las isotermas de adsorción de nitrógeno a 77 K, los diferentes catalizadores son estructuralmente similares antes y después de la reacción . Durante la reacción se producen cambios en los sólidos por su exposición al sistema reactante que los hace texturalmente más homogéneos con respecto a los materiales antes de la reacción. Estos cambios están asociados con la disminución del área BET y volumen de microporos como se observa en la tabla 3 y tabla 4, siendo más notorio para los catalizadores que en su proceso de preparación fueron oxidados. Los catalizadores que más se afectaron en área y microporosidad fueron los impregnados con mayor cantidad de CrO3 , que a su vez presentaron mayor porcentaje de conversión de isobutano en la reacción de DHO y menor selectividad. Esta disminución en el área superficial y microporosidad puede estar relacionada con deposición de coque sobre los catalizadores.
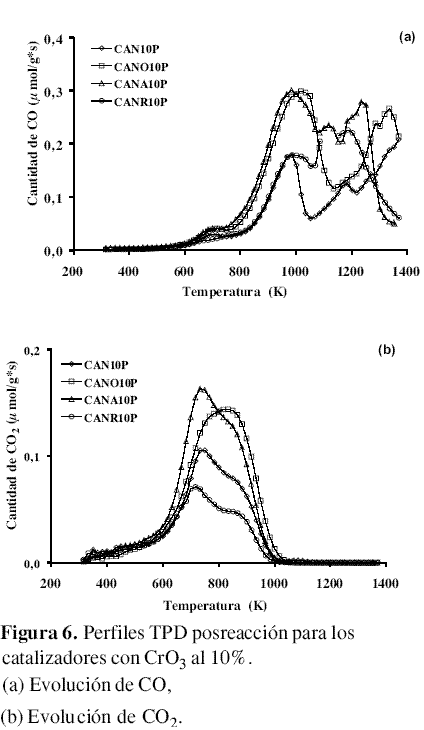
Desorción con Temperatura Programada posreacción (DTP). La figura 6, muestra los perfiles DTP de evolución de CO y CO2 para los catalizadores impregnados con CrO3 al 10 % después de ser utilizados en la reacción. En los perfiles de CO para los catalizadores oxidados se observó su corrimiento después de la reacción hacia la zona de los picos de anhídridos carboxílicos (800 K) que no eran evidentes antes de la reacción (figura 5) y fenoles, manteniendo relativamente constante la zona de los carbonil/quinonas; mientras que los catalizadores que no tenían o eran escasos en estos grupos generan los picos de anhídridos carboxílicos, fenoles y carbonil/quinonas. En el espectro CO2 se observó el corrimiento hacia los anhídridos y aumento de las lactonas. Esta observación puede indicar que con el transcurso de la reacción por acción del oxígeno y, a la temperatura que ésta se efectúa, se presenta un aumento de los grupos superficiales que se descomponen alrededor de los 800 K o anhídridos carboxílicos y de los 900 K o fenoles y de los grupos que descomponen formando CO2 . Igualmente, existe formación de grupos carbonil/quinona para los catalizadores que no los tienen (7). Es importante resaltar la casi desaparición de los grupos tipo ácido carboxílico. El mayor aumento de la cantidad de CO liberado con respecto a los catalizadores antes de reacción se presenta para los catalizadores CAN10P y CANR10P.
El comportamiento de los diferentes catalizadores en la reacción de deshidrogenación oxidativa de isobutano depende más de la química superficial introducida por los tratamientos modificatorios que de las características texturales. Las pruebas de los catalizadores en la reacción de deshidrogenación oxidativa de isobutano muestran que los tratamientos oxidativos presentan los mejores comportamientos, dado que la oxidación es un tratamiento que provoca aumento de grupos funcionales que se descomponen en CO en la prueba de desorción con temperatura programada. Entre estas funciones, los grupos carbonil/quinona que permanecen después de la reacción son los que catalizan, además del cromo, esta reacción.
Estos grupos ya habían sido sugeridos por otros autores como los sitios activos para la deshidrogenación oxidativa de etilbenceno a estireno (19 -22) Por diversas técnicas y análisis se ha propuesto (19,20, 22-27) que los grupos tipo quinona son especies oxidantes responsables de la extracción de hidrógeno del etilbenceno y del isobutano (7) dado que no se observó hidrógeno en la corriente de salida lo cual sugiere la participación de estos grupos en la reacción y en la producción de agua como subproducto (23) y por consiguiente, la reacción puede darse por un ciclo redox quinona/hidroquinona (7, 19-24, 28), en el cual los grupos quinona son reducidos para formar hidroquinonas por transferencia de hidrógeno del hidrocarburo y luego son rápidamente oxidadas por el oxígeno de la corriente reactante a quinonas, acompañados por la formación de agua (29). Este mecanismo redox también ha sido observado para la deshidrogenación oxidativa de isobutano sobre diferentes catalizadores (8, 9, 14, 30, 31) y por consiguiente podría decirse que tanto el cromo como los grupos carbonil/quinona catalizan la reacción.
CONCLUSIONES
Los diferentes tratamientos inducen cambios texturales y de química superficial en el carbón activado, que se refleja en su comportamiento en la reacción de deshidrogenación oxidativa de isobutano. La impregnación con CrO3 de los soportes modificados, aunque disminuye el área superficial y el volumen de microporo, favorece la reacción a una temperatura menor (443 K). A alta temperatura y alta carga de CrO3 , ocurre gasificación del carbón activado que conlleva a una pérdida de área superficial y de microporosidad con disminución de la selectividad a isobuteno. Los carbones activados son catalizadores activos y selectivos para la deshidrogenación oxidativa de isobutano y su comportamiento es mejor cuando presentan una alta concentración en su superficie de grupos carbonil/quinona.
AGRADECIMIENTOS
Los autores expresan sus agradecimientos a la Universidad Nacional de Colombia y a la División de Investigaciones de la Sede Bogotá (DIB) por el apoyo a este trabajo a través del proyecto de investigación Caracterización fisicoquímica de carbones activados modificados por diferentes tratamientos, código DIB-8003016.
REFERENCIAS BIBLIOGRÁFICAS
1. Grzybowska, B; Sloczynski, J; Grabowski, R; Wcislo, K; Kozlowska, A; Stoch, J, cols. Chromium Oxide/Alumina Catalysts in Oxidative Dehydrogenation of Isobutane. Journal of Catalysis 1998; 178(2):687-700. [ Links ]
2. Shimada, H; Akazawa, T; Ikenaga, N; Suzuki, T. Dehydrogenation of isobutane to isobutene with iron-loaded activated carbon catalyst. Applied Catalysis A: General 1998; 168(2):243-50. [ Links ]
3. Grabowski, R; Grzybowska, B; Slczynski, J; Wcislo, K. Oxidative dehydrogenation of isobutane on supported chromia catalysts. Applied Catalysis A: General 1996; 144(1-2):335-41. [ Links ]
4. Huang, Y; Wang, G; Valenzuela, R; Cortés Corberán, V. Catalizadores de Fe-Ti-O para la Oxideshidrogenación de Isobutano . En´ XVII Simposio Iberoamericano de Catálise . Oporto, Portugal, 2000; [ Links ]
5. De Rossi, S; Ferraris, G; Fremiotti, S; Indovina, V; Cimino, A. Isobutane dehydrogenation on chromia/zirconia catalysts. Applied Catalysis A: General 1993; 106(1):125-41. [ Links ]
6. Al-Zahrani, SM; Elbashir, NOA, A. E.; Abdulwahed, M. Catalytic Performance of Chromium Oxide Supported on Al 2 O 3 in Oxidative Dehydrogenation of Isobutane to Isobutene. Ind. Eng. Chem. Res. 2001; 40(3):781-84. [ Links ]
7. Díaz Velásquez, JdJ; Carballo Suárez, LM; Figueiredo, JL. Oxidative dehydrogenation of isobutane over activated carbon catalysts. Applied Catalysis A: General 2006; 311:51-57. [ Links ]
8. Hoang, M; Mathews, JF; Pratt, KC. Oxidative Dehydrogenation of Isobutane over Supported Chromium Oxide on Lanthanum Carbonate. Journal of Catalysis 1997; 171(1):320-24. [ Links ]
9. Grzybowska, B; Sloczinski, J; Grabowski, R; Wcislo, K; Koslowska, A; Stoch, cols. Oxidative Dehydrogenation of Isobutane on Chromium Oxide-Titania Catalysts. Polish Journal of Chemistry 1998; 72:2159-71. [ Links ]
10. Díaz, JJ. Modificación de las Características Superficiales de un Carbón Activado y su Aplicación como Catalizador en la Deshidrogenación Oxidativa de Isobutano . Bogotá, D.C, Universidad Nacional de Colombia, Tesis Doctoral, 2003. [ Links ]
11. Briceño Gamba, NO; Guzmán Guzmán, MY; Díaz Velásquez, JdJ. Grupos superficiales en materiales carbonosos. Caracterización por diferentes técnicas. Revista Colombiana de Química 2006; Suministrado para publicación. [ Links ]
12. Figueiredo, JL; Ramoa Ribeiro, F. Catálise Heterogénea . Lisboa Portugal; Fundaçao Calouste Gulbenkian.(1987). [ Links ]
13. Figueiredo, JL; Pereira, MFR; Freitas, MMA; Orfao, JJM. Modification of the surface chemistry of activated carbons. Carbon 1999; 37(9):1379-89. [ Links ]
14. Sloczinski, J; Grzybowska, B; Grabowski, R; Koslowska, A; Wcislo, K. Oxygen Adsorption and Catalytic Performance in Oxidative Dehydrogenation on Isobutane Chromium Oxide-based catalysts. Phys. Chem. Chem Phys 1999; 1:333. [ Links ]
15. Grzybowska, B; K., S; L., K; Wcislo, K; R., D; Serwicka, E. Effect of Thermal Treatment of the Al 2 O 3 and TiO 2 Supports on Properties of Dispersed Chromium Oxide in Oxidative Dehydrogenation of Isobutane. Polish Journal of Chemistry 2001; 75:283-92. [ Links ]
16. Grzybowska, B; Sloczynski, J; Grabowski, R; Keromnes, L; Wcislo, K; Bobinska, T. Oxidation of C2---C4 alkanes on chromium oxide/alumina and on Cr 2 O 3 : catalytic and TPD studies. Applied Catalysis A: General 2001; 209(1-2):279-89. [ Links ]
17. Rodríguez Reinoso, F; Linares Solano, A.. Microporous Structure of Activated Carbons as Revealed by Adsorption Methods. in: Thrower, PA editor. Chemistry and Physics of Carbon, 21, New York; Marcel Dekker, Inc. 1988; pp. 1-146. [ Links ]
18. Díaz Velásquez, JdJ; Carballo Suárez, LM; Figueiredo, JL. Thermal treatments of activated carbon catalysts under N 2 O. Carbon 2007; 45(1):212-14. [ Links ]
19. Pereira, MFR; Orfao, JJM; Figueiredo, JL. Oxidative Dehydrogenation of Ethylbenzene on Activated Carbon Catalysts. I. Influence of Surface Chemical Groups. Applied Catalysis A: General 1999; 184(1):153-60. [ Links ]
20. Pereira, MFR; Orfao, JJM; Figueiredo, JL. Oxidative Dehydrogenation of Ethylbenzene on Activated Carbon Fibers. Carbon 2002; 40(13):2393-401. [ Links ]
21. Schraut, A; Emig, G; Hofmann, H. Kinetic Investigations of the Oxidehydrogenation of Ethylbenzene. Journal of Catalysis 1988; 112(1):221-28. [ Links ]
22. Schraut, A; Emig, G; Sockel, HG. Composition and Structure of Active Coke in the Oxidehydrogenation of Ethylbenzene. Applied Catalysis 1987; 29(2):311-26. [ Links ]
23. Cadus, LE; Arrua, LA; Gorriz, OF; Rivarola, JB. Action of Activated Coke as a Catalyst: Oxidehydrogenation of Ethylbenzene to Styrene. Industrial and Engineering Chemistry Research 1988; 27(12):2241-46. [ Links ]
24. Cadus, LE; Gorriz, OF; Rivarola, JB. Nature of Active Coke in the Oxidehydrogenation of Ethylbenzene to Styrene. Industrial and Engineering Chemistry Research 1990; 29(7):1143-46. [ Links ]
25. Grunewald, GC; Drago, RS. Oxidative Dehydrogenation of Ethylbenzene to Styrene over Carbon-Based Catalysts. Journal of Molecular Catalysis 1990; 58:227-33. [ Links ]
26. Vrieland, GE. Oxydehydrogenation of Ethylbenzene to Styrene Over Metal Pyrophosphates. 1. Catalyst Composition and Reaction Variables. Journal of Catalysis 1988; 111(1):1-13. [ Links ]
27. Vrieland, GE; Menon, PG. Nature of the Catalytically Active Carbonaceous Sites for the Oxidehydrogenation of Ethylbenzene to Styrene. Applied Catalysis 1991; 77(1):1-8. [ Links ]
28. Lisovskii, AE; Aharoni, C. Carbonaceous Deposits as Catalysts for Oxydehydrogenation of Alkylbenzenes. Catalysis Review Science and Engineering 1994; 36(1):25-74. [ Links ]
29. Szymanski, GS; Zietek, S. Oxidative Dehydrogenation of Cyclic Hydrocarbons Over Modified Activated Carbons . in´ Carbon´03 An International Conference on Carbon . Oviedo (Spain), 2003. [ Links ]
30. Hoang, M; Mathews, J; Pratt, K. Oxidative Dehydrogenation of Isobutane to Isobutylene Over Supported Transition Metal Oxide Catalysts. Reaction Kinetics and Catalysis Letters 1997; 61(1):21-26. [ Links ]
31. Moriceau, P; Grzybowska, B; Gengembre, L; Barbaux, Y. Oxidative dehydrogenation of isobutane on Cr-Ce-O oxide: II. Physical characterizations and determination of the chromium active species. Applied Catalysis A: General 2000; 199(1):73-82. [ Links ]














