Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Colombiana de Química
versão impressa ISSN 0120-2804versão On-line ISSN 2357-3791
Rev.Colomb.Quim. v.36 n.2 Bogotá jul./dez. 2007
RELACIÓN DE LA EXPRESIÓN DE mARN DE LAS METALOPROTEINASAS 2 Y 9 Y EL INHIBIDOR TIMP-1 EN MOLA HIDATIDIFORME COMPLETA
RELATIONSHIP BETWEEN METALLOPROTEINASES 2 AND 9 AND TIMP-1 INHIBITOR mRNA EXPRESSION IN HYDATIDIFORME MOLE
RELAÇÃO DA EXPRESSÃO DE mRNA DAS METALOPROTEINASAS 2 E 9 E DO INHIBIDOR TIMP-1 NA MOLA HIDATIDIFORME COMPLETA
Martha L. Pinzón1, Blanca L. Ortiz2, Myriam Y. Sánchez de Gómez2,3
1 Instituto de Ciencias Básicas, Facultad de Medicina, Universidad del Rosario, Bogotá, Colombia. Martha.pinzon87@urosario.edu.co
2 Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia, sede Bogotá. Bogotá, Colombia blortizq@unal.edu.co
3 mysanchezg@unal.edu.co
Recibido: 15/12/06 - Aceptado: 15/06/07
RESUMEN
Durante el comienzo de la gestación el factor de crecimiento similar a la insulina tipo II (IGF-II) se expresa abundantemente en la placenta y podría regular el comportamiento invasivo de las células trofoblásticas. La habilidad invasiva dependerá también de la capacidad de secretar metaloproteinasas (MMPs), cuya expresión anormal contribuye a varios procesos patológicos. En la Enfermedad Trofoblástica Gestacional (ETG) estos factores podrían estar desregulados, así la mola hidatidiforme completa (MHC) conduce a la formación del coriocarcinoma, que es un tumor invasivo y metastásico. El objetivo de este estudio fue investigar la relación entre los niveles de mARN de IGF-II, MMP-2, MMP-9 y TIMP-1, por la técnica de RT-PCR, en tejidos de mola hidatidiforme vs. placentas de primer trimestre. La actividad de las MMPs se evaluó usando el ensayo de zimografía, encontrando que en MHC ésta se incrementa, lo cual podría relacionar la malignización del trofoblasto con el incremento en su capacidad invasiva. La expresión elevada de IGF-II en esta patología, también podría estar asociada con el incremento en la actividad de estas MMPs. Una mayor relación entre la expresión de mARNde MMP-9/TIMP-1 en la mola hidatidiforme completa se sugiere como predictor de malignización del tejido trofoblástico.
Palabras clave: metaloproteinasas, factor de crecimiento similar a la insulina tipo II (IGF-II), mola hidatidiforme completa.
ABSTRACT
At the beginning of gestation the Insulin Like Growth Factor II (IGF-II) is highly expressed in placenta and it could regulate the invasive behavior of trophoblastic cells. This invasive ability depends on its capability to secret metalloproteinases (MMPs) and tissue inhibitor of metalloproteinases (TIMPs), abnormal expression of which could contribute to several pathological processes.In the Gestational Trophoblastic Diseases (GTD) these factors could be unregulated, in this way complete hydatidiforme mole (CHM) produces the choriocarcinoma which is an invasive and metastasic tumor. The aim of this study was to investigate the relationship between IGF-II, MMP-2, MMP-9 and TIMP-1 mRNA levels by RT-PCR technique, in hydatidiform mole tissues vs. first normal trimester placentas. MMPs activity was evaluated using zimography assay finding that in CHM this is increased, which could relate trophoblast malignization with an increased invasive capability. The higher IGF-II mRNA expression in this pathology could, also, be associated with increased MMPs activity. A higher MMP-9/ TIMP-1 mRNA expression ratio in CHM is suggested as a predictor of trophoblastic tissue malignization.
Key words: metalloproteinases, Type II Insulin Like Growth Factor, Complete Hydatidiform Mole.
RESUMO
No início da gestação o fator de crescimento semelhante à insulina tipo II (IGF-II) é altamente expresso na placenta e poderia regular o comportamento invasivo das células trofoblásticas. Esta habilidade invasiva também depende da sua capacidade de produzir metaloproteinasas (MMP) e inibidores das mesmas (TIMP), expressão anormal da qual poderia contribuir em vários processos patológicos. Nas Doenças Trofoblásticas da Gestação (Gestational Trophoblastic Disease, ETG) estes fatores poderiam ser desregulados; deste modo a Mola Hidatidiforme Completa (MHC) produz coriocarcinoma que é um tumor invasivo e metastásico. O objetivo deste estudo era pesquisar a relação entre os níveis de mRNA do IGF-II, MMP-2, MMP-9 e TIMP-1, através da técnica de RT-PCR em tecidoos da MHC vs. placenta do primeiro semestre. Atividade das MMP foram avaliadas pelo ensaio de zimografia achando que em MHC aumenta; isto poderia relacionar o incremento do malignidade do trofoblasto com uma capacidade invasiva aumentada. A expressão mais alta do IGF-II nesta patologia pode também estar associada com atividade aumentada destas MMP. Uma relação aumentada da expressão do mRNA de MMP-9/TIMP-1 na MHC é sugerida como um preditor do incremento da malignidade do tecido trofoblástico.
Palavras-chave: metaloproteinasas, fator de crescimento semelhante à insulina Tipo II (IGF-II), mola hidatidiforme.
INTRODUCCIÓN
La exitosa implantación embrionaria, el desarrollo de la placenta y el crecimiento fetal dependen de la adecuada invasión del trofoblasto a la decidua materna, para tener acceso a los vasos sanguíneos de la madre. Es un proceso complejo similar a la invasión tumoral e involucra la proteólisis local de la matriz extracelular, el ataque celular y la migración, como también la inhibición de estos procesos. Los trofoblastos durante el proceso de implantación derivan en dos tipos celulares: las células citotrofoblásticas extravellosas que se localizan en el vello de anclaje y que presentan propiedades invasivas, y las células citotrofoblásticas que fusionan para generar el sincitiotrofoblasto. Las óptimas migración y función invasiva de las células trofoblásticas son esenciales para el normal desarrollo de la placenta, asegurando un eficiente intercambio de moléculas clave entre la madre y el feto (1); de no ser así, es posible que se presente el desarreglo molecular que conduce a desórdenes hipoinvasivos del trofoblasto, por ejemplo preclampsia y desórdenes hiperinvasivos, tal como ocurre en la ETG que comprende, entre otros, la mola hidatidiforme, la mola invasiva y el coriocarcinoma (2). Varios estudios han demostrado que la proliferación, migración e invasión in situ de las células trofoblásticas extravellosas son fuertemente reguladas por ciertos factores de crecimiento locales, por proteínas de unión a factores de crecimiento, así como también por la interacción del trofoblasto con ciertos componentes de la matriz extracelular (3, 4). Muchos factores estimulan la proliferación de las células trofoblásticas sin influir en su invasividad; sin embargo, se ha demostrado que existen dos factores que estimulan sus funciones migratorias e invasivas, sin ningún efecto en la proliferación. El factor de crecimiento similar a la insulina tipo II (IGF-II), producido por el trofoblasto, y la proteína de unión a IGF (IGFBP-1), producida por la decidua, independientemente estimulan la migración de estas células como también la invasión (5). IGF-II regula el desarrollo y función del trofoblasto en la interfase materno- fetal, durante el comienzo de la gestación, el IGF-II se expresa abundantemente en la placenta, y podría regular el comportamiento invasivo de las células trofoblásticas (6). Esta habilidad invasiva de las células citotrofoblásticas está en su capacidad de secretar enzimas proteolíticas las cuales degradan componentes de la matriz extracelular: metaloproteinasas (MMP) e inhibidores de metaloproteinasas (TIMP). En placenta normal se ha encontrado expresión de las metaloproteinasas MMP-2 y MMP-9, así como del inhibidor TIMP-2 (7, 8). La expresión anormal de estas metaloproteinasas parece contribuir a varios procesos patológicos que incluyen el crecimiento tumoral, la invasión y la metástasis. En células de coriocarcinoma se ha demostrado la expresión de las metaloproteinasas MMP-2 y MMP-9 (9); esta última es la que con más frecuencia se sobreexpresa en células tumorales malignas; sin embargo, poca información se tiene acerca de los factores que regulan la expresión de MMP-2 y MMP-9 durante la invasión del trofoblasto (10, 11).
En el grupo de investigación en Hormonas se desarrolla el proyecto “Estudio bioquímico y genético de la enfermedad trofoblástica gestacional”, en el cual se ha adelantado la caracterización citogenética de las muestras de mola hidatidiforme y la evaluación bioquímica y molecular de las mismas. En este trabajo, empleando tejido de placenta humana de primer trimestre como control y tejido de mola hidatidiforme como modelo de estudio, se evaluó la relación entre la expresión de mARN de IGF-II y la expresión de mARN de MMP-2, MMP-9 y TIMP-1 y la expresión del receptor IGF-IIR, implicados en el proceso de invasión. De esta manera se espera aportar al estudio de la enfermedad trofoblástica gestacional, y contribuir a ampliar el conocimiento de los factores que favorecen la invasividad celular, estrechamente relacionada con la agresividad del cáncer. Teniendo en cuenta que IGF-II estimula la migración/ invasión de células trofoblásticas y que esa habilidad invasiva depende de la capacidad de estas células de secretar metaloproteinasas (MMP), la hipótesis que planteó este estudio fue establecer si la expresión de MMP-2 y MMP-9 está directamente relacionada con la expresión de IGF-II. Así mismo establecer si la malignización del trofoblasto, es decir, la formación de mola hidatidiforme favorece la expresión/activación de MMP, tal como ocurre en otros tejidos malignos.
MATERIALES Y MÉTODOS
Sistemas biológicos
Las muestras se obtuvieron a partir de placentas de primer trimestre de mujeres que acudieron a los hospitales involucrados en el proyecto4, las cuales con un consentimiento previo permitieron su participación en el estudio; éste contó con la aprobación de los comités de ética de las entidades participantes (Laboratorio de Hormonas del Departamento de Química de la Universidad Nacional de Colombia, Instituto Nacional de Salud e Instituto Materno Infantil). Las pacientes después de ser valoradas por el médico se diagnosticaron con patología de aborto o mola hidatidiforme. Se emplearon 8 muestras de tejido de placenta de primer trimestre y 10 muestras de tejido trofoblástico clasificadas como mola hidatidiforme completa. (Las muestras clasificadas como mola hidatidiforme completa tienen periodos de gestación de entre 10 y 12 semanas; las muestras de placentas de primer trimestre tienen periodos de gestación de 12 semanas y se utilizan como control teniendo en cuenta que no es posible obtener muestras de abortos voluntarios; sin embargo, por estar dentro del mismo periodo de gestación, es posible su utilización como control). Los tejidos se mantuvieron a –70 ºC hasta el momento de su análisis.
Diseño experimental
RT-PCR (transcripción reversareacción en cadena de la polimerasa)
Para evaluar la expresión de mARN de IGF-II, MMP-2, MMP-9 y TIMP-1 en tejido, se empleó la técnica RT-PCR (transcripción reversa-reacción en cadena de la polimerasa). Inicialmente se hizo una extracción de ARN total proveniente de los tejidos empleando el reactivo Trizol (Invitrogen), según instrucciones de la casa productora. A partir del ARN total extraído se realizó la síntesis de cADN empleando un kit de RT-PCR SuperScript II (Invitrogen).
Posteriormente se hizo la amplificación de los genes correspondientes, a partir del cADN, empleando iniciadores o primers específicos. Como control se coamplificó un gen de expresión constitutiva: el gen de la gliceraldehído- 3-fosfato deshidrogenasa (GAPDH). Las condiciones de amplificación de cada uno de los genes por PCR se estandarizaron previamente. Los resultados se analizarno por densitometría empleando el programa de Biorad (Quantity One V. 4.1.1). Los programas para la PCR de cada gen y los primers específicos seleccionados para la amplificación se muestran en la Tabla 1.
Zimografía
La presencia de MMP gelatinolíticas en tejido se detectó por zimografía en gelatina (12). El contenido de proteína en los diferentes tejidos se midió de acuerdo con el método descrito por Bradford. Así, se utilizaron 20 µg de proteína en cada caso. Se usaron geles de poliacrilamida en una concentración del 7,5% y se les adicionó gelatina al 0,3%. Después de correr la electroforesis, los geles se lavaron con Tritón al 2,5%, y posteriormente se incubaron durante la noche en buffer (NaCl150 mM, CaCl2 150 mM y Tris-HCl 50 mM, pH 7,6) a 37 oC. Los geles se tiñeron con azul de Coomassie R-250 al 0,25% durante 30 minutos y después se destiñeron en metanol, ácido acético glacial, agua (50:10:40). La actividad gelatinolítica se detecta como bandas blancas sobre un fondo azul.
Estadística
Los ensayos se hicieron por triplicado en todos los casos. Los datos se reportan como el promedio, +/– SEM. Los grupos experimentales se compararon por análisis de varianza (Anova). Las diferencias se consideraron significativas a partir de P < 0,05.
RESULTADOS Y DISCUSIÓN
La enfermedad trofoblástica gestacional se caracteriza por la anormal proliferación del trofoblasto. En general las molas son benignas; sin embargo, cuando esta progresa puede llegar a ser invasiva y metastásica, o conducir a coriocarcinoma. La incidencia de la ETG es alta en Asia y Latinoamérica. En Colombia la incidencia del embarazo molar ha sido evaluada en el “Estudio bioquímico y genético de la enfermedad trofoblástica gestacional”5 y se ha encontrado que es de 3 en 100 embarazos (13). La incidencia en Asia está entre 3,2 y 9,9 por 1000 gestaciones, y en Norteamérica el rango es de 0,6 a 1,1 por 1000 embarazos. El embarazo molar es más común en mujeres muy jóvenes o en mujeres de edad avanzada y en multíparas. Un embarazo molar tiene un riesgo 10 veces más alto de repetirse. La mola hidatidiforme completa es benigna, pero puede transformarse en maligna e invadir localmente el miometrio y causar perforación del útero, y puede llegar a ser metastásica e invadir principalmente los pulmones, al cambiar a coriocarcinoma (14).
Es importante considerar que el significado de una apropiada invasión del trofoblasto para una implantación normal y que el embarazo llegue a buen término se demuestra en el hecho de que cuando esta falla hay una desregulación del proceso, que conduce a desórdenes hipoinvasivos como ocurre en la preclampsia, y a desórdenes hiperinvasivos como ocurre en la ETG (2). Esto indica la importancia de este estudio, al evaluar la expresión simultánea de mRNA de MMP-2, MMP-9, TIMP-1, la actividad de estas MMP en pacientes diagnosticados con mola hidatidiforme, y su correlación con factores como el IGF-II.
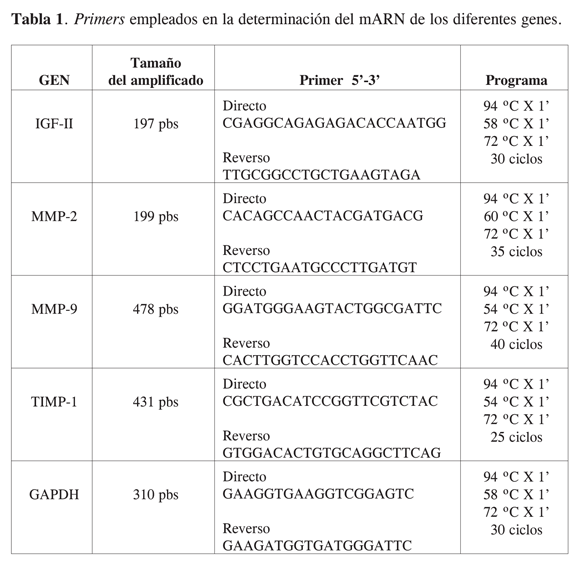
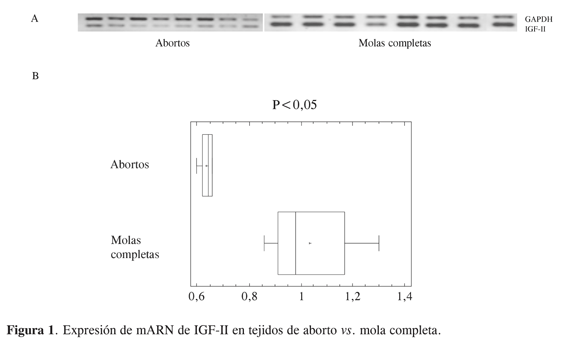
En diferentes clases de cáncer se ha demostrado que los factores de crecimiento incrementan la expresión y actividad de las metaloproteinasas. Así, los factores de crecimiento secretados por la célula hospedera o por células tumorales juegan un rol importante en la progresión del cáncer. Además de estimular la división celular, los factores de crecimiento también estimulan la migración y modulan la producción de MMP. En cáncer la proteólisis está regulada de forma anormal y favorece la degradación de la matriz extracelular, lo cual ayuda a la invasión tumoral y la metástasis. Estudios previos han determinado la expresión de proteinasas e inhibidores en casos de cáncer mediante una variedad de técnicas que incluyen inmunohistoquímica (14, 15); sin embargo, muchos se han enfocado en la expresión de metaloproteinasas. De acuerdo con la Figura 1, se encontró que la expresión de mARN de IGF-II es mayor en la patología que en abortos, situación que podría relacionarse con una secreción anormal de este factor en algunos casos de cáncer y que al parecer es propio del tejido molar, de acuerdo con lo reportado por Bernal (16), quien propone que el aumento en la expresión del IGF-II en mola hidatidiforme confirma la sobreexpresión de IGF-II que ha sido causada por la pérdida de la impronta genómica y alteraciones en el uso del promotor, ya que se ha demostrado que en tejidos tumorales en donde se mantiene la impronta la expresión de IGF-II es igual al estado normal y mucho menor que en aquellos tejidos tumorales en donde ocurre la pérdida de la impronta (17). En las muestras de tejido de placenta humana de primer trimestre (abortos espontáneos) y tejido de molas completas se evaluó la expresión de mARN de MMP y se reportó el resultado de acuerdo con lo obtenido para IGF-II, pues se considera que este factor de crecimiento puede ser usado como un marcador del tejido citotrofoblástico extravelloso, el cual tiene el fenotipo invasivo (18). Los niveles de expresión de mARN de MMP-2 y MMP-9 no son significativamente diferentes entre placentas de primer trimestre versus las patologías (Figura 2), y no se ven variaciones entre muestras, mientras que la expresión de mARN de IGF-II es mayor en las patologías que en placenta de primer trimestre, teniendo en cuenta que esta determinación se hace en los mismos tejidos. Estos resultados concuerdan con lo reportado por Li y cols. (19).
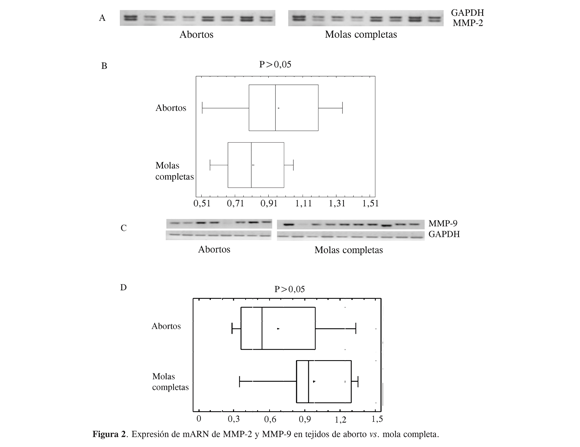
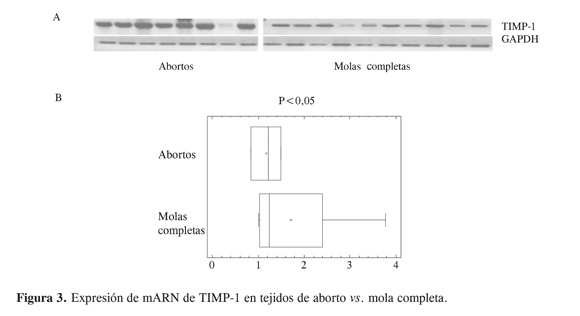
El inhibidor de metaloproteinasas tipo 1, TIMP-1, inhibe todas las metaloproteinasas y la forma activa de la MMP-9. La expresión de mARN de TIMP-1 en casos de mola hidatidiforme presenta, de acuerdo con la Figura 3, una tendencia a ser menor frente a lo obtenido en placentas de primer trimestre; sin embargo, no hay diferencias entre muestras. Se considera que una secreción o activación de MMP con un decrecimiento en la producción de TIMP podría ser responsable por la anormalidad del trofoblasto en la ETG. De ahí que se haga una relación entre la expresión de MMP/TIMP-1 (Figura 4) y se encuentra que en el caso de la relación de expresión de MMP-2/TIMP-1 no hay diferencias significativas entre los grupos; no obstante, la relación MMP-9/TIMP-1 da diferencias significativas entre los grupos y podría sugerirse como un indicativo de la malignización del tejido trofoblástico en la ETG.

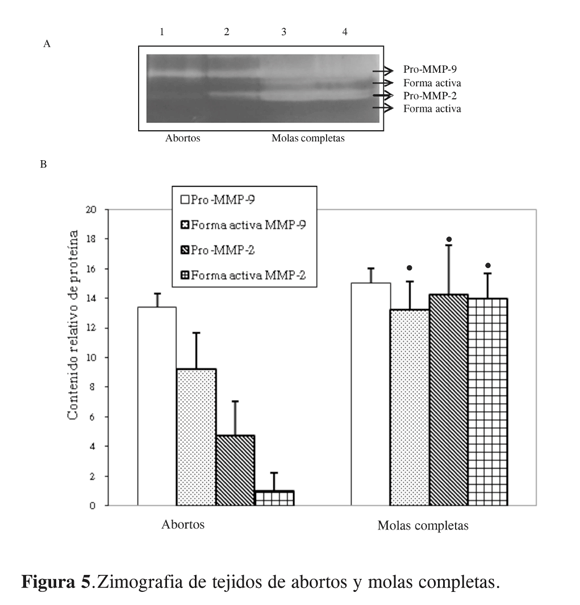
Las metaloproteinasas han sido consideradas como marcadores para pronosticar el progreso de un cáncer. Varios estudios han reportado que la expresión de MMP-9 podría estar asociada con la progresión e invasión de cáncer cerebral, glioma y cáncer de seno. Mientras que MMP-2 ha sido asociada con la invasión de cáncer de pulmón. Por consiguiente, ellas a menudo sirven como predictores de reducción de la enfermedad después de un tratamiento. La expresión de MMP-2 y MMP-9 no es necesariamente coordinada en todas las neoplasias y su valor como indicador pronóstico también varía, como sucede en el caso de cáncer de seno, donde un indicativo de incremento en la expresión de MMP-2 es también indicativo de la agresividad del tumor y de su malignización, mientras que un aumento de la expresión de MMP-9 en este cáncer podría ser indicativo de mejoría y reducción de la patogénesis. En el caso de carcinoma hepatocelular los pacientes con un cáncer más agresivo presentan niveles plasmáticos de MMP-9 elevados (20). Así mismo se ha considerado en los últimos años que la actividad proteolítica de las MMP debe controlarse farmacológicamente, pero aún no se ha tenido éxito con algunos tratamientos. Las razones por las cuales se da esta situación se deben al limitado conocimiento que se tiene acerca de las señales que controlan la expresión de las MMP en distintas patologías. Es el caso de la MMP-9, la cual se sobreexpresa de forma dramática en cáncer y en varias condiciones inflamatorias, por lo que puede ser un blanco potencial para el desarrollo de nuevas terapias (21). En este estudio demostramos que en las patologías conocidas como molas hidatidiformes la actividad de las metaloproteinasas 2 y 9 se incrementa frente a placentas de primer trimestre (Figura 5), situación que relacionaría la malignización del trofoblasto con el incremento en su capacidad invasiva, tal como ocurre en los casos de cáncer mencionados. Teniendo en cuenta la actividad de las MMP, la cual se evaluó por zimografía, se observa una actividad mayor para la MMP-2 y la MMP-9 en las patologías frente a las placentas de primer trimestre. Es decir, existe una relación entre la actividad de las metaloproteinasas 2 y 9 y la malignización del tejido trofoblástico, y este aumento en la actividad sugiere que la evaluación de la actividad de las MMP podría ser usada como predictor de la enfermedad.
De acuerdo con algunos autores, se plantea que las MMP serían las inductoras de la expresión de IGF-II, el cual a su vez incrementa las MMP, como lo demostramos en la línea celular JEG-3 (22). Se manifiesta que por efecto de la degradación de las proteínas de unión a IGF o IGFBP, mediadas por MMP, se estaría favoreciendo la acción de IGF y de su efecto mitogénico en algunas patologías. Así mismo se ha demostrado que TIMP-1, el principal inhibidor de metaloproteinasas, podría inhibir la tumorogénesis, reduciendo la actividad del mitógeno IGF-II (23). La habilidad de MMP en degradar a IGFBP-3, la principal proteína transportadora de IGF en suero tanto in vitro como in vivo, sugiere que las MMP podrían participar en el crecimiento celular y morfogénesis tisular no solo a través de su capacidad de alterar la arquitectura extracelular, sino también modulando la disponibilidad de los IGF para sus receptores. Algunos estudios han evaluado el efecto directo de inhibidores sintéticos de metaloproteinasas, y demuestran que se inhibe el crecimiento tumoral en una variedad de casos in vivo. Además recientemente se ha probado que la sobreexpresión de TIMP-1 en un tumor hepatocelular previene la proliferación y posterior tumorogénesis. Usando varias aproximaciones, se ha demostrado que la sobreexpresión de TIMP-1 en tejido hepático inhibe la proteólisis de IGFBP-3 y por consiguiente decrece la expresión de IGF-II, lo cual resulta en una disminución de la proliferación y tumorogénesis celular (24). Estudios como el anterior demuestran que el control de la degradación de IGFBP mediada por MMP podría considerarse como una terapia novedosa en el control de la biodisponibilidad de los factores de crecimiento similares a la insulina en cáncer. De acuerdo con los resultados obtenidos en este estudio y con lo planteado anteriormente, la tendencia a la disminución en la expresión de mARN de TIMP-1 podría favorecer la expresión de mARN de IGF-II, en la enfermedad trofoblástica gestacional, lo cual a su vez favorecería efectos mitogénicos en las molas hidatidiformes, que están más asociados con procesos invasivos.
Pero ¿qué hace que las molas completas no tengan un carácter invasivo como tal? Las molas completas se eliminan al tercer mes de gestación en la mayoría de los casos; sin embargo, la recurrencia en embarazos molares conduce a la formación de molas invasivas y coriocarcinomas que son altamente metastásicos. Es posible que la regulación de la invasividad en las molas completas esté dada por una mayor presencia de los inhibidores de metaloproteinasas, situación contraria a lo que ocurre con mola invasiva y coriocarcinoma.
REFERENCIAS BIBLIOGRÁFICAS
1. Bischof, P.; Meisser, A.; Campana, A. Paracrine and autocrine regulators of trophoblast invasion-a review. Placenta. 2000. Suppl. A; S55-60. [ Links ]
2. Ezpeleta, M.; López, A. Enfermedad trofoblástica gestacional. Aspectos clínicos y morfológicos. Revista Española de Patología. 2002. 35 (2): 187-200. [ Links ]
3. Rong-Hao, Li; Lin-Zhi Zhuang. The effects of growth factors on human placental cytotrophoblast cell proliferation. Human Reproductive. 1997. 12 (4). [ Links ]
4. Maudi, M.; Haas, J.; et al. Serum- dependent effects of IGF-I and insulin on proliferation and invasion of human first trimester trophoblast cell models. Histochem. Cell Biol. 2002. 117: 391-399. [ Links ]
5. Nayak, N. R.; Giuduce, L. C. Comparative biology of the IGF system in endometrium, decidua, and placenta, and clinical implications for foetal growth and implantation disorders. Placenta. 2003. 24: 281-296. [ Links ]
6. Hamilton, G. S.; Lala, P. K.; et al. Autocrine-paracrine regulation of human trophoblast invasiveness by insulin-like growth factor (IGF-II) and IGF-binding protein (IGFBP-1). Experimental Cell Research. 1998. 244: 147-156. [ Links ]
7. Vegh, G. L.; Selcuk Tuncer, Z. Matrix metalloproteinases and their inhibitors in gestational trophoblastic diseases and normal placenta. Ginecol. Oncol. 1999. 75 (2): 248-253. [ Links ]
8. Morgan, M. Expression of metalloproteinases and their inhibitors in human trophoblast continouos cell lines. Exp. Cell Res. 1998. 242 (1): 18-26. [ Links ]
9. Cohen, M.; Bischof, P. Metalloproteinases and Human Placental Invasiveness. Placenta. 2005. 27 (8): 783-93. [ Links ]
10. Librach, C. L.; Werb, Z.; et al. 92-kD type IV collagenase mediates invasion of human cytotrophoblasts. J. Cell Biol. 1991. 113: 437-449. [ Links ]
11. Staun-Ram, E.; Goldman, S.; et al. Expression and importance of matrix metalloproteinase 2 and 9 (MMP-2 and -9) in human trophoblast invasion. Reproductive Biology and Endocrinology. 2004. (2): 59. [ Links ]
12. Zhang, J.; Cao, Y. J. Expression of matrix metalloproteinase-2 and tissue inhibitor of metalloproteinase-4 in human normal cytotrophoblast cells and a choriocarcinoma cell line, JEG-3. Mol. Hum. Reprod. 2002. (7): 659-666. [ Links ]
13. Cantero, M. Evaluación de los factores de crecimiento similares a la insulina IGFs en sueros de pacientes con Enfermedad Trofoblástica Gestacional. Tesis de Maestría en Bioquímica. Departamento de Química, Universidad Nacional de Colombia. 2003. 34 pp. [ Links ]
14. Bredin, C. G.; Liu, Z.; et al. Growth factor-enhanced expression and activity of matrix metalloproteases in human non-small cell lung cancer cell lines. Anticancer Res. 2003. (23) pp: 5372. [ Links ]
15. Zygmunt, M.; Bischof, P.; et al. Invasion of cytotrophoblastic JEG-3 cells is stimulated by hCG in vitro. Placenta. 1998. 19 (8): 587-593. [ Links ]
16. Bernal, Y. Expresión del factor de crecimiento similar a la insulina tipo II (IGF-II) en placenta normal. Tesis de Química. Departamento de Química, Universidad Nacional de Colombia. 2004. 30 pp. [ Links ]
17. Kim, S. J.; Park, S. E.; et al. Alterations in promoter usage and expression levels of insulin like growth factor- II and H19 genes in cervical carcinoma exhibiting biallelic expression of IGF-II. Biochemica e Biophysica Acta. 2002. 1586: 307-315. [ Links ]
18. Han, V. K.; Bassen, N.; et al. The expression of insulin-like growth factor (IGF) and IGF-binding protein (IGFBP) genes in the human placenta and membranes: evidence for IGF:IGFBP interactions at the feto- maternal interface. Journal Clinical Endocrinol. Metabolism. 1996.81: 2680-2693. [ Links ]
19. Li, Z.; Xiang, Y.; Dai, L. Prediction of malignant transformation of hydatidiform mole by mRNA determination of matrix metalloproteinases and tissue inhibitor of metalloproteinases. Zhonghua Fu Chan Ke Za Zhi. 2000. 35 (9): 547-550. [ Links ]
20. Turpeenniemi-H., T. Gelatinases (MMP-2 and-9) and their natural inhibitors as prognostic indicators in solid cancers. Biochimia. 2005. 87: 287-297. [ Links ]
21. St-Pierre, Y. Regulation of MMP-9 gene expression for the development of novel molecular targets against cancer and inflamatory diseases. Review. Expert Opin. Ther. Targets. 2004. 8: 1-16. [ Links ]
22. Pinzón, M. L. Evaluación de la vía de señalización PI3K/Akt activada por el factor de crecimiento similar a la insulina tipo II (IGF-II) en la expresión de las metaloproteinasas 2 y 9 involucradas en el proceso de invasión en células de coriocarcinoma humano. Tesis de Maestría en Bioquímica. Departamento de Química, Universidad Nacional de Colombia, Bogotá. 2006. pp. 37-40. [ Links ]
23. Fowlkes, J. L.; Serra, D.; et al. Regulation of Insulin-like growth factor (IGF-I) action by matrix metalloproteinase- 3 involves selective disruption of IGF-I/IGF-Binding Protein-3 complexes. Endocrinology. 2004. 145: 620-626. [ Links ]
24. Martin, D. C.; Fowlkes, J. L.; et al. Insulin-like growth factor II signaling in neoplastic proliferation is blocked by the transgenic expression of the metalloproteinase inhibitor TIMP-1. The Journal of Cell Biology. 1999. 146 (4): 881-892. [ Links ]














