Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804On-line version ISSN 2357-3791
Rev.Colomb.Quim. vol.36 no.2 Bogotá July/Dec. 2007
INDUCCIÓN DE LA ACTIVIDAD DE LA ENZIMA FENILALANINA AMONIO LIASA EN CLAVEL (Dianthus caryophyllus L) POR ELICITORES DEL HONGO Fusarium oxysporum f. sp. Dianthi raza 2
PHENYLALANINE AMMONIUM LIASE INDUCTION ON CARNATION (Dianthus caryophyllus L) BY ELICITORS FROM Fusarium oxysporum f. sp. Dianthi race 2
INDUÇÃO DA ACTIVIDADE FENILALANINA AMONIO LIASA EM CRAVO (Dianthus caryophyllus L) POR ELICITORES DO FUNGO Fusarium oxysporum f. sp. Dianthi raça 2
Harold Ardila1, Beatriz Baquero y Sixta Martínez1,2
1 Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia, sede Bogotá, Bogotá, Colombia. hdardilab@unal.edu.co
2 stmartinezp@unal.edu.co
Recibido: 15/12/06 – Aceptado: 23/08/07
RESUMEN
Con el fin de evaluar el comportamiento a nivel del tallo de la enzima fenilalanina amonio liasa (PAL, por su nombre en inglés phenylalanine ammonia liase), durante la interacción clavel-Fusarium oxysporum f. sp. dianthi raza 2, se seleccionaron las condiciones para su extracción y cuantificación de la actividad. Para la extracción a partir de tallos y raíces se seleccionó un tratamiento previo del material vegetal con acetona y posterior extracción con buffer borato pH 8,8 con EDTA 2mMy β-mercaptoetanol 18 mM. Para su cuantificación a nivel del tallo se debe realizar un ensayo discontinuo por 10 min, a 37 oC, pH 8,0 y a una concentración de sustrato de 35 mM. Adicionalmente se muestra mediante un ensayo in vivo el efecto que tiene, como inductor de esta enzima, la aplicación de un extracto crudo del patógeno. Los resultados observados indican que esta enzima se induce significativamente en tallos de claveles de la variedad tolerante “Kiss” durante el tratamiento por aspersión con el extracto crudo del patógeno, mientras que dicha inducción fue inexistente para la infección directamente con el patógeno. La inducción en esta variedad indica que en este extracto del patógeno se presentan elicitores potenciales para la inducción de esta enzima y por ende de la ruta fenilpropanoide.
Palabras clave: enzimas, fenilalanina amonio liasa, elicitor, clavel, Fusarium oxysporum f. sp. dianthi.
ABSTRACT
The conditions of extraction and quantification of activity during interaction of carnation and Fusarium oxysporum f. sp. dianthi race 2 were selected to evaluate the dynamics of the enzyme Phenylalanine Ammonium Lyase (PAL) at the carnations steam. For the extraction from roots and stems a previous treatment with acetone and extraction with borate pH 8.8, EDTA 2 mMand mercaptoethanol 18 mM buffer were selected. For the quantification at steam level a discontinous assay for 10 min at 37 °C, pH 8.0 and substrate concentration 35mMshould be done. In addition an in vivo assay shows the effect that the applications of a raw extract of the pathogen as inductor of this enzyme. The results show that the enzyme is significantly induced in carnations stems of the tolerant variety “Kiss” during the treatment by aspersion with raw extract of the pathogen while the induction was non existing for direct infection with the pathogen. The induction in this variety shows that in the pathogen extract are present elicitors for the induction of this enzyme and thus the phenylpropanoid path.
Key words: phenylalanine ammonium liase, carnation, Fusarium oxysporum f. sp. dianthi.
RESUMO
Para avaliar o comportamento da enzima fenilalanina amonio liasa (PAL, pelo seu nome em inglês phenylalanine ammonia liase) no caule durante a interação cravo- Fusarium oxysporum f. sp. dianthi raça 2, foram seleccionadas as condiçes ideais para a sua extração e quantificação na atividade. Para a extração a partir de caules e raízes foi seleccionado um tratamento prévio do material vegetal com acetona e posterior extração com borato pH 8,8 com EDTA 2 mMe β-mercaptoetanol 18 mM. Para a quantificação da enzima no caule, deve-se realizar um ensaio descontínuo por 10 min., a 37 °C, pH 8,0 e a uma concentração de substrato de 35 mM. Além do mais, mostra-se mediante um ensaio in vivo, o efeito que tem como inductor desta enzima a aplicação de um extracto cru do patógeno. Os resultados observados indicam que esta enzima é induzida significativamente en caules de cravos da variedade tolerante “Kiss” durante o tratamento por aspersão com o extrato cru do patógeno, enquanto que esta indução foi inexistente para a infecção directa com o patógeno. A indução apresentada nesta variedade indica que neste extrato do patógeno estão presentes potencias elicitores para a indução desta enzima e portanto da rota fenilpropanoide.
Palavras-chave: enzimas, fenilalanina amonio liasa, elicitor, cravo, Fusarium oxysporum f. sp. Dianthi.
INTRODUCCIÓN
El cultivo del clavel constituye actualmente una de las actividades de mayor relevancia en el sector floricultor nacional, aunque su producción haya disminuido en los últimos años por factores que inciden en la producción y el mercado. Uno de los principales factores que afectan su producción es el marchitamiento vascular causado por el hongo Fusarium oxysporum f. sp. dianthi raza 2, patógeno ampliamente distribuido en las zonas donde se cultivan claveles en nuestro país. Aunque diversos grupos de investigación en el mundo han enfocado sus estudios para comprender cuáles son los fenómenos histológicos y bioquímicos involucrados en la interacción entre estos dos organismos, dichos fenómenos no han sido totalmente dilucidados y tanto las bases bioquímicas como moleculares en que se fundamenta la defensa del clavel contra este patógeno son aún desconocidas. De acuerdo con diversos estudios en otros modelos planta-patógeno, enzimas involucradas en la vía fenilpropanoide, como la fenilalanina amonio liasa (PAL), participan de manera determinante en la generación de compuestos fenólicos (1) y estructuras de defensa (2), y es probable que su regulación coordinada durante el evento de la interacción contra microorganismos patógenos sea clave en la activación de los mecanismos de defensa vegetales. La PAL es la enzima que, al catalizar la primera reacción de la ruta fenilpropanoide, se ha encontrado que puede regular la generación de los diferentes metabolitos obtenidos por esta vía biosintética y ha sido relacionada, por ello, con mecanismos de defensa que se activan en otros modelos (3, 4 y 5). El interés por el estudio de esta enzima en este modelo particular se basa en que, de acuerdo con estudios previos realizados en nuestro grupo de investigación, la síntesis de compuestos fenólicos así como la formación de estructuras de defensa hacen parte de la respuesta al ataque del patógeno (6 y 7) y por ende estas enzimas podrían ser determinantes para la activación adecuada de dichos mecanismos. En el presente estudio se seleccionaron inicialmente las mejores condiciones para realizar la extracción y cuantificación de esta enzima en tallos y raíces de clavel. La evaluación en estos dos órganos de la planta se llevó a cabo con fines comparativos, considerando que, tal y como se ha reportado en otras especies vegetales, es probable que se presenten diferentes isoformas en función del órgano de la planta involucrado (8). Seleccionadas estas condiciones, se evaluó en tallos de la variedad de clavel Kiss, tolerante al marchitamiento vascular, el efecto que sobre la actividad enzimática tenía el tratamiento por aspersión y por inmersión con una fracción cruda proveniente del patógeno. Con los resultados obtenidos en el presente estudio se propone que la activación de esta enzima podría ser un mecanismo de defensa potencial considerando su inducción significativa al realizar el tratamiento con una fracción cruda proveniente del patógeno.
MATERIALES Y MÉTODOS
Material vegetal y aislamiento del patógeno
Se usaron para el ensayo in vivo esquejes de clavel con 3 semanas de enraizamiento suministrados por la empresa América Flor S. A., pertenecientes a las variedades Uconn (susceptible) y Kiss (tolerante al marchitamiento vascular causado por Fusarium oxysporum f. sp. dianthi raza 2). El aislamiento del patógeno usado para este estudio fue suministrado por la misma empresa y se mantuvo en medio Czapek Dox-Brot durante su propagación.
Para la preparación del inóculo, el micelio del aislamiento de Fusarium oxysporum f. sp. dianthi raza 2 se propagó directamente a medio líquido Czapek Dox- Broth y se mantuvo por 4 días a 25 oC con agitación constante de 100 rpm. Cumplido este periodo, el cultivo se filtró en condiciones asépticas para retirar el micelio sobrenadante y el medio líquido se llevó a una concentración de 1 X 106 conidias / mL (por conteo con el hemocitómetro).
Obtención del extracto crudo del hongo
Para la obtención de la fracción cruda del hongo, micelio obtenido de la propagación en medio liquido de Fusarium oxysporum f. sp. dianthi raza 2, se lavó exhaustivamente con agua luego de separarlo del medio por filtración. Después de homogenizar y esterilizar por 15 min en autoclave, se centrifugó a 12000 rpm por 20 min y 8 oC. Se retiró el sobrenadante y se cuantificó en este la cantidad de azúcares totales, con el método de Dubois (9) usando glucosa como patrón. La concentración final de 1 mg/mL se obtuvo con la adición de agua estéril y esta fracción se guardó a –20 oC para llevar a cabo los ensayos de elicitación.
Ensayos preliminares para la extracción y cuantificación de la PAL a partir de tallos de clavel
La cuantificación preliminar de la actividad se realizó usando extractos de tallos y/o raíces obtenidos bajo condiciones de extracción reportadas para matrices similares a la de estudio (7). La extracción se realizó utilizando de 0,3 a 0,4 g de material vegetal previamente lavado y secado, el cual se maceró con aire líquido y se le adicionó acetona en una relación 1:2 con el material vegetal. En este punto fue necesario realizar dos lavados adicionales con este solvente, para eliminar compuestos fenólicos que pueden ser potenciales inhibidores de esta enzima (10). Una vez eliminados los compuestos interferentes, se adicionó amortiguador Na2HPO4-NaH2PO4 100 mM, pH 6,5; posteriormente se centrifugó a 11000 xg durante 30 min., el sobrenadante se retiró cuidadosamente y se guardó a –15 oC para someterlo a los análisis posteriores de actividad enzimática, y de cuantificación de proteína por el método de Bradford (11) y la linealización reportada por Zor y Sellinger (12). La actividad se determinó en los extractos crudos obtenidos, mediante cuantificación del ácido cinámico generado por la enzima a una longitud de onda de 270 nm en la que absorbe el doble enlace generado.
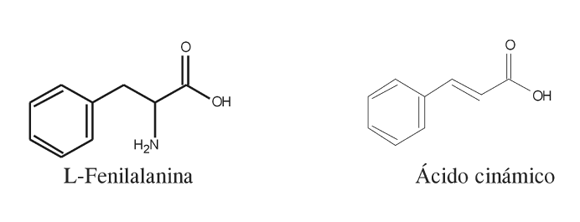
Para realizar la cuantificación espectrofotométrica del ácido cinámico generado, se realizó una curva de calibración (270 nm) en el rango de concentraciones en las que se presenta linealidad. Los resultados en esta parte se expresaron como actividad específica (nmoles ácido cinámico/ min*mg proteína) y como actividad por gramo de material vegetal (nmoles ácido cinámico/g material vegetal).
Selección de condiciones para la extracción de la PAL a partir de tallos y raíces de clavel
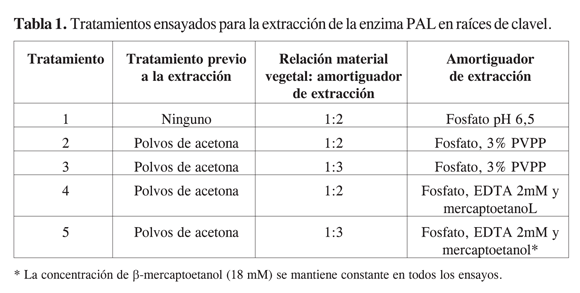
Bajo estas condiciones preliminares de cuantificación se llevó a cabo la selección de los parámetros para la extracción de esta enzima en tallos y raíces de clavel, usando esquejes de tres semanas de enraizamiento de la variedad Carolina, tolerante al marchitamiento vascular causado por Fusarium oxysporum f. sp. dianthi raza 2. Cada tratamiento se realizó por triplicado y la evaluación de actividad por duplicado. Los tratamientos iniciales utilizados para extraer la enzima se muestran en la Tabla 1.
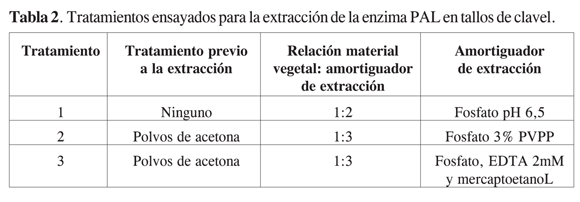
Los tratamientos 2 y 3 se basaron en la metodología reportada previamente para la extracción de enzimas similares en esta especie vegetal (7). En el tratamiento 3 se utilizó un amortiguador frecuentemente reportado para la extracción de esta enzima en diferentes fuentes vegetales (13). Así mismo, teniendo en cuenta que en esta evaluación realizada en raíces la relación material vegetal: amortiguador de extracción que generaba los mejores resultados en cuanto a la actividad extraída era la 1:3 (Figura 1), esta fue la que se usó para el caso de la selección en tallo. En la Tabla 2 se presentan los tratamientos ensayados para este último órgano.
Seleccionadas las condiciones de extracción más favorables para esta enzima, se evaluó el efecto que presentaba el pH del amortiguador de extracción (Tabla 3).
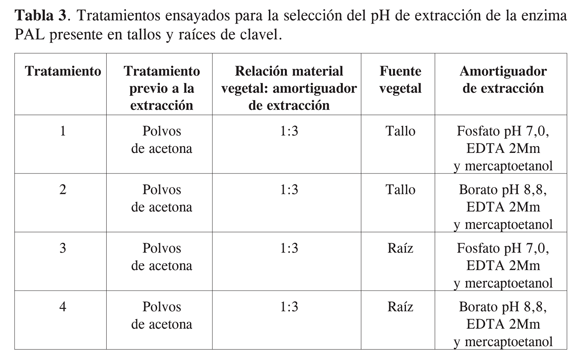
Considerando lo reportado por varios autores, se ensayaron los amortiguadores fosfato de sodio 100 mM pH 7,0 (13 y 14) y borato 100 mM pH 8,8 (15). Para este experimento se mantuvieron constantes algunos de los aditivos reportados por (13) de acuerdo con los resultados obtenidos previamente. Los ensayos a partir de este punto se hicieron de manera conjunta en tallos y raíces de clavel con el fin de evaluar la posible presencia de diferentes isoformas en las partes de la planta y considerando también el efecto que podía tener la composición de la matriz de extracción.
Algunos procedimientos sugieren el uso adicional de PVPP (polivinil polipirrolidona) durante la extracción de esta enzima, con el fin de eliminar completamente los compuestos fenólicos que pueden actuar como inhibidores de la misma (7 y 10). Para evaluar el efecto que presentaba este polímero en la extracción de la PAL, bajo las condiciones ya seleccionadas hasta este punto, se compararon los niveles de actividad con y sin la adición de este compuesto. Los tratamientos ensayados se encuentran resumidos en la Tabla 4.
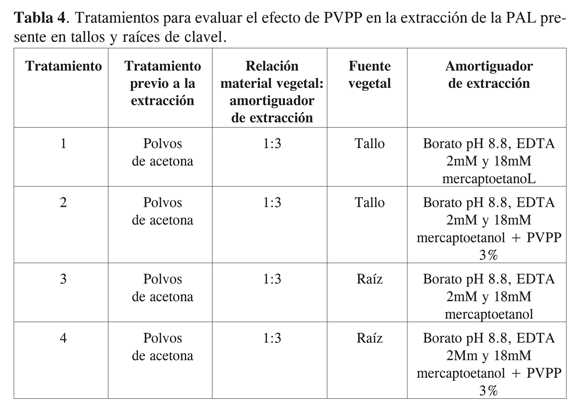
Selección de condiciones para determinar la actividad de la PAL en extractos obtenidos a partir de tallos y raíces de clavel
Una vez escogida la metodología para la extracción de la enzima a partir de tallos y raíces de clavel, se evaluaron las condiciones adecuadas para la determinación de su actividad. Para ello, con extractos obtenidos bajo las condiciones seleccionadas previamente, se determinó el efecto que presentaban parámetros como la concentración de sustrato, pH, temperatura y tiempo de reacción. Dichos ensayos se realizaron para extractos obtenidos tanto de tallos como de raíces de manera independiente. Para cada parámetro evaluado, cada una de las determinaciones de actividad se realizó por duplicado. Se contaba en este punto con un ensayo discontinuo usando fenilalanina como sustrato, a una concentración final de 5 mM en un amortiguador borato 60 mM a pH 8,8. Tanto la mezcla de reacción como los blancos correspondientes se mantenían a 37 ºC por 1 hora, para posteriormente detener la reacción con un calentamiento por 10 min a 80 ºC. De acuerdo con ensayos previos, se seleccionó que la relación enzima-sustrato más conveniente para la cuantificación de esta enzima tanto en tallos como en raíces era de 50 µL de extracto en una mezcla de reacción (15 µg de proteína aproximadamente) con un volumen final de 450 µL. Posteriormente, bajo las condiciones experimentales anteriormente descritas, se determinó la concentración de sustrato que generaba los mejores resultados en cuanto a actividad específica. Para ello se mantuvieron constantes los demás parámetros y la concentración de fenilalanina se varió en el rango de 5 mM a 50 mM.
Determinada la mejor relación enzima- sustrato, y manteniendo los demás parámetros constantes, se evaluó el efecto del pH en la reacción. Con este fin, se utilizaron los amortiguadores acetato de sodio-ácido acético a pH 4,0, citrato de sodio – ácido cítrico en el rango de 4 a 6; el amortiguador Na2HPO4- NaH2PO4 en el rango de 6,0 a 8,0, el amortiguador borato pH 9, glicina – NaOH a pH 10 y Na2HPO4- Na3PO4 a pH 11.
Con el pH y la relación enzima-sustrato seleccionados, se evaluó el efecto de la temperatura en la actividad enzimática. Para tal fin se determinaron las actividades enzimáticas a 0, 21, 37, 45, 55, 64, 81 y 90 ºC, y se escogió la que presentó los mayores niveles. Por último, se evaluó el tiempo óptimo de reacción determinando, con los parámetros previamente seleccionados (relación enzima-sustrato, pH y temperatura), la actividad para los tiempos 0, 10, 20, 30, 45 y 60 min.
Evaluación de la inducción de la PAL en el ensayo in vivo, usando como elicitor extracto crudo del hongo
Con el fin de evaluar el efecto del tratamiento con elicitores obtenidos de Fusarium oxysporum f. sp. dianthi raza 2 en la actividad de la enzima en estudio a nivel del tallo, se dispuso de un diseño experimental totalmente aleatorizado con 4 tratamientos (T1 variedad tolerante control, T2 variedad tolerante inoculada, T3 variedad tolerante aspersión y T4 variedad tolerante inmersión), con muestreos a las 0, 6, 12, 24, 48, 96 y 192 horas posinoculación. El tratamiento con la fracción cruda del hongo, se realizó por aspersión sobre los tallos de los esquejes y por inmersión de las raíces. Con el tratamiento de inmersión (T3) se buscaba simular las condiciones de inoculación que son propias del patógeno en su interacción natural con la planta. A su vez, el tratamiento con aspersión (T4) pretendía evaluar la factibilidad de una inducción mediante un tratamiento externo que asemejara las condiciones usadas en campo para la aplicación de productos usados como parte del control de plagas. Los esquejes sometidos a los diferentes tratamientos se mantuvieron bajo las mismas condiciones de temperatura, iluminación y humedad. La extracción se realizó con triplicado para cada tratamiento. La cuantificación de la actividad se hizo por duplicado en cada uno de los extractos obtenidos usando las condiciones previamente seleccionadas.
El análisis estadístico de los resultados se llevó a cabo mediante un análisis sencillo de varianza (Anova) usando la prueba de Tuckey para asignar grupos estadísticamente similares.
RESULTADOS Y DISCUSIÓN
Selección de condiciones para la extracción de PAL a partir de tallos y raíces de clavel
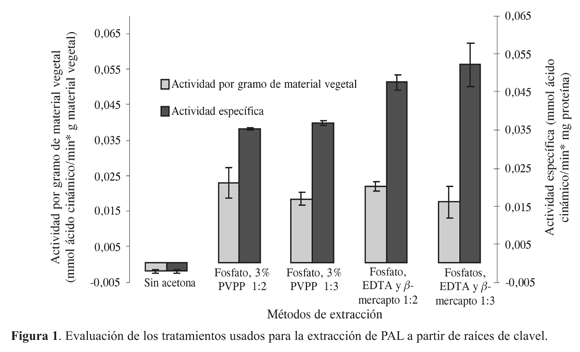
Para evaluar la actividad enzimática de PAL durante el ensayo in vivo, se requerían unas condiciones favorables y confiables tanto para su extracción como para su cuantificación en extracto crudo. Es por ello que los primeros ensayos realizados en el presente estudio pretendían evaluar cuál era el efecto de la utilización de los polvos de acetona y cuál procedimiento general era el adecuado para la extracción de la enzima de interés a partir de tallos y raíces de clavel. En este punto es importante citar que, aunque el ensayo evaluó la inducción solo a nivel del tallo, la evaluación de condiciones de extracción y cuantificación en raíces pretendía comparar con lo encontrado en tallo y de esta manera indagar acerca de la posible presencia de diferentes isoformas en estos dos órganos. La utilización de los polvos de acetona es determinante para poder llevar a cabo una adecuada extracción de esta enzima a nivel de la raíz (Figura 1). Dicho tratamiento elimina de manera eficiente los fenólicos y pigmentos que interfieren durante la cuantificación espectrofotométrica del ácido cinámico generado durante el ensayo de actividad. Se puede observar, además, que con los tratamientos 4 y 5 se presentan mejores resultados en cuanto a la selectividad de la extracción, pues la actividad por mg de proteína es mayor al compararla con los demás tratamientos, al nivel de significancia trabajado (=0,05). No existen diferencias en cuanto a la relación material vegetal: amortiguador de extracción; la relación 1:3 fue la seleccionada para realizar los ensayos en el tallo.
Los resultados obtenidos en el tallo (figura 2) coinciden con lo encontrado previamente en la raíz e indican que la extracción de esta enzima en clavel se ve favorecida al usar aditivos que comúnmente se utilizan para la extracción de algunas enzimas en diferentes fuentes vegetales.
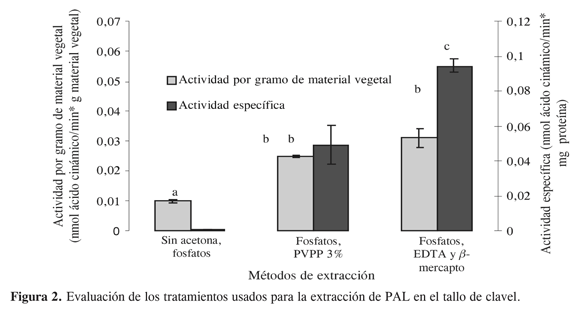
Por ejemplo, se reporta frecuentemente el uso de beta mercaptoetanol para la extracción de enzimas que presenten grupos sulfidrilo libres. Estos aditivos, a su vez, además de dar mayor estabilidad a la enzima en solución, hacen que la extracción pueda llevarse a cabo de manera más selectiva.
Una vez se seleccionaron estas condiciones, se dispuso evaluar, tanto en tallos como en raíces, el efecto del pH del amortiguador usado durante la extracción (Figura 3). La evaluación se llevó a cabo tanto en tallos como en raíces de manera conjunta con fines comparativos. En este ensayo se mantienen constantes los aditivos previamente seleccionados y las condiciones de extracción previamente descritas.
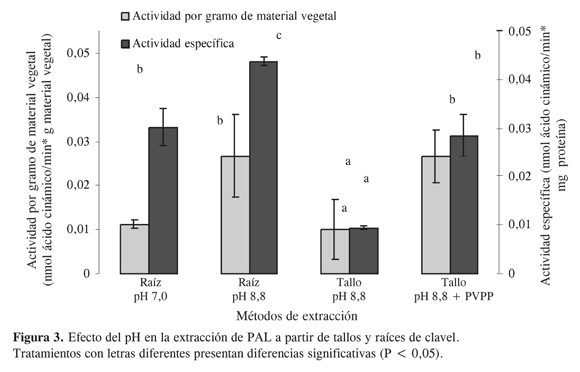
Los resultados indican que el pH de mayor extracción fue de 8,8 tanto para tallos como para raíces, el cual coincide con los pH de extracción usados para este tipo de enzimas (13) e indica, además, que es probable que las isoenzimas de la PAL en clavel presenten pI ácidos. Afirmación sustentada por la tendencia de proteínas con puntos isoeléctricos menores de 7 a presentar una alta carga y por ende importante solubilidad a pH básico. Por otro lado, tal y como se describe en la parte experimental, también se evaluó el efecto que tiene el PVPP en el proceso de extracción (Figura 4).
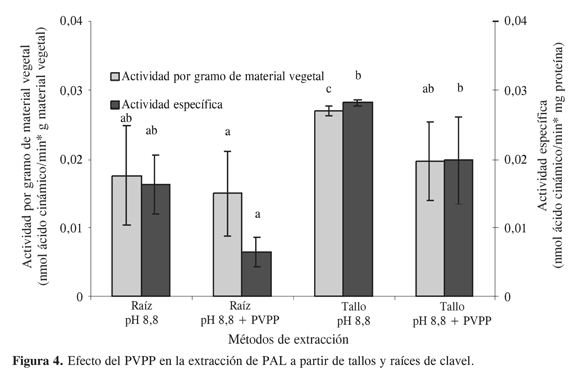
El PVPP se utiliza frecuentemente para la extracción de proteínas que presentan interferencia con compuestos fenólicos, teniendo en cuenta la capacidad que presenta para retener este tipo de compuestos. Como se puede observar en la Figura 4, en raíces la utilización de PVPP en el amortiguador de extracción disminuye la actividad. Esta disminución indica que es probable que los residuos de tipo aromático que se presentan en las enzimas PAL de clavel generen una retención de la proteína en este polímero insoluble y una posterior disminución en los niveles finales de actividad en el extracto. Dichos residuos aromáticos que, de acuerdo con el análisis de aminoácidos de la secuencia de PAL1 en clavel (BAB19128.1) con la herramienta bioinformática pepstat de EMBOSS, son el 9% de la secuencia primaria, se encuentran principalmente en dominios altamente conservados para este tipo de enzimas, que son característicos de la familia de PAL presentes en diferentes plantas y microorganismos (Conserved Domain 00332 en la base de datos del NCBI). De acuerdo con los alineamientos realizados con las secuencias que presentan este dominio y la secuencia de la enzima PAL1 de clavel (BAB19128.1), estos a.a. se mantienen en esta última y es probable que cumplan un papel funcional en este tipo de enzimas, justificando aun más el efecto inactivador de la PVPP. Por otro lado, al menos con los ensayos realizados a este punto, es evidente que no existen muchas diferencias entre las enzimas presentes en tallos y raíces. Es por ello que las condiciones finales seleccionadas y recomendadas para la extracción de esta enzima a partir de tallos y raíces de clavel consisten en un tratamiento con acetona a –15 ºC al material vegetal macerado con nitrógeno líquido y una posterior extracción en una relación 1:3 con el amortigudor borato pH 8,8 que contiene EDTA 2 mM y beta mercaptoetanol 18 mM.
Selección de condiciones para la cuantificación de PAL en extractos obtenidos a partir de tallos y raíces de clavel
Una vez determinadas las condiciones de extracción de esta enzima, se seleccionaron las mejores para su cuantificación. Tal y como se describe en la metodología, se evalúan diferentes parámetros con el fin de optimizar el ensayo enzimático. Los resultados obtenidos para la enzima PAL de los diferentes parámetros evaluados en tallos y raíces de clavel se resumen en la Figura 5.
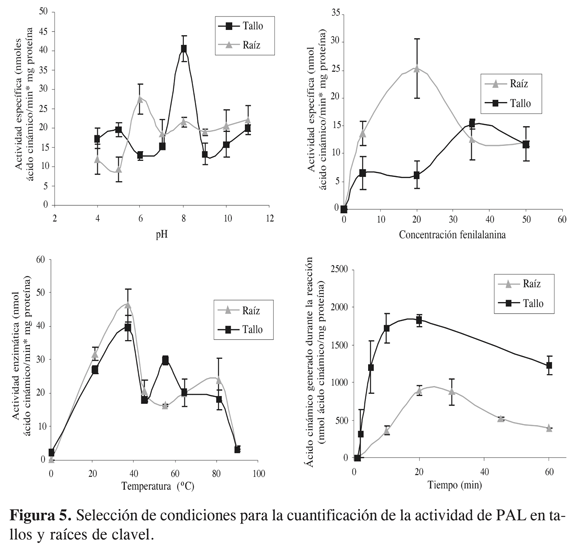
Como se puede observar en la Figura 5, el comportamiento de la actividad con respecto a los valores de temperatura de reacción es similar para extractos obtenidos de los dos órganos de la planta en estudio, siendo mayores en un valor de 37 ºC, temperatura frecuentemente reportada como óptima para este tipo de enzimas (5 y 16). Sin embargo, para los otros parámetros evaluados, se presentan diferencias importantes entre tallos y raíz lo que indica que es probable, tal y como ha sido reportado en otras fuentes vegetales (8 y 17), que en clavel se presenten diferencias en cuanto a las isoenzimas en estos dos órganos. Los valores seleccionados con estos ensayos para la cuantificación de la actividad en extractos obtenidos a partir de tallo son: concentración de sustrato 35 mM, pH 8,0, temperatura 37 ºC y tiempo de reacción de 10 min. Estos resultados son similares a los encontrados en otras fuentes vegetales, como es el caso del pH, en donde 8,8 es el valor más frecuentemente encontrado como óptimo para PAL de plantas (13, 14 y 15). A su vez, para raíz esta evaluación generó los siguientes resultados: concentración de sustrato 20 mM, pH 6,0, temperatura 37 ºC y tiempo de reacción de 20 min. Este conjunto de resultados permite evidenciar que es probable que exista una expresión diferencial de isoformas de la PAL en tallos y raíces de clavel, lo cual estaría de acuerdo con reportes generados por el grupo del japonés Yoshimoto (18), quienes realizando ensayos de Southern Blot encontraron al menos 5 isoformas para esta enzima en clavel. Con el fin de confirmarlo se requieren análisis electroforéticos de las diferentes isoformas en los extractos obtenidos de estos dos órganos. Por otro lado, estos resultados confirman también que es necesario realizar este tipo de estudios para llevar a cabo evaluaciones confiables de la actividad enzimática en diferentes órganos, a pesar de que se trate de un mismo genotipo vegetal.
Evaluación de la inducción de la PAL durante el tratamiento con el extracto del patógeno
En este punto se cuenta con un conjunto de condiciones que permiten no solo realizar la mayor extracción de la enzima, sino cuantificar la actividad de esta enzima de manera confiable. Con las condiciones seleccionadas, los resultados de la evaluación de la actividad enzimática de la PAL en los diferentes tratamientos de inducción propuestos para los diferentes tiempos de muestreo, se presentan resumidos en la Figura 6. En estos se puede observar que los niveles de la enzima PAL se mantienen con cambios moderados la mayor parte del tiempo de estudio para el tratamiento control (T1, a excepción de las 96 horas), lo cual indica que las condiciones ambientales del ensayo no afectaron los procesos en los que se encuentra involucrada esta enzima. Este hecho permite evidenciar que la utilización de estos controles se hace necesaria con el fin de asegurar que los resultados encontrados se presenten debido exclusivamente al fenómeno que se quiere evaluar y no debido a las condiciones externas del ensayo.
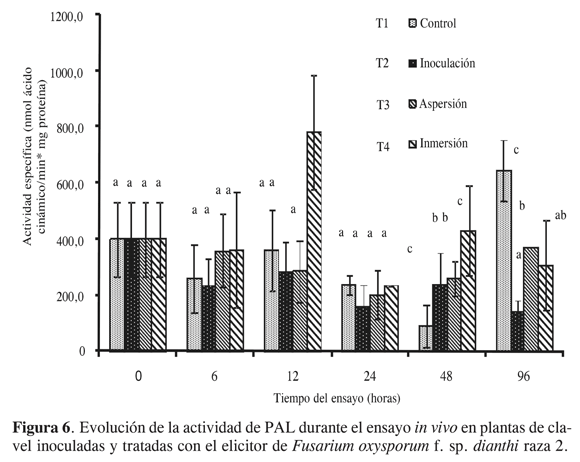
Con respecto a los resultados obtenidos en este ensayo, se puede evidenciar que los niveles de actividad en el tallo para esquejes de la variedad tolerante permanecen constantes a lo largo del estudio, en todos los tiempos de muestreo, tanto para controles “T1” como para plantas inoculadas con el patógeno “T2”. Estos resultados indican que la activación de la ruta fenilpropanoide como parte de la respuesta ante el ataque del patógeno a nivel del tallo es inexistente, al menos en los tiempos evaluados y con la variedad tolerante usada. Este ensayo muestra que cuando la acumulación de compuestos fenólicos se presenta a nivel del tallo durante el ataque del patógeno (19), puede deberse a la activación de otras rutas metabólicas de biosíntesis diferentes a la fenilpropanoide, fenómeno que se ha propuesto recientemente en otras especies vegetales (20). Por otro lado, como se puede observar en los tratamientos T3 y T4, mientras que el tratamiento con aspersión no generó cambios en la actividad de la PAL, a ninguno de los tiempos evaluados, el tratamiento de inmersión de las raíces en el extracto del hongo (T4) presentó una inducción estadísticamente mayor a las 12 h posinoculación. Este efecto se presentó de manera exclusiva con esta técnica de elicitación, e indica que con la otra técnica (aspersión) no se tiene ningún efecto sobre la actividad de la enzima. La inmersión de las raíces en el extracto crudo del hongo, que se asemeja a la técnica de inoculación usada para evaluar los efectos relacionados con la infección (21), permite que en el punto natural de contacto del patógeno, la raíz, se perciban el conjunto de elicitores que se encuentran en el extracto crudo del patógeno. Resultados similares en otros modelos que involucran patógenos del género Fusarium han mostrado también inducción de la ruta fenilpropanoide ante tratamientos similares con fracciones crudas del patógeno (5). En estos estudios también se ha encontrado que, a pesar de que la naturaleza química de las moléculas con actividad elicitora puede ser muy variada, los carbohidratos podrían ser determinantes para que se presente esta actividad en extractos crudos de este tipo de patógenos (5). Es importante destacar que, de acuerdo con este estudio, en el modelo clavel-Fod estos elicitores generan una inducción que se presenta únicamente durante el tratamiento con el extracto crudo, mas no con el patógeno directamente, lo cual indica que existen mecanismos particulares de regulación de la planta o supresión por parte del patógeno, que pueden en un momento dado determinar la expresión final de la inducción de la respuesta de defensa y que son regulados negativamente ante la presencia del patógeno. Fenómenos como la acción de supresores de mecanismos de defensa han sido involucrados en este tipo de comportamientos (22).
CONCLUSIÓN
En este estudio se evidencia la complejidad de los procesos de reconocimiento del patógeno Fusarium oxysporum f. sp. dianthi, agente causal del marchitamiento vascular en el clavel. Dichos procesos a su vez determinan que se presente en un momento dado la expresión final de la respuesta de defensa que tiene como objetivo localizar el patógeno y detener su avance a través de los tejidos de la planta. Con estos resultados se evidenció además la capacidad que tiene el clavel para reconocer elicitores del patógeno y el papel de estos últimos para inducir en la planta una respuesta relacionada con defensa. La complejidad de estos procesos confirma que estudios encaminados a su elucidación son fundamentales en la búsqueda de los fenómenos bioquímicos de defensa que presentan algunas variedades de clavel ante el ataque por este patógeno.
REFERENCIAS BIBLIOGRÁFICAS
1. Dixon, R. A.; Pavia, N. L. Stress- induced phenylpropanoid metabolism. Plant Cell. 1995. 7: 1085- 1097. [ Links ]
2. Alain-M., B. Lignins and lignification: Selected issues. Plant Physiol. Biochem. 2000. 38: 81-96. [ Links ]
3. Mohammadi, M.; Kamesi, H. Changes in peroxidase and polyphenol oxidase activities in susceptible and resistant wheat heads inoculated whit Fusarium graminearum and induced resistance. Plant Science. 2002. 162: 491-498. [ Links ]
4. Heather M. Way, Kemal Kazan, Neena Mitter, Kenneth C. Goulter, Robert G. Birch and John M. Manners. Constitutive expression of a phenylalanine ammonia-lyase gene from Stylosanthes humilis in transgenic tobacco leads to enhanced disease resistance but impaired plant growth. Physiological and Molecular Plant Pathology. 2002. 60: 275-282. [ Links ]
5. Modafar, El; Tantaoui, A.; Boustani, El. Differential induction of Phenylalanine ammonia-liase activity in date palm roots in response to inoculation with Fusarium oxysporum f. sp. albedinis and to elicitation with fungal wall elicitor. Journal of Plant Physiology. 2001. 158: 715-722. [ Links ]
6. Higuera, B. L. Contribución al estudio de la participación de los compuestos fenólicos en los mecanismos de la interacción clavel Dianthus caryophyllus L-Fusarium oxysporum f. sp. dianthi. 2001. Tesis de doctorado en Química. Universidad Nacional de Colombia. Bogotá. [ Links ]
7. Ardila, H. D.; Higuera, B. L. Inducción diferencial de Polifenol oxidasa y -1,3-glucanasa en clavel (Dianthus caryophyllus L.) durante la infección por Fusarium oxysporum f. sp. dianthi raza 2. Acta Biológica Colombiana. 2005. 10: 65-78. [ Links ]
8. Cochrane, F. C.; Davin, L. B.; Lewis, N. G. The Arabidopsis phenylalanine ammonia liase gene family: Kinetic characterization of the four PAL isoformas. Phytochemistry. 2004. 65: 1557-1564. [ Links ]
9. Dubois, M.; Gilles, K. A.; Hamilton, J. K.; Rebers, P. A.; Smith, F. Colorimetric method for determination of sugars and related substances. Anal. Chem. 1956. 28: 350-355. [ Links ]
10. Alunni, S.,; Cipiciani, A.; Fiorini, G.; Ottavi, L. Mechanisms of inhibition of phenylalanine ammonia-lyase by phenol inhibitors and phenol/ glycine synergistic inhibitors. Archives of Biochemistry and Biophysics. 2003. 412: 170-175. [ Links ]
11. Bradford, M. A. A rapid and sensitivity method for detection of binding- dye proteins. Anal. Biochem. 1976. 72: 248-254. [ Links ]
12. Zor and Sellinger. Linearization of the Bradford protein assay increases its sensitivity: Theorical and experimental studies. Anal. Biochem. 1996. 236: 302. [ Links ]
13. Camacho, J. J.; Anzelloti, D.; González-Fontes, A. Changes in phenolic metabolism of tobacco plants during short-term boron deficiency. Plant Physiol. Biochem. 2002. 40: 997-1002. [ Links ]
14. Yuan, Y. J.; Li, C.; Hu, Z. D.; Wu, J. C.; Zeng, A. P. Fungal elicitor- induced cell apoptosis in suspension cultures of Taxus chinensis var. mairei for Taxol production. Process Biochemistry. 2002. 38: 193-198. [ Links ]
15. De Ascensao, A. R. C. F.; Dubery, I. A. Panama disease: cell wall reinfoncement in Banana roots in response to elicitor from Fusarium oxysporum f. sp. cubense race four. Phytopathology. 2000. 90: 1173-1180. [ Links ]
16. Silva, M. C.; Nicol, M.; Guerra- Guimaraes, L.; Rodríguez, C. J. Hypersensitive cell death and post-haustorial defence responses arrest the orange rust (Hemileia vastatrix) growth in resistant coffee leaves. Physiological and Molecular Plant Pathology. 2002. 60: 169-183. [ Links ]
17. Kumar, A.; Ellis, B. E. The Phenylalanine Ammoinia-Lyase Family in raspberry. Structure expression and evolution. Plant Physiology. 2001. 127: 230-239. [ Links ]
18. Yoshimoto, Y.; Higeta, D.; Ito, Y.; Yoshida, H.; Hasebe, M.; Oseki, Y. Isolation and characterization of a c-DNA for Phenylalanine Ammonium Liase (PAL) from carnation (Dianthus caryophyllus L.). Plant Biotechnology. 2000. 17: 325-329. [ Links ]
19. Niemann, G. J.; Boon, J. J.; Pureveen, J. B. M.; Eijkel, G. B.; Van der Heijden, E. A microanalytical approach to plant tissue characterization: a comparative study of healthy and fungus- infected carnation by pyrolysis- mass spectrometry. J. Anal. and Appl. Pyrolysis. 1991. 19: 213-236. [ Links ]
20. Quiong, Y.; Shi, M.; Ng, J.; Wu, Y. Elicitor-induced rosmarinic acid accumulation and secondary metabolism enzyme activities in Salvia miltiorrhiza hairy roots. Plant Science. 2006. 170: 853-858. [ Links ]
21. Higuera, B. L.; Montes de, G. V. Contribution of HPLC to the study of the defence mechanisms acting in carnation (Dianthus caryophyllus L.) roots on infection with Fusarium oxysporum f. sp. dianthi. Journal of High Resolution Chromatography. 1996. 19: 706-708. [ Links ]
22. Ballester, A. R.; Lafuente, M. T.; González-Candelas, L. Spatial study of antioxidant enzymes, peroxidase and phenylalanine ammonia-lyase in the citrus fruit - Penicillium digitatum interaction. Postharvest Biology and Technology. 2006. 39: 115-128. [ Links ]














