Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804On-line version ISSN 2357-3791
Rev.Colomb.Quim. vol.36 no.2 Bogotá July/Dec. 2007
APLICACIÓN DE ENDOPEPTIDASA ALCALINA EN CARNAZA BOVINA PARA MEJORAR LA CALIDAD DE LA GELATINA
APPLICATION OF ALKALINE ENDOPEPTIDASE IN BOVINE HIDE TO IMPROVE THE QUALITY OF THE GELATINE
APLICAÇÃO DA ENDOPEPTIDASE ALCALINA NA PELE BOVINA PARA MELHORAR A QUALIDADE DA GELATINA
Liliana Serna-Cock1, Darío Pineda-Cuervo2, Alfredo Ayala-Aponte3
1 Facultad de Ingeniería y Administración, Universidad Nacional de Colombia, sede Palmira, Palmira, Colombia. lserna@palmira.unal.edu.co
2 Productora de Gelatina S. A. (Progel). pinda6@hotmail.com
3 Facultad de Ingeniería, Universidad del Valle, Cali, Colombia. alfayala@univalle.edu.co
Recibido: 23/01/07 – Aceptado: 10/08/07
RESUMEN
El precio de la gelatina en el mercado internacional está determinado por sus propiedades físico-químicas que dependen a su vez de la materia prima, de la forma de extracción del colágeno y de su método de concentración. En este estudio, utilizando procesos de producción en planta piloto de gelatina tipo B, se evaluó el efecto de la aplicación de una endopeptidasa alcalina en el pretratamiento de tres tipos de carnaza bovina sobre la calidad final de la gelatina medida como bloom, viscosidad y claridad. Los resultados se compararon con procesos en los cuales se utilizaron las mismas materias primas sin pretratamiento enzimático. Los análisis estadísticos mostraron diferencias significativas entre los tratamientos. Los mejores resultados de bloom, viscosidad y claridad se presentaron utilizando la enzima en el pretratamiento de la carnaza entera; en trece horas de proceso se obtuvo el 61,5% de la gelatina con bloom alto superior a 300 g, el 51,3% con viscosidades altas mayores de 42 mp y el 82,1% con claridades altas menores de 39 unidades nefelométricas de turbidez. La carnaza entera sin pretratamiento enzimático presentó el 41% de valores altos de bloom, el 7,7% de viscosidades altas y el 76,9% de claridades altas.
Palabras clave: gelatina, proteasa, carnaza.
ABSTRACT
The international market price of gelatine is determined by its physical–chemical properties, that depend on the raw material, the collagen extraction method and the concentration method. In this work, using class B gelatine production processes in pilot plant, the effect of application of alkaline endopeptidase was evaluated in the pre-treatment of three types of bovine hide on the gelatine final quality as measured by bloom, viscosity and clarity. The results were compared with processes in which the same raw materials were used without enzymatic pre-treatment. The statistical analysis showed significant differences among the treatments. The best bloom, viscosity and clarity results were presented using enzymatic pre- treatment in the whole hide, obtained in thirteen hours of process 61.5% of the gelatine with bloom higher than 300g, 51.3% with viscosities values higher than 42 mp and 82,1% with high clarities value, with values lower than 39 nephelometric turbidity units. The whole hide without enzymatic pre-treatment showed 41% of high values of bloom, 7.7% of high viscosities and 76.9% of high clarities.
Key words: gelatina, protease, bovine hide.
RESUMO
O preço da gelatina no mercado internacional é determinado pelas suas propriedades físico-químicas as quais dependem da matéria-prima, da forma de extração do colágeno bovino e do método de concentração. Neste estudo, utilizando processos de produção em planta piloto de gelatina tipo B, foi avaliado o efeito da aplicação da protease alcalina no pré-tratamento de três tipos de pele bovina sobre a qualidade final da gelatina determinada como bloom, viscosidade e transparência. Os resultados foram comparados com processos nos quais se utilizaram as mesmas matérias-primas sem pré-tratamento enzimático. As análises estatísticas mostraram diferenças significativas entre os tratamentos. Os melhores resultados de bloom, viscosidade e transparência foram obtidos utilizando protease alcalina no pré-tratamento da pele inteira, se obtendo em treze horas do processo o 61,5% de gelatina com bloom alto superior a 300 g, o 51,3% com viscosidades altas maiores a 42 mp e o 82,1% com transparências altas menores a 39 unidades nefelométricas de turbidez. A pele inteira sem pré-tratamento enzimático apresentou o 41% dos valores altos de bloom, o 7,7% de viscosidades altas e o 76,9% de transparências altas.
Palavras-chave: gelatina, protease, pele.
INTRODUCCIÓN
La gelatina es una mezcla heterogénea de proteínas de alto peso molecular, solubles en agua, de diferentes puntos isoeléctricos y diferentes propiedades de gelificación; la cual se obtiene comercialmente por hidrólisis selectiva del colágeno (1). Comercialmente, el colágeno se extrae del tejido conectivo de pieles procedentes de bovinos (carnaza), cerdos, pescado y huesos de animales, y más recientemente algunos autores plantean la posibilidad de producir gelatina recombinante a partir de microorganismos genéticamente modificados para eliminar las variables asociadas al uso de material de tejidos (2, 3).
En la producción de gelatina a partir de tejidos su calidad y rendimiento están determinados por propiedades físico-químicas como bloom, viscosidad y claridad que dependen a la vez de la materia prima y su pretratamiento, del método de extracción del colágeno, del número de enlaces rotos en las moléculas de colágeno original, del pH, la temperatura empleada en la extracción y del número de electrolitos en el material resultante (2, 4, 5). La naturaleza del pretratamiento de la materia prima determina la caracterización de la gelatina en “tipo A” cuando el pretratamiento se lleva a cabo con ácido, y en “tipo B” cuando el pretratamiento se realiza con álcali (5).
Lo que se busca con estos pretratamientos es eliminar el material no colagenoso de la materia prima, hinchar las partículas fibrosas de colágeno y debilitar las uniones de las cadenas proteicas por hidrólisis topoquímica, de modo que en la conversión a gelatina por agua caliente y vapor se produzca la ruptura final de uniones covalentes presentes en las moléculas de tropocolágeno, conservando la proteína un elevado peso molecular (4). En los procesos de producción de gelatina tipo B, para reducir el tiempo de pretratamiento de la materia prima, se ha propuesto el uso de enzimas (6). Las endopeptidasas cumplen esta función ya que son proteasas que hidrolizan las cadenas peptídicas en las regiones internas alejadas de los extremos carboxi y aminoterminal (7), y aunque hidrolizan selectivamente los constituyentes no colagenosos de la piel, eliminan las proteínas no fibrilares como albúminas y globulinas (8), y han sido utilizadas rutinariamente en la elaboración de quesos, hidrolizados de soya, elaboración de pan (8, 9, 10, 11, 12), producción de dipeptidos (13) y tripeptidos (14); existen escasos reportes en la literatura científica acerca del efecto que tiene el uso de endopeptidasas en el pretratamiento de materias primas sobre la calidad de la gelatina en polvo.
Por lo anterior, en este trabajo se evaluó, en la manufactura de gelatina tipo B, el efecto de utilizar una endopeptidasa alcalina en el pretratamiento de carnaza entera, en mezclas de 50:50 de carnaza entera y carnaza desorillo-sebo y en mezclas 50:25:25 de carnaza entera, carnaza desorillo-sebo y carnaza seca, respectivamente, sobre la calidad de la gelatina en polvo seca obtenida en trece horas de proceso. La calidad de la gelatina se estableció en términos de bloom, viscosidad y claridad.
MATERIALES Y MÉTODOS
Materia prima y enzima
Como materia prima se utilizó carnaza bovina entera, mezclas de 50:50 de carnaza entera y carnaza desorillo-sebo, respectivamente, y mezclas de 50:25:25 de carnaza entera, carnaza desorillo-sebo y carnaza seca, respectivamente. La carnaza provenía de bovinos cebú de la costa Atlántica (Colombia) en edad promedio de 2,5 años. Para el pretratamiento de la materia prima se utilizó una endopeptidasa alcalina del tipo serina, la cual se obtiene comercialmente a partir de una variedad alcalofílica de Bacillus licheniformis mediante fermentación sumergida; esta enzima se conoce comercialmente como esperasa® 8.0 L de Novo, Estados Unidos. Para todos los casos la materia prima se sometió a procesos en discontinuo de producción de gelatina tipo B.
Pretratamiento de materias primas
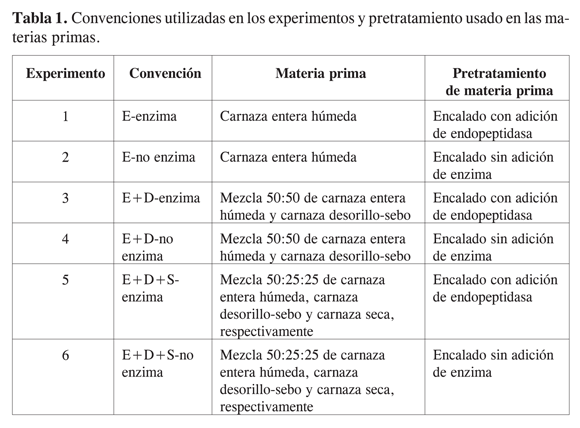
En la Tabla 1 se describen las convenciones utilizadas en los experimentos y el pretratamiento empleado en las materias primas. Para cada uno de los experimentos se emplearon 7 toneladas de carnaza y temperatura de 20 ºC.
La carnaza entera y la carnaza desorillo- sebo se cortaron por separado en cuadros de 10 x 10 cm y se lavaron durante dos horas con agua tratada mediante acción física de golpeo. La materia prima se cargó en tanques de concreto (redondos con agitación tipo paleta), de acuerdo con las mezclas descritas en la Tabla 1, y después se sometió a proceso de encalado durante 20 o 30 días dependiendo de la aplicación o no de enzima, respectivamente; el encalado se realizó adicionando 36 kg de CaO al 60% por tonelada de carnaza.
La carnaza seca se cortó en cuadros de 10 x 10 cm y se humectó por remojo durante 28 días con 214 kg de CaO al 60% por tonelada de carnaza, y 13,7 kg de sulfuro de sodio comercial ácido del 62,5% por tonelada de carnaza seca antes de ser sometida al proceso de encalado.
Transcurridos 10 días de encalado, a la mitad de los tanques de experimentación se les adicionó 250 mg de enzima en solución por kilogramo de carnaza a una concentración de 250 ppm; el mismo tratamiento enzimático se repitió a los 15 días de encalado y la enzima se dejó actuar por 5 días más. Los tanques que no recibieron tratamiento enzimático se dejaron en encalado durante 30 días con un pH de 12,6 mediante adición de CaO en exceso.
Transcurrido el tiempo de encalado, se lavó la carnaza con agua hasta alcanzar un pH de 11,3 durante 12 horas; posteriormente se realizó el proceso de desencalado utilizando H2SO4 hasta obtener un pH de 1,85 ± 0,05; este pH se mantuvo por 10 horas (acidulación). En el desencalado se adicionó además bisulfito de sodio en una proporción de 3 kg/ton, como agente blanqueador. Finalmente la materia prima se lavó con agua durante 12 horas, hasta conseguir un pH de 3,0.
Conversión de colágeno a gelatina
La gelatina se obtuvo por la solubilización del colágeno mediante la adición controlada de agua caliente. Para la extracción del colágeno, la materia prima pretratada se transportó por gravedad a tanques de acero inoxidable, se dejó escurrir y se le adicionó agua a 80 ºC con recirculación durante 35 minutos haciéndola pasar por un precalentador de vapor. La materia prima se dejó en reposo hasta alcanzar 30 ºC. Posteriormente se realizó el proceso de extracción controlada del colágeno utilizando agua a 80 ºC durante 16 horas. Se mantuvo un perfil térmico del extracto rico en colágeno que inició con 38 ºC y se aumentó en un grado centígrado por hora durante las 12 primeras horas de proceso hasta alcanzar una temperatura de 50 ºC, la cual se mantuvo constante hasta completar 20 horas de extracción de colágeno. Con este procedimiento se obtuvo un extracto acuoso rico en colágeno del 3% de sólidos totales.
Refinación
Para eliminar partículas indeseables, el extracto acuoso rico en colágeno se centrifugó a 5200 g utilizando una centrífuga clarificadora-separadora de platos (Westfalia Samn 5036, Alemania), se filtró en un filtro de marcos y platos con lonas y tierras diatomáceas (Niro de 40 cm x 40 cm y de 20 m2, Alemania) y se sometió a intercambio iónico para remover la dureza del extracto (columna catiónica Lewatit S-100 y una columna aniónica con resina tipo gel Lewatit M-500, Alemania).
Concentración
El extracto acuoso refinado se concentró a 18% de sólidos totales mediante un evaporador de triple efecto de placas al vacío (APV, Estados Unidos), con un flujo de 2500 kg/h a una temperatura de entrada del producto de 80 ºC y de salida de 45 ºC, el pH se ajustó previamente a 4,7. El extracto concentrado se filtró y se concentró nuevamente hasta 30% de sólidos totales a un flujo de evaporación de 170 kg/h, con un flujo de alimentación de 424 kg/h, temperatura de esterilización de 150 ºC a una presión de vacío de 630 mm de Hg (6 segundos) en el separador flash; para esto se usó un concentrador paraflash de placas al vacío (APV, Estados Unidos).
Solidificación
El extracto concentrado se transportó mediante una bomba de pistones (modelo 28-35, Estados Unidos) con un motor de 1 hp y 35 bares de presión a un intercambiador de calor de superficie raspada tipo horizontal concéntrico (modelo GL 031A, Inglaterra), con una temperatura de –10 ºC y acondicionado con una placa con huecos para obtener un extracto sólido en tiras en forma de espagueti.
Secado, molienda y tamizado
Para obtener una distribución uniforme de lecho en el secador, el extracto en forma de espagueti se descargó sobre un conveyor oscilante provisto de una banda transportadora a una velocidad de 0,134 m/min. El secado se realizó en un secador de túnel con aire caliente cruzado (17000 m3/h, HR 25%) en seis zonas de secado a temperaturas ascendentes de 32, 36, 42, 48, 54 y 60 ºC.
La gelatina seca proveniente del secador se partió en pequeños trozos mediante un triturador de dientes helicoidales y, para disminuir el tamaño de partícula, los trozos de gelatina se transportaron mediante un tornillo sin fin a un molino de martillo rotatorio provisto de un tamiz malla 40 (425 micrones). De cada uno de los tratamientos se tomaron muestras de gelatina en polvo cada hora durante las primeras trece horas de proceso. Las muestras se sometieron a pruebas de calidad (bloom, viscosidad y claridad) por triplicado. Las condiciones de proceso descritas anteriormente obedecen a experiencias previas no publicadas.
Evaluación de la calidad
Los sólidos totales se midieron directamente en un refractómetro para gelatina (K-Patents Process Instruments, Estados Unidos).
Para medir el bloom (medida arbitraria definida en condiciones exactas prescritas de la capacidad de cualquier gelatina para formar un gel) se disolvieron 7,5 g de gelatina en polvo en 105 mL de agua destilada utilizando jarras de vidrio bloom; las jarras se sellaron con tapones de caucho y se dejaron en reposo por tres horas, posteriormente se llevaron a baño maría a 60 ºC durante 15 minutos y cada 5 minutos se agitaron. Las jarras se sacaron del baño y se dejaron a temperatura ambiente durante 15 minutos; posteriormente se pasaron a un baño termostático a 10 ºC durante 18 horas (15). Cumplido el tiempo, a cada una de las jarras se les midió la dureza del gel, utilizando un gelómetro (Stevens-L.F.R.A, Inglaterra). La medida de la dureza del gel se determinó como el peso requerido para mover el émbolo del gelómetro una distancia de 4 mm (cuanto más elevado es el valor del bloom, más sólido es el gel que se produce y menor es la cantidad de gelatina que ha de utilizarse para producir un gel de valor normalizado). El valor del bloom se clasificó de acuerdo con normas de mercado internacional (16), en las cuales el bloom se clasifica en alto, medio y bajo. El bloom alto se clasifica en A si su poder gelificante es mayor de 300 gramos y en B si su poder gelificante es de 276 a 299 gramos. El bloom medio se clasifica en tipo CA si su poder gelificante está entre 251 y 275 g y en tipo C si su poder gelificante está entre 226 y 250 g. El bloom bajo se clasifica en tipo D si su poder gelificante es menor de 250 g.
Para medir la viscosidad se disolvieron 7,5 gramos de gelatina en 105 mL de agua destilada, se llevaron al baño maría a 60 ºC por 15 minutos (15) y la solución se llevó a un viscosímetro tipo Ostwald (Estados Unidos) provisto de dos pipetas volumétricas calentadas a 60 ºC y calibradas con glicerina bidestilada de densidad 1,23. La solución se depositó en las pipetas del viscosímetro y se midió el tiempo que demoró la solución de gelatina en llegar a un punto de referencia. Para obtener los resultados se multiplicaron los tiempos leídos por la constante de cada pipeta volumétrica. Los resultados se expresaron como viscosidad en milipoises a una concentración de 6,66% y a una temperatura de 60 ºC. La viscosidad se clasificó según normas de mercado internacional (17). La viscosidad de una gelatina se clasifica, al igual que el bloom, en alta, media y baja. La viscosidad alta se presenta en valores mayores de 42 milipoises (mp), la viscosidad media en valores entre 37 y 41,9 mp y la viscosidad baja en valores menores de 36,9 mp (16).
Para medir la claridad se preparó una solución de 4% p/p, la cual se tuvo en baño maría a 42 ºC hasta completa disolución, y luego se sometió a lectura en un espectrofotómetro a 500 nm (Milton Roy 20D, Estados Unidos). La claridad de una gelatina en el mercado internacional se clasifica como de alta claridad si presenta un valor menor de 39 unidades nefelométricas de turbidez (UNT), de mediana claridad si tiene entre 39,5 y 67,5 UNT y baja claridad si muestra más de 68 UNT (16).
Diseño estadístico
Para determinar el efecto de adicionar enzima en el pretratamiento de diferentes mezclas de materia prima sobre la calidad del producto final, se empleó un diseño factorial completamente al azar de 3*2 con tres réplicas así:
Factores y niveles
Factor materia prima, con tres niveles: carnaza entera húmeda, mezcla 50:50 de carnaza entera húmeda y carnaza desorillo- sebo y mezcla 50:25:25 de carnaza entera húmeda, carnaza desorillo-sebo y carnaza seca, respectivamente.
Factor pretratamiento de materia prima con dos niveles: encalado con adición de esperasa® 8.0 L y encalado sin adición de esperasa® 8.0 L.
Las variables de respuesta fueron valor de bloom, viscosidad y claridad.
Los datos experimentales se estudiaron mediante un análisis de varianza utilizando el programa SAS. El diseño se analizó con un nivel de confianza del 95%.
RESULTADOS Y DISCUSIÓN
En las Figuras 1, 2 y 3 se muestran respectivamente los promedios de los valores de bloom, viscosidad y claridad durante las 13 primeras horas de proceso para los seis tratamientos. Los valores de bloom, viscosidad y claridad presentaron diferencias estadísticamente significativas entre los tratamientos con un nivel de confianza del 95%. En la Figura 1 se observa que al utilizar E-enzima los valores de bloom variaron entre 326 y 295 gramos durante trece horas; el 97,4% de la gelatina obtenida con este tratamiento presentó alto bloom; el 61,5% se clasificó como tipo A (mayor de 300 g) y el 35,9% como tipo B (299-276 g); el 2,6% restante se clasificó como gelatina tipo CA (bloom medio, entre 251 y 275 g). En contraposición, para el tratamiento E-no enzima los valores de bloom variaron entre 333 y 262 gramos, el 87,2% de la gelatina obtenida por este proceso presentó alto bloom (41% tipo A y 46,2% tipo B) y el 12,9% bloom medio (CA el 10,3% y C el 2,6%).
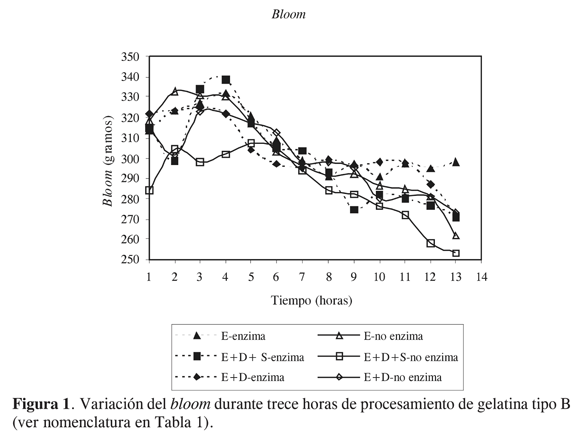
Cuando se utilizó E+D-enzima, los valores de bloom variaron entre 321 y 272 gramos, el 94,4% de esta gelatina presentó bloom alto (48,2% tipo A y 46,2% tipo B), 5,6% presentó bloom tipo CA. Con E+D-no enzima se obtuvo el 84,7% de gelatina de alto bloom (46,2% tipo A y 38,5% tipo B), el porcentaje restante fue gelatina tipo CA.
En el tratamiento E+D+S-enzima los valores de bloom fluctuaron entre 339 y 271 gramos; el 82,1% de esta gelatina presentó alto bloom (43,6% tipo A y 38,5% tipo B) y el 17,9% presentó bloom medio (tipo C). Con E+D+S-no enzima se obtuvo el 64,1% de gelatina de alto bloom (33,3% tipo A y 30,8% tipo B) y el 35,9% de gelatina de bloom medio (25,6% tipo CA y 10,3% tipo C).
Los bajos valores de bloom y viscosidad (ver Figuras 1 y 2) obtenidos en el tratamiento E+D+S-enzima y E+D+S-no enzima se explican por la adición de un 25% de carnaza seca dado que en su proceso de secado, por efectos de la temperatura, los taninos presentes en la carnaza penetran y se unen en forma irreversible al colágeno, lo cual ocasiona desnaturalización irreversible en las estructuras terciaria y secundaria del colágeno nativo, y esto disminuye notoriamente la viscosidad y el poder gelificante en su posterior conversión a gelatina (17).
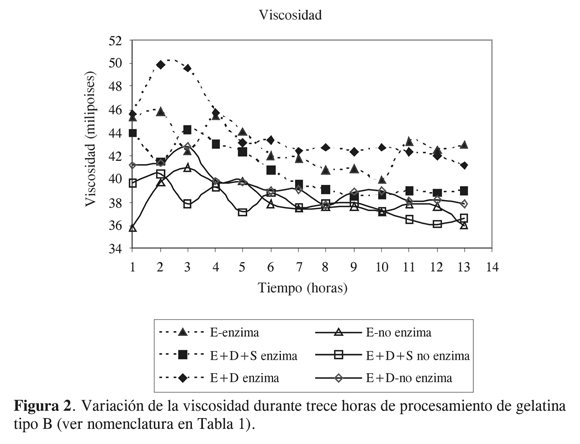
Con E-enzima se presentaron valores de viscosidad entre 45,4 y 39,9 mp durante 13 horas de proceso, de los cuales el 51,3% se consideraron viscosidades altas (mayor de 42 mp) y el resto de la producción se clasificó como viscosidades medias. En contraste con el tratamiento E-no enzima, los valores de viscosidad oscilaron entre 41 y 35,8 mp de los cuales solo el 7,7% se consideraron viscosidades altas y el 92,3% viscosidades medias (verFigura 2).
De igual manera en los tratamientos E+D-enzima y E+D+S-enzima se presentaron mayores viscosidades en comparación con E+D-no enzima y E+D+Sno enzima. El tratamiento E+D-enzima mostró un valor promedio de viscosidades de 43,7 mp y una desviación estándar de 2,5. El 74% de los datos analizados durante trece horas de proceso presentaron viscosidades mayores a 42 mp. En el tratamiento E+D+S-enzima hubo un promedio de viscosidad de 40,6 mp, el 28,2% de la producción durante las 13 horas de proceso presentó valores de viscosidad superiores a 42mp y el 71,8% estuvo entre 37 y 41,9 mp.
Los mayores valores de bloom y de viscosidad obtenidos con el uso de enzima se explican por la baja actividad proteolítica de la enzima frente al colágeno nativo, por la alta actividad proteolítica de la enzima sobre el colágeno desnaturalizado y por la especificidad de la enzima para romper selectivamente los enlaces cruzados intermoleculares presentes en las fibras de colágeno; esto permite que en la conversión de colágeno a gelatina las fibras de colágeno sufran menor encogimiento y desorganización, y la estructura helicoidal triple sufra menor colapso en sus subunidades polipeptidas, ya que el rompimiento de enlaces covalentes, enlaces intra e intermoleculares y enlaces peptídicos es más selectivo (18) comparado con el rompimiento de enlaces que experimenta la materia prima cuando solo se acondiciona en medio alcalino (19). La hidrólisis enzimática de estos enlaces permite conservar en mayor medida el diámetro aparente de las moléculas y por ende conservar su masa, tamaño, volumen, estructura, asimetría molecular y cargas eléctricas, y permite aumentar las interacciones proteínaproteína y las interacciones proteínaagua; esto se refleja en un aumento del poder gelificante y un incremento en el coeficiente de viscosidad. Estos resultados difieren de los obtenidos por Cole y McGillt (15), quienes al evaluar el efecto del acondicionamiento enzimático de pieles de animales de varias edades para la producción de gelatina encontraron que el pretratamiento enzimático no tenía ningún efecto sobre la viscosidad.
De otro lado, el rompimiento específico de los enlaces cruzados por acción enzimática permite, en el proceso de extracción del colágeno, que este sea más soluble en agua.
Analizando los respectivos rangos, desviaciones estándar y coeficientes de variación, se encontró que, utilizando endopeptidasa en el pretratamiento de carnaza entera y carnaza desorillo-sebo, se obtienen menores desviaciones estándar, y menores coeficientes de variación en la viscosidad de la gelatina durante las primeras 13 horas de proceso; estos resultados son de especial importancia para la industria farmacéutica en la elaboración de cápsulas duras donde se requiere que la viscosidad de soluciones de gelatina al 6,66% sea alta, lo que garantiza muy bajo porcentaje de descenso de la viscosidad en 24 horas (viscosidad breakdown). Es de anotar que la gelatina con estas características tiene un mayor precio en el mercado internacional (20).
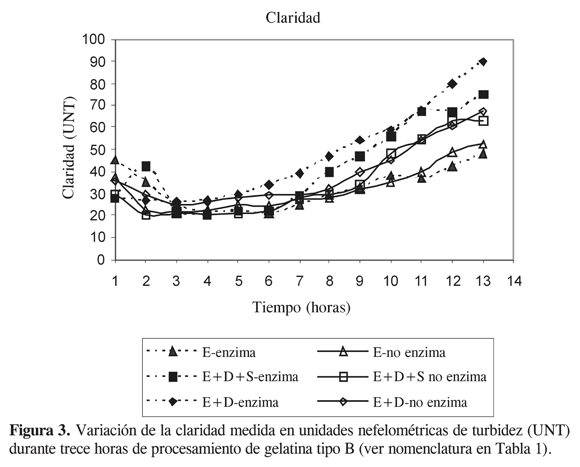
Para la variable respuesta claridad, el mejor rango, promedio, desviación estándar y coeficiente de variación se presentó con el tratamiento E-enzima. El 82,1% de la gelatina en este tratamiento exhibió alta claridad, entre 39 y 19,7 UNT, el 15,4% mostró claridades menores de 67,5 UNT y el 2,6% presentó claridades mayores de 68 UNT. Al emplearse E-no enzima se obtuvo el 76,9% de la gelatina con claridades altas. La Figura 3 muestra el comportamiento de la claridad durante las trece horas de proceso. En los tratamientos E+Denzima y E+D+S-enzima el 53,8% de la gelatina tuvo claridad alta. El ANOVA presentó diferencias significativas en la variable claridad; la prueba DSH para la claridad no mostró diferencias estadísticas entre los tratamientos E+D-enzima y E+D+S-enzima.
Los sólidos suspendidos causantes de la turbidez de la gelatina en solución pueden tener dos procedencias: una de la misma materia prima, debida a la precipitación en medio ácido de impurezas como sustancias nitrogenadas que no producen gelatina, tales como queratina, glicoproteínas, condrinas, mucinas, condromucinas, ácidos nucleicos y elastina; las cuales se eliminan con el pretratamiento enzimático. La otra causa de turbidez de la gelatina se debe a deficiencias en el lavado de la materia prima después de los tratamientos de encalado y acidulación.
CONCLUSIONES
En el proceso de producción de gelatina tipo B el uso de endopeptidasa alcalina para el pretratamieto de carnaza bovina entera y de carnaza desorillo-sebo mejora los parámetros de calidad físico-químicos de bloom, viscosidad y claridad. La viscosidad es el parámetro de calidad de gelatina que más se afecta con el uso de la enzima y, dado que esta es la principal propiedad que determina su uso e incide en el precio internacional, los resultados que se muestran en este artículo son alta relevancia. Con estos se reconfirma además el gran efecto que tiene el tipo de materia prima sobre la conversión de colágeno a gelatina y la importancia de las enzimas en el mejoramiento de los procesos en la industria alimentaria.
REFERENCIAS BIBLIOGRÁFICAS
1. Saddler, J.; Horsey, P. The new generation gelatins. A review of their history, manufacture and properties. Anaesthesia. 1987. 42: 998-1004. [ Links ]
2. Olsen, D.; Yang, CH.; Bodo, M.; Chang, R.; Leigh, S.; Báez, J.; Carmichael, D.; Perea, M.; Hamalainen, E.; Jarvinen, M.; Polarek, J. Recombinant collagen and gelatin for drug delivery. Advanced Drug Delivery Reviews. 2003. 55 (12): 1547-1567. [ Links ]
3. Weber, S. C.; Herz, A. H. Method for recombinant yeast expression and isolation of water-soluble collagen- type polypeptides. US Patent #5710252. 1998. Assigned to Eastman Kodak Company. [ Links ]
4. Duthie, S. J.; Johnson, W.; Dobson, V. L.; Nicolas-Simonnot, M.; Tréguer V.; Leclerc, J.; Sardin, M.; Brajoux, J.; Moy, J.; Takerkart, G. Experimental study and modelling of gelatin production from bone powder: elaboration of an overall Kinetic sécheme for the acid process. Chemical Engineering Journal. 1997. 67: 55-64. [ Links ]
5. Cole, C.; Mcgillt, A. The properties of gelatines derived by alkali and enzymic conditioning of bovine hide from animals of various ages. Journal of the Society of Leather Technologists and Chemistry. 1988; 72: 159-164. [ Links ]
6. Novo Industries. US Patent 4064008. 1997. [ Links ]
7. Kenny, A. J. Introduction: Nomenclature and classes of peptidases. E. E Sterchi and W. Stöcker (eds.). Proteolytic enzymes. Tools and targets. Berlin: Heidelberg, Springer- Verlag, Berlin. 1999. pp. 1-8. [ Links ]
8. Rao, B.; Tanksale, A.; Ghatge, M.; Deshpande, V. Molecular and biotechnological aspects of microbial porteases. Microbiology and Molecular Biology Reviews. 1998. 62 (3): 597-635. [ Links ]
9. Perea, A.; Ugalde, U.; Rodríguez I.; Serra J. Preparation and characterization of whey protein hydrolysates: Applications in industrial whey bioconversion processes. Enzyme Microbiol. Technol. 1993. 15 (5): 418-423. [ Links ]
10. Ward, A.; Courts, A. The science and technology of gelatin. London, UK: Academic Press, 1977. [ Links ]
11 Neklyudov, A.; Invankin, A.; Berdutina, A. Properties and uses of protein hydrolases. Appl. Biochem. Microbiol. 2000. 36: 452-459. [ Links ]
12. Gupta, R.; Beg, Q.; Lorenz, P. Bacterial alkaline proteases: Molecular approaches and industrial applications. Appl. Microbiol. Biotechnol. 2002. 59 (1):15-32. [ Links ]
13. Barros, R.; Wehtje, E.; Adlercreutz, P. Enhancement of immobilized protease catalyzed dipeptide synthesis by the presence of insoluble protonated nucleophile. Enzyme Microbial Technol. 1999. 24 (8-9): 480-488. [ Links ]
14. So, J.; Shin, J.; Kim, B. Protease- catalyzed tripeptide (RGD) synthesis. Enzyme and Microbial Technology. 2000. 26: 108-114. [ Links ]
15. British Standard 757. Methods for sampling and testing gelatine (Physical and Chemical Methods), 3rd ed. London: British Standards Institution. 1975. [ Links ]
16. Centro de Comercio Internacional (CCI). La gelatina: panorama del mercado mundial, con especial referencia a las posibilidades de los países en desarrollo. CCI, Unctad/GATT, Ginebra, 1984. [ Links ]
17. Simeonova, L.; Dalev, P. Utilization of a leather industry waste. Waste Management. 1996. 16 (8): 765-769. [ Links ]
18. McLain, P. E. Chemistry of collagen crosslinking: relationship to aging and nutrition. Advances in Experimental Medical Biology. 1997. 821: 603-618. [ Links ]
19. Cole, C.; Roberts, J. Further effects of animal age the alkali process gelatin manufactured from bovine hide. Proceedings of the Centenary Conference of the International Union of Leather Technologists and Chemists. London. 1997. [ Links ]
20. Boady, K.; Wang, Z.; Xu, S. Gelatin: A valuable protein for food and pharmaceutical industries: Review. Critical Reviews in Food Science and Nutrition. 2001. 41 (6): 481-492. [ Links ]














