Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804On-line version ISSN 2357-3791
Rev.Colomb.Quim. vol.36 no.2 Bogotá July/Dec. 2007
SÍNTESIS Y ESTUDIO TEÓRICO DFT DE COMPUESTOS DE RU(II) CON LIGANTES FERROCENÍLICOS PARA APLICACIONES ELECTROQUÍMICAS
SYNTHESIS AND THEORETICAL DFT STUDY OF RU(II) COMPLEXES WITH FERROCENYLIC LIGANDS FOR ELECTROCHEMICAL APPLICATIONS
SINTESE E ESTUDO TEÓRICO DFT DE COMPOSTOS DE RU(II) COM LIGANTES FERROCENILICOS PARA APLICAÇÃO ELETROQUÍMICA
Giovanny A. Parada, Daniel Fernández, Andrés Reyes, Marco F. Suárez y Luca Fadini1*
1 Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia, sede Bogotá, Bogotá, Colombia. lfadini@unal.edu.co
Recibido: 15/05/07 – Aceptado: 15/08/07
RESUMEN
En esta comunicación se reporta la síntesis y caracterización de nuevos compuestos de rutenio(II) con ligantes ferrocenílicos y/o fosfínicos de fórmula general: [RuCl2(PP)(NN)], donde PP = 1,1’-bis (difenilfosfina)ferroceno (dppf) ó 1,2-bis (difenilfosfina)etano (dppe); NN = 3,3’- dicarboxi-2,2’-bipiridina (3,3’-dcbpy) ó 2,2’-bipiridina (bpy). El estudio teórico DFT de estos compuestos permitió racionalizar algunos resultados experimentales y a la vez dio indicios teóricos de que compuestos de Ru(II) con ligantes ferrocenílicos tienen ciertas propiedades para utilizarlos como fotosensibilizadores en celdas solares sensibilizadas mediante colorantes (CSSC). La caracterización de los ligantes y de los complejos de rutenio( II) se realizó por 1 H-RMN y 31P – RMN, UV-Vis, IR, voltametría cíclica y diferencial de pulso.
Palabras clave: rutenio(II), ferroceno, fotosensibilizadores, celdas solares, cálculos DFT.
ABSTRACT
Novel ruthenium(II) complexes with ferrocenylic and/or phosphinic ligands of the type [RuCl2(PP)(NN)], with PP = 1,1’- bis(diphenylphosphino)ferrocene (dppf) or 1,2-dipheylphospinoethane (dppe) and NN = 3,3’-dicarboxyl- 2,2’-bipyridine (3,3’- dcbpy) or 2,2’-bipyridine (bpy) were synthesized and characterized. DFT studies of these compounds allowed to explain some experimental aspects, leading to a theoretical design of modified Ru(II) ferrocenylic complexes in order to be used as a dye for Photosensitized Solar Cells. The ligands and the complexes were characterized by 1H y 31P – NMR, UV-Vis, IR and Cyclic and differential pulse voltammetries.
Key words: Ruthenium(II), ferrocene, dye, solar cell, DFT calculations.
RESUMO
Nesta comunicação reporta-se a síntese e caracterização de novos compostos de rutênio(II) com ligantes ferrocenílicos e/ou fosfínicos de fórmula geral: [RuCl2 (PP)(NN)], onde PP = 1,1’-bis (difenilfosfina) ferroceno (dppf) ou 1,2-bis(difenilfosfina) etano (dppe); NN = 3,3’-dicarboxi- 2,2’-bipiridina (3,3’-dcbpy) ou 2,2’-bipiridina (bpy). O estudo teórico DFT destes compostos permitia racionalizar alguns resultados experimentais e, ao mesmo tempo, deu indicações teóricas de que compostos de Ru(II) com ligantes ferrocenílicos têm umas propriedades para utilizar-se como fotosensivilizadores em Células Solares Sensibilizadas diante Colorantes (CSSC). A caracterização dos ligantes e dos complexos de rutênio(II) foi por 1H-RMN e 31P-RMN, UV-Vis, voltametria cíclica e diferencial de pulso.
Palavras-chave: rutênio(II), ferroceno, fotosensivilizadores, células solares, cálculos DFT.
INTRODUCCIÓN
El aprovechamiento de la energía solar, ya sea para la conversión directa a energía eléctrica o para la producción de combustibles, es un tema de gran actualidad. La energía solar es una de las alternativas más prometedoras para satisfacer las crecientes necesidades energéticas de nuestra sociedad (1). Los primeros dispositivos desarrollados para la conversión directa de energía solar en energía eléctrica se construyeron con base en semiconductores de silicio. Sin embargo, el gran costo de producción de silicio de alta pureza ha impulsado la investigación en celdas solares más económicas que utilizan películas delgadas de semiconductores recubiertas con colorantes, los cuales actúan como sensibilizadores. Estos colorantes son capaces de inyectar electrones en la banda de conducción del semiconductor con una alta eficiencia cuántica y a altas velocidades. Este mecanismo para el aprovechamiento de la energía solar es la base de funcionamiento de las celdas solares sensibilizadas mediante colorantes (CSSC) desarrolladas por Grätzel y colaboradores a partir de la década de los setenta (2, 3). Uno de los componentes clave de este tipo de sistemas fotoelectroquímicos son las especies fotosensibilizadoras, que juegan el papel de transductores absorbiendo energía solar para permitir la generación de corriente eléctrica en la celda (4). El fotosensibilizador más eficiente sintetizado hasta el momento es el cis-ditioisocianato- bis (4,4’-dicarboxi- 2,2’-bipiridina) rutenio(II) conocido como N3 (rendimiento global de fotoconversión=10,4%) (5). Las variaciones en el ligante polipiridínico han incluido el uso de bipiridinas sustituidas en las posiciones 3 y 4. Por otro lado, se han reportado fotosensibilizadores basados en compuestos polinucleares conocidos como dyas y triads (6), que presentan una forma adicional de decaimiento del estado excitado denominada quenching intramolecular (7). Este efecto conocido en fragmentos ferrocenílicos puede llevar a la formación de estados moleculares intermediarios con separación de carga intramolecular. Al promover este efecto en las CSSC, se podría aumentar la constante de inyección (v.Figura 1) y, por lo tanto, la eficiencia del fotosensibilizador. El 1,1’- bis(difenilfosfina) ferroceno (dppf) es uno de los ligantes que con mayor versatilidad han permitido obtener especies polinucleares que presentan el efecto quenching (7, 8).
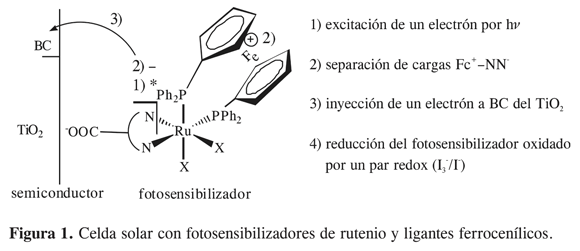
En este trabajo se presenta la síntesis y caracterización de complejos cuya fórmula base es [RuCl2(PP)(NN)], donde PP = 1,1’-bis (difenilfosfina) ferroceno (dppf) ó 1,2- bis(difenilfosfina)etano (dppe); NN=3,3’-dicarboxi-2,2’-bipiridina (3,3’-dcbpy) ó 2,2’-bipiridina (bpy). Estos estudios experimentales se acompañaron de estudios teóricos DFT (Gaussian 98 (9)) que se utilizaron para hacer una primera comparación con los resultados teóricos presentados por Grätzel y colaboradores sobre el N3 (10). Además, gracias al estudio teórico se pudieron interpretar algunas propiedades de los compuestos sintetizados y diseñar varios ligantes ferrocenílicos, que presentan alta posibilidad de mejorar las propiedades de los fotosensibilizadores basados en complejos organometálicos de Ru(II).
PARTE EXPERIMENTAL
Materiales y métodos
Todas las metodologías de síntesis desarrolladas se llevaron a cabo bajo condiciones inertes, mediante técnicas Schlenk en atmósfera deN2 o en caja seca (11). Los reactivos 2,2’-bipiridina (reactivo Merck), 1,2-bis(difenilfosfina)etano (reactivo Aldrich), [RuCl2(DMSO)4] (donación ETH Zürich) se utilizaron sin ulteriores purificaciones. 3,3’-dicarboxil–2,2’–biriridina, (3,3’-dcbpy) (12) y 1,1’-bis(difenilfosfina) ferroceno, (dppf) (13) se sintetizaron según la literatura. Los solventes de trabajo se purificaron bajo condiciones inertes antes de ser usados (14). Los espectros de 1H y 31P-RMN se midieron en un espectrómetro Bruker Avance 400 (400 MHz). Los desplazamientos químicos de 1H-RMN se reportan versus TMS. Para el caso de los estudios de 31P-RMN los desplazamientos químicos se reportan versusH3PO4. Los espectros UV-Vis se midieron en un espectrofotómetro miniatura con fibra óptica AD ocean optics USB2000 utilizando una celda de cuarzo y soluciones de diclorometano. Las determinaciones electroquímicas se realizaron en un potenciostato µ-Autolab-II (Ecochemie), y utilizando una celda típica de tres electrodos; un electrodo de platino como electrodo de trabajo, una lámina de platino como electrodo auxiliar y un electrodo de calomel como electrodo de referencia. E1/2 es el potencial de onda media y Epa es el potencial de pico anódico.
Síntesis de los compuestos de rutenio(II)
Síntesis de cis-dicloro-1,1’-bis(difenilfosfina) ferroceno-2,2’-bipiridinarutenio (II) cis-[RuCl2(dppf)(bpy)]: En un balón Schlenk de 20 ml se disolvieron 188,3 mg de [RuCl2(DMSO)4] (0,389 mmol) en 3,5 mL de una solución 1:6 DMF/CHCl3, y, por otro lado, en un segundo Schlenk de 50 mL se disolvió la mezcla de 60,7 mg de 2,2’-bipiridina (0,389 mmol) y 211,5 mg de 1,1’-bis(difenilfosfina) ferroceno (dppf) (0,389 mmol) en 5 mL de CHCl3. Mediante cánula se realizó la adición de la solución de [RuCl2(DMSO)4] a la solución de los ligantes por un periodo de 2 horas con agitación constante a 50 ºC. Finalizada la adición se emplearon 2mL de CHCl3 para lavar el Schlenk que contenía la solución de [RuCl2(DMSO)4]. En este punto se observó la aparición de un precipitado naranja intenso que hizo turbia la mezcla de reacción. Se conservaron las condiciones de reacción (agitación vigorosa, 50 ºC) por 1 hora, sin obtenerse la disolución del precipitado naranja. Se adicionaron 5 mL de DMF y la mezcla se calentó a reflujo (110 ºC) por 1 hora más. Se dejó enfriar y mediante cánula se separó el precipitado del sobrenadante. El sólido naranja intenso obtenido se lavó con dietil éter (3 x 3mL) y se secó a alto vacío (10-3 mbar) durante una noche. Rendimiento: 68%. UV max CH2Cl2 (log ): 257,5 (6,02), 309,6 (5,72), 423,6 (4,97). 1H –RMN (400 MHz, CDCl3/DMSO-d6 : 4,1 (2H, m, H-cp), 4,2 (2H, m, H-cp), 4,3 (2H, m, H-cp), 4,5 (4H, m, H-cp), 6,85-9,4 (28H, m, H aromáticos). 31P –RMN (400 MHz, CDCl3/DMSO-d6 4:1): = 43,5 (d, 2J(P-P) = 30,5Hz, P-2), 35,8 (d, 2J(P-P) = 30,5 Hz, P-2). VC (Electrodo de Pt, TBAHFP 0,1M en DCM): E1/2(I) = 929 mV / p(I) = 70 mV, Epa(II) = 1564 mV, Epa(III) = 1878 mV.
Síntesis de cis/trans-dicloro-1,1’-bis (difenilfosfina)ferroceno- 3,3’-dicarboxil– 2,2’–biriridina rutenio(II) [RuCl2 (dppf)(3,3’-dcbpy)]: En un balón Schlenk de 20 ml se disolvieron 201,8 mg de [RuCl2(DMSO)4] (0,417 mmol) en 2mL de DMSO mediante agitación vigorosa y calentamiento leve (~40 ºC) por 3 minutos. En un segundo Schlenk de 50 mL se disolvió la mezcla de 101,7 mg de 3,3’-dicarboxil- 2,2’-bipiridina (0,417 mmol) y 230,8 mg de 1,1’- bis(difenilfosfina) ferroceno(dppf) (0,417 mmol) en 8 mL de mezcla 1:3 CHCl3 /DMSO. Mediante cánula se realizó la adición de la solución de [RuCl2(DMSO)4] a la solución de los ligantes por un periodo de 2 horas con agitación constante a 85 ºC. Finalizada la adición, la mezcla de reacción se mantuvo bajo las mismas condiciones por 3 horas más. Los solventes de reacción se retiraron a presión reducida. El sólido así obtenido se filtró, se recristalizó con DCM/dietil y finalmente el sólido rojo intenso obtenido se lavó con dietil éter (3 x 2 mL) y éter de petróleo (3 x 2 mL). Este sólido se secó a alto vacío (10-3 mbar) durante una noche. Rendimiento: 34%. UV max CHCl3 (log ): 264,4 (4,12), 317,0 (3,83), 512,9 (3,15). 1H–RMN (400 MHz, CDCl3/DMSO-d6 4:1): 4,0-4,8 (8H, m, H-cp), 6,7-10,0 (26H, m, H aromáticos) (2H, m, H-cp). 31P –RMN (400 MHz, CDCl3/DMSO-d6 4:1): = 28,4 (s br, P trans), 44,3 (d, 2J(P-P)= 34,9 Hz, P-1 cis), 49,6 (d, 2J(P-P)= 35,3 Hz, P-2 cis), 35,8.VC(electrodo de Pt, TBAHFP 0,1M en DCM): E1/2(I) = 652 mV/ p(I) = 80 mV, E1/2(II)=947 mV/p(II)=185 mV.
Síntesis de cis-diclorobis(difenilfosfinoetano) rutenio(II), cis-[RuCl2 (dppe)2]: En un balón Schlenk de 20 mL se disolvieron 155,7 mg de [RuCl2(DMSO)4] (0,321 mmol) en 4 mL de una solución 1:1 DMF/CHCl3. A esta solución se adicionaron 50,2 mg de 2,2’- bipiridina (0,321 mmol), procedimiento que ocasionó un cambio del color de la solución de amarillo a naranja débil. Esta solución se mantuvo en agitación durante 30 minutos a 50 ºC. En un segundo Schlenk se disolvieron 128,5 mg de 1,2-bis (difenilfosfina)etano (dppe) (0,321 mmol) en 3 mL de CHCl3. La solución de dppe se adicionó a la primera solución durante 2 horas mediante cánula (T = 50 ºC). Finalizado este periodo, el sistema de reacción se mantuvo con agitación a 50 ºC por 4 horas más. El solvente de la reacción se retiró a presión reducida (10-3 mbar). El sólido así obtenido se recristalizó en CHCl3/éter de petróleo/dietil éter y se purificó por cromatografía en columna (sílica gel, CHCl3/CH3OH/AcOH 5:5:1) El sólido obtenido se secó a presión reducida (10-3 mbar). Rendimiento: 38%. UV: max CH2Cl2 (log ): 240,0 (4,85), 263,7 (4,75), 298,8 (4,59). 1H–RMN(400 MHz, CDCl3/DMSO-d6 4:1): = 2,7-3,05 (4H, m, CH2), 6,65-7,3 (20H, m, H aromáticos, 20H). 31P –RMN (400 MHz, CDCl3/ DMSO-d6 4:1): = 52,4 ppm (t, 2J(P-P) = 19,6 Hz, P-1), 38,0 (t, 2J(P-P) = 19,6 Hz, P-2). EM (MaldiHRes), m/z (int. rel.): 968 [M]+ (49), 933 [M-Cl]+ (44), 897 [M-Cl2]+ (100). VC (Electrodo de Pt, TBAHFP 0,1 M en DCM): E1/2(I) = 502 mV/ p(I) = 75 mV, E1/2(II) = 812 mV/ p(II) = 105 mV.
RESULTADOS Y DISCUSIÓN
Síntesis de compuestos de rutenio
Para la síntesis de los complejos se probaron diferentes metodologías aplicando los conceptos del efecto trans (efecto cinético) típico de ligantes fosfínicos (15). Se encontró que para promover la reacción completa entre el [RuCl2(DMSO)4] y los distintos derivados de la 2,2’-bipiridina deben alcanzarse temperaturas moderadamente altas (T >80 ºC), y utilizar solventes poco coordinantes para favorecer la sustitución de las moléculas de DMSO coordinadas al rutenio( II). Además, en el caso de los ligantes difosfínicos y de manera específica con el 1,2-bis(difenilfosfina)etano (dppe), fue necesario asegurar primero la coordinación del ligante polipiridínico antes que la coordinación de la difosfina. En caso contrario, se encuentra una gran tendencia a la di y tricoordinación de la difosfina. El efecto es tan grande que a pesar de todas las posibles precauciones nunca se pudo aislar el compuesto [RuCl2(dppe)(NN)]. Como se demostró mediante 31P-RMN y espectroscopía de masa MaldiHRes, el único producto aislado en esta reacción es el compuesto [RuCl2(dppe)2]. La alta tendencia a la disustitución que presenta el 1,2-bis(difenilfosfina) etano es consecuencia de su alto carácter -donor, a diferencia del 1,1’-bis (difenilfosfina)ferroceno, en el cual la densidad electrónica en los átomos de fósforo es menor al estar enlazados a carbonos con hibridación sp2 de un sistema aromático (mejores aceptores ). Los complejos se purificaron por cristalización fraccionada. Esta metodología de purificación permite retirar ligantes sin reaccionar, pero difícilmente permite la separación de isómeros del producto formado. La metodología puede causar la oclusión de solventes, que, sumada a la baja solubilidad de algunos complejos en CDCl3, hacen que no resulte viable realizar una asignación inequívoca de las señales de 1H-RMN para los complejos (la región aromática: un solo multipleto). Además se presentan equilibrios en solución de los isómeros cis y trans para cualquier complejo (16) y procesos dinámicos de intercambio de ligantes lábiles, como los cloros en presencia de solventes coordinantes (DMSO). Es por esto que los espectros de 1H-RMN a temperatura ambiental no son contundentes para la caracterización de los complejos [RuCl2(PP)(NN)] sintetizados, a pesar de que los espectros de 31P-RMN han servido como criterio de pureza isomérica. En la Tabla 1 se presentan las señales características de 31P-RMN para cada complejo de rutenio sintetizado.

Estudio electroquímico
En el voltamograma cíclico para el cis-[RuCl2(dppf)(bpy)] y [RuCl2(dppf) (3,3’-dcbpy)] se observa un primer proceso electroquímico cuasi reversible asociado al paso Fe(II/III) en el fragmento de ferroceno del ligante dppf (E1/2(I) = 929 y 652 mV, respectivamente). Para el compuesto cis- [RuCl2(dppf)(bpy)], E1/2(I) se encuentra anódicamente desplazado de +305mV(vs. SCE) con respecto al paso Fe(II/III) en el fragmento de ferroceno del ligante dppf libre (v. Figura 2). También para [RuCl2 (dppf)(3,3’-dcbpy)] se observa que la oxidación Fe(II/III) en el complejo a está a un potencial +28 mV (vs. SCE) con respecto al ferroceno-ferrocinio del ligante libre. Este desplazamiento muestra la disminución de densidad electrónica sobre el Fe(II) por efecto de la coordinación del ligante al centro metálico de Ru(II). De esta manera, su oxidación ocurre a potenciales más anódicos. También se observan dos procesos irreversibles en Epa(II) = 1564 mV y Epa (III) = 1878 mV. No es posible realizar una asignación precisa de la correspondencia de estas dos últimas señales, pero se puede comparar con los resultados de Yam et ál. (17), que presenta para [Ru(bpy)2 (dppf)]2+ Epa Fe(II/III)=910 mV (reversible) y Epa Ru(II/III)=1830 mV (irreversible). Si se considera la capacidad de los ligantes cloruros de aumentar la densidad electrónica sobre el centro metálico de rutenio( II) y así disminuir el potencial redox del paso Ru(II/III) (por cada cloruro se disminuye <240 mV el potencial redox de Ru(II/III) tomando el [Ru(bpy)3]2+ como referencia (18)), se puede afirmar que el
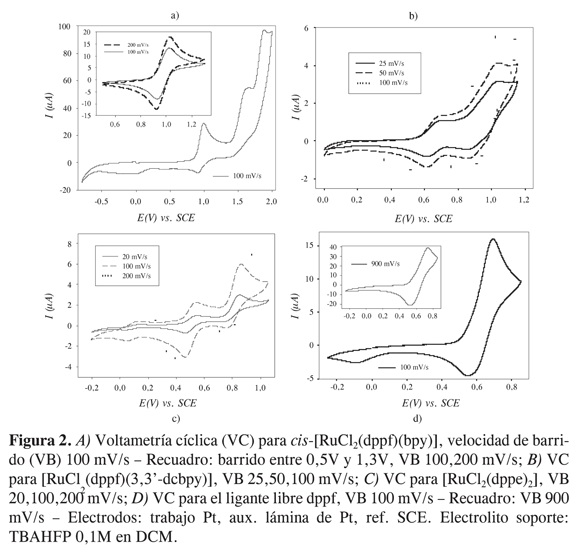
paso de Ru(II/III) en el cis-[RuCl2 (dppf) (bpy)] debe alcanzarse antes del final de la ventana de potencial de trabajo y por tanto debe estar asociado a alguna de estas señales (Epa(II) = 1564 mV y Epa(III) = 1878 mV). Como en la serie de compuestos reportados por Yam y colaboradores (17), el potencial redox del paso de Ru(II/III) en el cis-[RuCl2(dppf)(bpy)] y [RuCl2(dppf) (3,3’-dcbpy)] se encuentra atípicamente desplazado a valores de potencial muy positivos por efecto de la oxidación previa del ligante dppf que deja al Ru(II) coordinado con un ligante con una unidad de ión ferrocinio.
Como han demostrado Shan et. ál. (19), la disminución de las propiedades fotofísicas de complejos de rutenio(II) con bipiridinas 3,3’-sustituidas frente a sus análogos con bipiridinas 4,4’-sustituidas es dramática, lo cual se debe a la menor conjugación de los anillos piridínicos por la no coplanaridad de estos (ángulo entre los dos anillos: aproximadamente 30º). Esta falta de planaridad afecta también la capacidad -aceptora del ligante. La pérdida de estas características impide la estabilización efectiva del estado excitado de los complejos que permite una inyección electrónica efectiva a la banda de conducción del material semiconductor en CSSC. Este efecto estérico con consecuencias electrónicas en el ligante 3,3’-dicarboxi- 2,2’-bipiridina es la razón del valor atípico de los potenciales redox determinados para [RuCl2(dppf) (3,3’-dcbpy)], los cuales son menores que los determinados en el complejo cis-[RuCl2(dppf)(bpy)]. En la voltametría cíclica para cis- [RuCl2 (dppe)2], E1/2(I)=502 mV ha sido asociado al paso Ru(II/III) mientras que E1/2(II) = 812 mV ha sido considerado como la oxidación de Ru(III/IV) teniendo en cuenta que en este complejo el ión central se encuentra un entorno electrónico altamente enriquecido como consecuencia de la presencia de ligantes con alto carácter y - donor que promueven la disminución de E1/2 (Ru(II/III)) y por lo tanto el alcance de altos estados de oxidación del ión central. Las voltametrías cíclicas de los compuestos sintetizados y del ligante dppf se presentan en la Figura 2.
La absorción de radiación electromagnética en la región del visible es una de las características más importantes para los compuestos usados como fotosensibilizadores en celdas solares (20). En un complejo con geometría octaédrica como [Ru(bpy)3]2+ (grupo puntual D3) los orbitales t2g del metal son los orbitales de mayor energía ocupados (HOMO) y los orbitales desocupados de menor energía (LUMO) corresponden a orbitales antienlazantes del ligante. De esta manera, la transferencia electrónica de menor energía del complejo implica transferencia electrónica del metal al ligante y puede considerarse como una oxidación centrada sobre el metal y una reducción centrada sobre el ligante (3). En la Tabla 2 se presentan las bandas de los espectros UV-Vis para los complejos sintetizados.
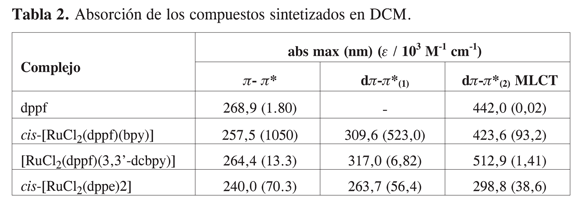
Con el complejo [RuCl2(dppf)(3,3’- dcbpy)] no se ha alcanzado un rango de absorción en el visible superior al de N3 el cual presenta sus absorciones en 518 y 380 nm . Esto podría mejorarse con el uso de 4,4’-dicarboxi-2,2’-bipiridina en lugar de 3,3’-dicarboxi-2,2’-bipiridina ya que la conjugación extendida que implica la coplanaridad de los anillos piridínicos en 4,4’-dicarboxi-2,2’-bipiridina permite disminuir aun más la energía de los orbitales* del ligante polipiridínico, para extender así el rango de absorción del complejo en el visible.
ESTUDIO TEÓRICO
Para poder corroborar y predecir las propiedades fotosensibilizadoras de los compuestos ya sintetizados y de los que se piensa sintetizar en el futuro, se realizaron cálculos computacionales DFT que involucraron una primera optimización de todas las geometrías moleculares utilizando un nivel de teoría B3LYP/LANL2 MB con una posterior evaluación de la geometría de equilibrio usando un nivel de teoría B3LYP/LANL2DZ, como se encuentran implementados en Gaussian 98 (9). Para comprobar la eficacia de este procedimiento computacional, fue preciso comparar el N3 con su geometría experimental (10). Dado que los valores obtenidos de la geometría calculada difirieron en 0,29% (Ru-NCS) y 6,49% (C-N en SCN) de los valores experimentales, se puede afirmar que el método propuesto es válido para la evaluación de los compuestos de rutenio. Los datos obtenidos se compararon también con los datos calculados para N3 (21). En la Tabla 3 se resumen los datos energéticos del HOMO y del LUMO de los compuestos sintetizados, que son los valores clave para poder empezar a predecir el posible comportamiento de estos compuestos como fotosensibilizadores.
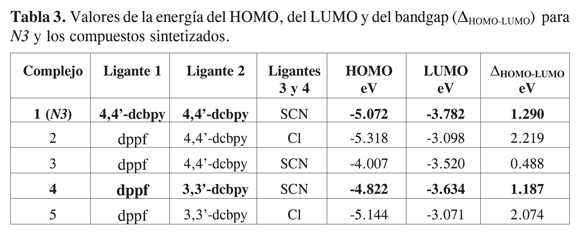
Se observa que en la mayoría de los compuestos de Ru(II) sintetizados los valores energéticos de los orbitales se encuentran a niveles superiores a los del N3.
Esto se debe principalmente al efecto aceptor de las fosfinas y del ión tiocianato sobre el centro metálico. Sin embargo, cuando la molécula contiene cloros, que son donores , el bandgap aumenta, lo que hace que el HOMO aparezca energéticamente por debajo del HOMO del N3. En el caso de la 3,3’-dcbpy se observa que la pérdida de planaridad de los anillos de la bipiridina causa la pérdida parcial de la aromaticidad. El efecto es un aumento de la diferencia HOMO-LUMO debido principalmente a un decaimiento energético del HOMO por la pérdida en el ligante de su propiedad de aceptor π. En cuanto a la distribución espacial HOMO- LUMO en las moléculas, se observa en todos los casos una distribución del HOMO sobre los sustituyentes no aromáticos en el complejo (Figura 3). Para los casos en los que hay tiocianatos, la distribución es mucho más poblada sobre dichos sustituyentes que cuando existen cloruros, lo cual indica claramente que podría haber una mejor interacción con el par redox en la celda solar. La distribución del LUMO se encuentra siempre sobre la bipiridina dicarboxilada, inclusive en el caso en el que existe una pérdida de planaridad. Esto implica que no deberían existir problemas asociados con la inyección electrónica en la banda de conducción del semiconductor en ninguna de estas moléculas y que, más bien, dicha inyección deberÃa ser asistida por la separación de carga causada por el ferroceno. Además, las moléculas que incluyen a la 3,3â-dcbpy poseen un bandgap de 1.187 eV, ideal para su uso en fotosensibilizadores (comparándolo con N3 que presenta un bandgap de 1.289 eV, se puede afirmar que la absorción en el espectro visible del compuesto sintetizado tiene que ser mejor). La localización y naturaleza del HOMO y el LUMO muestran también cómo la transición electrónica que ocurre es metal-ligante hacia la bipiridina, lo cual es vital para la inyección de electrones. El LUMO+1, LUMO+2 y LUMO+3 son de la misma naturaleza que el LUMO, que es un orbital con carácter mayoritariamente de la bipiridina. Este tipo de análisis es similar al reportado para el N3 y análogos (22).
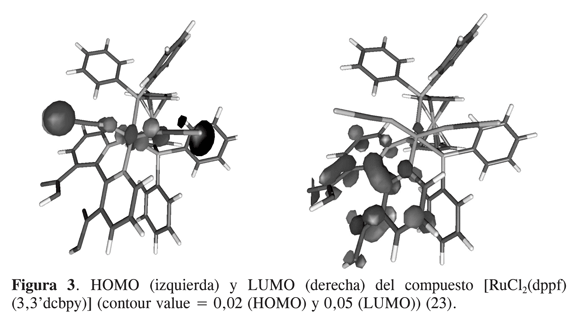
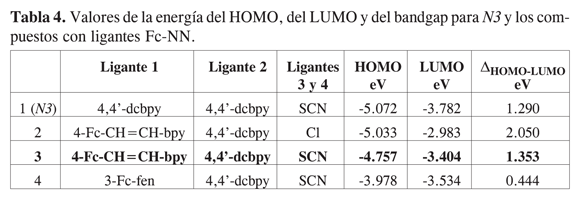
Gracias a los cálculos teóricos se puede predecir el efecto de los ligantes sobre los posibles fotosensibilizadores. Como el efecto aceptor de las fosfinas causa problemas en la sÃntesis de los compuestos y en las posibles reacciones quÃmicas acopladas en el estudio electroquÃmico, se compararon las energÃas de los HOMO y los LUMO de compuestos donde el fragmento ferrocenÃlico está directamente o de manera conjugada enlazado a ligantes NN (NN = 2,2â-bipiridina o 1,10-o-fenantrolina, Tabla 4). Se observa que los valores de bandgap de los compuestos con ligantes ferroceno-NN se acercan a los valores de N3 (Tabla 4, entrada 3). Además, se encuentra que el HOMO y el LUMO tienen energÃas ligeramente más altas que los respectivos orbitales de N3. Esto podrÃa mejorar la constante de inyección en la banda de conducción del TiO2 después de la excitación del fotosensibilizador gracias a la luz solar. Estos compuestos con ligantes ferroceno- NN cumplen con los requisitos de tener un fragmento ferrocenÃlico que permite la separación de carga intramolecular del estado excitado y con los valores energéticos del HOMO y el LUMO para la inyección en la banda de conducción del semiconductor. El trabajo experimental que se está desarrollando en nuestros laboratorios demostrará la veracidad de estos cálculos.
CONCLUSIONES
Se sintetizaron y caracterizaron por 1H-RMN, 31P-RMN IR y UV algunos compuestos de rutenio(II) con ligantes derivados de la 2,2â-bipiridina y del ferroceno. Los estudios electroquÃmicos por voltametrÃa cÃclica y por diferencial de pulso indican que se trata de sistemas complejos con procesos quÃmicamente reversibles de oxidación-reducción en el Fe del ferroceno, junto a procesos irreversibles en el Ru, ligados probablemente a reacciones quÃmicas acopladas. El estudio teórico de estos compuestos permitió aclarar los efectos de los ligantes (por sus propiedades estéricas y electrónicas) sobre los compuestos de rutenio. Gracias a los cálculos de las energÃas del HOMO y del LUMO, se pudo también comparar estos compuestos con N3, para su posible utilización como fotosensibilizadores en celdas solares. Además, abre las puertas hacia la sÃntesis de nuevos compuestos que podrÃan ser excelentes fotosensibilizadores para celdas solares sensibilizadas mediante colorantes.
REFERENCIAS BIBLIOGRÃFICAS
1. Goetzberger, A.; Hebling, C.; Schock, H. W. Photovoltaic materials, history, status and outlook. Materials Science and Engineering Reports. 2003. 40 (1): 1-46. [ Links ]
2. Miles, R. W.; Hynes, K. M.; Forbes, I. Photovoltaic solar cells: An overview of state- of-the-art cell development and environmental issues. Progress in Crystal Growth and Characterization of Materials. 2005. 51 (1-3): 1-42. [ Links ]
3. Scheerer, R.; Grätzel, M. Photo-induced oxydation of carbonate ions by duroquinone, a pathway of oxygen evolution from water by visible light. Berichte der Bunsengesellschaft/ Physical Chemistry Chemical Physics. 1976. 80 (10): 979-982. [ Links ]
4. Turro, N. J.; Grätzel, M.; Braun, A. M. Photophysical and photochemical processes in micellar systems. Angewandte Chemie Int. Ed. 1980. 19 (9): 675-696. [ Links ]
5. Hagfeldt, A.; Grätzel, M. Light-Induced Redox Reactions in Nanocrystalline Systems. Chem. Rev. 1995. 95: 49-68. [ Links ]
6. Kalyanasundaram, K. Photophysics, photochemistry and solar energy conversion with tris(bipyridyl)ruthenium(II) and its analogues. Coordination Chemistry Reviews. 1982. 46 159-244. [ Links ]
7. Hagfeldt, A.; Grätzel, M. Molecular Photovoltaics. Acc. Chem. Res. 2000. 33 (5): 269-277. [ Links ]
8. OâRegan, B.; Grätzel, M. Low-cost, high-efficiency solar cell based on dye-sensitized colloidal TiO2 films. Nature. 1991. 353 (6346): 737. [ Links ]
9. Argazzi, R.; Murakami Iha, N. Y.; Zabri, H.; Odobel, F.; Bignozzi, C. A. Design of molecular dyes for application in photoelectrochemical and electrochromic devices based on nanocrystalline metal oxide semiconductors. Coordination Chemistry Reviews. 2004. 248 (13-14): 1299- 1316. [ Links ]
10. Fery-Forgues, S.; Delavaux-Nicot, B. Ferrocene and ferrocenyl derivatives in luminescent systems. Journal of Photochemistry and Photobiology A: Chemistry. 2000. 132 (3): 137-159. [ Links ]
11. André-Bentabet, E.; Broussier, R.; Amardeil, R.; Hierso, J.-C.; Richard, P.; Fasseur, D.; Gautheron, B.; Meunier, P. Different coordination modes of a 1,1â,2,2â-ferrocenyltetraphosphine: bi- and tri-dentate behaviour with group 6 and 7 transition metals. J. Chem. Soc., Dalton Trans. 2002. 11: 2322-2327. [ Links ]
12. M. J. Frisch G. W. T., H. B. Schlegel, G. E. Scuseria, M. A. Robb, J. R. Cheeseman, V. G. Zakrzewski, J. A. Montgomery, Jr., R. E. Stratmann, J. C. Burant, S. Dapprich, J. M. Millam, A. D. Daniels, K. N. Kudin, M. C. Strain, O. Farkas, J. Tomasi, V. Barone, M. Cossi, R. Cammi, B. Mennucci, C. Pomelli, C. Adamo, S. Clifford, J. Ochterski, G. A. Petersson, P. Y. Ayala, Q. Cui, K. Morokuma, P. Salvador, J. J. Dannenberg, D. K. Malick, A. D. Rabuck, K. Raghavachari, J. B. Foresman, J. Cioslowski, J. V. Ortiz, A. G. Baboul, B. B. Stefanov, G. Liu, A. Liashenko, P. Piskorz, I. Komaromi, R. Gomperts, R. L. Martin, D. J. Fox, T. Keith, M. A. Al-Laham, C. Y. Peng, A. Nanayakkara, M. Challacombe, P. M. W. Gill, B. Johnson, W. Chen, M. W. Wong, J. L. Andres, C. Gonzalez, M. Head-Gordon, E. S. Replogle, J. A. Pople in Gaussian 98 (Revision A.1x), Vol. (Ed. Gaussian I.), Pittsburgh PA, 2001. [ Links ]
13. Nazeeruddin,M. K.; DeAngelis, F.; Fantacci, S.; Selloni, A.; Viscardi, G.; Liska, P.; Ito, S.; Takeru, B.; Grätzel, M. Combined Experimental and DFT-TDDFT Computational Study of Photoelectrochemical Cell Ruthenium Sensitizers. J. Am. Chem. Soc. 2005. 127 (48): 16835- 16847. [ Links ]
14. Shriver, D. F.; Drezdzon, M. A. The Manipulation of air sensitive compounds. New York: John Willey and Sons, 1986. [ Links ]
15. Kanungo, B. K.; Baral, M.; Bhattacharya, S.; Sahoo, Y. Synthesis of new macrocycles with 2,2â-bipyridyl and polyamine functions. Synthetic Communications. 2003. 33 (18): 3159-3164. [ Links ]
16. Bishop, J. J.; Davison, A.; Katcher, M. L.; Lichtenberg, D. W.; Merrill, R. E.; Smart, J. C. Symmetrically disubstituted ferrocenes: I. The synthesis of potential bidentate ligands. Journal of Organometallic Chemistry. 1971. 27 (2): 241-249. [ Links ]
17. Perrin, D. D.; Armarego, L. F. Purification of Laboratory Chemicals. Oxford: Pergamon Press, 1992. [ Links ]
18. Crabtree, R. H. In Carbonyls, Phosphine Complexes, and Ligand Substitution Reactions, 2005, pp. 87-124. [ Links ]
19. Nazeeruddin, M. K.; Gratzel, M. In Inorganic Syntheses, Vol. 33 (Ed. Wiley and Sons.), 2002, pp. 185-189. [ Links ]
20. Yam V., W.-W.; Lee V., W.-M.; Cheung, K.-K. Synthesis, electrochemistry and photophysics of ruthenium( II) diimine complexes of 1,1â-bis(diphenylphosphino)ferrocene (dppf). Crystal structure of [Ru(bipy)2(dppf)]2+ (bipy = 2,2â- bipyridine). J. Chem. Soc., Dalton Trans. 1997: 2335-2339. [ Links ]
21. Lever, A. B. P. Electrochemical parametrization of metal complex redox potentials, using the ruthenium( III)/ruthenium(II) couple to generate a ligand electrochemical series Inorg. Chem. 1990. 29 (6): 1271-1285. [ Links ]
22. Shan, B. Z.; Zhao, Q.; Goswami, N.; Eichhorn, D. M.; Rillema, D. P. Structure, NMR and other physical and photophysical properties of ruthenium( II) complexes containing the 3,3â-dicarboxyl-2,2â-bipyridine ligand. Coordination Chemistry Reviews. 2001. 211 (1): 117-144. [ Links ]
23. Nazeeruddin, M. K.; Grätzel, M. In Comprehensive Coordination Chemistry II, Vol. 9. Amsterdam: Elsevier Pergamon. 2004, pp. 719-758. [ Links ]
24. Barolo, C.; Nazeeruddin, M. K.; Fantacci, S.; DiCenso, D.; Comte, P.; Liska, P.; Viscardi, G.; Quagliotto, P.; DeAngelis, F.; Ito, S.; Grätzel, M. Synthesis, Characterization, and DFT-TDDFT Computational Study of a Ruthenium Complex Containing a Functionalized Tetradentate Ligand. Inorg. Chem. 2006. 45 (12): 4642-4653. [ Links ]
25. Sugihara, H.; Sano, S.; Yamaguchi, T.; Yanagida, M.; Sato, T.; Abe, Y.; Nagao, Y.; Arakawa, H. Highly efficient photosensitization of TiO2 with diimine(diketonato)ruthenium (II) complexes. Journal of Photochemistry and Photobiology A: Chemistry 2004. 166 (1-3): 81-90. [ Links ]
26. Schaftenaar, G.; Noordik, J. H. Molden: a pre- and post-processing program for molecular and electronic structures. Journal of Computer- Aided Molecular Design. 2000. 14 (2): 123-134. [ Links ]














