Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804On-line version ISSN 2357-3791
Rev.Colomb.Quim. vol.36 no.3 Bogotá Sep./Dec. 2007
REACCIONES CON TEMPERATURA PROGRAMADA ENTRE EL METANO Y CARBÓN ACTIVADO OXIDADO
TEMPERATURE PROGRAMED REACTIONS BETWEEN METHANE AND OXIDIZED ACTIVATED CARBON
REACÇÕES A TEMPERATURA PROGRAMADA ENTRE METANO E CARVÃO ACTIVADO OXIDADO
Laura R. Conde1, Alfonso Conde1, José de J. Díaz2
1Departamento de Ingeniería Química, Universidad Nacional de Colombia, Sede Bogotá, Bogotá, Colombia. lrconder@unal.edu.co
2Departamento de Química, Universidad Nacional de Colombia, Sede Bogotá, Bogotá, Colombia.
Recibido: 17/08/07 – Aceptado: 27/11/07
RESUMEN
Se realizaron reacciones en ausencia de O2, entre mezclas de CH4 con He y carbón activado oxidado, haciendo un barrido continuo de temperaturas. Se observó la presencia de tres tipos de reacciones: a baja temperatura, formación agotable de etileno; a temperatura media, la formación de CO, CO2, H2O, C3H8 y C4H10 que cesaron al incrementar la temperatura de reacción, y a temperatura alta se formaron C2H4yC2H6 que se mantuvieron al incrementar la temperatura de trabajo. Se discuten dos mecanismos de reacción: uno que podría explicar la formación agotable de C2H4, C3H8 y C4H10, y otro que podría explicar la formación sostenida de C2H4 y C2H6. Los resultados evidencian la posibilidad de valorización simultánea de metano y carbón.
Palabras clave:metano, hidrocarburos ligeros, carbón activado, reacciones con temperatura programada.
ABSTRACT
The partial oxidation of methane was studied by reactions in absence of O2, between methane diluted with helium and oxidized carbon. In each reaction the molar fraction of methane was held constant while the temperature was modified continuously. The method probed to be useful to distinguish the presence of three kinds of reactions: one at low temperature with the exhaustible formation of C2H4, other at medium temperature that led to the formation of CO, CO2, H2O, C3H8yC4H10 and other at high temperature that led to the formation of C2H4 y C2H6; the products at low and mediumtemperature disappeared as the temperature increased while the products observed at high temperature increased with the increase in temperature. Two mechanisms of reaction are proposed: one of them could explain the discontinuous formation of C2H4, C3H8 and C4H10 at low and medium temperatures; the other could explain the formation of C2H4 and C2H6 at high temperature. The results show the possibility of simultaneous valorization of methane and carbon.
Key words:Partial oxidation, methane, light hydrocarbons, oxidized carbon, temperature program reactions.
RESUMO
Realizaram-se na ausência de O2 reacções entre misturas de metano e He e carvão activado oxidado, por varrimento contínuo de temperaturas. Observou-se a ocorrência de três tipos de reacções: formação desprezável de etileno a baixa temperatura, formação de CO, CO2, H2O, C3H8 e C4H10 a média temperatura, que cessou com o aumento da temperatura da reacção e formação de C2H4 e C2H6 a alta temperatura, que se manteve com o aumento da temperatura de trabalho. Discutem- se dois mecanismos de reacção: um que pode explicar a formação desprezável de C2H4, C3H8 e C4H10 e outro que pode explicar a formação sustentada de C2H4 e C2H6. Os resultados evidenciam a possibilidade de valorização simultânea de metano e carvão.
Palavras-chave: metano, hidrocarbonetos leves, carvão activado, reacções a temperatura programada.
INTRODUCCIÓN
La disminución de las reservas probadas de petróleo, junto con una demanda creciente del mismo y sus derivados (1) ha conducido a incrementos en los precios y, en consecuencia, a la búsqueda de fuentes alternativas de energía e insumos para la industria química (2, 3). La transformación del metano en productos de mayor peso molecular, o con presencia de grupos funcionales, se ha convertido en un objetivo prioritario para la academia y la industria (2, 4, 5).
En los procesos actuales el metano se convierte en gas de síntesis (H2 y CO) y luego en hidrocarburos de mayor tamaño a través del proceso Fischer-Tropsch (2), o se transforma en compuestos oxigenados tales como metanol, y éste a su vez se oxida para producir formaldehído. La posible transformación de metano en compuestos de mayor peso molecular o compuestos funcionalizados, en un proceso que implique un sólo equipo de reacción, representa una alternativa muy atractiva para la industria.
En este trabajo se empleó como hipótesis de partida que los grupos de la forma M=O(conMcualquier átomo) presentes en los catalizadores se involucran en la oxidación parcial de metano (5-9), y que el oxígeno molecular interviene tan sólo en la regeneración de dichos grupos superficiales. Por tanto, se planteó la realización de reacciones en ausencia de O2, entre CH4 y un sólido con grupos del tipo M=O. Se escogió como sólido reactivo un carbón activado oxidado, gracias a su alta área superficial y a la facilidad de modificar su contenido de grupos M=O. Se plantearon y efectuaron reacciones conun barrido continuo de temperatura, como nueva metodología de trabajo para explorar las posibles reacciones entre metano y el sólido reactivo.
MATERIALES Y MÉTODOS
Se seleccionó un carbón activado comercial NORIT ROX 0,8, obtenido a partir de turba, y se sometió a oxidación en un reactor de acero inoxidable 316 provisto de un horno capaz de elevar la temperatura hasta 1000 ºC, un controlador de temperatura marca WATLOW serie 96, y una termocupla tipo K. Se cargaron 2,2 g de carbón activado NORIT ROX 0,8, se aumentó la temperatura a velocidad de 10 ºC/min en presencia de He (47,3 cm3/min). Cuando la temperatura llegó a 450 ºC se inició el flujo de O2 (2,9 cm3/min), sin suspender el flujo de He. El flujo de mezcla se mantuvo por 10 horas, y luego se dejó enfriar hasta temperatura ambiente en atmósfera de He. La alimentación de los gases se hizo con dos controladores de flujo másico marca BROOKS modelo 5850 E. Los materiales original y modificado se caracterizaron por análisis próximo, elemental, propiedades texturales y descomposición con temperatura programada como lo describen Briceño y cols. (10).
Para la reacción con metano, el sistema de reacción empleado consistió en un reactor de cuarzo en U con los mismos sistemas de control de temperatura y de alimentación de los gases que se emplearon en la oxidación del carbón. Para el análisis de los productos, el efluente del reactor se conectó en línea con un cromatógrafo de gases marca HP Serie 6890 plus con detector de conductividad térmica y sistema de inyección automático de muestra, la columna empleada fue una HP PLOT Q de 30 m (0,53 mm x 40 μm). El cromatógrafo se manejó desde un computador con el software HP Chem Station. Las condiciones utilizadas para la toma de los cromatogramas se muestran en la Tabla 1.

Antes de iniciar la reacción se purgaron las líneas de alimentación de CH4 y de He para eliminar impurezas. El reactor se cargó con 200 mg del carbón activado oxidado. Cada una de las reacciones se llevó a cabo a concentración constante de metano en el alimento, utilizando porcentajes molares de 30, 50, 74 y 100%. Las reacciones se hicieron con un barrido continuo de temperatura, iniciando a temperatura ambiente y finalizando a temperatura superior a 750 ºC. El metano (Union Carbide) y el He (Ingegas) utilizados fueron grado AP.
RESULTADOS Y DISCUSIÓN
El sólido escogido para realizar el trabajo fue un carbón activado NORIT ROX 0,8, cuya química superficial es fácil de modificar por tratamientos oxidativos, y la concentración de los grupos tipo C=O sobre su superficie puede cuantificarse por técnicas como descomposición con temperatura programada, DTP (10-15). En la Tabla 2 se presentan las características del carbón original y modificado.
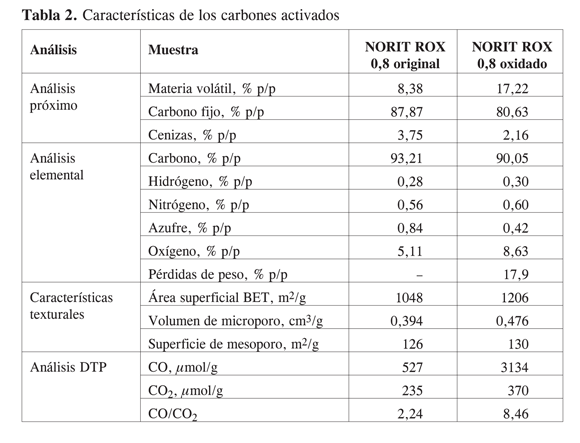
En la Tabla 2 puede observarse que los materiales carbonosos tienen bajo contenido de cenizas y alto contenido de carbono fijo, el cual disminuye por el tratamiento en el carbón oxidado, y se compensa por un mayor contenido de materia volátil; el incremento en la materia volátil (8,38% en el carbón original frente a 17,22% en el carbón oxidado) indica que el carbón modificado tiene un mayor grado de oxidación (10, 16, 17) ya que este tratamiento conduce a la ruptura dealgunas estructuras aromáticas, generando un mayor contenido de estructuras de tipo alifático en el material tratado con respecto al material original, que se desprenden como materia volátil en el material tratado con oxígeno; el mayor grado de oxidación en el material tratado con oxígeno se confirma además por el aumento en el contenido de este último compuesto dado por el análisis elemental. El carbón activado es un material que tiene un área superficial alta, y el tratamiento en oxígeno ocasiona un mayor desarrollo de la porosidad lo cual se nota por el aumento del volumen de microporo y la superficie de mesoporo calculados por el método t (10, 16, 17).
La descomposición con temperatura programada es una técnica popular para el estudio de la química superficial de materiales carbonosos (10, 13, 16, 17); los grupos de oxígeno superficial formados durante la preparación o subsecuente tratamiento del carbón se descomponen por calentamiento liberando CO y CO2 a diferentes temperaturas. De esta manera, el perfil de CO2 resulta de la descomposición de ácidos carboxílicos a temperaturas bajas y lactonas a temperaturas altas, además de los anhídridos carboxílicos que se descomponen liberando CO y CO2. Los fenoles, éteres, carbonilos y quinonas originan un pico de CO (13). Las temperaturas de descomposición de los grupos superficiales encontradas por deconvolución de los espectros en el trabajo de Figueiredo y cols. (13) fueron alrededor de los 820 K (547 °C) para los anhídridos, 940 K (667 °C) para las lactonas en el espectro de CO2, y 820 K (547 °C) para los anhídridos, 905 K (632 °C) para los fenoles y 1080 K (807 °C) para los carbonil/quinonas en el espectro de CO. Esta técnica suministra información única sobre la estabilidad térmica de los grupos superficiales en los carbonos sólidos, lo cual es importante para aplicaciones a temperaturas altas. En la Tabla 2 se observa que el incremento de la cantidad de CO y CO2 liberados por la descomposición de los grupos superficiales se incrementa con el tratamiento lo que indica un aumento de los grupos funcionales introducidos en la superficie. El incremento en la cantidad de CO liberado es mayor que el aumento en las cantidades de CO2 y, por tanto, la relación CO/CO2 aumenta como se observa en la Tabla 2; ello indica que el tratamiento realizado privilegia la formación de grupos que evolucionan a CO, que son los anhídridos, quinona, fenoles y carbonil quinona; todos, excepto el fenol, contienen grupos C=O.
Los resultados de las reacciones se muestran como curvas de producción acumulativa neta en función del tiempo en las Figuras 1 y 2; la línea continua indica el programa de aumento de temperatura, y las curvas de puntos representan los datos de reacción a las diferentes concentraciones de metano en el alimento. El tiempo cero marca el inicio de la alimentación de este gas. Vale la pena aclarar que el metano tiene como impurezas etano y dióxido de carbono, mientras que el helio presenta oxígeno y agua como impurezas. El contenido de éstas en ambos gases se estimó a partir de los resultados de ensayos en ausencia de carbón, y se descontaron estas cantidades para construir las curvas de producción acumulativa neta que se muestran en las figuras subsiguientes. También es importante anotar que se realizaron reacciones en ausencia de material carbonoso, en las mismas condiciones de reacción, para descartar la ocurrencia de reacciones en la fase homogénea.
En la Figura 1 se presenta la evolución de los compuestos oxigenados (CO, CO2 y H2O) durante los procesos de reacción entre carbón activado oxidado y mezclas con diferente concentración de metano en helio. En las curvas de evolución de CO (Figura 1a) se notan dos momentos de liberación sobresaliente de este compuesto: uno a baja temperatura que se asocia con el desprendimiento de oxígeno adsorbido en el carbón, posteriormente se presenta una evolución importante a partir de 450 ºC que se vincula con la descomposición térmica de grupos superficiales oxigenados del carbón, y que muestra una clara tendencia al agotamiento. Para porcentajes molares de metano inferiores a 74%, se observó un incremento en la producción de CO al incrementar la concentración de metano.
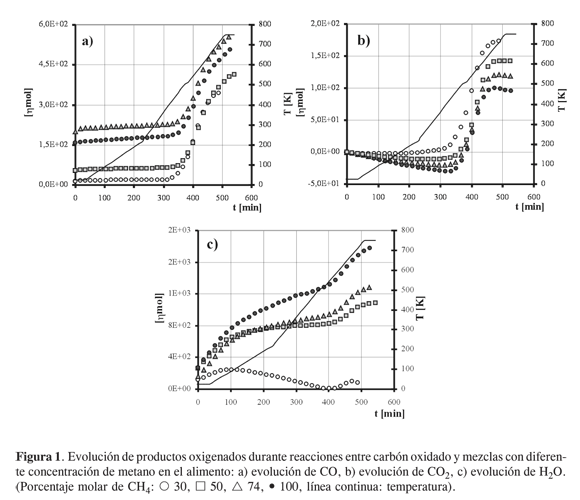
Las curvas de evolución de CO2 (Figura 1b) muestran un consumo de éste en los primeros momentos de reacción, y a partir de 450 ºC se presenta una evolución importante de CO2 que se relaciona con la descomposición térmica de los grupos superficiales oxigenados del carbón; esa evolución muestra una clara tendencia al agotamiento, y se desfavorece al incrementar la concentración de metano en el alimento.
El H2O (Figura 1c) presenta dos momentos de evolución sobresaliente: el primero de ellos se da alrededor de 100 ºC, y se relaciona con el desprendimiento de humedad adsorbida en el carbón; el segundo se presenta alrededor de 550 ºC, y se favorece con el incremento de la concentración de metano, razón por la cual puede afirmarse que su formación se debe a una reacción del metano con el carbón oxidado. La evolución de agua muestra una clara tendencia al agotamiento al aumentar la temperatura de trabajo, comportamiento análogo al presentado con la evolución de monóxido y dióxido de carbono.
En la Figura 2 se muestra la evolución de los productos no oxigenados (C2H4, C2H6, C3H8 y C4H10) que se formaro durante la reacción de metano con carbón activado oxidado. El incremento del porcentaje molar de metano en el alimento produjo el incremento en la producción de etileno, propano y butano; para el caso del etano, a pesar de que su menor producción acumulativa neta se presentó con el mayor porcentaje molar de metano, su velocidad de formación se incrementó al aumentar la concentración de metano en el alimento.
El etileno (Figura 2a) apareció como producto de la reacción a temperatura baja (50-100 ºC) pero en cantidades pequeñas; a partir de 500 ºC se observa su formación de manera importante, y crece al incrementar la temperatura de trabajo. El etano (Figura 2b) presentó un consumo aparente durante los primeros 450 minutos de reacción (650 ºC), pero a partir de ese momento se presentó su formación creciente al incrementar la temperatura.
La formación del propano (Figura 2c) se dio a partir de 400 ºC, mientras que el butano (Figura 2d) se formó desde 550 ºC; la formación de estos dos compuestos mostró tendencia al agotamiento al incrementar la temperatura de operación.
Para explicar la formación de los productos observados debe considerarse que el carbón activado, debido a su tratamiento con el oxígeno, desarrolla en su superficie diferentes grupos superficiales oxigenados tales como ácidos y anhídridos carboxílicos, lactonas, fenoles, éteres y, especialmente, grupos carbonilquinona dada la temperatura de tratamiento a que fue sometido (11-15, 17). Entre el carbón y diferentes especies gaseosas, pueden presentarse reacciones a alta temperatura, tal y como lo presenta Johnson (18):

Donde CF corresponde a sitios activos del carbón y C(X) significaX quimisorbido sobre el mismo. Las primeras cinco reacciones son quimisorciones de especies que pueden estar presentes durante la gasificación. Las siguientes nueve son transformaciones directas de las especies quimisorbidas o reacciones de las mismas con reactivos del entorno. En el carbónactivado previamente oxidado abundan los grupos tipo C(O) que participan en la gasificación como se muestra en las ecuaciones 3, 7, 8, 10, 12 y 13.
Estas reacciones, más los resultados obtenidos en este trabajo en presencia de concentraciones altas de metano, permiten sugerir las siguientes reacciones complementarias de formación de hidrocarburos:

Los grupos C(O) quimisorben el metano y su impureza, el etano (reacciones 15, 17, 19 y 21). La quimisorción se da de dos maneras: adicionando radicales alquilo al centro activo que se complementa con la adición de hidrógeno al oxígeno (reacciones 15, 19 y 21), o formando grupos alcoxi más la adición de hidrógeno al centro activo (reacción 17). Las reacciones 16 y 18 pueden responder por la producción continua de etileno y etano por cuanto la primera reproduce el grupo C(H2) requerido, mientras la segunda reproduce el C(O) y permite la catálisis en la formación de etano.
De otro lado, las reacciones 20, 22, 23 y 24 producen los hidrocarburos observados desde el etileno hasta el butano, presentándose el consumo de los grupos C(O) reactivos, con lo cual se suspenden las reacciones.
Por último, el agua se produce por vías múltiples pero también se consume por las reacciones 4, 7 y 13 correspondientes a la gasificación normal, a partir de lo producido, pero también de lo alimentado como impurezas medidas del helio.
De acuerdo con los resultados obtenidos, al incrementar la temperatura de reacción cesó la formación de propano y butano, mientras que se sostuvo la forma ción de etano y etileno; en vista de este comportamiento –que denota el agotamiento de especies involucradas en la formación de los dos primeros–, el manejo de los datos que se presenta a continuación sólo se hizo para el etano y el etileno. Utilizando los datos obtenidos en el reactor diferencial es posible evaluar la cinética de las reacciones de formación de etano y etileno a través de la siguiente expresión de balance instantáneo de materia en el reactor:
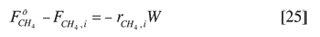



W: masa de carbón o de catalizador presente en el reactor.
Sustituyendo la definición de conversión del metano hacia el componente i, y despejando la cinética de la reacción, se encuentra la siguiente expresión:

donde:
Xi: conversión del metano hacia el componente i.
Dicha conversión se puede evaluar experimentalmente como la relación entre el flujo molar del producto en el efluente del reactor y el flujo molar del metano en el alimento al reactor.
Si la cinética de la reacción fuera de primer orden con respecto al metano, entonces tendría la siguiente forma:
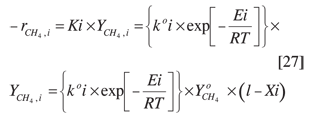
donde:

Ki: constante específica de velocidad de la reacción de formación del componente i.
k°i: factor pre-exponencial de la constante específica de velocidad de formación del componente i.
Ei: energía de activación de la reacción que da como producto el componente i.
Al igualar las ecuaciones 26 y 27, se puede despejar el valor de la velocidad específica de reacción. Tomando el logaritmo natural de la velocidad específica, se encuentra la siguiente expresión:
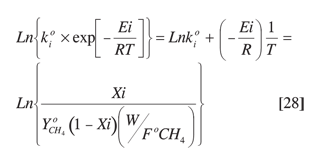
donde:
Ki: constante específica de velocidad de la reacción de formación del componente i.
k°i: factor pre-exponencial de la constante específica de velocidad de formación del componente i.
Ei: energía de activación de la reacción que da como producto el componente i.
Xi: conversión del metano hacia el componente i.

W: masa de sólido reactivo empleada en la reacción.

T: temperatura de reacción.
La aplicación de la ecuación 28 a los puntos obtenidos durante las reacciones de formación de etano y etileno a partir de 500 ºC, y su ajuste por regresión lineal, condujo a las constantes cinéticas que se consignan en la Tabla 3.
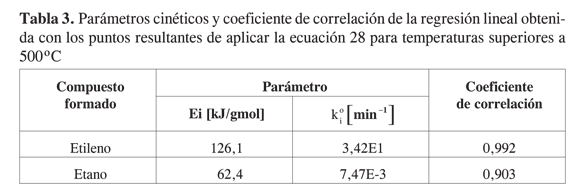
Los coeficientes de correlación de las regresiones lineales fueron cercanos a uno tanto para el etano como para el etileno, indicando que la suposición de cinética de primer orden aparente con respecto al metano puede ser correcta.
CONCLUSIONES
La metodología propuesta de reacción con temperatura programada demostró su utilidad para discernir diferentes tipos de reacción entre metano y carbón activado oxidado.
Las reacciones con temperatura programada entre el metano y el carbón activado oxidado permitieron detectar reacciones a temperatura baja (menor a 150 ºC) de formación de etileno, reacciones a temperatura intermedia (400 a 600 ºC) de formación de propano, butano, agua, monóxido y dióxido de carbono, y reacciones a temperatura elevada (500 ºC en adelante) de formación de etileno y etano. Las reacciones de temperatura baja e intermedia tienden a detenerse, mientras que las de alta temperatura se sostienen con el aumento de ésta. El aumento en la concentración de metano favorece la formación de hidrocarburos. La cinética delas reacciones de formación de etano y etileno por reacción de metano con carbón oxidado fue de primer orden aparente con respecto al metano.
AGRADECIMIENTOS
Los autores agradecen al Laboratorio de Investigación en Combustibles y Energía del Departamento de Química de la Universidad Nacional de Colombia por la colaboración para la realización de este trabajo.
REFERENCIAS BIBLIOGRÁFICAS
1. British Petroleum Company. BP Statistical Review of World Energy June 2004. London, British Petroleum Company. 2004. p 40. [ Links ]
2. Lunsford, J. H. Catalytic conversion of methane to more useful chemicals and fuels: a challenge for the 21st century. Catalysis Today. 2000. 63: 165-174. [ Links ]
3. Zaman, J. Oxidative processes in natural gas conversion. Fuel Processing Technology. 1999. 58: 61-81. [ Links ]
4. Otsuka, K.; Wang, Y. Direct conversion of methane into oxygenates. Applied Catalysis A: General. 2001. 222: 145-161. [ Links ]
5. Sokolovskii, V.; Covillea, N.; Parmaliana, A.; Eskendirov, I.; Makoa, M. Methane partial oxidation: Challenge and perspective. Catalysis Today. 1998. 42: 191-195. [ Links ]
6. Conde, L. Funcionalización de metano. Trabajo de grado. Universidad Nacional de Colombia. Bogotá. 2003. p. 70. [ Links ]
7. López, M. Evaluación de un catalizador para la obtención de metanol a partir de metano parte I. Trabajo de grado. Universidad Nacional de Colombia. Bogotá. 2001. p. 65. [ Links ]
8. Smith, M. R. Transient isotopic labeling studies under steady-state conditions in partial oxidation of methane to formaldehyde over molibdenum trioxide catalyst. Journal of Catalysis. 1993. 142(1): 226-236. [ Links ]
9. Smith, M. R.; Ozkan, U. S. The partial oxidation of methane to formaldehyde: role of different crystal planes of MoO3. Journal of Catalysis. 1993. 141: 124-139. [ Links ]
10. Briceño, N.; Guzmán, M.; Díaz, J. Grupos superficiales en materiales carbonosos. Caracterización por diferentes técnicas. Revista Colombiana de Química. 2007. 36(1): 121-130. [ Links ]
11. Biniak, S.; Szymánski, G.; Siedlewski, J.; Swiatkowski, K. The characterization of activated carbons with oxygen and nitrogen surface groups. Carbon. 1997. 35(12): 1799-1810. [ Links ]
12. Domingo, M.; López, F.; Pérez, M. Modification of an activated carbon by several oxidation treatments. En: Eurocarbon 2000. Berlín. 1st World Conference on Carbon. 2000. 155-156. [ Links ]
13. Figueiredo, J. L.; Freitas, M. M.; Pereira, M. F.; Orfao, J. J. Modification of the surface chemistry of activated carbons. Carbon. 1999. 37: 1379-1389. [ Links ]
14. Haydar, S.; Moreno, C.; Ferro, M. A.; Carrasco, F.; Rivera, J.; Perrard, A. y cols. Regularities in the temperature programmed desorption spectra of CO2 an CO from activated carbons. Carbon. 2000. 38: 1297-1308. [ Links ]
15. Moreno, C.; López, M.; Carrasco, F. Changes in surface chemistry of activated carbons by wet oxidation. Carbon. 2000. 38(14): 1995-2001. [ Links ]
16. Díaz Velásquez, J. de J.; Carballo Suárez, L. M.; Figueiredo, J. L. Oxidative dehydrogenation of isobutane over activated carbon catalyts. Applied Catalysis A: General. 2006. 311: 51-57. [ Links ]
17. Díaz Velásquez, J. de J.; Carballo Suárez, L. M.; Figueiredo, J.L. Thermal treatments of activated carbon catalyts under N2O. Carbon. 2007. 45(1): 212-214. [ Links ]
18. Johnson, J. L. Kinetics of Coal Gasification. New York, John Wiley & Sons. 1979. p. 324. [ Links ]














