Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804On-line version ISSN 2357-3791
Rev.Colomb.Quim. vol.36 no.3 Bogotá Sep./Dec. 2007
REMOCIÓN DE CROMO VI DE SOLUCIONES ACUOSAS POR ADSORCIÓN SOBRE CARBONES ACTIVADOS MODIFICADOS
REMOVAL OF CROMIUM (VI) FROM AQUEOUS SOLUTIONS OVER MODIFIED ACTIVATED CARBONS
REMOÇÃO DE CRÓMIO VI DE SOLUÇÕES AQUOSAS POR ADSORÇÃO EM CARVÕES ACTIVADOS MODIFICADOS
Nubia E. Céspedes1, Jesús S. Valencia1, José de J. Díaz1
1Departamento de Química, Universidad Nacional de Colombia, Sede Bogotá, Bogotá, Colombia. necespedesp@unal.edu.co
Recibido: 24/07/07 – Aceptado: 28/11/07
RESUMEN
En este trabajo se determina la adsorción de Cr6+ de disoluciones acuosas en dos carbones activados comerciales en función del grado de modificación (reducción, oxidación) de la superficie de los adsorbentes, con tratamientos térmicos en presencia de hidrógeno, oxígeno y ácido nítrico. La química superficial de los carbones activados originales y modificados se examina por los métodos de titulaciones de Böehm y descomposición con temperatura programada (DTP). Los ensayos de evaluación de la capacidad de adsorción se realizan con soluciones modelo de ión cromato y bajo distintas condiciones de concentración inicial, tiempo de contacto, pH del medio, temperatura y masa de adsorbente. Se comprueba que la modificación de la superficie de los adsorbentes afecta el grado de adsorción del ión cromato en la medida en que los sólidos tratados con H2 muestran la mayor capacidad de remoción. Las variables que afectan favorablemente la extensión de la remoción de cromo son: concentración inicial de 100 ppm, pH inicial de 2,0, temperatura de 25 °C y masa de adsorbente de 100 mg.
Palabras clave: carbón activado, química superficial, tratamientos térmicos, remoción de Cr VI.
ABSTRACT
In this work, the influence of the degree of surface modification of activated carbons in the adsorption of Cr6+ from aqueous solution was determined modifying two commercial activated carbons by thermal oxidative and reductive treatments (oxygen or nitric acid and hydrogen, respectively). The surface chemistry of the original and modified activated carbons was examined by Böehm’s titrationand thermal programmed decomposition (TPD). The adsorption capacities were tested with model solutions of chromate ion, and under different initial concentrations, contact times, pH, temperature and adsorbent mass. The surface chemistry modifications showed that they have an important influence in the adsorption capacity of the activated carbons, being the hydrogen modified carbons the best for the chromate ion adsorption. The conditions that presented the maximum adsorption capacity were: initial concentration of 100 ppm, initial pH of 2.0, temperature of 25°C and adsorbent mass of 100 mg.
Key words: Activated carbon, surface chemistry, thermal treatments, Cr VI removal.
RESUMO
Neste trabalho estudou-se a adsorção de Cr6+ de soluções aquosas em dois carvões activados comerciais em função do grau de modificação (redução, oxidação) da superfície dos adsorventes com tratamentos térmicos na presença de hidrogénio, oxigénio e ácido nítrico. A química superficial dos carvões activados originais e modificados foi examinada pelos métodos de titulação de Böehm e de decomposição a temperatura programada (DTP). Os ensaios de avaliação da capacidade de adsorção realizaram-se com soluções modelo de ião cromato sob diferentes condições de concentração inicial, tempo de contacto, pH do meio, temperatura e massa de adsorvente. Comprovou-se que a modificação da superfície dos adsorventes afecta a extensão da adsorção do ião cromato, sendo que os sólidos tratados com H2 mostram a maior capacidade de remoção. As variáveis que afectam favoravelmente a extensão da remoção do crómio são: concentração inicial de 100 ppm, pH inicial de 2.0, temperatura de 25ºC e massa de adsorvente de 100 mg.
Palavras-chave: carvão activado, química superficial, tratamentos térmicos, remoção de Cr VI.
INTRODUCCIÓN
El cromo con número de oxidación 6+ (presente en los iones cro4 = y cr2o7 =) es un oxidante poderoso, altamente tóxico (1-3), y está clasificado como un agente carcinogénico (4, 5). Ciertas labores antrópicas como el revelado de películas fotográficas, los procesos de curtiembre y la galvanoplastia, entre otras, involucran el uso frecuente del cromo. Como resultado de estas actividades, en Colombia se vierten cerca de 300 toneladas por año de derivados del cromo a los cursos de agua, lo cual promueve que los controles sobre tales vertimientos sean cada día más estrictos, con el propósito de mitigar el impacto que este tipo de compuestos genera para la flora y la fauna de las zonas donde se depositan.
Existen distintas alternativas para tratar el problema del cromo en los efluentes acuosos como son la sustitución parcial o total por otros agentes en curtiembres, la disminución de la concentración residual de cromo mediante técnicas que aumenten la fijación de éste en el cuero, la reutilización del cromo contenido en los baños agotados y, por supuesto, la remoción con adsorbentes. La remoción mediante sólidos adsorbentes es una práctica muy extendida ya sea como estrategia de control o como parte de un conjunto de actividades encaminadas a remediar el dañoambiental causado por tales sustancias. Entre los adsorbentes más usados se destacan las arcillas (naturales y modificadas) (6), las zeolitas (7, 8) y el carbón activado (9-10), entre otros materiales.
El estudio de la capacidad de adsorción del carbón activado, frente a numerosos adsorbibles orgánicos e inorgánicos, presentes en medio acuoso, tiene un especial interés tanto científico como tecnológico. En primer lugar, el carbón activado es un sólido poroso versátil, relativamente estable, con alta área superficial y con una estructura de microporos que no constituyen marcadas barreras de difusión aún bajo conformaciones granulares compactas (11); en segundo término, el carbón activado es un material renovable en la medida en que se obtiene a partir de materias primas vegetales (residuos agrícolas, madera, algas, semillas, cortezas), hulla, lignitos, turba y residuos poliméricos (caucho, plásticos, textiles); finalmente, las estructuras tipo grafeno del carbón activado poseen grupos funcionales que en virtud del método de activación o del tratamiento químico (oxidativo o reductivo) confieren al adsorbente características fisicoquímicas de superficie excepcionales, que luego afectan los mecanismos de adsorción. La influencia de la química superficial de los carbones activados en las propiedades de adsorción es objeto de investigación debido a que los grupos presentes en la superficie le confieren selectividad (12-18). En función de su origen y del método de preparación (reacciones heterogéneas gas-sólido entre el material carbonoso y las sustancias activantes), el carbón activado puede alcanzar áreas superficiales del orden de los 1500 m2; g1. El área de un carbón activado es una propiedad que se relaciona con la distribución, la morfología y el tamaño de los poros.
Este trabajo tiene como propósito contribuir al conocimiento del proceso de adsorción de cromo, como ión cromato o dicromato, sobre carbón activado granular (CAG) a partir de soluciones modelo, examinando para ello la influencia en la capacidad de adsorción de algunas variables como concentración de adsorbible, pH del medio, temperatura de adsorción y naturaleza de la superficie del adsorbente.
MATERIALES Y MÉTODOS
Los materiales adsorbentes utilizados en el presente estudio corresponden a dos carbones activados, C*CHEM® (CAC) de morfología granular, origen lignocelulósico y elaborado a partir de cuesco de coco y NORIT ROX 0.8® (CAN), granular, de origen lignítico sometido a tratamientos ácidos con el propósito de disminuir el contenido de cenizas. Los carbones activados fueron modificados por tratamientos en fase gaseosa y en fase líquida, con el objeto de obtener diferentes características texturales y de química superficial. Los tratamientos realizados fueron: oxidación con oxígeno al 8,8% en nitrógeno, oxidación con HNO3 5M y reducción con hidrógeno. Los materiales obtenidos se caracterizaron mediante análisis próximo, características texturales por adsorción de N2 a 77 K (métodos BET, t y Dubinin-Radushkevich), y evaluación de los grupos superficiales por los métodos de Böehm y de descomposición con temperatura programada. Tanto el procedimiento modificatorio de los materiales como la descripción de los métodos de caracterización son descritos por DíazVelásquez y cols. (13), y Briceño y cols. (18).
El medio de adsorción está conformado por una solución acuosa “modelo” de cromo 6+ que se prepara en agua desionizada a partir de K2Cr2O7 o de K2CrO4. Las distintas concentraciones del adsorbible se obtienen a partir de una disolución “stock” de 1000 ppm de Cr; en cada caso el pH se ajusta con disolución de ácido nítrico 0,2 M o de hidróxido de potasio. Para realizar el proceso de adsorción, la disolución de cromo se dispone en una celda termostatada; una vez se verifica la temperatura de trabajo, se adiciona el adsorbente (carbón activado granular) previamente pesado y se permite el alcance de la condición de equilibrio (entre 60 y 180 min); posteriormente se toma una alícuota, con la ayuda de un pipeteador automático, y se determina el contenido residual de ión cromato por espectrofotometría UV-Vis, desarrollando color con DPC en medio ácido, y leyendo la absorbancia a 540 nm (19-23).
Para cada adsorbente tratado a las distintas condiciones de oxidación y reducción, se cuantifica la capacidad de adsorción (mg g–1) tomando como variables la concentración inicial de la disolución de cromo, la masa de adsorbente, la temperatura del medio, el tiempo de contacto y el pH. Las concentraciones de cromo ensayadas son 10, 100 y 1000 ppm; la masa de carbón activado se modifica entre 0,1 y 2,0 g; la temperatura se cambia entre 25 y 50 °C; el tiempo de contacto se varía entre 10 y 120 min; el pH se modifica entre 2,0 y 8,0.
RESULTADOS Y DISCUSIÓN
Caracteristicas de los absorbentes
Extensión del quemado, análisis próximo y pH. En la Tabla 1 se muestran los resultados de la extensión de los tratamientos (porcentaje de quemado), análisis próximo y pH de los carbones activados modificados y sin modificar. Los datos de quemado indican que el tratamiento conoxígeno es el que induce la mayor pérdida de masa, mientras que el ácido nítrico y el hidrógeno dan valores relativamente pequeños.
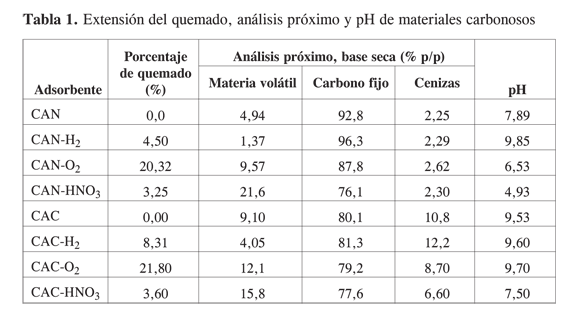
Comparativamente, los valores de porcentaje de quemado son ligeramente superiores en los carbones CAC con respecto a los carbones CAN. El carbón CAN se caracteriza por valores relativamente bajos de volátiles y de cenizas, mientras que el tratamiento con hidrógeno disminuye notablemente los volátiles. El tratamiento con agentes oxidantes (oxígeno y ácido nítrico) aumentó significativamente el contenido de volátiles y redujo el carbono fijo; llama la atención el hecho de que el ataque con HNO3 resulta más agresivo que el tratamiento con oxígeno en el sentido de que la pérdida de volátiles fue del 21,6% contra el 9,57%.
El carbón CAC presenta casi el doble de contenido de materia volátil, 5 veces mayor contenido de cenizas, y menor cantidad de carbono fijo, con relación al carbón CAN. El tratamiento reductivo (CAC-H2) disminuye la materia volátil, incrementa ligeramente las cenizas y no modifica el carbono fijo; es claro que los procedimientos oxidantes ejercen efectos notables sobre la cantidad de materia volátil y sobre el carbono fijo; además, contrario a lo observado para el carbón CAN, la carga de cenizas no solo disminuye con relación al material sin tratar, sino que la oxidación con HNO3 disminuye el contenido de cenizas en casi seis puntos porcentuales. El pH del CAN sin tratamiento es de 7,89, ligeramente básico; el contacto con hidrógeno lo hace aún más alcalino, la exposición al oxígeno genera una condición de pH muy cercana a la neutralidad (pH=6,53), pero el HNO3 conduce a un material ácido (pH=4,93). El carbón activado CAC sin tratamiento presenta un pH básico (pH = 9,53) que aumenta levemente como efecto de la exposición del adsorbente a hidrógeno y a oxígeno.
Características texturales. Los carbones activados exhiben isotermas de adsorción de nitrógeno a 77 K tipo I, característica de sólidos microporosos, tal como se destaca en la Figura 1. Existen,sin embargo, para los carbones CAN anillos pequeños de histéresis que se manifiestan a presiones relativas superiores a 0,510. Es evidente que el tratamiento de este carbón con oxígeno incrementa la capacidad de adsorción del sólido, mientras que la exposición al hidrógeno y al ácido nítrico no solo disminuye la adsorción sino que además suprime la histéresis; adicionalmente, el oxígeno parece afectar la histéresis en la medida en que la limita a presiones relativas superiores a 0,550. La capacidad de adsorción del CAC se muestra un poco más baja que la del carbón CAN sin tratamiento pero comparativamente igual que el CAN-H2 y el CAN-HNO3. La exposición del carbón CAC a ácido nítrico induce un anillo de histéresis que se manifiesta a presiones relativas mayores a 0,480; la reducción con hidrógeno no produce histéresis.
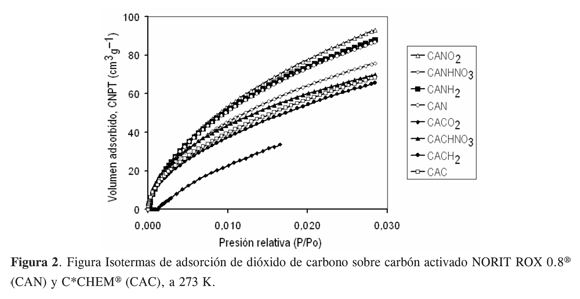
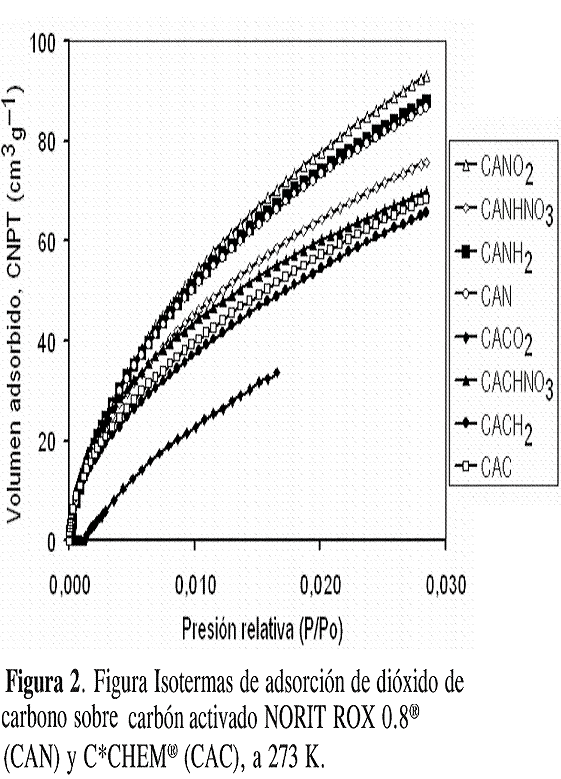
Tal como se ilustra en la Figura 2, la adsorción de CO2 a 273 K sobre los carbones CAN y CAC –modificados y sin modificar– se traduce en isotermas tipo I según la clasificación de la IUPAC. La capacidad de adsorción de CO2 de los distintos sólidos se puede organizar en la secuencia CAN-O2 > CAN-H2 ≈ CAN > CAN-HNO3 > CAC-HNO3 > CAC > CAC-H2. En conjunto, es posible observar que cualquiera de los tratamientos (oxidativos o reductivos) conduce a mayor capacidad de adsorción en los carbones CAN.
A partir de las isotermas de adsorción de N2 a 77 K y de CO2 a 273 K, fue posible calcular las distintas propiedades de textura para los carbones activados, objeto de este estudio. Los resultados se muestran en la Tabla 2. En primer lugar vale destacar que el área –calculada por el método BET– de los adsorbentes es prácticamente la misma; sin embargo, la diferencia entre estos materiales parece residir en el área equivalente de microporos (822 y 721 m2 g-1, respectivamente) determinada por adsorción de CO2; de otra parte, el área de mesoporos es distinta; en consecuencia, los volúmenes de microporo son similares y el tamaño, estimado a partir de las isotermas de N2, es apenas mayor en el carbón CAN. En ambos adsorbentes la exposición al hidrógeno nomodifica el área BET, mientras que el tamaño de microporo parece aumentar ligeramente en el carbón CAN. En éste, el volumen de microporo, determinado por adsorción de CO2, tiende a disminuir, mientras que en el carbón CAC parece aumentar; estas tendencias se manifiestan al estimar el área equivalente de microporos. Un hecho evidente es que el área de mesoporos disminuye notablemente con relación a los sólidos sin tratamiento.
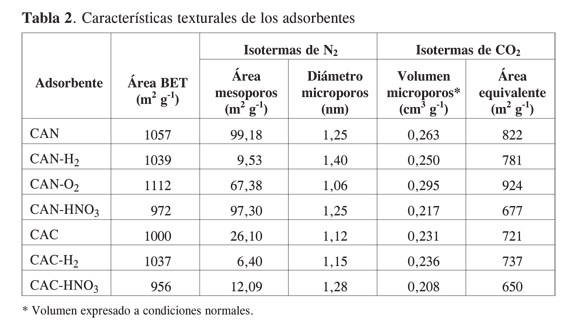
La exposición al oxígeno incrementa ligeramente el área BET, el caso más notable corresponde al adsorbente CAN-O2. El área de mesoporos disminuye poco y el área equivalente (concomitante con el incremento del volumen de microporo estimado por CO2) aumenta en un 12%, con respecto al carbón sin oxidar. El ataque con HNO3 disminuye en 8,0% el área BET del CAN, y en 4,4% en el CAC; estos valores no son muy significativos; de igual forma, el área de mesoporos no se afecta en el absorbente CAN mientras que en el CAC cae marcadamente en 53,7%; en ambos casos, el diámetro promedio de microporos no se modifica apreciablemente. El volumen de microporo, y consecuentemente el área equivalente calculados a partir de los datos de adsorción de CO2 señalan que el tratamiento con ácido nítrico modifica la textura de los carbones. De una parte, se observa que para el carbón CAN-HNOV3 el área equivalente es de 677 m2g-1, esto es, un 82,4% del valor del parámetro observado en el material sin oxidar; para el carbón CAC-HNO3, el área equivalente es de 650 m2g-1, que equivale al 90% del dato obtenido en el mismo sólido sin tratamiento.
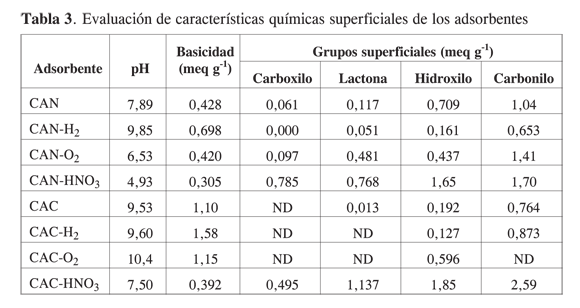
Evaluación de grupos superficiales. En la Tabla 3 se presentan los datos correspondientes a la evaluación de la química superficial de los materiales. Como resultado de la aplicación del método de Böehm es factible asociar la fuerza ácida de los diversos agentes de valoración a la existencia de posibles grupos funcionales en la superficie del carbón; así, es claro que los grupos carboxilo parecen estar restringidos, según esta técnica, a los carbones CAN; sólo el tratamiento con ácido nítrico induce la presencia de estos grupos en las estructuras grafénicas. Otro caso evidente es que la exposición al hidrógeno suprime los grupos carboxilo (anhídrido yácido carboxílico) en el carbón NORIT ROX 0.8®; es cierto, además, que el HNO3 contribuye a la formación de estructuras muy ricas en oxígeno (carboxilo y lactona). Debe tenerse en cuenta que los tratamientos en oxígeno e hidrógeno se llevaron a cabo a temperaturas altas superiores a 1000 K, haciendo que los ácidos carboxílicos no aparezcan o sean muy pocos.
La Tabla 3 muestra que los carbones CAN y CAC tienen un alto contenido de grupos carbonilo en la superficie (1,04 y 0,76 meq g-1). Es evidente también que estos grupos son algo “resistentes” a la acción del hidrógeno en comparación con los hidroxilos, las lactonas y los carboxilos; incluso, en el sólido CAC se observa una tendencia al incremento. Por lo demás, es claro que el oxígeno y el ácido nítrico aumentan la cantidad de estos grupos funcionales (1,41 y 1,70 meq g-1) en el carbón NORIT ROX 0.8® y, 2,59 meq g-1 (el valor más alto obtenido) en el carbón C*CHEM®. En líneas generales es posible observar que los distintos tratamientos inducen en los adsorbentes grupos funcionales con la siguiente tendencia en orden de abundancia: carbonilos>hidroxilos> lactonas > carboxilos.
De acuerdo con el procedimiento sugerido por Figueiredo y cols. (24), en la Tabla 4 se muestra la cuantificación de los diferentes grupos funcionales obtenidos para los distintos tratamientos de los carbones activados, en función de la cantidad de CO2 y CO producidos durante las pruebas DTP. Los datos indican que el tratamiento con ácido nítrico promueve en conjunto la mayor cantidad de grupos superficiales oxigenados que liberan CO2 (lactonas, anhídridos y ácidos carboxílicos), en comparación con la exposición a oxígeno y a hidrógeno. Se pone en evidencia que el tratamiento en hidrógeno disminuye significativamente los grupos superficiales ricos en oxígeno.
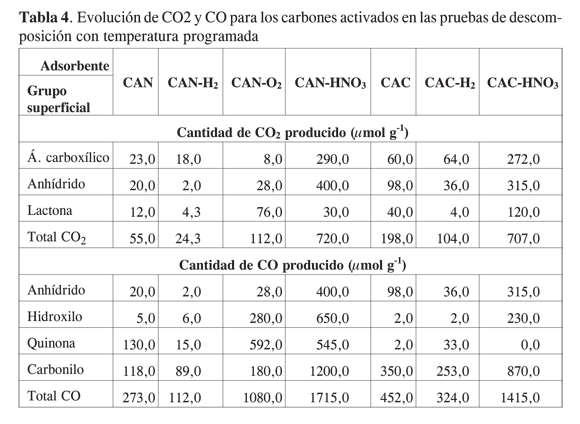
Por otro lado, dado que el monóxido de carbono evoluciona bajo tratamiento térmico por descomposición de anhídridos carboxílicos, hidroxilos unidos a carbono, carbonilos y quinonas, se verifica, como era de esperarse, que la mayor población de estos grupos superficiales se genera como consecuencia de los tratamientos con oxígeno y ácido nítrico e, igualmente, el tratamiento en hidrógeno los disminuye de manera apreciable.
Estudio de la capacidad de adsorción de cromo
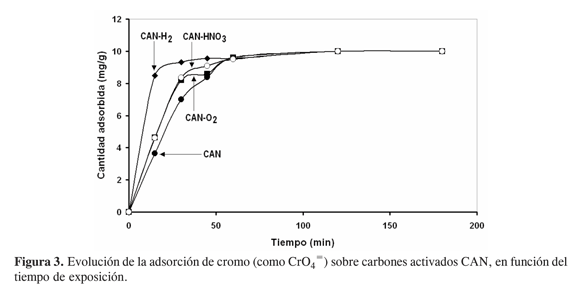
En la Figura 3 se ilustra el comportamiento de los carbones activados CAN y sus modificaciones bajo las siguientes condiciones: concentración inicial de 25 ppm de cromo, pH de 2,0 y masa de adsorbente de 100 mg. Los resultados muestran que el tratamiento con hidrógeno origina una superficie y una textura que retienen con rapidez el adsorbible con relación al sólido no tratado que adsorbe más lentamente. La máxima capacidad de adsorción del material tratado con hidrógeno se alcanza hacia los 17 min; para los adsorbentes oxidados y el carbón sin tratamiento, la capacidad máxima (mg g–1) se verifica hacia los 60 min. Después de este tiempo, todos los carbones presentan idéntica cantidad adsorbida (9,5 mg g-1).
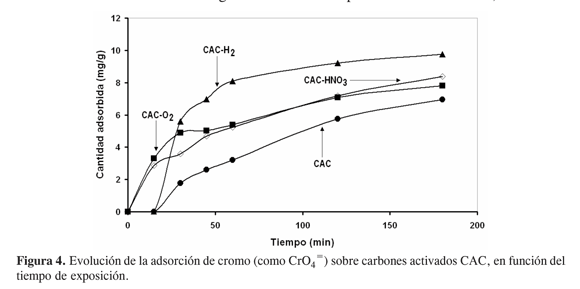
Bajo las condiciones del ensayo, los carbones activados CAC y sus tratamientos despliegan una menor capacidad de adsorción con respecto a los carbones CAN; sin embargo, tal como se muestra en la Figura 4, es evidente que los tratamientos térmicos en atmósfera oxidante o reductora aumentan de manera significativa la cantidad adsorbida siendo ésta muy notoria para el sólido CAC-H2, aunque con el mismo “periodo de inducción” obtenido para el adsorbente sin tratamiento.
Es claro que los tratamientos oxidativos (con oxígeno o con ácido nítrico) suprimen el “periodo de inducción” pero, al igual que el sólido original, el tiempo de equilibrio (de saturación de la superficie) se sitúa más allá de los 150 min; por el contrario, la tendencia observada con el material “reducido” con hidrógeno sugiere que el tiempo para alcanzar la máxima adsorción (8,0 mg g-1) es tan solo de 50 min. En términos comparativos, es posible establecer que en las condiciones del medio de adsorción, los carbones presentan un mejor comportamiento para la adsorción de cromo (como CrO4 =), aún después de tratamientos oxidantes y reductores, que los carbones CAC.
A partir de la Figura 5, que muestra la variación de la capacidad de adsorción de cromo en función del pH inicial de la solución para los carbones CAN, se establece que la cantidad adsorbida disminuye paulatinamente en la medida en que se incrementa el pH. Para todos los adsorbentes, estos resultados indican que el pH del medio de adsorción más adecuado para la remoción de cromo es de 2,0.
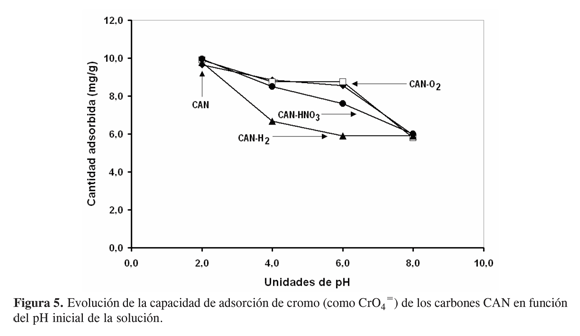
Tal parece además que los tratamientos con oxígeno y ácido nítrico incrementaron la capacidad “reguladora de pH” del carbón, toda vez que en el rango de pH comprendido entre 2,0 y 6,0, la capacidad de adsorción tan sólo cayó de 10 a 8 mg g-1, en el adsorbente original, y de 10 a 9 mg g-1 en los carbones oxidados. El adsorbente reducido (CAN-H2) disminuyó rápidamente la capacidad de adsorción de cromo (de 10 a 6,5 mg g-1) al avanzar el pH entre 2,0 y 4,0; luego, a pH mayor de 4,0, la cantidad removida cae asintóticamente a 6 mg g-1. A pH 8,0 sin embargo, todos los sólidos presentan idéntica capacidad de adsorción (6 mg g-1).
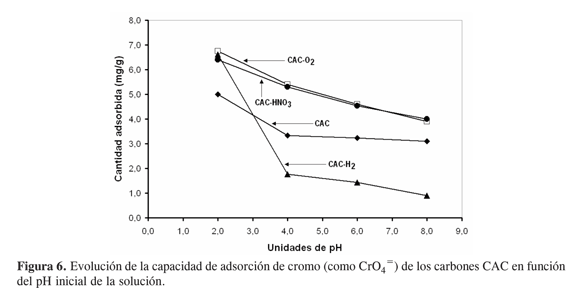
Los efectos del pH de la solución inicial de cromo sobre la capacidad de adsorción de los carbones activados CAC, modificado y sin modificar, son apreciables. Este comportamiento se destaca en la Figura 6. En primer lugar, se observa que la cantidad adsorbida de cromo se incrementa en la medida en que disminuye el pH del medio de adsorción. Así, tal parece que el carbón activado CAC sin tratamiento despliega su máxima capacidad de adsorción (5 mg g-1) a pH menor de 2,0; luego decrece suavemente hasta valores cercanos a 3, y se mantiene a pH 8,0. En segundo lugar, los tratamientos oxidativos incrementan la cantidad adsorbida en función del pH (valores cercanos a 7 mg g-1 a pH 2,0) y comparativamente, el decremento en función de pH es mucho más suave que para el caso del material original; la cantidad retenida a pH8 es del orden de 4 mg g-1.
Finalmente, aunque la cantidad removida a pH 2,0 (6,5 mg g-1) por el carbón reducido en atmósfera de hidrógeno es la misma que la de los sólidos oxidados (CAC-O2 y CAC-HNO3), la capacidad de adsorción de este sólido es muy sensible al pH en la medida en que a pH 4,0 disminuye a 2 mg g-1, y a pH 8,0 tan sólo es de 1 mg g-1.
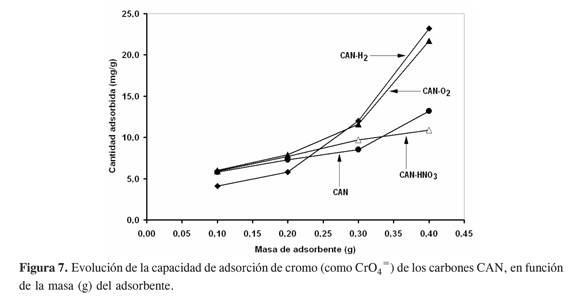
La Figura 7 señala el efecto de la masa de adsorbente sobre la capacidad de adsorción de cromo para los carbones CAN. Entre 100 y 300 mg, el carbón sin modificar, CAN, muestra un incremento lineal en la capacidad de adsorción; para cargas mayores a 300 mg, la cantidad removida se hace mayor. El adsorbente tratado con HNO3 muestra una tendencia lineal, mientras que los sólidos expuestos al oxígeno y al hidrógeno sugieren tendencias exponenciales; en estos materiales la capacidad de adsorción crece notablemente con la masa de adsorbente, aunque a cargas menores de 200 mg la capacidad de remoción del carbón reducido es ciertamente menor con respecto a los carbones no tratados y oxidados, lo cuales exhiben la misma cantidad.
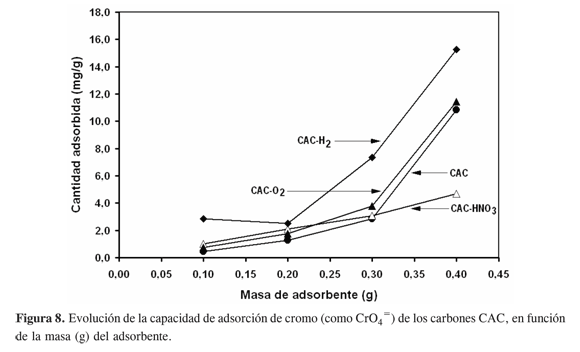
Tal como se muestra en la Figura 8, la capacidad de adsorción en función de la masa de adsorbente para el carbón CAC-HNO3 muestra un comportamiento lineal; el carbón original CAC, el adsorbente modificado con oxígeno CAC-O2, y el sólido tratado con hidrógeno CAC-H2 muestran una dependencia de la cantidad adsorbida de cromo que es prácticamente exponencial con la masa de adsorbente; las tendencias del material expuesto al oxígeno, y del carbón sin modificar, son similares y exhiben cantidades retenidas que son menores a las observadas con el CAC-H2.
En general, de la Figura 8 también se desprende, en comparación con la Figura 7, que aún a la carga de adsorbente más alta (400 mg) los carbones CAN producen para los mismos tratamientos superficies que tienen mayor capacidad de adsorción de cromo que los carbones CAC; en ambos casos se resalta, sin embargo, que la exposición al hidrógeno genera adsorbentes modificados (CAN-H2 y CAC-H2) con mayor poder de remoción de cromo desde soluciones acuosas.
En este trabajo se comprueba que los tratamientos oxidantes o reductores del carbón activado modifican la capacidad de adsorción del ión cromato desde disoluciones acuosas, y que además de la textura, la dinámica de remoción del adsorbible depende de los grupos funcionales presentes en la superficie del adsorbente, es función del pH, guarda relación con la concentración inicial, y es extensiva frente a la masa del sólido. En este sentido se examinan dos adsorbentes: un carbón activado CAC, que sin tratamiento tiene un pH básico (pH = 9,53), y un CAN, que en iguales condiciones tiene un pH de 7,89; esto es, ambos materiales son básicos. Así, con frecuencia estos sólidos se denominan carbones H ya que desarrollan grupos básicos superficiales que al contacto con agua incrementan el pH de la solución y exhiben un potencial zeta| positivo; por tanto, estos materiales son capaces de adsorber sustancias ácidas y, por supuesto, retener iones metálicos. En consecuencia, estos carbones deben mostrar una baja capacidad de adsorción de iones cromato y un alto poder de remoción de Cr3+; aparentemente existe una contradicción cuando se plantea que la capacidad de adsorción de cromo avanza en el sentido CAN-H2 > CAN-HNO3 ≈ CAN-O2 > CAN > CAC-H2 > CACHNO3≈CAC-O2 > CAC, con relación a los adsorbentes sometidos a los distintos tratamientos; es decir, se pone de manifiesto que el sólido más básico es el que despliega la mayor capacidad de remoción de ión cromato; se ha comprobado que los carbones H, al ponerse en contacto con el aire, cambian el potencial zeta de positivo a negativo en virtud de la formación de grupos superficiales acídicos; por tanto, se postula que este tipo de comportamiento juega un papel determinante en la adsorción de cromato.
En numerosos estudios se ha mostrado que las interacciones electrostáticas adsorbente- adsorbible y adsorbato-adsorbible están controladas por el pH de la solución debido a que los electrolitos de carácter ácido se disocian favorablemente cuando el pH es mayor que el pKa. Este hecho se corrobora con el comportamiento favorable del carbón CAC-H2 (pH = 9,8) frente al material original; la capacidad de adsorción es mayor en un 22%, hecho que significa que el tratamiento reductivo genera un sólido cuya superficie interna mantiene un carácter básico mientras el área externa mantiene cierto grado de oxidación.
Se verifica que el sólido que tiene la mayor capacidad de adsorción de cromato proviene del tratamiento de los carbones originales con hidrógeno. No existen referencias bibliográficas en las cuales se consignen este tipo de observaciones; tampoco se encuentran resultados sobre el efecto que puedan ejercer otro tipo de agentes reductores (hidruros alcalinos, boruros, amoniaco, hidracina, entre otros). En numerosos estudios de la adsorción de cromo se ha demostrado que la cantidad adsorbida (mg g-1) en función de la concentración inicial se ajusta muy bien al modelo de Langmuir, esto es:
donde
na: cantidad adsorbida en el equilibrio
nm: capacidad de monocapa
b: coeficient de adsorción
Co: concentración inicial del adsorbible
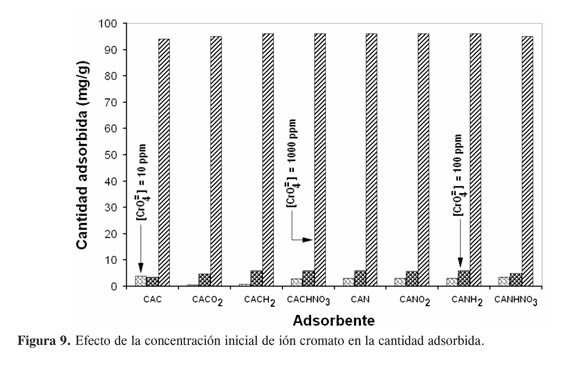
Muchas investigaciones consideran el modelo de Freundlich para evaluar la adsorción de cromo sobre carbón activado a partir de disolución acuosa. En este trabajo se partió de disoluciones “stock” de 1000 ppm de cromo (preparado como Cr2O7 =) para obtener disoluciones de CrO4 = de distinta concentración y efectuar los ensayos de adsorción. Las pruebas de adsorción se realizaron con disoluciones de 10, 100 y 1000 ppm; no obstante, resulta claro, tal como se indica en la Figura 9, que la cantidad adsorbida es nula cuando la concentración es de 10 ppm; en consideración a que el carbón activado es granular, no es extraño que algunos fenómenos de transporte (transporte de materia por difusión) hagan que a tiempos de exposición cortos, el procesode adsorción se manifieste por periodo de inducción en el cual la cantidad adsorbida permanezca en cantidades no detectables. Por el contrario, también se observa que la capacidad de adsorción crece rápidamente con la concentración de cromo y a pesar de que las lecturas más altas se dan con 1000 ppm; por razones de predominancia de la especie cromato, sensibilidad del método de análisis, reproducibilidad de la cuantificación en términos de las posibilidades de no dilución, y una capacidad de adsorción razonable, se optó por utilizar concentraciones de 100 ppm de cromo (como cromato) para todos los estudios. En este sentido, la relación entre la concentración inicial y su influencia sobre la capacidad de adsorción observada en este trabajo, corresponden muy bien con los resultados de Yu y cols. (25) quienes ensayaron concentraciones iniciales desde 1 ppm; por su parte, Hu y cols. (26) probaron concentraciones iniciales en el rango de 10 a 200 ppm.
El análisis de la evolución de la capacidad de adsorción en función de la masa de adsorbente confirma en primer lugar la naturaleza extensiva de la adsorción; por otra parte se destaca que, salvo para los carbones activados modificados con ácido nítrico (CAN-HNO3 y CAC-HNO3), en los cuales la cantidad adsorbida varía en forma proporcional con la masa de carbón, en los sólidos restantes la relación es de tipo exponencial. Este comportamiento confirma que en adición al fenómeno de fisiadsorción, los grupos funcionales de superficie y otros posibles efectos como el intercambio iónico, contribuyen en forma significativa a incrementar la cantidad adsorbida. En ensayos realizados a pH 1,0 y concentraciones de 10, 20 y 30 ppm, Mohanty y cols. (27) encuentran que la adsorción de cromo avanza en forma progresiva y lineal para masas de adsorbente comprendidas entre 50 y 150 mg; en este trabajo las cantidades de carbón activado se dosificaron entre 100 y 400 mg.
CONCLUSIONES
Los métodos de titulación de Böehm, y de descomposición a temperatura programada (DTP), demuestran que los tratamientos de reducción y de oxidación efectuados a los carbones originales afectan la química superficial del adsorbente. Esta observación es relevante en los sólidos modificados con HNO3, toda vez que se promueve la mayor cantidad de grupos oxigenados; contrario a este hecho, es evidente que la exposición al H2 disminuye notablemente la población de los grupos ricos en oxígeno.
Las modificaciones introducidas a los carbones activados afectan directamente la capacidad adsortiva de los adsorbentes; así, se resalta el hecho de que la reducción con hidrógeno a altas temperaturas favorece en un 45% la capacidad de remoción del cromo de soluciones acuosas a pH = 2,0, y en concentraciones iniciales de 100 ppm. En este mismo sentido, se confirma que el origen del carbón activado es un parámetro que incide sobre la extensión de la adsorción en la medida en que el adsorbente de génesis lignítica (NORIT ROX 0,8®, CAN) despliega un mayor poder de remoción de ión cromato frente al material de procedencia lignocelulósica (C*CHEM®, CAC). Es importante destacar que el pH inicial de la solución del adsorbible también es un factor determinante en la magnitud de la adsorción de Cr6+; de otra parte, se verifica que el tratamiento térmico en presencia de hidrógeno produce un incremento del pH del adsorbente en la medida que esta variación es compatible con la remoción de grupos carboxílicos de la superficie del carbón.
De las distintas variables estudiadas: concentración inicial de ión cromato, cantidad de adsorbente, tiempo de contacto y pH inicial, es esta última, en conjunción con el tipo de tratamiento (oxidación o reducción), la que ejerce mayor influencia sobre la capacidad de adsorción. En todos los casos la máxima cantidad removida (entre 6,5 y 10 mg g-1) se observa a pH = 2,0; sin embargo, también es cierto que los sólidos modificados con hidrógeno, respecto a los tratados con HNO3 u oxígeno, muestran una drástica disminución de la magnitud de la adsorción en la medida en que el pH se incrementa.
AGRADECIMIENTOS
Los autores expresan sus agradecimientos a la Universidad Nacional de Colombia y a la División de Investigaciones de la Sede Bogotá (DIB) por el apoyo a este trabajo a través del proyecto de investigación “Caracterización fisicoquímica de carbones activados modificados por diferentes tratamientos”, código DIB-8003016.
REFERENCIAS BIBLIOGRÁFICAS
1. Kozyuh, N.; Sytupar, J.; Gorenc, B. Reduction and oxidation processes of chromium in soils, Environ. Sci. Technol. 2000. 34 (1): 112-119. [ Links ]
2. Depault, F.; Cojocaru, M.; Fortin, F.; Chakrabarti, S.; Lemieux, N. Genotoxic effects of chromium(VI) and cadmium(II) in human blood lymphocytes using the electron microscopy in situ end-labeling (EM-ISEL) assay. Toxicology in Vitro. 2006. 20 (4): 513-518. [ Links ]
3. Kretchick, J. T. OSHA's final standard on hexavalent chromium. J. Chem. Health Safety. 2006. 13 (3): 39. [ Links ]
4. Goldbohm, R. A.; Tielemans, E. L. J. P.; Heederik, D.; Rubingh, C. M.; Dekkers, S.; Willems, M. I.; Kroese, D. Risk estimation for carcinogens based on epidemiological data: A structured approach, illustrated by an example on chromium. Regulat. Toxicol. Pharmacol. 2006. 44 (3): 294-310. [ Links ]
5. Juturu, V.; Komorowski, J. R. Chromium compounds: cytotoxicity and carcinogenesis. Toxicology. 2003. 186 (1-2): 171-173. [ Links ]
6. Tahir, S. S.; Naseem, R. Removal of Cr(III) from tannery wastewater by adsorption onto bentonite clay. Separat. Purif. Technol. 2007. 53 (3): 312-321. [ Links ]
7. Gazola, F. C.; Pereira, M. R.; Barros, M. A. S. D.; Silva, E. A.; Arroyo, P. A. Removal of Cr3+ in fixed bed using zeolite NaY. Chem. Eng. J. 2006. 117 (3): 25-261. [ Links ]
8. Barros, M. A. S. D.; Silva, E. A.; Arroyo, P. A.; Tavares, C. R. G.; Schneider, R. M.; Suszek, M.; Sousa- Aguiar, E. F. Removal of Cr(III) in the fixed bed column and batch reactors using as adsorbent zeolite NaX. Chem. Eng. Sci. 2004. 59 (24): 5959-5966. [ Links ]
9. Arslan, G.; Pehlivan, E. Batch removal of chromium(VI) from aqueous solution by Turkish brown coals. Bioresource Technol. 2007. 98 (15): 2836-2845. [ Links ]
10. Gasser, M. S.; Morad, G. H. A.; Aly, H. F. Batch kinetics and thermodynamics of chromium ions removal from waste solutions using synthetic adsorbents. J. Hazardous Mater. 2007. 142 (1-2): 118-129. [ Links ]
11. Carrott Suhas, P. J. M.; Ribeiro Carrott, M. M. L. Lignin-from natural adsorbent to activated carbon: A review. Bioresource Technol. 2007. 98 (12): 2301-2312. [ Links ]
12. Liu, S. X.; Chen, X.; Chen, X. Y.; Liu, Z. F.; Wang, H. L. Activated carbon with excellent chromium (VI) adsorption performance prepared by acid-base surface modification. J. Hazardous Mater. 2007. 141 (1): 315-319. [ Links ]
13. Díaz Velásquez, J. de J.; Carballo- Suárez, L. M.; Figueiredo, J. L. Thermal treatments of activated carbon catalysts under N2O. Carbon. 2007. 45 (1): 212-214. [ Links ]
14. Yang, Y. Ch.; Aroua, M. K.; Wan Daud, W. M. A. Review of modifications of activated carbon for enhancing contaminant uptakes from aqueous solutions. Separat. Purif. Technol. 2007. 52 (3): 403-415. [ Links ]
15. Centeno, T. A.; Stoeckli, F. The role of textural characteristics and oxygen-containing surface groups in the supercapacitor performances of activated carbons. Electrochim. Acta. 2006. 52 (2): 560-566. [ Links ]
16. Zhao, N.; Wei, N.; Li, J.; Qiao, Zh.; Cui, J.; He, F. Surface properties of chemically modified activated carbons for adsorption rate of Cr (VI). Chem. Eng. J. 2005. 115 (1-2): 133-138. [ Links ]
17. Bleda-Martínez, M. J.; Maciá-Agulló, J. A.; Lozano-Castelló, D.; Morallón, E.; Cazorla-Amorós, D.; Linares- Solano, A. Role of surface chemistry on electric double layer capacitance of carbon materials. Carbon. 2005. 43 (13): 2677-2684. [ Links ]
18. Briceño, N. O.; Guzmán, M. Y.; Díaz, J. de J. Grupos superficiales en materiales carbonosos. Caracterización por diferentes técnicas. Rev. Colomb. Quím. 2007. 36 (1): 121-130. [ Links ]
19. Zhao, Zh.; Gao, R.; Li, J.; Liu, S.; Liu, H. Chromotropic acid as a reagent for ultraviolet spectrophotometric determination of hexavalent chromium in water. Microchem. J. 1998. 58 (1): 1-5. [ Links ]
20. Salinas-Hernández, P.; Rojas-Hernández, A.; Ramírez-Silva, M. T. Kinetic and thermodynamic study of the behaviour of diphenylcarbazide in aqueous solution with pH. Spectrochim. Acta A: Molecular Biomol. Spectrosc. 2003. 59 (11): 2667- 2675. [ Links ]
21. Bardiya, N.; Hwang, Y. W.; Bae, J.H. Interference of thiosulfate during colorimetric analysis of hexavalent chromium using 1,5-diphenylcarbazide method. Anaerobe. 2004. 10 (1): 7-11. [ Links ]
22. Pettine, M.; Capri, S. Removal of humic matter interference in the determination of Cr(VI) in soil extracts by the diphenylcarbazide method. Anal. Chim. Acta. 2005. 540 (2): 239-246. [ Links ]
23. Gómez, V.; Callao, M. P. Chromium determination and speciation since 2000. Trends Anal. Chem. 2006. 25 (10): 1006-1015. [ Links ]
24. Figueiredo, J. L.; Pereira, M. F. R.; Freitas, M. M. A.; M. Órfão, J. J. Modification of the surface chemistry of activated carbons. Carbon. 1999. 37 (9): 1379-1389. [ Links ]
25. Yu, L. J.; Shukla, Sh. S.; Dorris, K. L.; Shukla, A.; Margrave, J. L. Adsorption of chromium from aqueous solutions by maple sawdust. J. Hazardous Mater. 2003. 100 (1-3): 53-63. [ Links ]
26. Hu, Zh.; Lei, L.; Li, Y.; Ni, Y. Chromium adsorption on high-performance activated carbons from aqueous solution. Separat. Purificat. Technol. 2003. 31 (1): 13-18. [ Links ]
27. Mohanty, K.; Jha, M.; Meikap, B. C.; Biswas, M. N. Removal of chromium (VI) from dilute aqueous solutions by activated carbon developed from Terminalia arjuna nuts activated with zinc chloride. Chem. Eng. Sci. 2005. 60 (11): 3049-3059. [ Links ]














