Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804On-line version ISSN 2357-3791
Rev.Colomb.Quim. vol.36 no.3 Bogotá Sep./Dec. 2007
EFECTO DEL ION CITRATO EN EL COMPORTAMIENTO ELECTROQUÍMICO DEL ESTAÑO Y EL ACERO
EFFECT OF THE CITRATE ION ON THE ELECTROCHEMICAL BEHAVIOR OF TIN AND STEEL
EFEITO DO ÍON CITRATO NO COMPORTAMENTO ELETROQUÍMICO DO ESTANHO E DO AÇO
Jorge A. Calderón1, Paula M. Montoya1
1 Grupo de Corrosión y Protección, Universidad de Antioquia, Medellín-Colombia. jacalder@udea.edu.co
Recibido: 25/08/07 – Aceptado: 27/11/07
RESUMEN
El presente trabajo pretende hacer un aporte al conocimiento del comportamiento electroquímico de recipientes de hojalata en medio del ion citrato, y al papel que juega la concentración de dicho ion en la estabilidad de los recipientes. Todo ello, a través del estudio electroquímico individual de los materiales con los cuales son fabricados los recipientes de hojalata, acero y estaño. El estudio se llevó acabo mediante medidas de polarización potenciodinámica e impedancia electroquímica sobre electrodos fabricados con ambos materiales e inmersos en soluciones de diferentes concentraciones de citrato a un valor de pH de 3,0. Se evidencia que a este valor de pH, el ion citrato ejerce un notable efecto de despolarización anódica sobre el estaño, por la formación de complejos solubles y estables. Esto hace que el estaño se torne anódico respecto al acero pudiendo otorgar una protección anticorrosiva al sustrato de acero de los recipientes de hojalata.
Palabras clave: citrato, corrosión, hojalata, polarización potenciodinámica, impedancia electroquímica.
ABSTRACT
The present work tries to do a contribution to the knowledge of the electrochemical behavior of tinplate containers in citrate ion medium and the role that citrate ion concentration plays on the stability of the containers; all that, through the individual electrochemical study of the materials of which the tinplate is made, steel and tin. The study was done by potentiodynamic polarization and electrochemical impedance on electrodes made with both materials, immersed in solutions of different citrate concentrations at pH 3,0. It was evidenced that the citrate ion has a remarkable effect of anodic depolarization on tin with the formation of soluble and stable complexes. This causes that tin becomes anodic with respect to the steel being able to grant an anticorrosive protection to the steel substrate of the tinplate containers.
Key words: Citrate, corrosion, tinplate, potentiodynamic polarization, electrochemical impedance.
RESUMO
O presente trabalho tem como objetivo contribuir com o conhecimento do comportamento eletroquímico da folha de flandes em meios contendo íons citrato, bem como o papel que a concentração de íon citrato desempenha na estabilidade dos recipientes. Os estudos eletroquímicos foram conduzidos a partir dos materiais individuais que constituem o ferro estanhado, ou seja, o aço e o estanho. Os experimentos foram realizados utilizando- se técnicas de polarização potenciodinâmica e de impedância eletroquímica em eletrodos formados, separadamente, por aço e estanho que permaneceram imersos em soluções de citrato, a pH 3,0 com diferentes concentrações. Foi evidenciado que o íon citrato apresenta um efeito notável de depolarização anódica no estanho pela formação de complexos estáveis e solúveis. Consequentemente, o estanho se torna anódico em relação ao aço e oferece uma proteção anticorrosiva aos substratos de aço que constituem os recipientes de ferro estanhado.
Palavras-chave: citrato, corrosão, folha de flandes, polarização potenciodinâmica, impedância eletroquímica.
INTRODUCCIÓN
El estaño es un material ampliamente utilizado en la fabricación de envases para el embalaje de alimentos y bebidas debido a su baja toxicidad y buenas propiedades electroquímicas (1-3). En la fabricación de hojalata para la construcción de envases, el estaño es depositado sobre láminas de acero al carbono mediante electrodeposición, obteniéndose de este modo películas de 0,4 μm de espesor aproximadamente, que le confieren al sustrato de acero una protección ante el ataque corrosivo de las soluciones contenidas en el recipiente. Para que exista corrosión, en la mayoría de los casos es necesario que simultáneamente a la reacción anódica de disolución metálica coexista la reacción catódica de consumo de electrones.
En medios naturales acuosos las reacciones catódicas que se presentan son la reacción de reducción de hidrógeno y la reducción de oxígeno (4). No obstante, debido a las condiciones de sellado de los recipientes, la disponibilidad de oxígeno es limitada, por lo que la reducción de hidrógeno sería la más probable de suceder. El estaño posee un alto sobrepotencial de reducción de hidrógeno (1), por lo que dicha reacción sobre la superficie del metal sucede con gran dificultad. Sin embargo, cuando el estaño entra en contacto con otro metal con bajo sobrepotencial de hidrógeno, como el acero, el ataque sobre el estaño puede ser acelerado. Esta situación puede presentarse por la presencia de defectos en el depósito de estaño, como poros y discontinuidades debido a fallas mecánicas, que hacen que coexistan ambos metales en contacto con la solución.
Harms y cols. (5) estudiaron el comportamiento electroquímico del acero de bajo carbono en soluciones naturales de pH 7,2, conteniendo diferentes quelatos. Ellos reportaron que los (O)-ligantes forman fuertes y estables complejos con Fe(III), mientras que con (N)-ligantes los complejos con Fe(II) son más estables. El ion citrato también forma fuertes quelatos con el Fe(III), la formación de complejos solubles con el ion citrato hace que difícilmente se formen películas de óxidos de hierro (6). El estaño puede formar complejos altamente solubles con los denominados ácidos de las frutas (cítrico, tartárico y málico) (1, 7). En el comportamiento de recipientes de hojalata para el almacenamiento de bebidas y comidas, el oxígeno y los aniones complejantes compiten por formar especies pasivas en el interior de los recipientes. El oxígeno tiende a formar óxidos como el SnO y el SnO2, y los aniones complejantes, especies solubles Sn-citrato. La estabilidad de uno u otro compuesto determinará, en último caso, la velocidad de corrosión del recubrimiento de estaño depositado en los recipientes y, finalmente, la resistencia a la corrosión del empaque y su durabilidad.
El objetivo del presente trabajo es aportar al conocimiento sobre el papel que juega el ion citrato sobre la estabilidad del estaño y el hierro en soluciones de cloruro y a bajo pH, lo cual podría extrapolarse hacia el desempeño de recipientes de hojalata y mejoramiento de su vida útil en condiciones de servicio. Todo ello mediante el estudio electroquímico del acero y el estaño, materiales con los cuales son fabricados los recipientes de hojalata.
PROCEDIMIENTO EXPERIMENTAL
Para la evaluación del comportamiento frente a la corrosión de los materiales con los cuales se fabrican los envases de hojalata se procedió a trazar curvas de polarización potenciodinámica e impedancia electroquímica. Los ensayos fueron realizados en una celda convencional de tres electrodos, utilizando como electrodos de trabajo barras metálicas de los materiales puros constituyentes de la hojalata (estaño del 99,75% de pureza y acero al carbono AISI 1020), (ver composición química en la Tabla 1). Las barras metálicas fueron embebidas en resina de poliéster insaturado a fin de tener solo el área circular expuesta (0,28 cm2) a las soluciones de trabajo. Antes de cada experimento, los electrodos de trabajo fueron pulidos con papel metalográfico grado 600 y sometidos a un proceso de limpieza en baño ultrasónico en una mezcla acetona-agua 50:50. Como electrodo de referencia fue usado uno de Calomel saturado (ECS), y como electrodo auxiliar una malla de platino. Todos los potenciales aquí presentados son referidos al ECS. Como electrolito fueron usadas soluciones 0,02 M de NaCl + xM de C6H5Na3O7 (x= 0,05; 0,1; 0,2; 0,4; 0,8), aciduladas con HCl hasta un pH de 3,0. Las soluciones fueron preparadas con agua destilada y reactivos grado analítico. Las curvas de polarización potenciodinámicas fueron realizadas a una velocidad de barrido de 1,666x10-4 V.s-1 en sentido anódico partiendo de 300 mV de sobretensión catódica respecto al PCA (potencial de circuito abierto), hasta 300 mV de sobretensión anódica por encima del PCA. Antes de dar inicio al barrido en potenciales, se esperó la estabilización de PCA por 60 minutos. Las curvas de polarización se trazaron por duplicado con la celda electroquímica descrita anteriormente. La densidad de corriente de corrosión, icorr, se determinó usando las curvas de Tafel y el software que opera el potenciostato.

Las curvas de impedancia fueron realizadas en el PCA, a 100 y 200 mV de sobrepotencial anódico, en un rango de frecuencias de 60 kHz hasta 5 mHz, con una perturbación de 5mV de amplitud. Todos los ensayos electroquímicos se realizaron a temperatura ambiente y con aireación natural. Las curvas de polarización y los ensayos de impedancia fueron realzados usando un potenciostato-galvanostato PGST-30 Autolab.
RESULTADOS Y DISCUSIÓN
Curvas de polarización
En la Figura 1 se presentan las curvas de polarización potenciodinámica del estaño y el acero en soluciones de NaCl a pH=3,0, con diferente contenido de citrato. Se observa que a medida que se incrementa la concentración de citrato, los potenciales de corrosión (Ecorr) de ambosmetales se desplazan en sentidos opuestos, el Ecorr del acero tiende aumentar, mientras que el Ecorr del estaño a disminuir. Esta tendencia se exhibe más claramente en la Figura 2, en donde se presenta la variación de Ecorr y de la corriente decorrosión (Icorr) con el aumento de citrato en el electrolito.
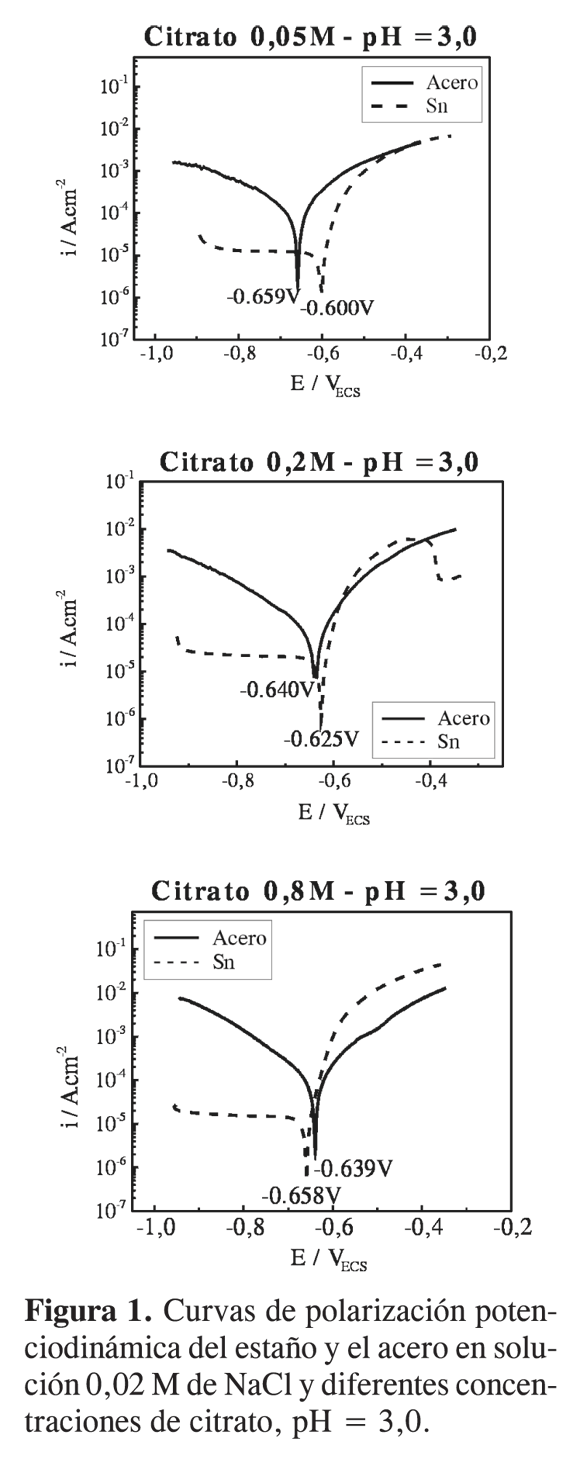
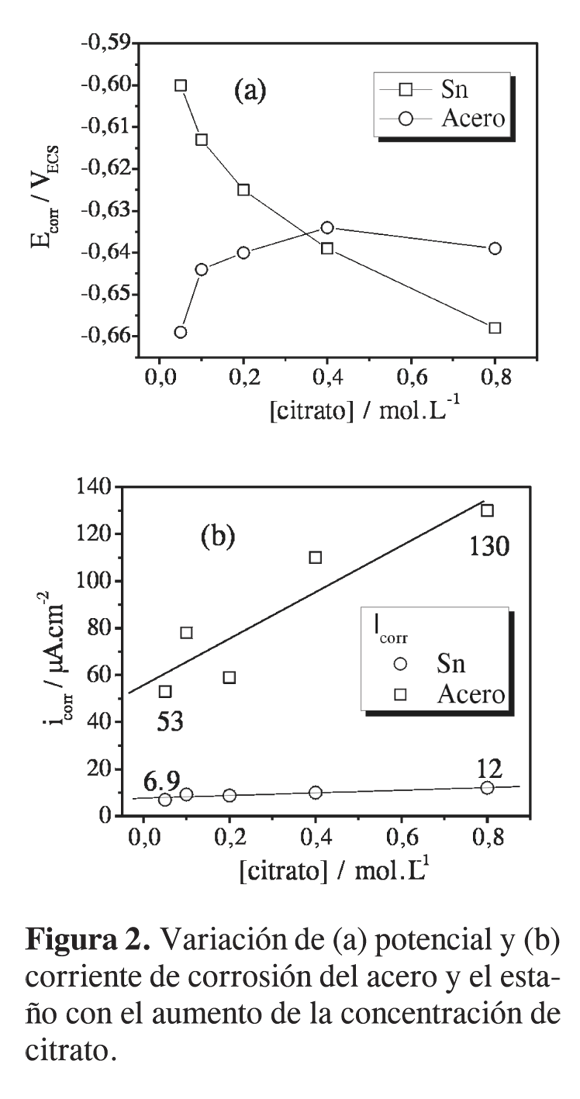
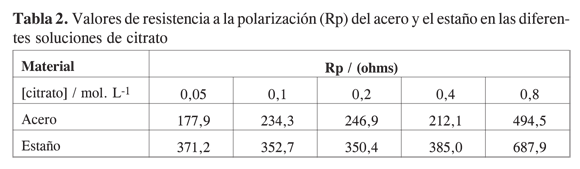
Analizando las gráficas se observa una disminución del potencial de corrosión del estaño y un aumento del potencial de corrosión del acero con el incremento de la concentración de citrato en la solución. La disminución del potencial de corrosión del estaño se explica por el efecto complejante que ejerce el citrato sobre los iones de estaño que están en equilibrio con el metal (7-9). Como lo predice la ecuación de Nernst, la formación de complejos solubles de estaño promovida por la presencia del citrato hace que la concentración de iones Sn2+ en equilibrio con el metal disminuya, llevando consigo una caída en el potencial. Al estudiar la disolución del estaño en soluciones de ácidos orgánicos Gouda (8) encontró que a valores de pH por debajo de 4, la disolución del estaño está bajo control anódico debido a la habilidad que tienen tales aniones para formar complejos solubles con el estaño. Por otro lado, el potencial de corrosión del acero tiende a aumentar, hasta llegar a un valor en el que se estabiliza, indicando la posible formación de especies adsorbidas sobre la superficie del metal, que provoca un aumento en la resistencia a la polarización (Rp); este aumento se ha comprobado experimentalmente a partir de la curvas de polarización (ver Tabla 2). Estos resultados sugieren que en la interfase metal-solución puede estar sucediendo la formación de complejos solubles más estables en el estaño que en el acero, lo cual concuerda con resultados reportados en la literatura (5, 8). Como se observa en la Tabla 2, laresistencia a la polarización del acero tiende a aumentar con el aumento de la concentración de citrato en la solución, mientras que en el estaño la Rp tiende a permanecer estable.
Según Harms (5), el citrato tiende a formar complejos solubles más estables con Fe3+ que con Fe2+. De acuerdo con los resultados de polarización, durante la primera etapa de disolución activa del acero (oxidación del hierro a Fe2+), se observa un aumento del potencial de corrosión con el incremento de la concentración de citrato (Figura 2), esto podría deberse a la escasa tendencia a la formación de complejos de hierro solubles. Presumiblemente, se forman especies de Fe2+ adsorbidas sobre la superficie, que conllevan un aumento del potencial de corrosión del acero.
Como todos los experimentos fueron realizados a pH=3,0, es de esperarse que la reacción catódica sea la reducción de hidrógeno. De acuerdo con las curvas de polarización obtenidas, la cinética de la reacción catódica de evolución de hidrógeno es más rápida sobre el acero que sobre el estaño. En el acero se observa una clara polarización por activación, mientras que en el estaño la reacción es inhibida por un alta sobretensión de hidrógeno (1). Esto último hace que las corrientes de corrosión en el estaño sean inferiores a las del acero (Figura 2b), lo cual implica que en el caso de la hojalata, para las condiciones evaluadas, la presencia de defectos en el recubrimiento de estaño ocasionaría una rápida corrosión del sustrato de acero, desde que éste sea anódico respecto al estaño (Ecorracero < EcorrSn).
El aumento tanto del potencial como de la corriente de corrosión del acero con el incremento de la concentración de citrato es una clara evidencia del control catódico del proceso de corrosión de este metal en dicho medio. Algo similar fue encontrado por Gouda a diferentes valores de pH (10). El hecho de que a bajas concentraciones de citrato el estaño sea catódico respecto al acero, puede atribuirse al bajo poder de complejación que poseen las soluciones diluidas de citrato (8).
Impedancia electroquímica
La impedancia electroquímica es una herramienta útil para el análisis de los procesos de disolución, adsorción de especies, difusión y de pasivación, que suceden durante la disolución de un metal. En la Figura 3 se presentan los diagramas de impedancia del acero y del estaño en soluciones libres de citrato para diferentes condiciones de sobrepotencial anódico.
La impedancia electroquímica para el acero en soluciones libres de citrato presenta diagramas constituidos por tres arcos. El primero, a altas frecuencias (2,9 Hz), está relacionado con la carga de la doble capa eléctrica en paralelo con la resistencia de transferencia de carga (Rtc). El segundo es un arco inductivo, a frecuencias intermedias (0,3 Hz) que puede relacionarse con procesos de disolución del metal, y el tercero es un arco capacitivo a bajas frecuencias (3 mHz) relacionado con procesos de adsorción de especies (11, 12). Es probable que procesos de difusión de especies disueltas estén acoplados al segundo y tercer arcos. Como es de esperarse, y de acuerdo con las curvas de polarización, la impedancia disminuye a medida que la polarización se incrementa.
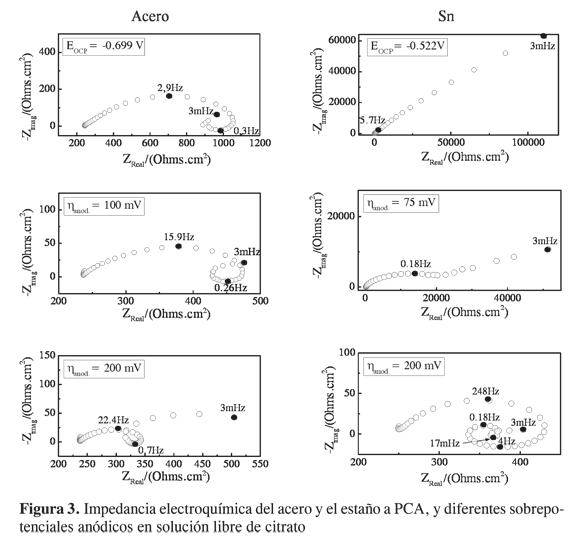
La frecuencia del arco inductivo aumenta cuando aumenta la polarización, esto indica que la disolución es estimulada. No se observan procesos de pasivación del metal, conforme fue observado en los resultados de polarización potenciodinámica. La impedancia del estaño en solución libre de citrato (Figura 3) es diferente a la presentada por el acero. Los diagramas de impedancia del estaño a PCA y bajas polarizaciones muestran acoplamiento entre la doble capa eléctrica en paralelo con la Rtc y procesos de difusión. Luego, a mayor polarización anódica (η = 200 mV), se presentan múltiples constantes de tiempo, ya desacopladas. A altas frecuencias, el arco a 248 Hz, corresponde a la carga de la doble capa eléctrica en paralelo con Rtc; a frecuencias intermedias se presenta un arco inductivo y uno capacitivo a 4 y 0,18 Hz, respectivamente. A bajas frecuencias se presentan igualmente un arco inductivo y otro capacitivo a 17 y 3 mHz, respectivamente. Los arcos presentados a frecuencias intermedias y bajas pueden relacionarse con diferentes especies intermediarias que se forman durante la disolución del metal.
Según la impedancia electroquímica, el comportamiento del acero en presencia del ion citrato, en términos generales, no difiere mucho del que se presenta cuando no hay citrato. Como se observa en la Figura 4, las tres constantes de tiempo observadas en los diagramas sin citrato se presentan igualmente en presencia de citrato. Sin embargo, el arco inductivo que se presenta a frecuencias intermedias en las diferentes condiciones de polarización, disminuye de manera considerable cuando hay citrato en el electrolito. Por otro lado, el arco capacitivo a bajas frecuencias tiende a crecer cuando hay citrato. Puede observarse que en presencia de alta cantidad de citrato (0,8M) y altas polarizaciones (η = 200 mV), dicho arco tiende a una resistencia negativa, mostrando una tendencia hacia la pasivacióndel metal. Lo anterior indica que el citrato, en las condiciones de polarización estudiadas, participa de manera leve en la cinética de corrosión del acero, puesto que no aparece ninguna constante de tiempo asociada al ion citrato. Sin embargo, es probable que el citrato contribuya en la formación de especies menos solubles de hierro que se adsorben a la superficie del metal, de acuerdo con la evolución de los arcos capacitivos presentes a bajas frecuencias.
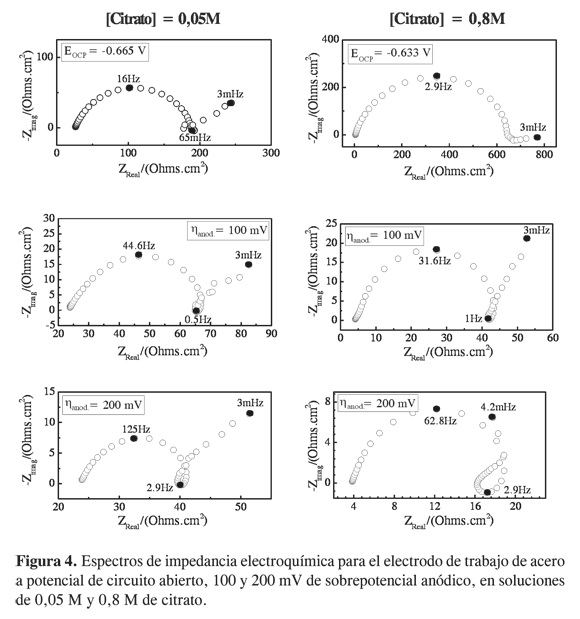
En la Figura 5 se presentan los diagramas de impedancia electroquímica realizados al estaño en presencia de 0,05 M y 0,8 M de citrato para 100 y 200 mV de polarización anódica. A diferencia de lo que pasa con el acero, el citrato interviene notablemente en la cinética de disolución del estaño. Puede observarse que en presencia de citrato la impedancia disminuye considerablemente, estimulando la disolución del metal. Los diagramas realizados a PCA, y en presencia de citrato, muestran un desacople entre los procesos de carga de la doble capa en paralelo con Rtc y procesos de difusión de especies. A altas concentraciones de citrato (0,8M) y diferentes condiciones de polarización (η =100 y 200 mV), se observa la aparición de un arco inductivo a frecuencias intermedias (4 Hz y 16 Hz) que puede ser asociado a procesos de disolución de especies. El arco inductivo a 4 Hz, fue evidenciado a altas polarizaciones (200 mV) sin la presencia de citrato, y no fue observado en soluciones con baja concentración de citrato. De esta manera, la impedancia electroquímica muestra que solo a altas concentraciones de citrato puede estimularse la disolución del estaño, corroborando lo observado mediante las curvas de polarización.
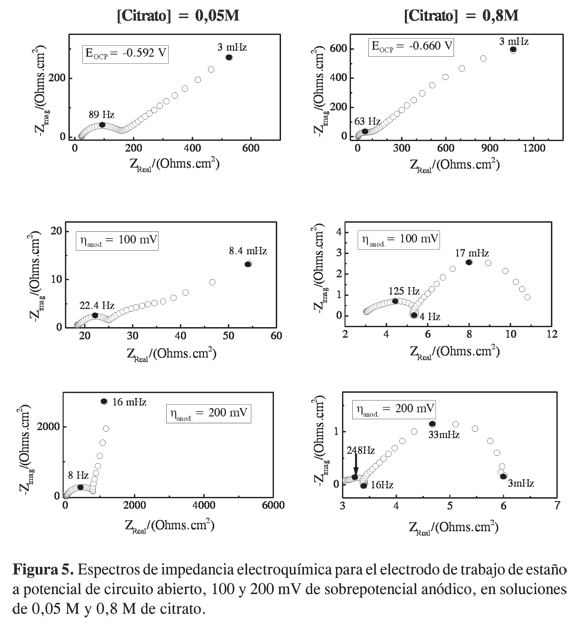
A bajas concentraciones de citrato, debido al bajo poder de complejación que se tiene, los iones de estaño liberados durante la disolución forman especies poco solubles que se adsorben o precipitan sobre la superficie del metal, creando posiblemente una barrera de resistencia. Especies adsorbidas sobre la superficie del estaño en presencia de citrato han sido reportadas en la literatura como precursoras de películas pasivas e inhibidoras del picado (13, 14). Esto puede ser visto en los diagramas de impedancia a 0,05Mde citrato, en donde la resistencia a la polarización, leída en límite de bajas frecuencias, tiende a crecer considerablemente. Por otro lado, a mayores concentraciones de citrato (0,8 M), los diagramas de impedancia muestran a frecuencias intermedias un arco inductivo asociado a la disolución del metal, procesos de difusión de especies y una resistencia a la polarización (Rp) muy pequeña, comparada con la obtenida en soluciones libres y con bajo contenido de citrato. La Rp puede ser leída al extrapolar el límite de bajas frecuencias hacia el eje real de la impedancia, mostrando valores de 12 y 6 Ohm.cm-2, a sobrepotenciales de 100 y 200 mV, respectivamente. Esto indica velocidades de corrosión mayores en soluciones de alto contenido de citrato.
CONCLUSIONES
A altas concentraciones el ion citrato ejerce un notable efecto de despolarización anódica sobre el estaño, por la formación de complejos solubles y estables. Esto hace que el estaño se torne anódico respecto al acero, posibilitando su actuación como ánodo de sacrificio en recipientes de hojalata.
A bajas concentraciones el citrato no actúa como despolarizador anódico debido al bajo poder de complejación que presenta en tales condiciones. Existe una relación casi lineal entre las corrientes de corrosión del acero y del estaño, y el aumento de la concentración de ion citrato.
La protección anticorrosiva de recipientes de hojalata en soluciones de citrato a bajos valores de pH solo es posible si existe una alta concentración de citrato que haga al estaño anódico respecto al sustrato de acero. En tales condiciones, el estaño podrá disolverse a muy baja velocidad, debido al alto sobrepotencial de hidrógeno, posibilitando la protección del sustrato por largo tiempo. Si la condición anódica del estaño no se presenta, el sustrato de acero se corroerá rápidamente debido a la alta corriente de corrosión asociada a este metal en tales condiciones.
AGRADECIMIENTOS
Los autores desean expresar su agradecimiento a la Universidad de Antioquia, a Prodenvases-Crown, y al Centro de Excelencia en Nuevos Materiales (CENM) por el apoyo financiero para el desarrollo de este proyecto.
REFERENCIAS BIBLIOGRÁFICAS
1. Murphy, T. P. (2000). Uhlig's Corrosion Handbook. 2 edition. R. Winston Revie (ed.). John Wiley & Sons. New York. p. 858. [ Links ]
2. Steve, B.; Wallace, T. Tin in canned food: a review and understanding of occurrence and effect. Food and Chemical Toxicology. 2003. 41 (12): 1651-1662. [ Links ]
3. Bernardo, P. E. M.; Dos Santos, J. L. C.; Costa, N. G. Influence of the lacquer and end lining compound on the shelf life on the steel beverage can. Prog. Org. Coat. 2005. 54 (1): 34-42. [ Links ]
4. Jones, D. A. (1992). Principles and Prevention of Corrosion. D. Johnstone (ed.). MacMillan Publishing Company. New York. p. 5. [ Links ]
5. Harms, H.; Volkland, H.-P.; Repphun, G.; Wanner, A. H. O.; Zehnder, A. J. B. Action of chelators on solid iron in phosphate-containing aqueous solutions. Corros. Sci. 2003. 45 (8): 1717-1732. [ Links ]
6. Modiano, S.; Fugivara, C. S.; Benedetti, A. V. Effect of citrate ions on the electrochemical behaviour of low-carbon steel in borate buffer solutions. Corros.Sci. 2004. 46 (3): 529-545. [ Links ]
7. Abdel, S. S.; Sayyah, S. M.; El Deeb, M. M. Corrosion of tin in citric acid solution and the effect of some inorganic anions. Materials Chemistry and Physics. 2003. 80 (3): 696-703. [ Links ]
8. Gouda, V. K.; Rizkalla, E. N.; Abd El-Wahab, S.; Ibrahim, E. M. Corrosion behaviour in organic acid solutions- I. Tin electrode. Corros. Sci.1981. 21 (1): 1-15. [ Links ]
9. Bombara, G.; Azzerri, N.; Baudo, G. Electrochemical evaluation of the corrosion behaviour of tinplate. Corros. Sci. 1970. 10 (12): 847-856. [ Links ]
10. Gouda, V. K.; Abd El Wahaab, S. M.; Ibrahim, E. M. The corrosion behaviour in organic acid solutions- II. A steel electrode. Corros. Sci. 1980. 20 (10): 1091-1099. [ Links ]
11. Keddam, M.; Mattos, O. R.; Takenouti, H. Reaction Model for Iron Dissolution Studied by Electrode Impedance. I. Experimental Results and Reaction Model. J. Electrochem. Soc. 1981. 128 (2): 257-266. [ Links ]
12. Keddam, M.; Mattos, O. R.; Takenouti, H. Reaction Model for Iron Dissolution Studied by Electrode Impedance. II. Determination of the Reaction Model. J. Electrochem. Soc. 1981. 128 (2): 266-274. [ Links ]
13. Almeida, C. M. V. B.; Giannetti, B. F. Inhibiting effect of citric acid on the pitting corrosion of tin. J. Appl. Electrochem. 1999. 29 (1): 123-128. [ Links ]
14. Almeida, C.M. V. B.; Giannetti, B. F. Protective film growth on tin in perchlorate and citric acid electrolytes. Mat. Chem. Phys. 2001. 69 (1-3): 261-266. 360 [ Links ]














