Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804On-line version ISSN 2357-3791
Rev.Colomb.Quim. vol.36 no.3 Bogotá Sep./Dec. 2007
EVALUACIÓN DEL EFECTO DE LA IMPREGNACIÓN DE PLATINO SOBRE LAS CARACTERÍSTICAS SUPERFICIALES Y ESTRUCTURALES DE UNA ZEOLITA Y
EVALUATION OF THE PLATINUM IMPREGNATION EFFECT ON THE SURFACE AND STRUCTURE FEATURES OF A ZEOLITE Y
AVALIAÇÃO DO EFEITO DA IMPREGNAÇÃO DA PLATINA SOBRE AS CARACTERÍSTICAS SUPERFICIAIS E ESTRUTURAIS DE UMA ZEOLITA Y
José Carriazo1, Mario Barrera2, Ovidio Almanza3
1 Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia, Sede Bogotá, Bogotá, Colombia. jcarriazog@unal.edu.co
2 Departamento de Química, Facultad de Ciencias e Ingeniería, Universidad de Córdoba, Montería, Colombia.
3 Departamento de Física, Facultad de Ciencias, Universidad Nacional de Colombia, Sede Bogotá, Bogotá, Colombia.
Recibido: 25/08/07 – Aceptado: 27/11/07
RESUMEN
El presente artículo muestra la evaluación de los cambios texturales, superficiales y estructurales en una zeolita Y empleada en la síntesis de sólidos a base de platino soportado. Las características estructurales se analizaron mediante difracción de rayos X (DRX), y las propiedades texturales y morfológicas mediante fisiadsorción de nitrógeno a 77K y microscopía electrónica de barrido (SEM). Adicionalmente, se determinó la dimensión fractal y la distribución de potenciales de adsorción para todos los sólidos. Los resultados muestran que el proceso de síntesis induce la formación de microporosidad en los sólidos, conservando la estructura de la zeolita y sin ocasionar alteraciones topográficas o energéticas importantes sobre la superficie del soporte.
Palabras clave: zeolita Y, catalizadores de Pt, dimensión fractal, heterogeneidad energética.
ABSTRACT
The present paper shows the evaluation of texture, surface and structure changes on a zeolite Y employed in the synthesis of solids based on supported platinum. The structure features were analyzed by X-ray diffraction (XRD) whereas the texture and morphologic properties were studied from nitrogen adsorption isotherms (77K) and scanning electron microscopy (SEM). In addition, fractal dimension and adsorption potential distribution were determinedall solids. The results show that the synthesis process induces the microporosity formation, maintaining the zeolite structure and without important topographic or energetic alterations on the surface.
Key words: Zeolite Y, Pt catalysts, fractal dimension, energetic heterogeneity.
RESUMO
O presente artigo mostra a avaliação das mudanças texturais, superficiais e estruturais em uma zeolita Y empregada na síntese de sólidos na base de platina suportada. As características estruturais foram analisadas mediante difração de raios X (DRX) e as propriedades texturais e morfológicas mediante fisiadsorção de nitrogênio a 77K e microscopia eletrônico de varredura (SEM). Adicionalmente se determinou a dimensão fractal e a distribuição dos potenciais de adsorção para todos os sólidos. Os resultados mostram que o processo da síntese induz a formação da microporosidade, conservando a estrutura da zeolita sem causar alterações topográficas ou energéticas importantes sobre a superfície de suporte.
Palavras-chave: zeolita Y, catalisadores da Pt, dimensão fractal, heterogeneidade energética.
INTRODUCCIÓN
El desempeño de sólidos en las diferentes aplicaciones (adsorción, separación o catálisis) requiere de propiedades estructurales y texturales adecuadas, para lo cual el control de la microporosidad (tamaño, volumen y forma de poros) y el área superficial son aspectos cruciales, puesto que tales parámetros determinan y limitan el empleo exitoso de estos materiales (1). En catálisis heterogénea, la geometría de la superficie, definida por la forma y el tamaño de los poros, controla la difusión de las especies reactantes hacia, y desde, los sitios activos del sólido, determinando así la actividad y la selectividad del catalizador (2, 3).
De otro lado, las zeolitas son aluminosilicatos cristalinos (tectosilicatos), estructuralmente formados por redes tridimensionales de entidades de SiO4 y AlO4 unidas mediante oxígenos compartidos. La formación de dicha estructura genera canales y cajas interconectadas que constituyen una red completamente microporosa (3). La zeolita Y, un tipo de zeolita sintética muy usado en catálisis heterogénea, presenta estructura similar a la faujasita (un mineral natural), que muestra una estructura microporosa de “supercajas” con dimensiones aproximadas de 13Å de diámetro, e interconectadas con cajas menores de aproximadamente 8Å de diámetro (3, 4).
Las zeolitas son empleadas ampliamente en procesos de catálisis heterogénea, como catalizadores o como soportes catalíticos, en reacciones de oxidación de compuestos orgánicos, reacciones de craqueo de hidrocarburos, de hidrogenación, de isomerización, y en general en procesos ácido-base (2, 5). Por otra parte, los catalizadores de platino son utilizados con frecuencia en reacciones de oxidación de CO y de compuestos orgánicos volátiles (COV) (6-9), dos reacciones de alto interés ambiental debido a la necesidad de eliminar dichos compuestos como contaminantes atmosféricos y de ambientes industriales. Para tales aplicaciones es fundamental el conocimiento profundo de las características de la superficie, entre las cuales se destacan la textura, su geometría fractal y la heterogeneidad energética. Sin embargo, según nuestro conocimiento, no existe en literatura ningún trabajo que describa el efecto de la impregnación de platino sobre dichas características en una zeolita.
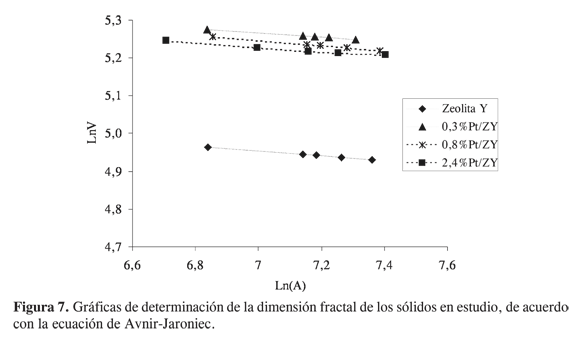
Aunque en la actualidad existen varios métodos para determinar la dimensión fractal (10, 11), quizá el carácter abstracto del concepto y la complejidad de las relaciones teóricas hacen que este tipo de caracterización sea poco aplicado. La dimensión fractal, D, es un parámetro empleado para evaluar cuantitativamente la geometría fractal, y representa una medida de las irregularidades (rugosidad) de la superficie de un sólido (10, 12). El valor de dicho parámetro puede variar de 2 a 3. El valor límite inferior, 2, corresponde a una superficie perfectamente lisa, mientras que el valor límite superior, 3, corresponde a una superficie irregular o rugosa (10-14). Una de las relaciones más simples y empleadas para determinar la dimensión fractal de un sólido a partir de datos de adsorción fue deducida por Avnir y Jaroniec (14) partiendo de la ecuación de Frenkel-Halsey-Hill (FHH), mediante la extensión de la isoterma de Dubinin-Raduskevich. La ecuación derivada por Avnir-Jaroniec es:
Ln(x) = K–(3–D)Ln(A) [1]
donde x es la cantidad adsorbida, K es constante y A es el potencial de adsorción (10, 12).
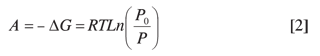
donde R es la constante universal de los gases, T es la temperatura absoluta y P0 y P son, respectivamente, las presiones de saturación y de equilibrio durante la adsorción del gas.
Por otra parte, se considera que los sólidos porosos son heterogéneos desde el punto de vista estructural y energético (15-17) (aquí el término estructural se refiere a la estructura porosa o microporosa del sólido). La heterogeneidad estructural se caracteriza usualmente mediante funciones de distribución de tamaño de poro, mientras que la heterogeneidad energética se evalúa mediante funciones de distribución de potenciales de adsorción (15-18). En principio, la heterogeneidad energética total de un sólido es el resultado de las contribuciones energéticas de superficie (heterogeneidad de la superficie: debida a grupos funcionales de la superficie, impurezas, defectos) y las contribuciones energéticas debido a la heterogeneidad estructural (microporosidad: tamaño y forma de poros) (15, 18). Para construir la distribución de potenciales de adsorción, X(A), es necesario obtener inicialmente la curva característica de adsorción v(A) (gráfica de la cantidad adsorbida (volumen líquido) como una función del potencial de adsorción), y luego derivar dicha función para obtener la siguiente expresión:

La Ecuación 3 se denomina función diferencial de distribución de potencial (15, 19), y puede expresarse en términos de la ecuación de Dubinin-Astakhov:
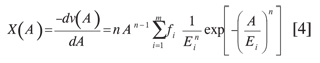
Donde fi denota la fracción de sitios de adsorción en los microporos con una energía de adsorción característica Ei, y nes el exponente clásico de la ecuación de Dubinin-Astakhov (18, 20, 21).
El objetivo del presente artículo es evaluar las variaciones en estructura y superficie (incluyendo textura, heterogeneidad energética y dimensión fractal) de una zeolita Y, después de ser modificada mediante el método de impregnación con acetilacetonatoplatino(II) para obtener catalizadores de Pt soportado. Las contribuciones del presente estudio conducen a un conocimiento más elaborado de las relaciones estructura-superficie- propiedades de este tipo de catalizadores. Así, las distribuciones de potencial de adsorción y la dimensión fractal se evalúan a partir de la medida de isotermas de adsorción de nitrógeno y la modificación estructural se verifica mediante difracción de rayos X (DRX).
MATERIALES Y MÉTODOS
Material de partida
La serie de catalizadores se sintetizó empleando como soporte una zeolita Y (ZY) sódica, suministrada por la empresa W. R. Grace Davison, con 36% de Si y 10,9% de Al (relación Si/Al de 3,4), y una capacidad de intercambio catiónico (CIC) de 78 meq/100 g.
Preparación de los materiales modificados
Los sólidos modificados se prepararon mediante impregnación húmeda con Pt, para lo cual una masa determinada de sólido (zeolita Y) se somete a presión reducida (70 mm Hg), en un rotaevaporador, a una temperatura de 80 °C por dos horas, con el fin de desalojar el agua fisiadsorbida en la superficie. Luego se adiciona un volumen apropiado de solución de acetilacetonatoplatino(II) (Aldrich, 97%) en dioxano (Merck, 99,5%), y se deja en contacto por 24 horas a temperatura ambiente. El sólido se seca a 80 ºC durante 2 horas y luego se calcina a 500 °C por 2 horas, empleando rampa de calentamiento. Finalmente, los sólidos se designan x%Pt/ZY (x representa el porcentaje de platino determinado experimentalmente).
Caracterización de los sólidos
El contenido de Pt en los sólidos se determinó por absorción atómica en un espectrofotómetro Varian A10. Los análisis de difracción de rayos X (DRX) se desarrollaron en un difractómetro Philips PW 1820 (radiación Kα de Cu, λ =1,54056Å), con geometría 2θ y configuración Bragg-Brentano. Los difractogramas se tomaron a temperatura ambiente empleando la técnica de polvo forzado, con tamaño de paso de 0,05°2θ y tiempo de paso de 10s. Los análisis de microscopía electrónica de barrido (SEM) se realizaron en un microscopio FEI QUANTA 200, con analizador EDX. Cada sólido se analizó mediante la toma de más de tres micrografías (con EDX) en sitios diferentes de la superficie, con el fin de obtener mayor confiabilidad en el análisis.
Las isotermas de adsorción de nitrógeno se tomaron a una temperatura de 77K, en un sortómetro Quantachrome Autosorb 1, en el rango P/P0 de 10-5 hasta 0,99. Para ello las muestras se desgasificaron previamente a 300 °C, alcanzando presiones menores a 50 µmHg, durante 12 horas. Las áreas superficiales se calcularon mediante el modelo de Langmuir, y las áreas y los volúmenes de microporo se determinaron mediante el método de Dubinin- Astakhov (DA) (22, 23). Para todos los cálculos se asume que la molécula de nitrógeno (N2) ocupa un área de 16,2 Å2, y que la densidad del nitrógeno condensado en los poros es igual a la del nitrógeno líquido a 77K, ρ=0,81 g/cm3 (1, 24, 25). Finalmente, la dimensión fractal se determinó mediante el método de Avnir-Jaroniec, en el rango de presión relativa (P/P0) comprendido entre 0,08 y 0,2 (10, 12, 14), las distribuciones de potencial de adsorción se determinaron mediante la extensión de Dubinin-Astakhov (Ecuación 4) y mediante la forma diferencial (Ecuación 3).
RESULTADOS Y DISCUSIÓN
El análisis por DRX de los diferentes sólidos (Figura 1) revela la conservación de la estructura cristalina de la zeolita Y luego de la modificación con Pt. En principio, todos los difractogramas muestran las señales características de la zeolitaY(26-28) conservando los valores de intensidad y ancho de pico. Además, en ningún caso se observan señales características de especies de Pt, probablemente debido a las bajas cantidades del metal y su buena dispersión sobre el soporte. La Tabla 1 muestra los valores de “ancho a altura media” para la señal a ángulo más bajo, la posición de dicha señal y los tamaños de partícula, para el soporte (zeolita), calculados por la ecuación de Scherrer. Evidentemente no ocurre variación significativa en el tamaño de partícula o en la cristalinidad de los materiales. Sin embargo, se observa un ligero corrimiento (hacia ángulos más bajos, es decir, hacia espaciados interplanares mayores) en la posición de las señales correspondientes a los sólidos modificados con respecto las de la zeolita Y. Dicho corrimiento se verifica para todas las señales y en todos los casos sucede en la misma proporción (Figura 2). Adicionalmente, se observó un desplazamiento similar para la zeolita Y secada a 80 °C y posteriormente calcinada a 500 °C durante dos horas (difractograma no incluido aquí).
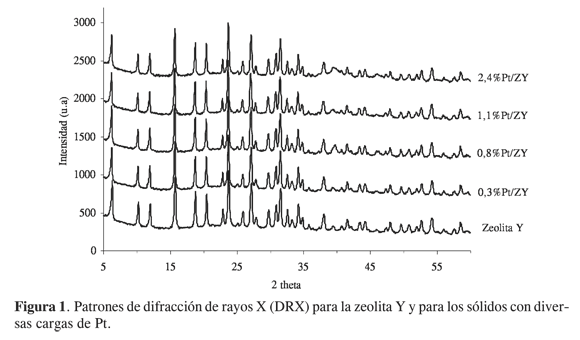
Las ligeras variaciones en todas las posiciones de las señales de difracción para los sólidos modificados con Pt, denotan un aumento en los espaciados interplanares y por tanto una ligera expansión en el tamaño de la celda cristalina del material original (recuérdese que la zeolita Y es un sistema cristalino cúbico, y para este tipo
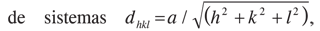
donde a es la longitud de la arista de la celda, dhkl es el espaciado interlaminar y h, k, l, son los índices de Miller de los planos considerados), como consecuencia del proceso de modificación en su conjunto. Evidentemente el método de impregnación empleado, con solvente orgánico (dioxano), evita el contacto de la zeolita con la humedad favoreciendo al máximo la ausencia de condiciones hidrotérmicas durante el proceso de secado y calcinación. En efecto, las condicioneshidrotérmicas conllevan (en otros métodos de síntesis) a la pérdida de cristalinidad y al colapso parcial de los sólidos (debido a la dealuminización) aún bajo condiciones de temperatura relativamente moderadas (26, 29, 30). De esta manera, en el presente estudio es evidente que el empleo de dioxano como solvente permite conservar la estructura cristalina de la zeolita.
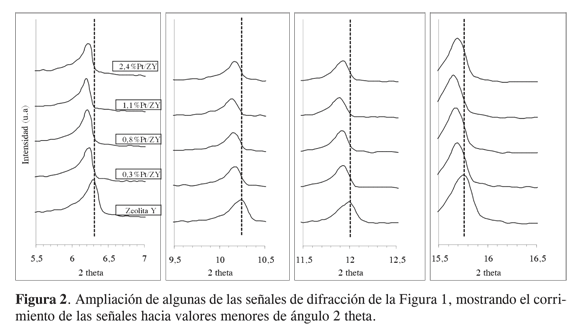
Por otra parte, es probable que la ligera expansión de la celda cristalina de la zeolita favorezca la incorporación de especies de platino en las cajas de la misma, de manera muy bien distribuida. De hecho, se tiene conocimiento sobre la posible migración de ciertas especies metálicas al interior de las cavidades o cajas de sólidos tipo zeolita (27-29).
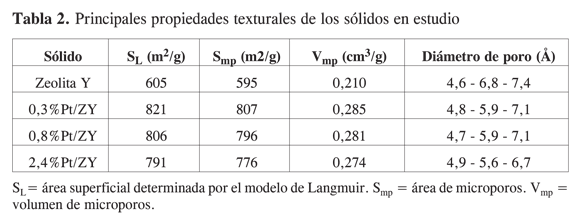
La Figura 3 muestra las isotermas de adsorción de nitrógeno para la zeolita Y y para los catalizadores sintetizados (no se incluye la isoterma del sólido 1%Pt/ZY, por su similitud con el sólido 0,8% Pt/ZY). Se observa que todas las isotermas son claramente de tipo I (según la clasificación de la IUPAC), típicas de adsorción en monocapa. La forma de las isotermas refleja la predominancia de texturas microporosas (con histéresis, no mostradas aquí, de forma idéntica en todos los casos). Además, es evidente que el proceso de impregnación con Pt conduce a un aumento en la capacidad de adsorción. En la Tabla 2 se observa que, aunque inicialmente es evidente el aumento de los valores de área y volumen de microporo, luego dichos valores empiezan a decaer cuando se alcanza cierta cantidad incorporada de Pt (0,8%), como consecuencia del posible crecimiento de los agregados de Pt, sobrepasando la capacidad de alojamiento en los microporos del sólido, e iniciando el bloqueo al acceso de las moléculas de adsorbato.
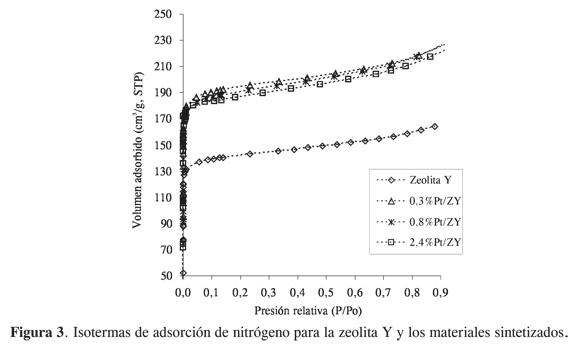
En suma, el mejoramiento de las propiedades texturales de los materiales durante su modificación probablemente podría estar relacionado con los efectos decalcinación de los sólidos, es decir, con la consecuente deshidroxilación de la estructura (pérdida de grupos OH, disminución en la capacidad de formar enlaces de hidrógeno y formación de microcavidades), que sin la formación de especies de platino con tamaño suficiente que pudieran generar obstrucción de las estructuras microporosas, sino con la formación de especies muy pequeñas que se localizanen las cavidades del sólido, conjuntamente contribuyen a la formación de microporos. La hipótesis anterior puede soportarse en tres eventos fundamentales:
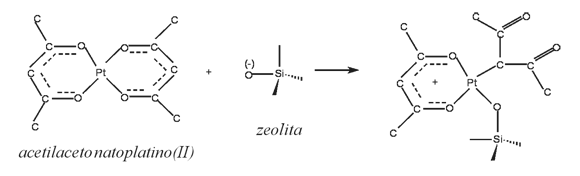
1. El elevado valor de CIC en la zeolita Y(78 meq/100g) podría permitir una mejor dispersión de las especies de Pt, llevando a la formación de especies de tamaño muy pequeño y distribuidas por toda la superficie microporosa: Aunque generalmente se considera que los sitios de intercambio iónico no juegan papel importante en los procesos de impregnación con especies neutras, como el acetilacetonatoplatino(II), los sitios donores de electrones (sitios Brönsted o Lewis en la zeolita) favorecen el anclaje del compuesto de coordinación precursor, como sigue (31, 32):

2. Los elevados valores de área superficial y volumen de microporo en la zeolita Y favorecen la dispersión de la fase metálica. Como se mencionó, se sabe que las especies de platino pueden migrar a través de los canales de la zeolita y localizarse en las cajas (29).
3. La calcinación de la zeolita conduce a la deshidroxilación de la estructura delmaterial, con la consecuente generación de porosidad en los sitios donde existen defectos de vacancias, debido a la pérdida de grupos OH (pérdida de enlaces de H) y la generación de enlaces siloxano (29):
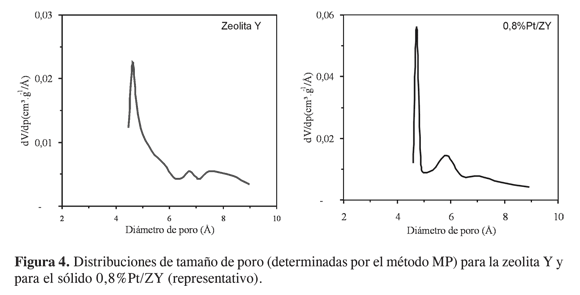
La Figura 4 muestra la forma típica de las distribuciones de tamaño de poro obtenidas mediante el método MP (24). En todos los casos se verifica la heterogeneidad estructural de los sólidos mediante la detección de distribuciones multimodales con tres máximos importantes, correspondientes a los tres valores de diámetro de poro indicados en la Tabla 2. Además, se observó que dichos valores son aproximadamente iguales, pero los volúmenes adsorbidos son mayores en los sólidos que contienen Pt, revelando nuevamente la generación de microporosidad como consecuencia del proceso de modificación. También puede observarse que la distribución de tamaño de poros correspondiente a la zeolita Y presenta el máximo más importante (4,6Å) con forma asimétrica, indicando la posible existencia de máximos adicionales entre 4,6 y 6Å. De esta manera, parece claro que con el proceso de modificación con Pt se generan microporos alrededor de 4,6Å y 5,9Å, mientras que se pierde otra fracción menor de microporos en intervalos intermedios.
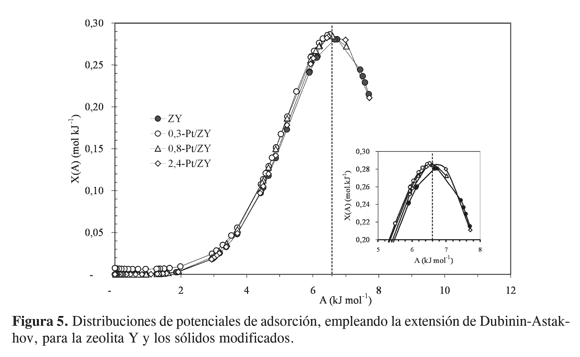
Por otra parte, la evaluación de la heterogeneidad energética mediante la función de distribución de potenciales de adsorción empleando la extensión de Dubinin-Astakhov (Ecuación 4), indica un máximo alrededor de un valor de potencial de 6,6 kJ/mol en todos los sólidos, sin mostrar diferencias significativas entre los materiales dopados con Pt y la zeolita de partida (Figura 5). Lo anterior puede explicarse teniendo en cuenta que todos los sólidos presentan el mismo tipo de microporosidad (poros con tamaño y forma semejante, de acuerdo con la información proporcionada por la histéresis), como se indicó en la Tabla 2, y que además la superficie de los sólidos es bastante homogénea (heterogeneidad superficial baja) y similar en todos los casos. Esto indica que el Pt soportado sobre la zeolita no genera alteraciones energéticas considerables sobre la superficie del sólido de partida. De la misma manera, debe tenerse en cuenta que en sólidos altamente microporosos (como los estudiados en el presente trabajo), en donde el área superficial es casi en su totalidad área de microporos, y por consiguiente el área externa es mínima, el origen de la heterogeneidad energética puede atribuirse casi en su totalidad a la heterogeneidad estructural (18). Sin embargo, como se mencionó, aunque los sólidos presentan microporosidad semejante en cuanto a forma y tamaño, los volúmenes de poro son mayores en los sólidos modificados que en la zeolita Y, lo cual no es observado por las distribuciones de potenciales de adsorción de la Figura 5. De hecho, según Kruk-Jaroniec-Choma (19) la aplicación de la ecuación de Dubinin-Astakhov como una isoterma local o individual (33) en la ecuación integral que describe la isoterma general de adsorción, y por tanto en la distribución X(A), es cuestionable para determinar la cantidad total adsorbida.
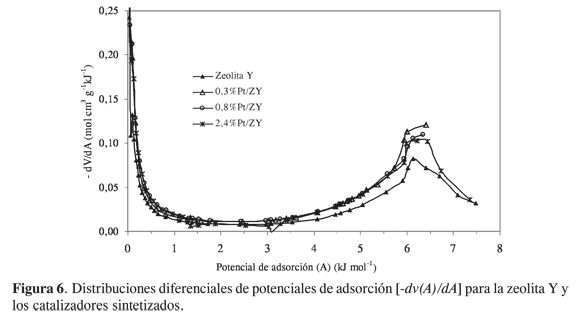
Con el objetivo de explorar una mayor información sobre la heterogeneidad energética de los materiales en estudio, seobtuvo adicionalmente la distribución de potenciales de adsorción para cada sólido a partir de la primera derivada (Ecuación 3) de la curva característica de adsorción (Figura 6). En dichas distribuciones se observa nuevamente un máximo característico alrededor de 6,2 kJ/mol y, a diferencia de las distribuciones mostradas en la Figura 5, en este caso se notan diferencias importantes en cuanto a la altura del máximo en las curvas de los catalizadores con respecto al de la zeolita Y, como consecuencia de incrementos mayores en los volúmenes de microporo de los sólidos modificados con Pt. La señal alrededor de 6,2 kJ/mol corresponde a la microporosidad de los sólidos (a mayores valores de potencial de adsorción, menores valores de presión relativa), mientras que el aumento de las funciones de distribución en la medida en que el potencial de adsorción tiende a cero (presiones relativas altas) refleja la adsorción en multicapa y la posible condensación capilar (15).
De otro lado, la Figura 7 y la Tabla 3 muestran los resultados de la determinación de la dimensión fractal de los sólidos. El elevado valor de dimensión fractal (2,94, muy cercano a 3) para la zeolita Y y los materiales modificados, revela la elevada rugosidad de la superficie de dicho soporte, correspondiente con su alta microporosidad. Sin embargo, la modificación de los sólidos con platino no conduce a ninguna variación significativa de la dimensión fractal. La conservación de los valores de dimensión fractal en los materiales sintetizados a partir de la zeolita Y indica que no ocurren modificaciones topográficas o morfológicas significativas en la superficie del sólido, lo que probablemente puede relacionarse con una muy buena dispersión de la fase metálica y la posible migración de especies muy pequeñas de platino hacia el interior de la estructura microporosa del soporte.
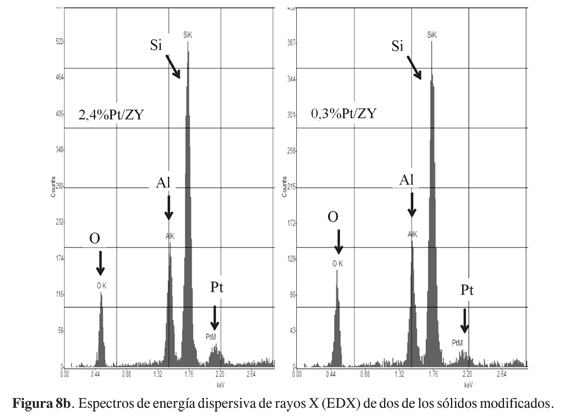
La Figura 8a muestra algunas micrografías (SEM) representativas de los sólidos, en donde se registran aglomerados de partículas (zeolita) con morfología irregular. El análisis por microscopía electrónica de barrido no revela modificaciones apreciables en la morfología de las partículas de la zeolita luego de su modificación con Pt, aunque el análisis por EDX indica la presencia del metal en los sólidos. Dichos resultados concuerdan con la ausencia de variación en los valores de dimensión fractal, corroborando la conservación de la morfología y la topografía (geometría fractal) de la superficie de las partículas.

CONCLUSIONES
A partir del presente trabajo es posible establecer que, en las condiciones de síntesis empleadas y con las cantidades de platino incorporadas, no ocurren alteraciones energéticas ni topográficas importantes sobre la superficie de la zeolita Y; sin embargo, el proceso de modificación, en su conjunto, induce la formación de microporosidad en los sólidos. Además, dichas observaciones fortalecen la hipótesis sobre la migración del Pt hacia el interior de las cajas de la zeolita, ya reportada en literatura.
REFERENCIAS BIBLIOGRÁFICAS
1. Barrera-Vargas, M.; Valencia-Rios, J.; Vicente, M.; Korili, S.; Gil, A.Effect of the platinum content on the microstructure and micropore size distribution of Pt/alumina- pillared clays. J. Phys. Chem. B. 2005. 109: 23461-23465. [ Links ]
2. Weitkamp, J.; Ernst, S.; Puppe, L. Shape-Selective Catalysis in Zeolites. In: Catalysis and Zeolites: Fundamentals and Applications. Berlin. 1999 (J. Weitkamp and L. Puppe, Editors) Springer-Verlag. pp. 327-376. [ Links ]
3. Satterfield, C. N. Heterogeneous Catalysis in Industrial Practice. 2 edition. New York, McGraw-Hill. 1991. pp. 230-232, 244-247. [ Links ]
4. Leach, B. E. Applied Industrial Catalysis (Vol. 3). USA, Academic Press. 1984. p.p. 273-276. [ Links ]
5. Blauwhoff, P. M. M.; Gosselink, J. W.; Kieffer, E. P.; Sie, S. T.; Stork, W. H. J . Zeolites as Catalysts in Industrial Processes. In: Catalysis and Zeolites: Fundamentals and Applications. Berlin. 1999 (J. Weitkamp and L. Puppe, Editors) Springer- Verlag. pp. 437-538. [ Links ]
6. Zwinkels, M; Järas, S.; Menon, P.; Griffin, T. Catalytic materials for high-temperature combustion. Catal. Rev. Sci. Eng. 1993. 35: 319- 358. [ Links ]
7. Gil, A.; Vicente, M. A.; Lambert J.-F.; Gandía L. Platinum catalysts supported on Al-pillared clays. Application to the catalytic combustion of acetone and methylethyl- ketone. Catalysis Today. 2001. 68: 41-51. [ Links ]
8. Mhadeshwar, A. B.; Vlachos, D. G. Is the water-gas shif reaction on Pt simple? Computer-aided microkinetic model reduction, lumped rate expression, and rate-determining step. Catalysis Today. 2005. 105: 162-172. [ Links ]
9. Querino, P. S.; Bispo, J. R. C.; Rangel, M. C. The effect of cerium on the properties of Pt/ZrO2 catalysts in the WGSR. Catalysis Today. 2005. 107-108: 920-925. [ Links ]
10. Jaroniec, M. Evaluation of the fractal dimension from single adsorption isotherms. Langmuir. 1995. 11: 2316-2317. [ Links ]
11. De Stefanis, A.; Tomlinson, A.; Steriotis, T. A.; Charalambopoulou, G.; Keiderling, U. Study of structural irregularities of smectite clay systems by small angle neutron scattering and adsorption. Applied Surface Science. 2007. 253: 5633-5639. [ Links ]
12. Gil, A.; Cherkashinin, G. Y.; Korili, S. A. Fractal dimension of a pillared montmorillonite from nitrogen adsorption at 77K. J. Chem. Eng. Data. 2004. 49: 639-641. [ Links ]
13. Sonwane, C. G.; Bhatia, S. K.; Calos, N. J. Characterization of surface roughness of MCM-41 using methods of fractal analysis. Langmuir. 1999. 15: 4603-4612. [ Links ]
14. Avnir, D.; Jaroniec, M. An isotherm equation for adsorption on fractal surfaces of heterogeneous porous materials. Langmuir. 1989. 5: 1431- 1433. [ Links ]
15. Jaroniec, M.; Gadkaree, K. P.; Choma, J. Relation between adsorption potential distribution and pore volume distribution for microporous carbons. Colloids and Surfaces A. 1996. 118: 203-210. [ Links ]
16. Korili, S. A.; Gil, A. On the applications of various methods to evaluate the microporous properties of activated carbons. Adsorption. 2001. 7: 249-264. [ Links ]
17. Gil, A.; Gandía, L. M. Microstructure and quantitative estimation of the micropore-size distribution of a alumina-pillared clay from nitrogen adsorption at 77K and carbon dioxide adsorption at 273K. Chemical Engineering Science. 2003. 58: 3059-3075. [ Links ]
18. Jaroniec, M.; Gilpin, R. K.; Kaneko, K.; Choma, J. Evaluation of heterogeneity and microporosity of activated carbon fibers on the basis of gas adsorption isotherms. Langmuir. 1991. 7: 2719-2722. [ Links ]
19. Kruk, M.; Jaroniec, M.; Choma, J. Comparative analysis of simple and advanced sorption methods for assessment of microporosity in activated carbons. Carbon. 1998. 36: 1447-1458. [ Links ]
20. Gil, A.; Grange, P. Application of the Dubinin-Radushkevich and Dubinin- Astakhov equations in the characterization of microporous solids. Colloids and Surfaces A. 1996. 113: 39-50. [ Links ]
21. Jaroniec, M.; Choma, J. On the characterization of structural heterogeneity of microporous solids by discrete and continuous micropore distribution functions. Materials Chemistry and Physics. 1988. 19: 267-289. [ Links ]
22. Greeg, S. J.; Sing, K. S. W. Adsorption, surface area and porosity. 2 edition. London. Academic Press. 1982. pp. 225-227. [ Links ]
23. Rouquerol, F.; Rouquerol, J.; Sing, K. S. W. Adsorption from the gas phase. The experimental approach. In: Handbook of porous solids (Vol. 1). Winheim (Germany) 2002. Wiley- VCH. pp. 236-275. [ Links ]
24. Leofanti, G.; Padovan, M.; Tozzola, G.; Venturelli, B. Surface area and pore texture of catalysts. Catalysis Today. 1998. 41: 207-219. [ Links ]
25. Thomas, J. M.; Thomas, W. J. Principles and Practice of Heterogeneous Catalysis. Weinheim, VCH Verlag. 1997. pp. 80, 105, 106, 259, 270-282. [ Links ]
26. Xu, B.; Rotunno, F.; Bordiga, S.; Prins, R.; van Bokhoven, J. A. Reversibility of structural collapse in zeolite Y: Alkane cracking and characterization. Journal of Catalysis. 2006. 241: 66-73. [ Links ]
27. Ramos Moreira, C.; Maciel Pereira, M.; Alcobé, X.; Homs, N.; Llorca, J.; Fierro, J. L.; Ramírez de la Piscina, P. Nature and location of cerium in Ce-loaded Y zeolites as revealed by HRTEM and spectroscopic techniques. Microporous and Mesoporous Materials. 2007. 100: 276-286. [ Links ]
28. Castaño, P.; Pawelec, B.; Fierro, J. L.; Arandes, J. M.; Bilbao, J. Aromatic reduccion of pyrolysis gasoline (PyGas) over HY-supported transition metal catalysts. Applied Catalysis A. 2006. 315: 101-113. [ Links ]
29. Kühl, G. H. Modification of Zeolites. In: Catalysis and Zeolites: Fundamentals and Applications. Berlin. 1999 (J. Weitkamp and L. Puppe, Editors) Springer-Verlag. pp. 437-538. [ Links ]
30. Tonetto, G.; Atias, J.; de Lasa, H. FCC catalysts with different zeolite crystallite sizes: acidity, structural properties and reactivity. Applied Catalysis A. 2004. 270: 9-25. [ Links ]
31. Cotton, F. A.; Wilkinson, G. Química Inorgánica Avanzada 4 edición. México. Limusa. 2001. pp. 1146-1149. [ Links ]
32. Gunter, P.; Niemantsverdriet, J. W. Surface science approach to modelling supported catalysts. Catal. Rev. Sci. Eng. 1997. 39: 77-168. [ Links ]
33. Gil, A.; Korili, S. Cherkashinin. G. Y. Extension of the Dubinin- Astakhov equation for evaluating the micropore size distribution of a modified carbon molecular sieve. Journal of Colloid and Interface Science. 2003. 262: 603-607. [ Links ]














