Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804On-line version ISSN 2357-3791
Rev.Colomb.Quim. vol.36 no.3 Bogotá Sep./Dec. 2007
EFECTO DE LA TEMPERATURA SOBRE LAS PROPIEDADES VOLUMÉTRICAS DE ALCOHOLES ALIFÁTICOS EN SOLUCIONES ACUOSAS DILUIDAS
EFFECT OF TEMPERATURE ON THE VOLUMETRIC PROPERTIES OF ALIPHATIC ALCOHOLS IN DILUTE AQUEOUS SOLUTIONS
EFEITO DA TEMPERATURA SOBRE AS PROPRIEDADES VOLUMÉTRICO DE ÁLCOOIS ALIFÁTICOS EM SOLUÇÕES AQUOSAS DILUÍDAS
Carmen M. Romero1, Andrés F. Suárez2, Eulogio Jiménez3
1 Departamento de Química, Universidad Nacional de Colombia, Sede Bogotá. Bogotá, Colombia. cmromeroi@unal.edu.co
2 Departamento de Química, Universidad Nacional de Colombia, Sede Bogotá. Bogotá, Colombia.
3 Facultad de Ciencias, Departamento de Física, Universidade da Coruña, España.
Recibido: 27/08/07 – Aceptado: 27/11/07
RESUMEN
La influencia de la temperatura sobre las propiedades volumétricas de soluciones acuosas ha sido frecuentemente usada para obtener información sobre los efectos de los distintos solutos sobre la estructura del agua.
En este trabajo se presentan los resultados experimentales de densidades de soluciones acuosas diluidas de n-pentanol, n-hexanol, n-heptanol y n-octanol a 288,15; 293,15; 298,15; 303,15 y 308,15 K. Las medidas de densidad fueron realizadas en un densímetro Antón Paar de tubo vibracional (DMA 60/602) y a partir de los datos obtenidos se calcularon volúmenes de exceso, volúmenes molares aparentes y volúmenes molares parciales a dilución infinita. Para determinar el carácter hidrofóbico de los solutos empleados y su efecto sobre la estructura del agua se empleó el criterio de la segunda derivada del volumen molar parcial en función de la temperatura. Se calculó la contribución volumétrica del grupo CH2 encontrándose que tiene un valor constante en el rango de temperatura estudiado.
Palabras clave: alcohol, volumen molar parcial, contribución de grupos, interacciones soluto-solvente.
ABSTRACT
The effect of temperature on the behavior of volumetric and surface properties of aqueous solutions has often been used to obtain information about solute effect on water structure.
In this work, we present experimental results for densities of dilute aqueous solutions of n-pentanol, n-hexanol, n-heptanol and n-octanol at 288.15; 293.15; 298.15; 303.15 and 308.15 K. Density measurements were realized using an Anton Paar (DMA 60/602) vibrating tube densimeter. Excess volumes, apparent volumes and molar partial volumes at infinite dilution were evaluated from density data. The second derivate of partial molar volume with temperature was used to determine the hydrophobic character of the solutes and their effect on the water structure. The volumetric contribution of CH2 group was evaluated and it has a constant value at the studied temperatures.
Key words: Alcohols, partial molar volumes, group contribution, solute-solvent interactions.
RESUMO
A influência da temperatura sobre as propriedades volumétricas de soluções aquosas tem sido freqüentemente usada para obter informação sobre os efeitos dos diferentes solutos na estrutura do água.
Neste trabalho apresentam-se os resultados experimentais de densidades de soluções aquosas diluídas de n-pentanol, n-hexanol, n-heptanol y n-octanol à 288,15; 293,15; 298,15; 303,15 y 308,15 K. As medidas de densidade foram realizadas num densímetro Anton Paar de tubo vibracional (DMA 60/602) e partindo dos dados obtidos calcularam-se volumes de excesso, volumes molares aparentes e volumes molares parciais à diluição infinita. Para determinar o caráter hidrofóbico dos solutos e o seu efeito sobre estrutura de água usou-se o critério da segunda derivada do volume molar parcial em função da temperatura. Foi calculado a contribuição volumétrica do grupo de CH2 encontrando- se que tem um valor constante na faixa de temperatura estudada.
Palavras-chave: água do álcool, volumes molares parciais, contribuição volumétrica do grupo, interações soluto-solvente.
INTRODUCCIÓN
El comportamiento de soluciones acuosas altamente diluidas presenta uno de los ejemplos más interesantes en la fisicoquímica de soluciones ya que se puede obtener información acerca de las interacciones soluto–solvente y sobre los cambios inducidos por los solutos sobre la estructura del agua. Adicionalmente, esta información es muy importante en el desarrollo de modelos termodinámicos semiempíricos para la predicción de propiedades en solución acuosa.
Las propiedades termodinámicas de las soluciones acuosas de alcoholes son de gran importancia ya que presentan un comportamiento complejo especialmente en la zona diluida, debido a la diferente naturaleza de las interacciones entre los grupos polares y apolares con el agua; y si bien se sabe que dicho comportamiento tiene origen en las características estructurales del agua, aún no ha sido claramente explicado.
La determinación de propiedades molares parciales a dilución infinita a partir de datos experimentales tiene una importancia fundamental, ya que en ese estado las interacciones soluto-soluto están ausentes. Puesto que el comportamiento complejo tiene origen en la naturaleza de las interacciones alcohol-agua y en el efecto del soluto sobre la estructura del solvente acuoso, el estudio del volumen molar parcial a dilución infinita de los alcoholes de cadena lineal provee información importante acerca de los procesos de hidratación hidrofóbica e hidratación hidrofílica.
Los alcoholes de bajo peso molecular han sido ampliamente estudiados ya que la solubilidad de éstos es bastante alta, en búsqueda de una explicación sobre el comportamiento particular que presentan a baja concentración (1-15). El metanol, el etanol y el propanol son completamente solubles en agua a 298,15K y presiones cercanas a 1 atm. Sin embargo, a medida que la longitud de cadena aumenta, la solubilidad disminuye drásticamente. Es así como para el heptanol y el octanol las solubilidades reportadas a 25 oC son de 0,0930 y 0,0538 g/100g H2O (16, 17). Lo anterior dificulta mucho el trabajo experimental y por ello para alcoholes con cadenas apolares de más de cuatro carbonos, la información es muy escasa en especial a temperaturas distintas de 298,15K (9, 10, 18).
Por esta razón, en este estudio se presentan las densidades de soluciones acuosas de n-pentanol, n-hexanol, n-heptanol y n-octanol a 288,15; 293,15; 298,15; 303,15 y 308,15 K. Los alcoholes fueron seleccionados ya que el incremento en la longitud de cadena permite analizar la naturaleza de las interacciones entre los grupos no polares y el agua en términos de aditividad de grupos CH2.
El efecto de la temperatura sobre el comportamiento de las propiedades volumétricas se discute en términos del balance entre las interacciones hidrofóbicas e hidrofílicas y su efecto sobre la estructura del agua. Se utiliza el criterio propuesto por Hepler quien plantea que si la segunda derivada del volumen molar parcial a dilución infinita es negativa(∂2V0/∂T2) <0, el soluto tiene un carácter disruptor de estructura, mientras que si el comportamiento de la segunda derivada es positivo(∂2 V0/∂T2) >0, el soluto tiene un efecto formador de estructura (19).
MATERIALES Y MÉTODOS
Las soluciones acuosas de n-pentanol, n-hexanol, n-heptanol y n-octanol fueron preparadas por pesada en una balanza Mettler AT201 de doble rango con sensibilidad de 10 –5 g en el rango bajo. Se utilizó agua bidestilada y desgasificada y 1-heptano (Fluka puriss. > 99,5%). Los alcoholes: 1-pentanol (Fluka puriss. >99%), 1-hexanol (Fluka puriss. >99%), 1 heptanol (Fluka puriss. > 99,5%), 1-octanol (Fluka puriss >99,5%) fueron secados sobre tamiz molecular para retirar posibles rastros de humedad.
Para la determinación de las densidades se usó un densímetro de tubo vibracional (Anton Paar 60/602), el cual tiene una precisión de 5x10-6 g cm-3. El equipo tiene un termostato Schott-Gerate CT 1450, que permite un control de temperatura de ± 0,01 K. La determinación de la temperatura de la celda se realizó mediante un termistor ubicado en su interior que se encuentra conectado a dos termómetros digitales Anton Paar DT 100-20 para las temperaturas entre 288,15 K y 293,15 K y DT 100-30 para las temperaturas entre 298,15 K y 308,15 K que permiten efectuar lecturas con una precisión de ± 0,01 K.
La calibración del densímetro se hizo a cada temperatura con agua bidestilada y n-heptano, para los cuales se tienen valores de densidad de muy buena precisión reportados en la literatura . Tanto para la calibración como para la determinación de la densidad de las soluciones acuosas, las medidas se efectuaron por triplicado. La incertidumbre experimental en la densidad es de ±1x10-5 g cm-3.
RESULTADOS Y DISCUSIÓN
Las Tablas 1-4 muestran la densidad promedio de las mezclas alcohol–agua para diferentes concentraciones a cada temperatura.
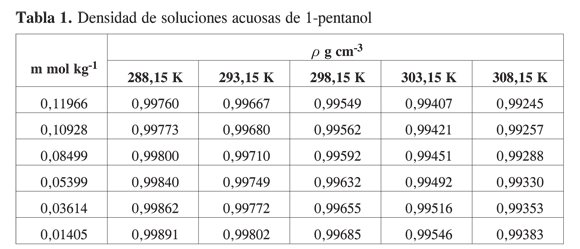
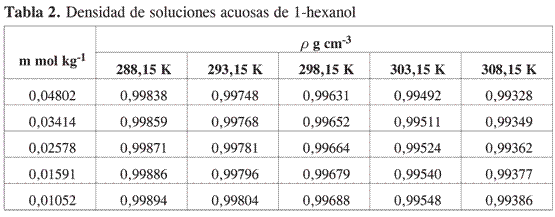
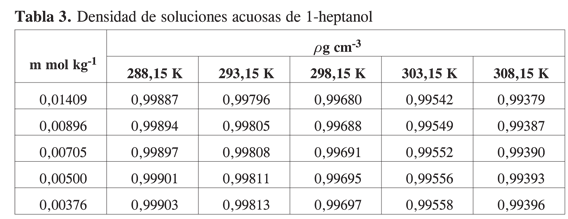
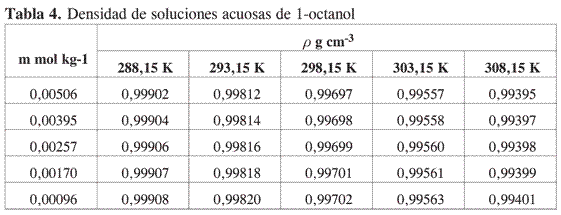
Los métodos experimentales para la determinación de propiedades a dilución infinita, implican la extrapolación a concentración cero de medidas realizadas a concentración finita y la única forma de minimizar el error involucrado en la extrapolación es tener suficientes datos en la región de muy alta dilución.
Para la determinación del volumen molar parcial a dilución infinita es necesario escoger cuidadosamente el método de extrapolación. Para el caso de soluciones acuosas diluidas el método de los volúmenes molares aparentes resulta conveniente ya que su determinación se hace directamente a partir de las medidas de densidad y, en consecuencia, la extrapolación a dilución infinita tiene una incertidumbre inferior a la que se obtiene calculando los volúmenes molares parciales a cada concentración para luego efectuar la extrapolación. Un ajuste como el de Redlich– Kister ha sido usado por varios investigadores (12-14, 21, 22), pero en este caso no es aplicable debido al pequeño intervalo de concentraciones en el que se hicieron los experimentos debido a la baja solubilidad de los alcoholes.
Los volúmenes molares aparentes de los solutos øv fueron calculados mediante la siguiente ecuación:
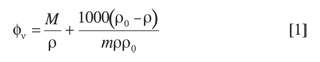
donde
M: masa molecular del soluto
m: molalidad del soluto
ρ y ρ0: densidades de la solución y del agua respectivamente.
Los resultados obtenidos se presentan en las Tablas 5-8.
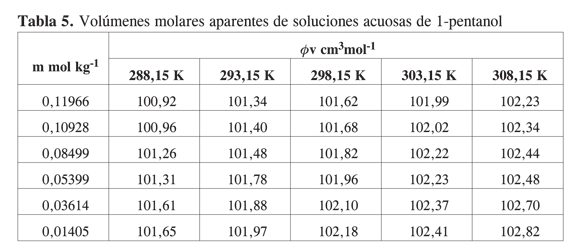
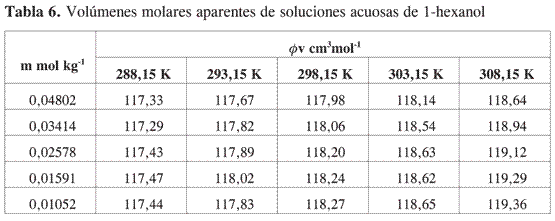
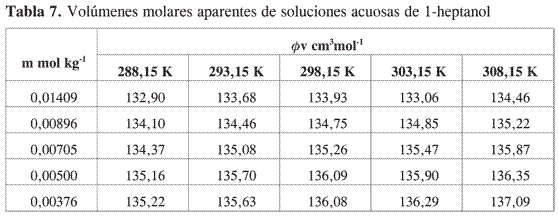
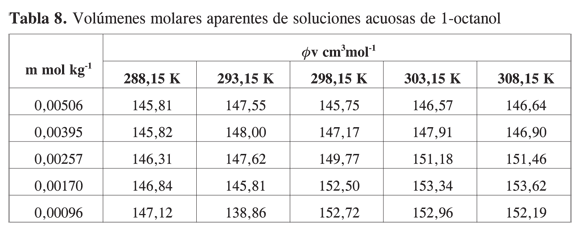
Se aprecia que los volúmenes molares aparentes se hacen mayores a medida que aumenta la temperatura y disminuye la concentración. A diferencia de lo que se observa en alcoholes de cadena corta, el mínimo característico que se nota en estos alcoholes, en los alcoholes estudiados no se observan mínimos ni inflexiones en la curva en el rango de concentración en el cual se obtuvieron los datos experimentales.
La tendencia observada muestra que en la región diluida los volúmenes molares aparentes disminuyen a medida que aumenta la concentración de alcohol. Todas las pendientes límites son negativas, lo que indica la presencia de interacciones específicas importantes por puentes de hidrógeno entre los alcoholes y el agua.
Los datos de volumen molar aparente en función de la molalidad fueron ajustados por mínimos cuadrados a una ecuación de segundo orden y por extrapolación se obtuvo a cada una de las temperaturas el volumen molar aparente a dilución infinita.
El volumen molar parcial del soluto señalado con el subíndice 2, y el volumen molar aparente se pueden relacionar a partir de la ecuación:
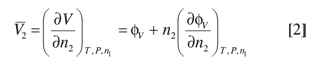
De esta ecuación se deduce que a dilución infinita el volumen molar aparente se hace igual al volumen molar parcial, es decir:

En la Tabla 9 se muestran los valores del volumen molar parcial a dilución infinita para los alcoholes estudiados y los valores reportados en la literatura para los alcoholes de menor longitud de cadena (1, 2, 7, 9). Los resultados obtenidos concuerdan con los datos disponibles en la literatura. No se han encontrado valores reportados para el volumen molar parcial a dilución infinita para el 1-heptanol y el 1-octanol.
A todas las temperaturas estudiadas el volumen molar parcial a dilución infinita aumenta linealmente con el número de grupos CH2 y para cada alcohol el valor crece al aumentar la temperatura.
La tendencia lineal de los datos de volumen molar parcial en función del número de átomos de carbono permite obtener la contribución al volumen molar parcial del alcohol para cada uno de los grupos CH2.No se nota una tendencia definida en el valor de la contribución volumétrica del grupo CH2 en función de la temperatura, lo cual puede deberse a que el rango de temperatura trabajado no es muy grande y por ello su valor es aproximadamente constante. El valor promedio de la contribución volumétrica en el rango de temperatura es 15,84 cm3 mol-1.
Son varios los criterios usados para interpretar el efecto de los solutos sobre la estructura del agua. La pendiente negativa

algunos investigadores como indicadora de comportamiento hidrofóbico, en particular en el caso de series homólogas . Sin embargo, el criterio más general basado en propiedades volumétricas es el propuesto por Hepler (19) según el cual, la segunda derivada del volumen molar parcial con respecto a la temperatura refleja el efecto del soluto sobre la estructura del agua. Valores positivos se asocian con solutos formadores de estructura y valores negativos se asocian con solutos disruptores de la estructura del agua. Se encontró que la segunda derivada es positiva para los alcoholes de cadena de 5, 6, 7 y 8 carbonos, lo que refleja que todos los solutos estudiados tienen un efecto formador de estructura. Los valores no se presentan ya que son muy pequeños, y del orden de la incertidumbre estimada en los volúmenes molares parciales a dilución infinita.
AGRADECIMIENTOS
Este trabajo fue realizado con el apoyo de la Universidad Nacional de Colombia y de la Universidade da Coruña, España.
REFERENCIAS BIBLIOGRÁFICAS
1. Alexander, D. M. Apparent Molar Volume of Alcohols in dilute aqueous solutions. J. Chem. & Eng. Data. 1959. 4 (3): 252-254. [ Links ]
2. Alexander, D. M.; Hill D. J. T. Apparent molar volumes in dilute aqueous propanol solutions. Aust. J. Chem. 1965. 18 (5): 605-608. [ Links ]
3. Cabani, S.; Conti, G.; Matteoli, E. Partial molal expansibilities of organic compounds in aqueous solution. I. Alcohols and ethers. J. Solution Chem. 1976. 5 (11): 751-763. [ Links ]
4. Hoiland, H. Partial molal volumes, expansibilities, and compressibilities for aqueous alcohol solutions between 5 °C and 40 °C. J. Solution Chem. 1980. 9 (11): 857-866. [ Links ]
5. Jolicoeur C.; Lacroix G. Thermodynamic properties of aqueous organic solutes in relation to their structure. Part III. Apparent molal volumes and heat capacities of low molecular weight alcohols and polyols at 25 °C. Can. J. Chem. 1976. 54 (4): 624-631. [ Links ]
6. Makhatadze, G. I.; Privalov, P. L. Heat capacity of alcohols in aqueous solutions in the temperature range from 5 to 125 °C. J. Solution Chem. 1989. 18 (10): 927-936. [ Links ]
7. Nakajima, T.; Komatsu, T.; Nakagawa, T. Apparent Molal Volumes and Adiabatic Compressibilities of n-Alkanols and -Alkane Diols in Dilute Aqueous Solutions at 5, 25, and 45 . I. Apparent Molal Volumes. Bull. Chem. Soc. Jpn. 1975. 48 (3): 783-787. [ Links ]
8. Perron, G.; Joly, D.; Desnoyers, J. E.; Avédikian, L. Thermodynamics of the salting effect; free energies, enthalpies, entropies, heat capacities, and volumes of the ternary systems electrolyte-alcohol-water at 25 °C. Can. J. Chem. 1978. 56 (4): 552-559. [ Links ]
9. Sakurai, M.; Nakamura, K.; Nitta, K. Volumetric Properties of Dilute Aqueous Alcohol Solutions at Different Temperatures. Bull. Chem. Soc. Jpn. 1994. 67 (6): 1580-1587. [ Links ]
10. Saleh, M. A.; Akhtar, S.; Begum, S.; Shamsuddin, M. A.; Begum, S. K. Density and viscosity of 1-alkanols. Phys. Chem. Liq. 2004. 42 (6): 615-623. [ Links ]
11. Fenclova, D.; Perez-Casas, S.; Costas, M.; Dohnal, V. Partial Molar Heat Capacities and Partial Molar Volumes of All of the Isomeric (C3 to C5) Alkanols at Infinite Dilution in Water at 298.15 K. J. Chem. & Eng. Data. 2004. 49 (6): 1833-1838. [ Links ]
12. Arce, A.; Blanco, A.; Soto, A.; Vidal, I. Densities, refractive indices, and excess molar volumes of the ternary systems water + methanol + 1-octanol and water + ethanol + 1-octanol and their binary mixtures at 298.15 K. J. Chem. & Eng. Data. 1993. 38 (2):336-340. [ Links ]
13. Arce, A.; Martínez-Ageitos, J.; Mendoza, J.; Soto, A. Densities, Refractive Indices, and Excess Molar Volumes of Water + Methanol + 2-Methoxy-2-methylpropane at 298.15 KJ. Chem. & Eng. Data. 1995. 40. (3): 647-649. [ Links ]
14. Arce, A.; Martínez-Ageitos, J.; Mendoza, J.; Soto, A. Densities, Refractive Indices, Speeds of Sound, and Isentropic Compressibilities of Water + Methanol + 2-Methoxy-2-methylbutane at 298.15 KJ. Chem. & Eng. Data. 1996. 41 (4): 724-727. [ Links ]
15. Cibulka, I.; Hnìdkovský, L.; Hynèica, P. Standard partial molar volumes in water of mono- and polyhydric aliphatic alcohols in wide ranges of temperature and pressure J. Mol. Liq. 2007. 131-132: 206-215. [ Links ]
16. Riddick, J., A. and Bunger, W. B. Techniques of Chemistry Volume II. Organic Solvents. Wiley-Interscience. New York. 1970. [ Links ]
17. Kinoshita, K.; Ishikawa, H.; Shinoda, K. Solubility of alcohols in water by the surface tension measurements. Bull. Chem. Soc. Jpn. 1958. 31 (9): 1081-1082. [ Links ]
18. Inglese, A.; Robert, P.; De Lisi, R.; Milioto, S. Apparent molar volumes of 1-pentanol in water fromT=298 K to T=413 K at p=0.1 MPa and p = 19 MPa. J. Chem. Thermodyn. 1996. 28 (8): 873-886. [ Links ]
19. Hepler, L. G. Thermal expansion and structure in water and aqueous solutions. Can. J. Chem. 1969. 47 (24): 4613-4617. [ Links ]
20. Texas Engineering Experiment Station, and American Petroleum Institute. TRC Thermodynamic Tables. Hydrocarbons. Washington D.C. 2000. [ Links ]
21. Giro, F.; Goncalves, M. F.; Ferreira, A. G. M.; Fonseca,. I. M. A. Viscosity and density data of the system water + n-pentyl acetate + methanol: Calculations with a modified Redlich-Kwong-Soave equation of state. Fluid Phase Equilib. 2003. 204 (2): 217-232. [ Links ]
22. Rived, F.; Roses, M.; Bosch, E. Densities, Refractive Indices, Absolute Viscosities, and Static Dielectric Constants of 2-Methylpropan-2-ol+ Hexane, + Benzene, + Propan-2- ol, + Methanol, + Ethanol, and + Water at 303.2 K J. Chem. & Eng. Data. 1995. 40 (5): 1111-1114. [ Links ]
23. Franks, F. Water a matrix of life. 2 ed.: The Royal Society of Chemistry. Cambridge. 2000. [ Links ]














