Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804On-line version ISSN 2357-3791
Rev.Colomb.Quim. vol.37 no.1 Bogotá Jan./Apr. 2008
ESTUDIO TEÓRICO PARA EVALUAR LA CONDUCTIVIDAD DEL POLIFURANO Y EL EFECTO DE LOS SUSTITUYENTES SOBRE LA CADENA POLIMÉRICA
THEORETICAL STUDY TO EVALUATE POLYFURAN ELECTRICAL CONDUCTIVITY AND THE SUBSTITUENT EFFECTS ON THE POLYMERIC CHAIN
ESTUDO TEORICO PARA AVALIAR A CONDUCTIVIDADE DO POLIFURANO O E EFEITO DOS SUBSTITUINTES SOBRE A CADEIA POLIMERICA
Ricardo Vivas-Reyes1,2, Jorge Anaya1, Luz Mercado1
1 Departamento de Química, Universidad de Cartagena, Campus de Zaragocilla, Cartagena, Colombia.
Recibido: 18/02/08 – Aceptado: 07/04/08
RESUMEN
Una serie de oligómeros de furano y furano sustituido fueron estudiados desde el punto de vista teórico con el objeto de conocer las propiedades electroconductoras de estos compuestos, y su respectiva extrapolación a polímeros, aprovechando la capacidad de la química computacional para proponer y diseñar nuevos materiales y sus posibles propiedades. Se relacionaron las propiedades electrónicas de estos oligómeros tales como la afinidad electrónica (AE), el potencial de ionización (PI), el band-gap (HOMOLUMO), y la relación de éstos con la conductividad; además, se demostró cómo cambia la longitud de los enlaces de los oligómeros al estar cargados; la longitud de los oligómeros de estudio fuer de dos, cuatro, seis y ocho anillos. En este estudio se realizaron cálculos a niveles AM1 y DFT/B3LYP/6-31G (d).
Palabras clave: polímeros conductores, furano, AM1, DFT, band gap, potencial de ionización, afinidad electrónica, química cuántica.
ABSTRACT
DFT/B3LYP/6-31G (d) calculations were carried out on a series of molecules of furan and substituted furan to observe the type of variables that affect the conductivity of these molecules. In order to propose and design new molecules and its possible properties. The Ionization potential (IP), band-gap (HOMO-LUMO), electronic affinity (EA), was related with its conductivity. It was also shown how change the length of the olygomers bond when the number of the rings is changed from two to four, six and eight.
Key words: Conducting polymer, Furan, AM1, DFT, band gap, Ionization potential, electronic affinity, quantum chemistry.
RESUMO
Uma serie de oligômeros de furano y furano substituido foram estudados teoricamente com a intenção de conhecer as propriedades electro-conductoras desses compostos e sua respectiva extrapolação a polímeros, aproveitando a capacidade da química computacional para propor e desenhar novos materiais e suas possíveis propriedades. Relacionaram-se as propriedades eletrônicas destes oligômeros, tais como a afinidade eletrônica (AE), o potencial de ionização (PI), o band-gap (HOMO-LUMO) e a relação destes com a condutividade, também se demostrou a mudança do comprimento das ligações dos oligômeros ao estar carregados, o comprimento dos oligômeros em estudo foram de dois, quatro, seis e oito anéis. Em este estudo realizaram-se cálculos a níveis AM1 e DFT/B3LYP/6-31G (d).
Palavras-chave: Polímeros condutores, furano, AMI, DFT, band-gap, potencial de ionização, afinidade eletrônica, química quântica.
INTRODUCCIÓN
En los últimos años se ha intensificado de forma especial la investigación en polímeros conductores heterocíclicos, que pueden ser sintetizados tanto de forma química como electroquímica (1). Los polímeros conductores más comunes presentan una distribución alterna de enlaces carbono-carbono simples y dobles a lo largo de sus moléculas. Este hecho permite una deslocalización considerable de los electrones de valencia a lo largo del sistema π de la cadena polimérica. Sin embargo, esta deslocalización no suele ser suficiente como para que el material sea conductor, una de las características principales de los polímeros heterocíclicos conductores es su tendencia a adoptar una geometría plana, pues ésta favorece el máximo solapamiento entre los orbitales atómicos p (conjugación π), esto trae como consecuencia la existencia de bandas dadoras de alta energía o bandas aceptoras de baja energía (2). A estos polímeros se les pueden adicionar distintos grupos funcionales que permiten regular sus propiedades eléctricas, ópticas y magnéticas (3). Los polímeros heterocíclicos conjugados de cinco miembros, tales como polipirrol, politiofeno y polifurano, constituyen una importante clase de material polimérico conductor, debido a que poseen estabilidad bajo condiciones normales y a su notable conductividad eléctrica en su forma oxidada (4-8).
La cantidad de aplicaciones que tienen estos polímeros hace interesante su estudio, entre ellas tenemos: baterías orgánicas, visores electrocrómicos, sensores químicos, diodos emisores de luz, antiestáticos (2); sin embargo, las aplicaciones más revolucionarias las encontramos en el campo de la biomedicina (9).
La conductividad en medios sólidos es explicada principalmente mediante la teoría de bandas. La idea central de la teoría de bandas subyace en la descripción de la estructura electrónica de los sólidos metálicos, en la cual los electrones de valencia de cada átomo se distribuyen a través de toda la estructura. De acuerdo con esta teoría, la banda que está completamente llena de electrones se llama banda de valencia, y la banda vacía que se encuentra inmediatamente encima de esta última recibe el nombre de banda de conducción. Las definiciones de materiales aislantes, semiconductores y conductores se basan en la diferencia de energía entre la banda de valencia y la banda de conducción, denominada intervalo de banda (band gap Eg), entre más pequeña sea esta diferencia más electroconductor es el material (10).
Las propiedades de conducción de los polímeros están relacionadas con propiedades eléctricas tales como potencial de ionización (PI), afinidad electrónica (AE) y band gap (Eg). El band gap de un polímero es una medida de su capacidad para mostrar conductividad intrínseca, mientras que los valores de PI y AE determinan su capacidad para formar polímeros conductores mediante un dopaje oxidativo (tipo p) o reductivo (tipo n), respectivamente (11).
El polifurano ha cautivado relativamente baja atención, a pesar de tener una estructura molecular regular y alta conductividad, esto se debe principalmente al hecho de que su síntesis no es fácil (12), por lo que se hace necesario hacerle sustituciones en la cadena polimérica para evaluar su estabilidad; por esta razón en este trabajo se estudiaron teóricamente oligómeros de furano monosustituido con grupos metilo, metilamino, metoxilo, hidroxilo, amino y con átomos de flúor; el criterio de escogencia de los sustituyentes está basado en las características electrodonadoras o electroactractoras de los grupos funcionales o átomos mencionados anteriormente, y el halógeno se escogió para observar el efecto de la electronegatividad sobre la conductividad.
De hecho, la química computacional se ha constituido en una herramienta útil para el estudio de nuevos materiales, ya que facilita el cálculo de propiedades moleculares que nos dan información sobre las características que posee una determinada especie química y su estabilidad energética. Además, los cálculos teóricos también han sido importantes en este campo debido a que es posible evitar ciertas limitaciones experimentales (13). Los estudios teóricos de oligómeros ciertamente han facilitado el conocimiento de la estructura polimérica, ya que han evidenciado un alto grado de similaridad entre las propiedades de los polímeros y de los oligómeros de menor tamaño, esto es importante para el entendimiento del mecanismo de transporte de carga y de las propiedades mecánicas de los diferentes polímeros (14-15).
DETALLES COMPUTACIONALES
Teniendo en cuenta el mecanismo de policondensación de cationes radicales propuesto por Del valle y cols. (16) se optimizaron a nivel AM1 las diferentes geometrías de los oligómeros formados en una polimerización por etapas, esto es agregando monómeros uno a uno, para saber cuál es el oligómero más estable desde el punto de vista energético, comparando oligómeros de igual tamaño sustituidos por extremos opuestos de la cadena. Los monómeros consisten en anillos de furano sin sustituir y monosustituidos con grupos amino, metilo, hidroxilo, metilamino y metoxilo, de igual manera sustituidos con átomos de flúor.
Los oligómeros de igual tamaño que mostraron ser energéticamente más estables fueron posteriormente optimizados en sus estados neutros y doblemente cargados a nivel DFT/B3LYP/6-31G (d) implementado en el programa GAUSSIAN 94 (17).
El valor del band gap (Eg) para cada olígomero fue calculado como la diferencia entre la energía del LUMO y el HOMO.
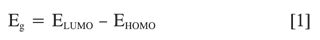
Calculamos el Eg para los oligómeros en estado neutro y di-iónicos (singletes) para ver en qué estado es más conductor cada uno de los polímeros. Los valores de potencial de ionización y de afinidad electrónica fueron calculados como la diferencia de energía entre el olígomero en su estado neutro y el estado eléctricamente cargado (18, 19).
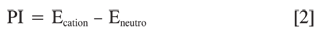
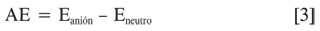
Los valores energéticos para los cálculos de PI y AE fueron obtenidos mediante un cálculo energético a partir del olígomero optimizado en estado neutro.
El band gap de los polímeros se obtuvo mediante una extrapolación de los valores obtenidos para los oligómeros, al graficar el valor de band gap (Eg) contra el inverso del número de monómeros (1/N); de igual manera extrapolamos los valores de PI y AE con el objetivo de obtener los valores de estas propiedades electrónicas que tiene el polímero a longitud de cadena infinita. También se estudiaron las diferencias en las longitudes de enlace carbono-carbono de los diferentes hexámeros para visualizar las alteraciones en las longitudes de enlace en las diferentes estructuras quinoides que se forman en los oligómeros cargados.
RESULTADOS Y DISCUSIÓN
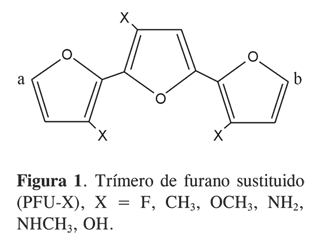
Como se mencionó, se partirá del mecanismo de policondensación de cationes radicales propuesto por Del Valle y cols. (16) (Figura 1), en el cual los puntos marcados como a y b muestran ambientes químicos que no son semejantes o equivalentes; para mejor comprensión se utilizará la siguiente nomenclatura: entre paréntesis aparece un número que indica el lado hacia donde están orientados los sustituyentes de anillos adyacentes, por ejemplo, en un octámero (Figura 2), el número cinco entre paréntesis indica cinco sustituyentes a la derecha con la misma orientación y tres sustituyentes orientados a la izquierda.
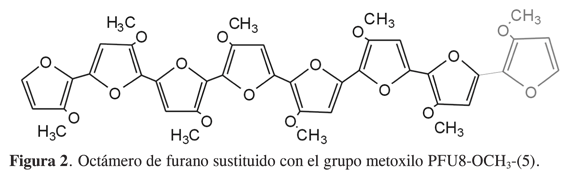
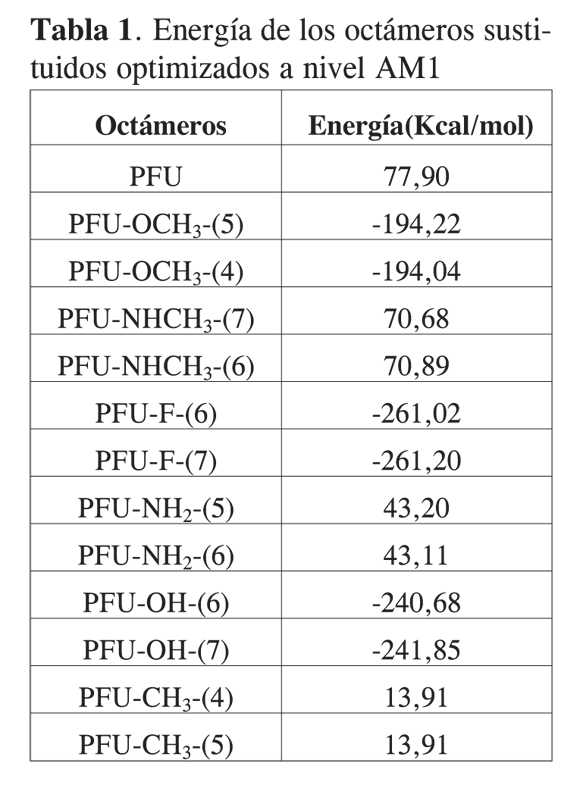
En la Tabla 1 se muestran los valores de la energía de los diferentes octámeros. Se puede observar que existe una diferencia energética entre los diferentes oligómeros sustituidos con el mismo átomo o grupo funcional, en algunos casos estas diferencias no son muy notorias, lo que indica que la disposición espacial de los sustituyentes no está afectando de manera considerable la energía de la molécula. Cabe indicar que la disposición espacial de los sustituyentes hace posible la presencia de fuerzas intramoleculares de atracción o repulsión dependiendo de los efectos electrónicos, lo que le suma o le resta estabilidad al oligómero, por lo cual se partirá de los oligómeros más estables para estudiar las propiedades electrónicas relacionadas con la electroconductividad utilizando la Teoría del Funcional de la Densidad (DFT).
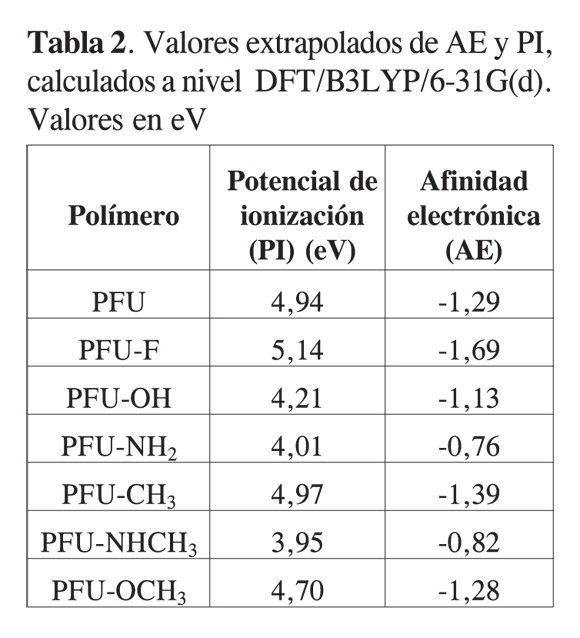
Como se muestra en la Tabla 2, los valores de los PI para todos los polímeros sustituidos son menores que el polifurano sin sustituir, exceptuando al sustituido con flúor; esto indica que los sustituyentes en general facilitan la salida de electrones de las moléculas, es decir, son más fácilmente oxidables; la tendencia en los potenciales de ionización es PFU-F > PFU > PFU-CH3> PFU-OCH3> PFU-OH > PFU-NH2>PFU-NHCH3. Lo que revela que entre más electrodonador sea el sustituyente menor potencial de ionización tendrá la molécula oligomérica. En cuanto a la AE, en la Tabla 2 se observa que la tendencia es PFU-F<PFU-CH3<PFU< PFU-OCH3< PFU-OH < PFU-NHCH3 <PFU-NH2. Esta tendencia se puede explicar por el efecto de la alta electronegatividad del átomo de flúor y el efecto electroatrayente de los grupos funcionales, lo que facilita la retención de los electrones en la cadena polimérica.
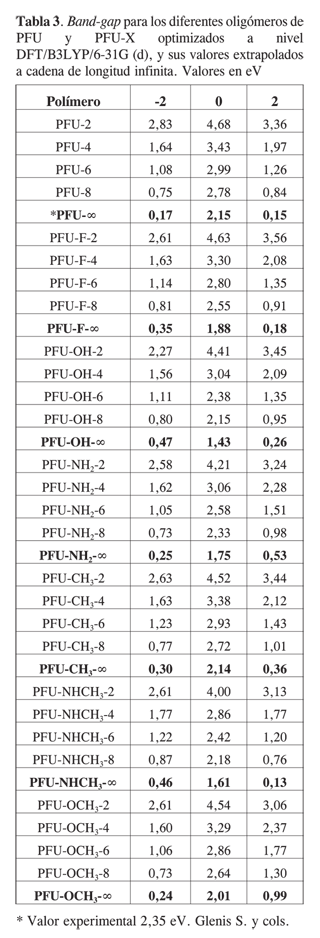
En la Tabla 3 se muestran los valores del band-gap (Eg) para todos los polímeros de estudios (además se muestran los valores extrapolados a cadena de longitud infinita), estos valores se calcularon para los estados neutros, dicatión y dianión con el fin de encontrar el estado más conductor y el tipo de dopado que favorece la conducción. Podemos observar que los valores del band-gap van disminuyendo al aumentar el número de monómeros en la cadena, lo que está en total acuerdo con la teoría de bandas; podemos ver que en estado neutro el polímero sin sustituir presenta mayor valor de Eg entre todos los polímeros estudiados. Cabe anotar que los estados cargados en todos los casos presentan los valores de Eg menores que los estados neutros, lo que corrobora que cuando están dopados los polímeros son mejores electroconductores, como es el caso del PFU-NH2, PFU-CH3 y PFUOCH3 que son las moléculas que presentan el menor valor de band-gap en el estado cargado (-2), lo que nos da una buena indicación de que una mejor conducción se podría presentar con el dopado del tipo n, los polímeros PFU, PFU-F, PFU-OH, y PFU-NHCH3 presentan el menor valor de band-gap estado dicatiónico, la electroconductividad se favorecería con un dopaje de tipo p. Otro aspecto que cabe anotar es que el PFU-NHCH3 en estado dicatiónico es el mejor electroconductor de todos los polímeros estudiados.
De acuerdo con los resultados obtenidos, los polímeros de furano y de furano sustituido con metilamino son más conductores en sus estados cargados dianiónico y dicatiónico respectivamente. Esto último es posible explicarlo haciendo un análisis de las longitudes de enlaces carbono- carbono, en estado neutro y el estado cargado más conductor, para observar cuál es el efecto que causa la remoción o adición de electrones a la cadena oligomérica correspondientes a los hexámeros (Figuras 3-4). Al estudiar la diferencia en las longitudes de enlaces entre la forma neutra y la forma más conductora del hexámero de furano sustituido con el grupo metilamino, podemos observar que en el oligómero en estado dicatiónico las longitudes son más largas que en estado neutro, y se presentan formas quinoides en la estructuras, como se ve en la Figura 4.
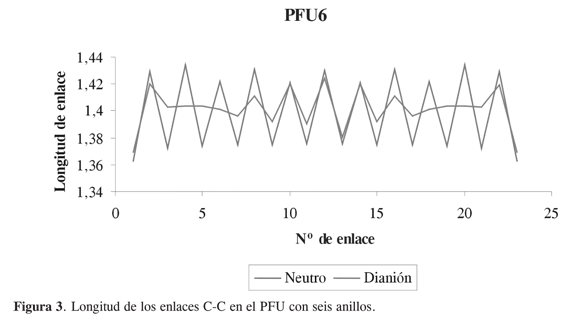
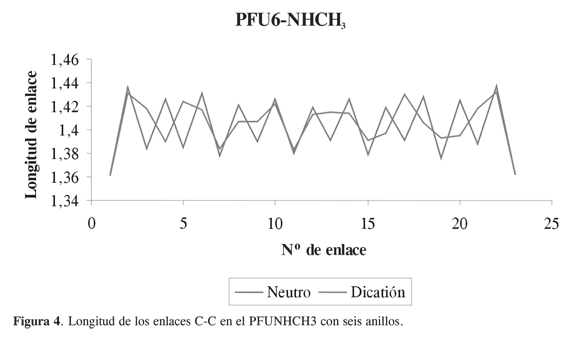
CONCLUSIONES
En este artículo se han examinado varias características de polímeros a base de furano que están relacionadas con sus propiedades electroconductoras. Las variaciones energéticas entre los oligómeros al extenderse la cadena por alguno de los dos extremos no son notorias, ya que al aumentar el número de unidades monoméricas el cambio de energía entre una forma de polimerización u otra tiende a cero. En cuanto a la diferencia de energía entre los oligómeros de igual longitud de cadena, los oligómeros sustituidos son más estables que los no sustituidos. Respecto a los potenciales de ionización, solo el PFU-F presenta mayor valor que el PFU, los polímeros sustituidos con grupos donadores de electrones son los que poseen menor valor de potencial de ionización, es decir, retienen los electrones más débilmente. Con la afinidad electrónica como se esperaba, el PFU-F es el que necesita mayor energía para quitarle un electrón, este átomo es el sustituyente más atractor de electrones de los utilizados en este trabajo.
Los resultados de band gap expuestos en este artículo nos señalan que los polímeros de furano sustituidos son más conductores. De igual manera, todos los polímeros eléctricamente cargados presentan menor band, lo cual implica que estos polímeros son mejores conductores con dopado tipo p o tipo n. El polímero más conductor de todos es el sustituido con el grupo metilamino. Algo muy importante es la formación de estructuras quinoides en los estados cargados eléctricamente, ya que las formas quinoides favorecen la conductividad dentro de una cadena polimérica.
REFERENCIAS BIBLIOGRÁFICAS
1. Roncali J. Synthetic Principles for Band Gap Control in Linear p-Conjugated Systems. Chem. Rev. 1997. 97 (1): 173-206. [ Links ]
2. Casanovas J.; Armelin E.; Iribarren J.; Alemán C.; Liesa F. La modelización molecular como herramienta para el diseño de nuevos polímeros conductores. Polímeros: Ciência e Tecnologia. 2005. 15 (4): 239-244. [ Links ]
3. Skoteheim, T.; Elsenbaumer, R.; Reynolds, J. Handbook of Conducting Polymers. New York: Dekker. 1998. pp. 85-90. [ Links ]
4. Tourillon G.; Garnier F. New Electrochemically Generated Organic Conducting Polymers. J. Electroanal. Chem. 1982. 135: 173-178. [ Links ]
5. Bakhshi A.; Ladik J.; Seel M. Comparative Study of the Electronic Structure and Conduction Properties of Polypyrrole, Polythiophene, and Polyfuran and their Copolymers. Phys. Rev. B. 1987. 35 (2): 704-712. [ Links ]
6. Bätz P.; Göpel W.; Schmeisser D. Electronic Structure of Polypyrrole Films. Phys. Rev. B. 1991. 43 (11): 9178-9189. [ Links ]
7. Glenis S.; Benz M.; LeGoff E.; Schindler J.; Kannewurf C.; Kanatzidis M. Polyfuran: A New Synthetic Approach and Electronic Properties. J. Am. Chem. Soc. 1993. 115 (26): 12519-12525. [ Links ]
8. González-Tejera M.; Carrillo I.; Hernández-Fuentes I. Polyfuran: Electrosynthesis and Electrochemical Behaviour. Synth. Met. 1995. 73 (2): 135-140. [ Links ]
9. Armelin E.; Iribarren J.; Casanovas J.; Liesa F.; Alemán C. Polímeros conductores con aplicaciones biomédicas y biotecnológicas. Química e Industria. 2004. 51 (554): 13-20. [ Links ]
10. Rojas I.; Mora C.; Herrera H. Bandas de Energía, Origen y Consecuencias. Lat. Am. J. Phys. Educ. 2007. 1 (1): 89-94. [ Links ]
11. Gandhi G.; Bakhshi A. Theoretical Designing of the Electronic Structures and Conduction Properties of Copolymers of Donor-Acceptor Polymers: Effect of Multi-Neighbour Interaction. Chem. Phys. 2005. 309 (2):143-155. [ Links ]
12. Li X.; Kang Y.; Huang M. Optimization of Polymerization Conditions of Furan with Aniline for Variable Conducting Polymers. J. Am Chem Soc. 2006. 8 (5): 670-678. [ Links ]
13. Chien, J. Polyacetylene: Chemistry, Physics, and Material Science. London, UK: Academic Press. 1984. pp. 628. [ Links ]
14. Bredas J.; Street G.; Themahs B.; André J. Organic Polymers Based on Aromatic Rings (Polyparaphenylene, Polypyrrole, Polythiophene): Evolution of the Electronic Properties as a Function of the Torsion Angle Between Adjacent Rings. J. Chem. Phys. 1985. 83 (3): 1323. [ Links ]
15. Libert J.; Cornil J.; dos Santos D.; Brédas L. From Neutral Oligoanilines to Polyanilines: A Theoretical Investigation of the Chain-Length Dependence of the Electronic and Optical Properties. Phys. Rev. B. 1997. 56 (14): 8638-8650. [ Links ]
16. Del Valle M.; Díaz F.; Bodini M.; Alfonso G.; Soto G.; Borrego E. Electrosynthesis and Characterization of o-Phenylenediamine Oligomers. Polymer Internacional. 2005. 54 (3): 526-532. [ Links ]
17. Frisch, M. J.; Trucks, G. W.; Schlegel, H. B.; Gill, P. M. W.; Johnson, B. G.; Robb, M. A. et ál., Pittsburgh, PA: Gaussian Inc. 1995. [ Links ]
18. Aleman C.; Casanovas J. Theoretical Investigation of the 3,4-Ethylenedioxythiophene Dimer and Unsubstituted Heterocyclic Derivatives. J. Phys. Chem. A. 2004. 108 (8): 1440-144. [ Links ]
19. Casanovas J.; Ricart J.; Rubio J.; Illas F.; Jiménez-Mateos J. Origin of the Large N 1s Binding Energy in X-ray Photoelectron Spectra of Calcined Carbonaceous Materials. J. Am. Chem. Soc. 1996. 118 (34): 8071-8076. [ Links ]














