Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804On-line version ISSN 2357-3791
Rev.Colomb.Quim. vol.37 no.1 Bogotá Jan./Apr. 2008
OXIDACIÓN DE ANTRACENO CON OXÍGENO SINGULETE GENERADO QUÍMICAMENTE POR EL SISTEMA MOLIBDATO DE SODIO/PERÓXIDO DE HIDRÓGENO
OXIDATION OF ANTHRACENE WITH SINGLET OXIGEN GENERATED CHEMICALLY BY THE SODIUM MOLIBDATE/HYDROGEN PEROXIDE SYSTEM
OXIDAÇÃO DE ANTRACENO COM OXIGÊNIO SINGLETE GERADOS QUIMICAMENTE PELO SISTEMA MOLIBDATO DE SÓDIO / PERÓXIDO DE HIDROGÊNIO
Carlos E. Díaz1, Freddy León1, Fernando Martínez1, Martha C. Daza1,2
1 Escuela de Química, Facultad de Ciencias, Universidad Industrial de Santander, Bucaramanga, Colombia.
Recibido: 14/09/07 – Aceptado: 07/04/08
RESUMEN
La oxidación del antraceno con oxígeno singulete, generado químicamente por el sistema molibdato de sodio/peróxido de hidrógeno (Na2MoO4/H2O2), fue estudiada en una microemulsión tipo micela invertida (agua/aceite). El seguimiento de la reacción se realizó midiendo la absorbancia en la banda de 375 nm por espectrofotometría UV-Vis. Se identificaron como productos de la oxidación: la antraquinona, el endoperóxido- 9,10-antraceno, la 9-hidroxiantrona, la antrona y el 9,10-dihidrodihidroxiantraceno mediante cromatografía de gases-espectrometría de masas (CG-EM). Los tres primeros productos son el resultado de la cicloadición [4+2] del oxígeno singulete sobre el antraceno. La antrona y el 9,10-dihidrodihidroxiantraceno pueden ser generados por la presencia de un radical generado en el medio de reacción. En las condiciones de reacción usadas se determinó una constante de la velocidad de la oxidación con oxígeno singulete.
Palabras clave: antraceno, molibdato de sodio/peróxido de hidrógeno, oxígeno singulete, azida de sodio, oxidación.
ABSTRACT
The oxidation of anthracene with singlet oxygen, chemically generated by sodium molybdate/hydrogen peroxide system (Na2MoO4/H2O2), was studied in an inverted mycelle-type microemulsion (Oil/ Water). The tracking of the reaction was carried out by measuring the absorbance at the 375 nm band, using UV-Vis spectrophotometry. Oxidation products (anthraquinone, endoperoxide-9,10-anthracene, 9-hydroxyanthrone, anthrone and 9,10-dihydrodihydroxianthracene) were identified by gas chromatography massspectrometry (GC-MS). The first three products come of the singlet oxygen [4+2] cycloaddition on the anthracene. Anthrone and 9,10-dihydrodihydroxianthracene can be generated by the presence of a radical that is produced in the reaction. Under the used reaction conditions it was determined the rate constant of the oxidation with oxygen singlet.
Key words: Anthracene, sodium molibdate/ hydrogen peroxide, singlet oxygen, sodium azide, oxidation.
RESUMO
A oxidação do antraceno com o oxigênio singlete, gerado quimicamente pelo sistema sódio molibdato / peróxido de hidrogênio (Na2MoO4/H2O2); foi estudada numa microemulsão tipo, mycelle - invertida (água /óleo ). O acompanhamento da reação foi feito, pela absorvância na banda em 375 nm, utilizando espectrofotometria UV-Vis. Depois da a oxidacao; e utilizando as ténicas de, cromatografia gasosa, GC, e espectrometria de massa, MS; foram identificados os seguintes produtos: antraquinona, endoperóxido- 9,10-antraceno, 9-hidroxiantrona, antrona e 9,10- dihidrodihidroxiantraceno. Os três primeiros, sao provenientes da cicloadicao [4 +2] do oxigênio singlete sobre o antraceno. Antrone e 9,10 –dihidrodihidroxianthracene, podem ser gera- dos pela presença de um radical que é produzido na própria reação. Das condições utilizadas na reação, foi determinada uma taxa constante de oxidação com oxigênio singlete.
Palavras-chave: Antraceno, molibdato de sódio/peróxido de hidrogênio, oxigênio singlete, azida de sódio, oxidação.
INTRODUCCIÓN
Las reacciones de oxidación de hidrocarburos policíclicos aromáticos, como el antraceno, pueden ser iniciadas por el oxígeno singulete o por un radical libre del oxígeno como el hidroxilo (HO•), el anión superóxido (O2-•), el hidroperoxilo (HOO•) u otro radical similar. Estas reacciones son importantes, no sólo desde el punto de vista químico sino también ambiental, ya que están implicadas en procesos que afectan al metabolismo humano y al medioambiente (1). Los métodos más utilizados para la oxidación de estas moléculas son las reacciones tipo Fenton y foto-Fenton, en las que se generan radicales HO•, O2-•, y HOO•. Sin embargo, cuando se está interesado en el estudio de los mecanismos de reacción y en la caracterización de los productos de oxidación con cada una de estas especies, es de suma importancia garantizar que sólo se produce una de estas especies reactivas del oxígeno.
En un estudio de la oxidación del antraceno con oxígeno singulete generado fotocatalíticamente a partir de azul de metileno, Madhavan y Pitchumani (2) obtuvieron en mayor proporción la antraquinona, producto de la ruptura del endoperóxido formado de la cicloadición [4+2] del 1O2. También obtuvieron la antrona, y proponen que ésta es el resultado de la adición del anión superóxido al catión radical del antraceno, generado en el medio de reacción.
Con el fin de estudiar la oxidación del antraceno con oxígeno singulete se utilizó el sistema (Na2MoO4/H2O2), suspendido en una microemulsión tipo micela invertida (agua/aceite) a un pH de 10. Este sistema genera exclusivamente 1O2 según lo reportado por Aubry (3). La descomposición del H2O2 en presencia de iones molibdato [Mo(VI)O(-1)4]2- forma complejos intermediarios oxotriperoxomolibdato [Mo(VI)O(-II)(O(-1)2)3]2- que por descomposición térmica liberan 1O2. Estas microemulsiones (agua/aceite) están compuestas por pequeñas burbujas acuosas en las que se ubican el MoO42- y el H2O2 (4, 5). Se ha propuesto que este sistema genera oxígeno singulete con una eficiencia del 100%, y que la vida media del 1O2 en esta microemulsión es de 42,4 µs. Para evidenciar la generación del oxígeno singulete se utilizó azida de sodio (6, 7).
Como productos de oxidación con el 1O2 se obtuvieron el endoperóxido- 9,10-antraceno, la antraquinona, la 9-hidroxiantrona, antrona y 9,10-dihidrodihidroxiantraceno. Los tres primeros productos provienen de la cicloadición [4+2] del oxígeno singulete (8), y los otros dos podrían ser el resultado de la reacción del antraceno con un radical libre, según lo propuesto por Goulay y cols. (9). Uno de los posibles radicales podría ser el hidroxilo que según Lau (10) se formaría a partir de la reacción del 1O2 y el H2O2 en medio básico. Además, se encontró que el peróxido de hidrógeno en exceso en el medio de reacción actúa como un inhibidor. Este resultado está de acuerdo con lo propuesto por Aubry y Nardillo quienes reportan que el H2O2 en concentraciones altas reacciona con el intermediario oxotriperomolibdato produciendo el intermediario tetraperoxomolibdato que no genera el 1O2 (11).
MATERIALES Y MÉTODOS
Preparación de la emulsión
Se preparó una mezcla de 4,7 g (0,016 moles) de dodecil sulfato de sodio (SDS) con 9,4 g (0,13 moles) de 1-butanol, y se agregó a 60 mL (0,93 moles) de diclorometano formando la fase continua de la microemulsión. Luego se adicionó a esta microemulsión 6 mL de una solución 0,2 M de Na2 MoO4•2H2O, gota a gota con agitación constante hasta obtener una emulsión transparente.
Reacción de oxidación del antraceno
La oxidación del antraceno se realizó en un balón de fondo redondo de 50 mL, recubierto con papel aluminio, a temperatura ambiente. Se disolvieron 0,2 mmol de antraceno en 15 mL de la microemulsión (agua/aceite) con agitación magnética durante 10 min. Luego se adicionaron en total 500 µL de H2O2 (30 v/v%). El peróxido de hidrógeno se adicionó lentamente en alícuotas de 100 μL con un espacio de 15 min entre una y otra. El seguimiento de la reacción se realizó determinando la concentración del antraceno, midiendo el cambio de la intensidad de la banda a 375 nm en un espectrómetro UV-Vis Hewlett-Parkard 8453 con arreglo de diodos. Para evidenciar la generación del oxígeno singulete se utilizó azida de sodio en una concentración de 0,2 mmol (6, 7).
Determinación de la expresión cinética de la oxidación del antraceno
La expresión de velocidad global de la oxidación del antraceno con 1O2 se obtuvo utilizando el método de la pendiente inicial, midiendo la concentración de antraceno a los 3 min de reacción. Para esto se varió la concentración de antraceno y se mantuvo constante la concentración de H2O2; también se disminuyó la concentración de peróxido a la mitad.
Identificación de los productos de la oxidación
Los productos de la oxidación del antraceno se aislaron del medio de reacción adicionando 10 mL de agua a la emulsión, y separando la fase orgánica de la acuosa. A la fase orgánica se le adicionó sulfato de sodio anhidro para eliminar las trazas de agua. Después se separó el SDS mediante una columna de intercambio aniónico, Amberjet 4200, utilizando como fase móvil diclorometano. Finalmente, los productos de la reacción que quedaron en la fase orgánica se identificaron en un cromatógrafo de gases Hewlett Packard, modelo 5890, con un detector selectivo de masas, modelo 5972, y una columna HP5-MS (30 m de largo y 0,25 mm de diámetro interno), con una velocidad de flujo de gas de arrastre (He) de 1 mL/min. Una alícuota de 1 µL de la muestra se inyectó con división (split:ratio) en el puerto de inyección (1:30). El programa de temperatura se mantuvo durante 5 min en 200 ºC, con una rata de 10 ºC /min hasta 300 ºC, durante 15 min, y el tiempo total de análisis fue de 63,33 min. Las condiciones para el detector fueron: 70 eV, impacto electrónico, rango de masas entre 35 y 400 m/z: EM voltaje (A-tune 200 V), frecuencia de barrido 20 Hz y temperatura 230 ºC.
RESULTADOS Y DISCUSIÓN
El estudio de la oxidación del antraceno con oxígeno singulete se hizo midiendo la desaparición del antraceno en función del tiempo (Figura 1).
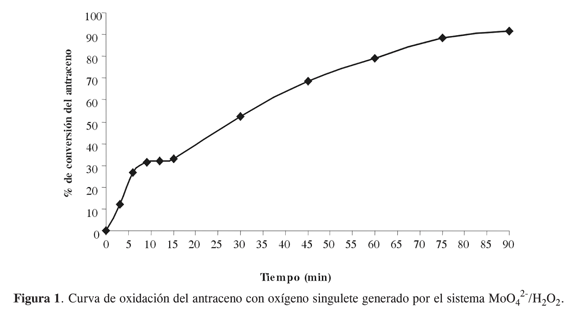
En la Figura 1 se aprecia un cambio de la pendiente en el intervalo entre 9 y 15 min, correspondiente a la primera alícuota de H2O2, lo cual tarda 15 min en descomponerse y no se genera más 1O2 (lo que indica que la reacción de oxidación del antraceno alcanza el equilibrio). La adición de otras alícuotas de H2O2 continúa con la oxidación del antraceno presente en el medio de reacción alcanzando casi la conversión total a los 90 min, demostrando así la estabilidad de la microemulsión.
En la Figura 2 se puede apreciar el aumento de la intensidad de la banda en 274 nm a medida que avanza la reacción. Según Klein, esta banda corresponde al primer estado singulete excitado 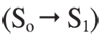 de simetría B2 del endoperóxido-9, 10-antraceno (12).
de simetría B2 del endoperóxido-9, 10-antraceno (12).
Cuando la reacción se realiza en presencia de azida de sodio (bloqueador del 1O2) no se observa disminución en la intensidad de la banda de absorción del antraceno a 375 nm, ni la aparición del pico de absorción a 274 nm. Estos resultados indican que la azida de sodio desactivó el 1O2 en el medio de reacción y, por tanto, no hubo oxidación.
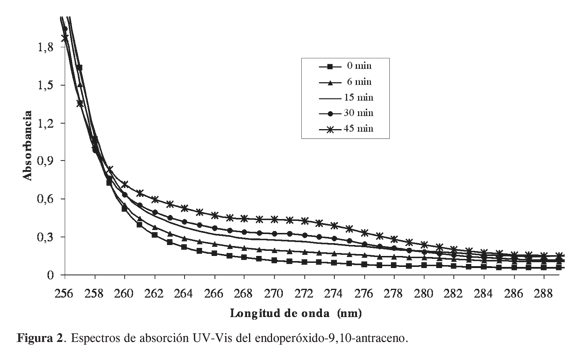
Los productos de la oxidación del antraceno, identificados por CG-EM (Figura 3) a los 90 min de reacción son: antraquinona (40,5%), el endoperóxido- 9,10- antraceno (22,2%), la 9- hidroxiantrona (13,3%), antrona (12%), 9,10-dihidrodihidroxiantraceno (11,9%).
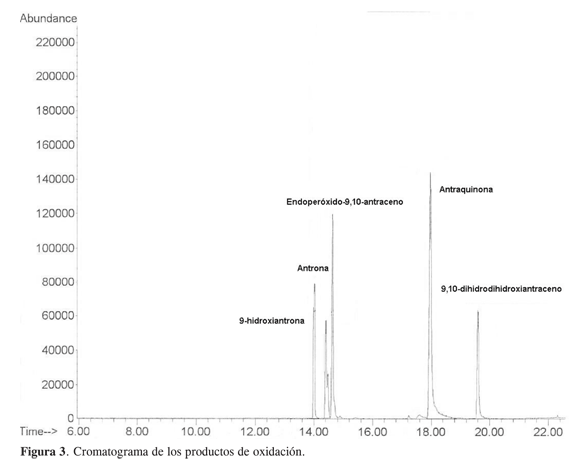
Teniendo en cuenta el mecanismo de cicloadición [4+2] (8) propuesto para la reacción del oxígeno singulete con el antraceno, se formaría el endoperóxido-9,10-antraceno, según el esquema de reacción indicado en la Figura 4.
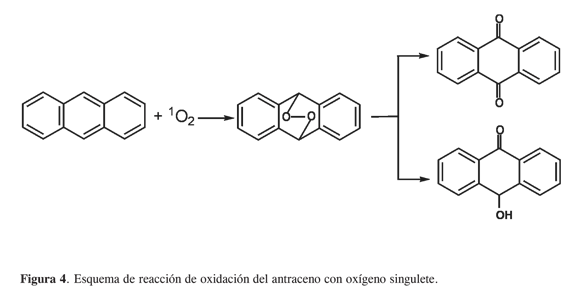
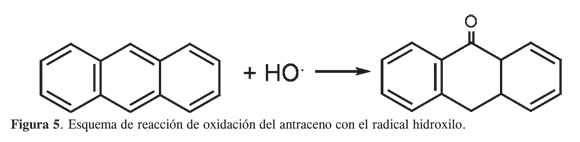
La descomposición del endoperóxido- 9,10-antraceno puede formar la antraquinona y el 9-hidroxiantrona. Además de estos productos también se formaron antrona (12%) y 9,10-dihidrodihidroxiantraceno (11,9%). Goulay (9) sugiere que la presencia de un radical es la responsable de la formación de estos productos hidroxilados, y que no pueden ser explicados por la cicloadición del oxígeno singulete sobre el antraceno (Figura 5). Esto permite plantear que además del oxígeno singulete, este sistema catalítico generó algún radical libre del oxígeno.
La expresión cinética de la reacción de oxidación del antraceno con el 1O2 se determinó en los primeros 15 min de la reacción. En la Figura 6 se muestra el efecto de la concentración de antraceno y de peróxido de hidrógeno sobre la velocidad de oxidación del antraceno.
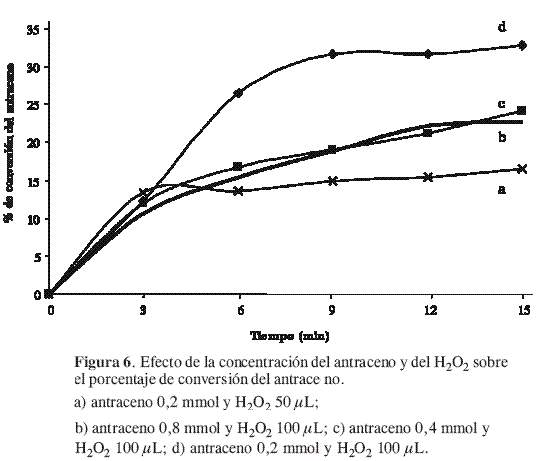
Mediante el cálculo de la pendiente inicial (3 min) para cada una de las curvas de conversión, se obtuvo la siguiente expresión de velocidad para la reacción global (13).
v = k[antraceno]0,901[H2O2]-0,129
Donde la constante de velocidad k=0,019 L/(min·mol-0,228)
Según esta expresión de velocidad, el H2O2 inhibe la reacción de oxidación del antraceno con 1O2 debido a que presenta un orden de reacción negativo (-0,129). Este resultado está de acuerdo con lo propuesto por Aubry y Nardillo (11), quienes evidenciaron que el H2O2 en concentraciones altas reacciona con el intermediario oxotriperomolibdato produciendo el intermediario tetraperoxomolibdato que no genera el 1O2.
A los 3 min de reacción se puede observar que el porcentaje de conversión es semejante en todos los casos, incluso cuando la concentración del H2O2 se disminuye a la mitad, y se logra una mayor conversión a medida que aumenta el exceso del H2O2. Además, al aumentar la concentración del antraceno se alcanza el equilibrio más rápidamente dada la disponibilidad del 1O2 por encima de la cantidad estequiométrica requerida; luego la expresión cinética se cumple cuando exista un exceso de H2O2, que disminuye la generación del 1O2.
CONCLUSIONES
La descomposición del peróxido de hidrógeno por el catalizador molibdato de sodio, suspendido en una microemulsión tipo micela invertida a pH de 10 genera 1O2. Esto se evidencia por la formación de productos de oxidación del antraceno. Estos productos son el endoperóxido 9,10-antraceno, la antraquinona, y la 9-hidroxiantrona, que pueden ser explicados teniendo en cuenta que el oxígeno singulete se adiciona al antraceno en un mecanismo de adición [4+2]. Puesto que también se formaron la antrona y el 9,10-dihidrodihidroxiantraceno, y estos productos, según Goulay y cols. (9), son el resultado de la reacción del antraceno con un radical libre, se puede inferir que el sistema Na2MoO4/H2O2 en ausencia de luz y a una temperatura de 25 ºC produce también especies radicalarias.
Los resultados del estudio de la oxidación del antraceno con oxígeno singulete generado químicamente por el sistema molibdato de sodio/peróxido de hidrógeno sugieren que el H2O2 inhibe la producción de oxígeno singulete debido a que presenta un orden de reacción negativo en la expresión de velocidad para la reacción.
REFERENCIAS BIBLIOGRÁFICAS
1. Kohtani S.; Tomohiro M.; Tokumara K.; Nakagaki R. Photooxidation reactions of polycyclic aromatic hydrocarbons over pure and Ag-loaded BiO4 photocatalysts. Applied Catalysis B: Environmental. 2005. 58: 265. [ Links ]
2. Madhavan D.; Pitchumani K. Photoreactions in clay media: singlet oxygen oxidation of electron-rich substrates mediated by clay-bound dyes. Journal of Photochemistry and Photobiology A: Chemistry. 2002. 153: 205. [ Links ]
3. Aubry J.; Bouttemy S. Preparative oxidation of organic compounds in microemulsions with singlet oxygen generated chemically by the Sodium molibdate/hydrogen peroxide system. Journal of the American Chemical Society. 1997. 119: 5286. [ Links ]
4. Bohme K.; Brauer H. Generation of singlet oxygen from hydrogen peroxide disproportionation catalyzed by molybdate ions. Inorganic Chemistry. 1992. 31: 3468. [ Links ]
5. Nardello V.; Bogeart S.; Alsters P. Singlet oxygen generation from H2O2/MoO4 2-: peroxidation of hydrophobic substrates in pure organic solvents. Tetrahedron Letters. 2002. 43: 8731. [ Links ]
6. Schweitzer C.; Schmidt R. Physical mechanisms of generation and deactivation of singlet oxygen. Chemical Reviews. 2003. 103: 1685. [ Links ]
7. Yang S.; Lee J.; Lee C.; Lee H. Effects of riboflavin-photosensitization on the formation of volatiles in linoleic acid model systems with sodium azide or D2O. Food Chemistry. 2007. 105: 1375. [ Links ]
8. Aubry J.; Pierlot C.; Rigaudy J.; Schmid T. Reversible binding of oxygen to aromatic compounds. Accounts Chemical Research. 2003. 36: 668. [ Links ]
9. Goulay F.; Rebrion C., Le Garrec J., Le Picard S., Casona A. The reaction of anthracene with OH radicals: An experimental study of the kinetics between 58 and 470 K. Journal Physical Chemistry. 2005. 120 (9): 3132. [ Links ]
10. Lau C.; Lu J.; Kai M. Chemiluminescence determination of tetracycline based on radical production in a basic acetonitrile-hydrogen peroxide reaction. Analytica Chimica Acta. 2003. 503: 235. [ Links ]
11. Nardello V.; Marko J.; Vermeersch G.; Aubry J. 95Mo NMR and kinetic studies of peroxomolybdic intermediates involved in the catalytic disproportionation of hydrogen peroxide by molibdate ions. Inorganic Chemistry. 1995. 34: 4950. [ Links ]
12. Klein A.; Kalb M.; Gudipati. New assignment of the electronically excited states of anthracene- 9,10-endoperoxide and its derivatives: a critical experimental and theoretical study. Journal Physical Chemistry. A. 1999. 103: 3843. [ Links ]
13. Laidler K. Cinética de reacciones. Madrid. Alhambra. 1971. p. 7. [ Links ]














