Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804On-line version ISSN 2357-3791
Rev.Colomb.Quim. vol.37 no.1 Bogotá Jan./Apr. 2008
OXIDACIÓN DE UN CARBÓN ACTIVADO COMERCIAL Y CARACTERIZACIÓN DEL CONTENIDO DE GRUPOS ÁCIDOS SUPERFICIALES
OXIDATION OF AN ACTIVATED CARBON COMMERCIAL AND CHARACTERIZATION OF THE CONTENT OF SUPERFICIAL ACID GROUPS
OXIDACIÓN DE UM CARVÃO ATIVADO COMERCIAL E CARACTERIZAÇÃO DO CONTEÚDO DE GRUPOS ÁCIDOS SUPERFICIAIS
Juan C. Cortés1, Liliana Giraldo1, Andrés A. García2, César García2, Juan C. Moreno2
1 Departamento de Química, Facultad de Ciencias. Universidad Nacional de Colombia, sede Bogotá, Bogotá, Colombia. lgiraldogu@unal.edu.co
2 Departamento de Química. Facultad de Ciencias. Universidad de los Andes, Bogotá, Colombia.
Recibido: 14/09/07 – Aceptado: 07/04/08
RESUMEN
Se estudian las modificaciones de los grupos ácidos superficiales de un carbón activado comercial después de someterlo a un tratamiento de oxidación con ácido nítrico a diferentes tiempos –entre 1,5 y 9 horas–, y diferentes concentraciones –entre 4 y 7 molL-1–.
El estudio se realiza determinando entalpías de inmersión, titulaciones tipo Boehm, FTIR, y el pH en el punto de carga cero, pHPZC. Se encuentra que los grupos ácidos totales están en un rango de 0,207 mmolg-1 a 1,247 mmolg-1, y son proporcionales a las entalpías de inmersión en NaOH que están entre 40 y 54 Jg-1. El pHPZC disminuye con el tratamiento de oxidación y sus valores están entre 8,3 y 4,3.
Palabras clave: grupos ácidos superficiales, calorimetría de inmersión, pHPZC, titulaciones tipo Boehm.
ABSTRACT
The changes of the surface acid groups of an activated commercial carbon after placing it under oxidation treatment with nitric acid are studied. The time used was in the range 1.5 and 9 hours, the concentrations range was from 4 to 7 molL-1.
The study included the determination of immersion entalphy, Boehm´s type titrations, FTIR, and pH at the point of zero charge, pHPZC. It was found that total the acid groups are in a range from 0.207 mmolg-1 to 1.247 mmolg-1, and that they are proportional to the immersion entalphy in NaOH that are between 40 and 54 Jg-1. The pHPZC decreases with the oxidation treatment and have values between 8.3 and 4.3.
Key words: surface acid groups, immersion entalphy, pHPZC, Boehm´s type titrations.
RESUMO
Estudam-se as modificações dos grupos ácidos superficiais de um carvão ativado comercial após submetê-lo a umtratamento de oxidación com ácido nítrico a diferentes tempos, entre 1,5 e 9 horas, e diferentes concentrações, entre 4 e 7 molL-1. O estudo realiza-se determinando entalpias de imersão, titulações tipo Boehm, FTIR, e o pH no ponto de ónus zero, pHPZC. Encontra-se que os grupos ácidos totais estão num rango de 0,207 mmolg-1 a 1,247 mmolg-1, e são proporcionales às entalpias de imersão em NaOH que estão entre 40 e 54 Jg-1.OpHPZC diminui com o tratamento de oxidación e seus valores estão entre 8,3 e 4,3.
Palavras-chave: grupos ácidos superficiais, entalpias de imersão, pHPZC, titulações tipo Boehm.
INTRODUCCIÓN
La química superficial de los materiales carbonosos está principalmente determinada por el carácter ácido o básico de la superficie, y puede ser cambiada mediante tratamientos con agentes oxidantes ya sean en fase gaseosa o en fase líquida (1).
Los átomos de carbono ubicados en la superficie del carbón activado tienen una valencia insaturada, lo cual hace que éstos actúen como sitios activos con una fuerte tendencia a quimisorber elementos como oxígeno, nitrógeno, hidrógeno, azufre, para crear varios tipos de especies químicas con heteroátomos. Ya que estos heteroátomos se ubican en la superficie del carbón son de gran importancia para la adsorción. La fijación de grupos ácidos en la superficie de los materiales carbonosos afecta sus propiedades pues los hace más hidrofílicos, y puede afectar su área superficial (2).
El proceso de adsorción del carbón activado está influenciado por los grupos oxigenados de superficie. La introducción de grupos oxigenados a la superficie del carbón puede ser hecha usando medios acuosos como soluciones de: H2O2, (NH4)2S2O8, HClO4 o HNO3, y son ampliamente usados porque con estos agentes oxidantes se puede controlar el tiempo de oxidación, la concentración y la temperatura. El contenido de los grupos ácidos creados en la superficie puede ser determinado y diferenciado por métodos químicos, como titulaciones con bases de diferente fuerza básica, como NaOH, Na2CO3, NaHCO3, las cuales hacen diferencias entre grupos carboxilos, lactonas, fenoles (3). La Figura 1 muestra los grupos oxigenados de la superficie del carbón activado que pueden ser cuantificados por titulaciones con diferentes bases.
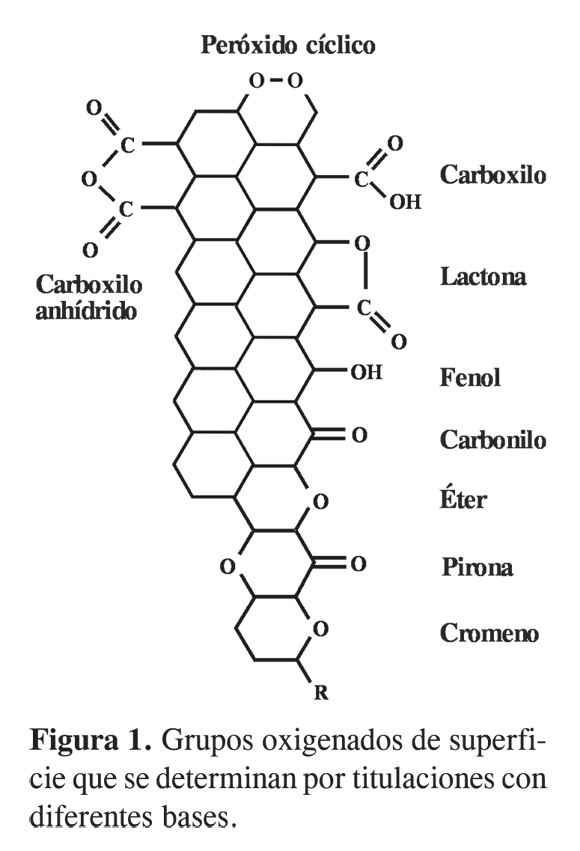
La existencia de grupos químicos en la superficie de los carbones activados hace que las partículas en solución presenten una carga eléctrica que influye en el fenómeno de adsorción. La carga eléctrica se cuantifica con la determinación del pH en el punto de carga cero, pHPZC, que mide la carga superficial total. Cuando el pH de la solución es menor que el pHPZC la carga del sólido será positiva, mientras que si el pH de la solución es mayor que el pHPZC la superficie estará cargada negativamente (5, 6).
La interacción sólido-líquido se puede evaluar al determinar la entalpía de inmersión del sólido en un líquido determinado; cuando se utiliza como líquido de inmersión un solvente polar o una solución, el efecto de calor que se produce incluye las interacciones del líquido con la superficie química del sólido. Esta situación se presenta si se emplean soluciones de ácidos o bases como líquido de mojado, en este caso el valor del calor determinado involucra las interacciones del líquido y de las sustancias disueltas con los grupos funcionales superficiales, que son de tipo específico y, por tanto, de magnitud diferente que cuando se usa un solvente que no interactúa. La entalpía de inmersión permite obtener información de los grupos superficiales en los materiales carbonosos mediante el planteamiento de relaciones entre entalpías de inmersión y grupos funcionales previamente determinados por otros métodos (7).
MATERIALES Y MÉTODOS
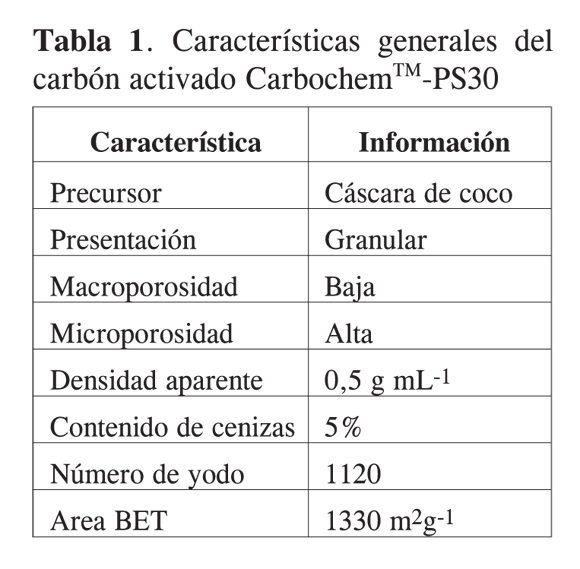
El carbón activado de partida para el tratamiento de oxidación con HNO3, es un material comercial CarbochemTM-PS30, que de acuerdo con su ficha técnica, que se obtiene del fabricante, tiene las características que se resumen en la Tabla 1.
Oxidación de los carbones con solución de HNO3
Muestras de carbón activado original de aproximadamente 6 g se oxidan variando el tiempo de oxidación entre 1,5 a 9,0 horas con una solución de ácido nítrico de concentración 7 molL-1, usando una relación de 60 mL de ácido por gramo de carbón; la mezcla descrita se coloca en un equipo soxlet, a la temperatura de ebullición de la solución, durante el tiempo determinado. Además, el carbón se oxida variando la concentración de ácido nítrico entre 4 molL-1 y 7 molL-1 a un tiempo constante de 1,5 horas, de manera similar a la mencionada.
Posteriormente, el carbón se lava con agua destilada hasta fin de nitratos, que se controla midiendo la conductividad de las aguas de lavado a 10 ìS, y después de esto puesto a reflujo con agua destilada durante 5 días hasta alcanzar un pH constante cercano a 5,5.
Determinación de los grupos ácidos de superficie
La acidez total de los carbones activados se determina por el método de Boehm (8). Se pesan 0,5 g de cada carbón activado y se adicionan soluciones 0,05 molL-1 de NaOH, Na2CO3, y NaHCO3 en un frasco de plástico. Los sistemas se equilibran durante 7 días a temperatura de 18 ºC burbujeándoles nitrógeno periódicamente. Las soluciones se titulan con HCl de concentración 0,05 molL-1 usando un pH meter CG840B Schott.
Determinación de punto de carga cero, pHPZC. Método de titulación de masas
Se pesan cantidades de carbón entre 10 y 600 mg, luego se agregan 10 mL de una solución de NaCl 0,1 molL-1. El sistema se equilibra durante 4 días a 18 ºC y el pH de cada una de las soluciones se mide con un pH meter CG840B Schott (9-11).
Espectroscopia infrarroja
Se usaron pastillas de KBr que contenían cerca del 0,05% de masa en carbón, y se secaron a 90 °C toda la noche. Los espectros FTIR de las muestras fueron obtenidos por la suma de 160 SCANS a una resolución de 1 cm-1 en un equipo Termo- Nicolet FT-IR Nexus (1).
Determinación de la entalpía de inmersión
Para determinar las entalpías de inmersión se usa un microcalorímetro de conducción de calor con una celda calorimétrica de acero inoxidable. Se colocan 8 mL de la solución de NaOH de concentración 0,1 molL-1, o agua según el caso; se pesa una cantidad de carbón activado del orden de 0,200 g, y se coloca dentro de la celda calorimétrica en una ampolleta de vidrio. Luego se realiza el registro de potencial de salida por un periodo aproximado de 30 minutos haciendo mediciones de potencial cada 2 segundos, se procede a realizar el rompimiento de la ampolleta de vidrio, se registra el efecto térmico generado, y se continúa con el registro de potencial durante aproximadamente 30 minutos más. Por último, se calibra el sistema eléctricamente (12).
RESULTADOS Y DISCUSIÓN
El carbón activado comercial se seca a 110 ºC durante 12 horas, se almacena en atmósfera de nitrógeno y se le determina el valor de área superficial, de 1330 m2g-1; el volumen total de poro, de 0,65 cm3g-1, y el volumen de microporo de 0,58 cm3g-1, resultados que están de acuerdo con la información que suministra el fabricante, dado que se encuentra que alrededor del 95% del volumen del sólido corresponde a microporos.
En la Tabla 2 se presentan los resultados obtenidos del contenido de grupos químicos superficiales. En ésta se presenta el tiempo de oxidación en horas, la concentración de HNO3 que se usa y el contenido de grupos carboxílicos, lactonas y fenoles en mmolg-1.
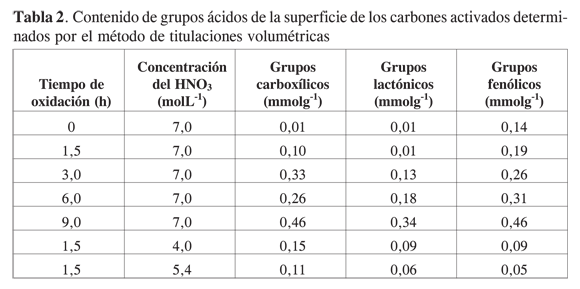
En la Tabla 2 se observa que el material carbonoso de partida tiene un menor contenido de grupos carboxílicos, 0,01 mmolg-1, y una cantidad más representativa de grupos fenólicos, lo que le confiere un carácter básico frente a los carbones oxidados. Al realizar los tratamientos con ácido nítrico se genera un aumento de grupos carboxílicos y lactónicos, lo que hace más ácida la superficie del carbón, hecho que está de acuerdo con los resultados obtenidos por Moreno-Castilla (1) y otros (2). La muestra con un mayor aumento en los grupos ácidos superficiales es la que se oxida con HNO3 7 molL-1 durante 9 horas, como se muestra en la Tabla 2, con un contenido total de acidez de 1,26 mmolg-1, y con el valor más alto en el contenido de ácidos carboxílicos de la serie de carbones activados modificados.
En la Figura 2 se muestra cómo varía el contenido de grupos ácidos en la superficie de los carbones activados oxidados con ácido nítrico, a diferentes tiempos de oxidación, y se encuentra que al variar el tiempo de oxidación entre 0 y 9 horas, el contenido de grupos ácidos titulados con NaOH 0,05 molL-1 aumenta con una tendencia lineal alcanzando un máximo de grupos ácidos totales de 1,26 mmolg-1 para el carbón oxidado 9 horas con ácido nítrico 7 molL-1. Un comportamiento similar al anterior se encuentra para el contenido de los grupos carboxilos y lactonas que se determinan con las bases de fuerza media NaHCO3 y Na2 CO3 respectivamente.
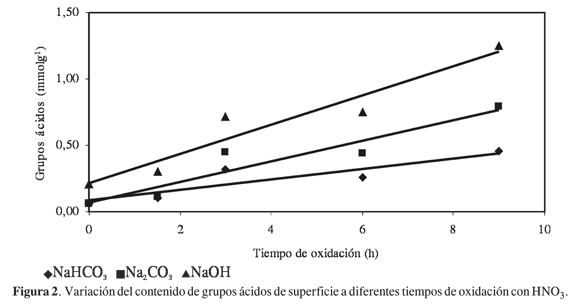
La diferencia con el carbón comercial no modificado es significativa, con un aumento en el contenido de grupos ácidos totales de 1,04 mmolg-1. Los grupos carboxilos reaccionan con el bicarbonato de sodio; los grupos carboxilos y lactonas reaccionan con el carbonato de sodio y los fenoles, carboxilos y lactonas reaccionan con el hidróxido de sodio, para cuantificar así el contenido de la acidez total. El efecto del tiempo de contacto en el proceso de oxidación se aprecia en el comportamiento lineal de las tendencias, que para el caso de los carbones activados oxidados titulados con NaOH, presenta un coeficiente de correlación de 0,9251, que indica dispersión en los valores experimentales, con un promedio lineal.
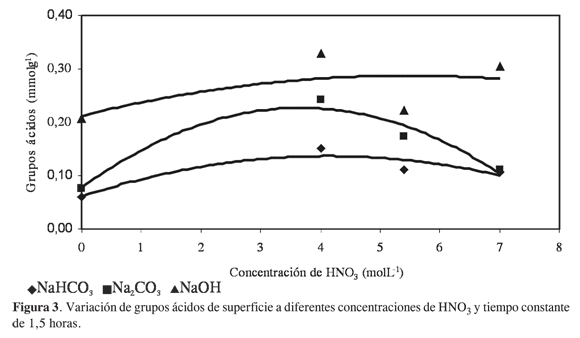
En la Figura 3 se presenta el comportamiento de la cantidad de grupos ácidos con respecto a la concentración de la solución de HNO3 a un tiempo constante de 1,5 horas, y se ve que hay una tendencia ascendente en la cantidad de los grupos ácidos hasta una concentración de 4 molL-1, pues después de ésta los valores de acidez total tienden a ser constantes, con valores que se encuentran entre 0,22 y 0,33 mmolg-1; esto se presenta porque a un tiempo corto de oxidación, de 1,5 horas, el proceso tiene lugar hasta un cierto contenido, y al aumentar la concentración del agente oxidante no se produce un aumento significativo de los grupos ácidos en la superficie. Con estos resultados se observa que para el carbón activado del estudio, el factor que más influye en la oxidación de la superficie es el tiempo de contacto del sólido con la solución, más que la concentración de la misma.
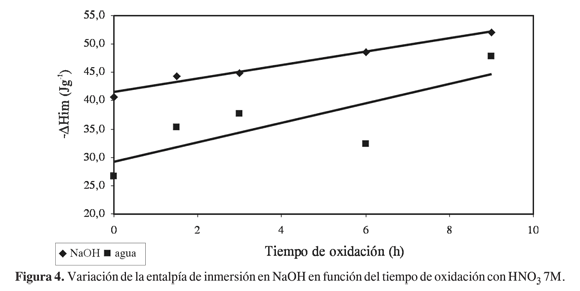
En la Figura 4 se muestra la variación de las entalpías de inmersión de los carbones activados modificados, en NaOH y agua, y se observa, en los dos casos, un comportamiento lineal con un incremento en los valores de la entalpía de inmersión con el aumento de las horas de oxidación y con la cantidad de grupos ácidos totales determinados en la titulación; este comportamiento cada vez más exotérmico, que se observa a medida que aumenta el contenido de los grupos ácidos en la superficie, muestra que el método calorimétrico permite establecer correlaciones que llevan a hacer una estimación del contenido total de grupos funcionales ácidos en estos materiales carbonosos, como se observó en trabajos anteriores (13). Las entalpías de inmersión en la solución de NaOH se ajustan a la tendencia lineal con un coeficiente de correlación de 0,9767, que indica que la entalpía, que se establece para interacciones totales, cambia con la modificación por oxidación que se realiza en los carbones activados; en cuanto a la entalpía de inmersión de los sólidos en agua, los valores experimentales están más dispersos con respecto al promedio, y las entalpías determinadas incluyen las interacciones del solvente con la superficie y con los grupos ácidos.
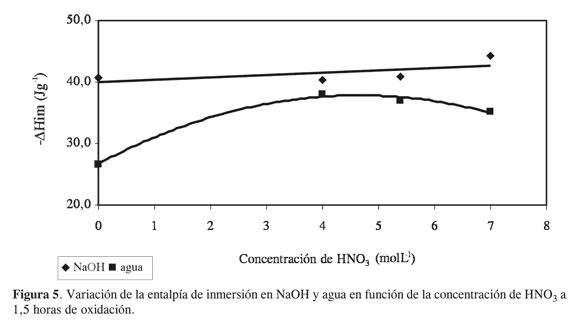
En la Figura 5 se muestra cómo cambian las entalpías de inmersión en agua y NaOH con el aumento de la concentración del ácido nítrico a un tiempo de oxidación constante de 1,5 horas. Se observan valores constantes para las entalpías de inmersión de los carbones activados en solución de NaOH en función de la concentración de HNO3, debido a que el tiempo de oxidación al cual se expone el material carbonoso es moderado –1,5 horas–, para obtener una diferencia de grupos ácidos superficiales suficientes; en este caso hay variaciones en las cantidades de grupos ácidos totales de alrededor de 0,1 mmolg-1, mientras que cuando se varían los tiempos de oxidación con ácido nítrico de concentración 7 molL-1 se presentan variaciones del orden de 1,0 mmolg-1 o superiores. Los valores para las entalpías de inmersión de estos carbones activados en agua presentan un aumento inicial desde el carbón activado sin modificar, con un valor de entalpía de inmersión alrededor de 26 Jg-1, a las muestras modificadas con valores similares alrededor de 35 Jg-1.
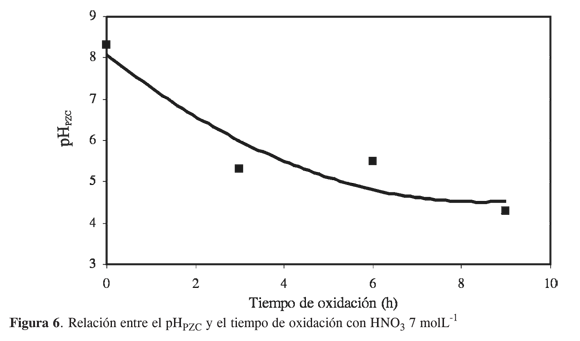
La Figura 6 muestra cómo se comporta el pH en el punto de carga cero, pHPZC, con respecto al tiempo de oxidación. Se observa que al mantener constante la concentración del HNO3, el pHPZC disminuye conforme aumenta el tiempo de oxidación, y los puntos experimentales se ajustan a una función de segundo orden, lo que indica que el tiempo de contacto entre el sólido y la solución es un factor de alta influencia para que el carbón activado adquiera una mayor acidez y, por tanto, la modificación que se busca en la superficie sea más eficiente y se refleje en valores del pHPZC menores.
La Figura 7 muestra cómo el pHPZC disminuye linealmente a medida que aumenta la cantidad de grupos ácidos en la superficie; la relación anterior confirma la variación de las propiedades acidez, pHPZC y entalpía de inmersión en soluciones de NaOH, con el tiempo establecido en el tratamiento de oxidación.
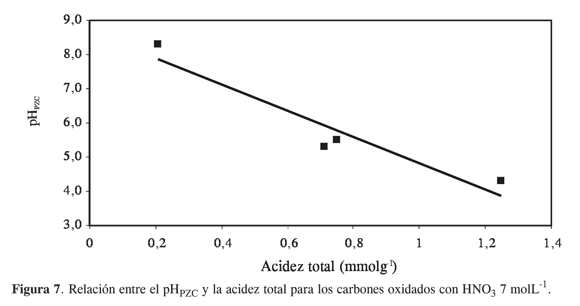
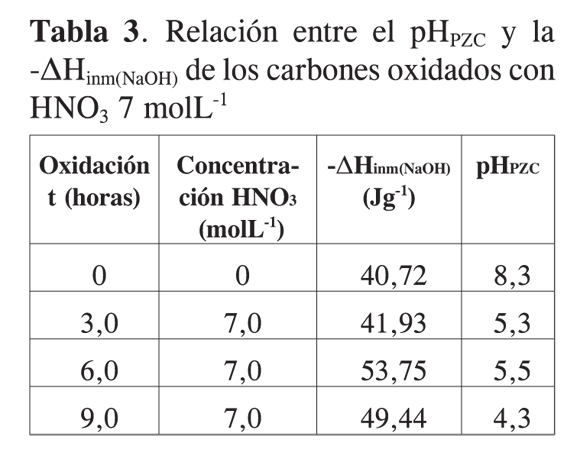
Al examinar los resultados obtenidos para el pHPZC de los carbones activados modificados, y las entalpías de inmersión en solución de NaOH, resultados que se muestran en la Tabla 3, se observa que con respecto al carbón activado original, las muestras modificadas disminuyen los valores de pHPZC y aumentan los valores de las entalpías de inmersión. Se puede así establecer una relación entre el pH en el punto de carga cero, pHPZC, en función de la entalpía de inmersión que presenta un comportamiento descrito por una función de segundo orden, con un coeficiente de correlación de 0,763; de tal forma que se requiere un mayor número de datos experimentales para verificar la relación entre las dos propiedades mencionadas.
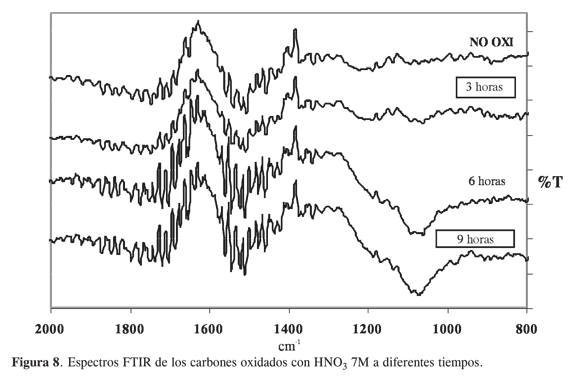
En la Figura 8 se presentan los espectros infrarrojos correspondientes a los carbones activados oxidados a diferentes tiempos con ácido de concentración 7 molL-1. Se puede observar que en 1100 cm-1 aparece una banda que se hace cada vez más intensa con el aumento de los tiempos de oxidación, la cual se puede atribuir a estiramientos en enlaces C-O de tipo alcohol, que se forman durante el proceso de oxidación por la fijación de grupos oxigenados a la superficie del carbón como alcoholes (1, 2), además, se observan incrementos en la banda 1820 cm-1 que pueden ser asociados estiramientos de enlaces C=O en grupos carboxilos y carbonilos en aldehídos y cetonas (1, 2); de allí que entre más horas de oxidación la banda se hace más intensa pues la cantidad de grupos ácidos oxigenados es mayor para una oxidación de 9 horas como se puede ver en la Figura 2.
CONCLUSIONES
Los materiales carbonosos como los carbones activados son complejos debido a su estructura irregular y a su alta heterogeneidad, por esto el estudio de sus propiedades químicas se hace complicado; en este trabajo se relacionaron diferentes métodos de análisis para estudiar la formación de grupos ácidos superficiales con tratamientos de oxidación, y se observó cómo las entalpías de inmersión en agua y base están relacionadas con los grupos ácidos de superficie; además, se estudió cómo estas entalpías pueden ser relacionadas con cantidades de estos grupos ácidos determinados por otras técnicas como titulaciones tipo Boehm, encontrándose también una buena correlación.
Se estudió la relación de los grupos ácidos de superficie con el pHPZC y se encontró que a una mayor concentración de grupos ácidos en la superficie del carbón se hace más pequeño el punto de carga cero de los carbones. Además de esto se estudió, por medio de espectroscopía infrarroja, la fijación de grupos oxigenados a la superficie del carbón y se encontraron algunas modificaciones en bandas de enlaces C-O con lo que también se puede identificar la presencia de estos grupos oxigenados.
AGRADECIMIENTOS
Los autores agradecen al Convenio Marco entre la Universidad de los Andes y la Universidad Nacional de Colombia, y al Acta de Acuerdo entre los Departamentos de Química de las dos Universidades. Se agradece a las Vicerrectorías de Investigación.
REFERENCIAS BIBLIOGRÁFICAS
1. Moreno-Castilla, C.; López-Ramón, M.V. Changes in surface chemistry of activated carbons by wet oxidation. Carbon. 2000. 38: 1999- 2001. [ Links ]
2. Bhabendra, K.; Sandle, N. K. Effect of different oxidizing agent treatments on the surface properties of activated carbons. Carbon. 1998. 37: 1323-1332. [ Links ]
3. Boehm, H.P. Surface oxides on carbon and their analysis: a critical assessment. Carbon. 2001. 40: 145- 149. [ Links ]
4. Rodríguez-Reinoso, F. El carbón activado como adsorbente universal. En Juan Carlos Moreno P. (editor académico). Sólidos porosos. Preparación, caracterización y aplicaciones. Bogotá: Editorial Uniandes. 2007. p. 4. [ Links ]
5. Navarrete, L. F.; Giraldo, L.; Moreno, J.C. Influencia de la química superficial en la entalpía de inmersión de carbones activados en soluciones acuosas de fenol y 4-nitrofenol. Rev. Colomb. Quim. 2006. 35 (2): 215- 224. [ Links ]
6. Radovic, L. R.; Moreno-Castilla, C.; Rivera-Utrilla, J. Carbon Materials as Adsorbents in Aqueous Solution. In Chemistry and Physics of Carbon. A Serie of Advances. New York: Marcel Dekker. 2000. 293- 297. [ Links ]
7. Giraldo, L., Moreno, J.C. Calorimetric determination of activated carbons in aqueous solutions. J. Therm. Anal. Cal., DOI: 101007/s 10973-006-7524-3. [ Links ]
8. Boehm, H. P. Advances in Catalysis. Nex York: Academic Press. 1966, 192-203. [ Links ]
9. Noh, S. J.; Schwarz, A. J. Estimation of the Point Zero Charge of Simple Oxides by Mass Titration. Journal of Colloid and Interface Science. 1988. 130 (1): 157-164. [ Links ]
10. Giraldo, L.; Moreno, J.C. Determinación de la entalpía de inmersión y capacidad de adsorción de un carbón activado en soluciones acuosas de plomo. Rev. Colomb. Quim. 2004. 33: 87-97. [ Links ]
11. Pérez-Cárdenas, A.; Maldonado- Hódar, F.; Moreno-Castilla, C. On the nature of surface acid sites of chlorinated activated carbons. Carbon. 2003. 41: 473-478. [ Links ]
12. Giraldo, L.; Moreno, J.C. Heats Conduction Micro-Calorimeter With Metallic Reaction Cell. Instrumentation Science & Technology. 2002. 30 (2): 177-186. [ Links ]














