Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804On-line version ISSN 2357-3791
Rev.Colomb.Quim. vol.37 no.1 Bogotá Jan./Apr. 2008
EFECTO DE LA TEMPERATURA SOBRE LA VISCOSIDAD DE SOLUCIONES ACUOSAS DILUIDAS DE 1,2-HEXANODIOL, 1,5-HEXANODIOL, 1,6-HEXANODIOL Y 2,5–HEXANODIOL
EFFECT OF TEMPERATURE ON THE VISCOSITIES OF DILUTE AQUEOUS SOLUTIONS OF 1,2-HEXANEDIOL, 1,5-HEXANEDIOL, 1,6-HEXANEDIOL AND 2,5–HEXANEDIOL
EFEITO DA TEMPERATURA SOBRE AS PROPRIEDADES VISCOSIMETRICO DE SOLUÇÕES AQUOSAS DILUÍDAS DE 1,2-HEXANODIOL, 1,5-HEXANODIOL, 1,6-HEXANODIOL Y 2,5–HEXANODIOL
Manuel S. Paez1, Óscar Julio2, Maximiliano Méndez2, Dairo Pérez2, Carmen M. Romero3
1 Departamento de Química, Universidad de Córdoba, Montería, Colombia. mpaez@sinu.unicordoba.edu.co
2 Departamento de Química, Universidad de Córdoba, Montería, Colombia.
3 Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia, sede Bogotá, Bogotá, Colombia.
Recibido: 01/02/08 – Aceptado: 15/04/08
RESUMEN
Se determinó la viscosidad de soluciones acuosas diluidas de 1,2-hexanodiol, 1,5- hexanodiol, 1,6-hexanodiol y 2,5–hexanodiol en un rango de temperatura entre 283,15 y 308,15 K usando viscosímetros tipo Ubbelohde. Los valores de viscosidad relativa fueron ajustados a una ecuación de segundo orden para obtener el coeficiente B que está relacionado con el tamaño y la forma de la molécula de soluto.
La dependencia del coeficiente B de viscosidad con la temperatura se discute en términos de la posición de los grupos hidroxilo en la estructura del agua.
Palabras clave: viscosidad, coeficiente B, parámetros de activación, hexanodioles, hidratación.
ABSTRACT
Experimental viscosities of dilute aqueous solutions of 1,2-hexanediol, 1,5-hexanediol, 1,6-hexanediol and 2,5-hexanediol were measured in the temperature range from 283,15 to 308,15 K using Ubbelohde viscometers. The relative viscosity values were adjusted by least-squares to a second order equation to obtain the viscosity B coefficient which has been related to the size and shape of the solute molecule.
The temperature dependence of the viscosity B coefficient is discussed in terms of the effect of the position of the hydroxyl groups in the diol molecules on water structure.
Key words: Viscosity, B coefficient, activation parameters, hexanediols, hydration.
RESUMO
Determinou-se a viscosidade de soluções aquosas diluídas de 1,2-hexanodiol, 1,5- hexanodiol, 1,6- hexanodiol y 2,5- hexanodiol numa faixa de temperatura entre 283,15 y 308,15 K, com o auxílio de viscosímetros tipo Ubbelohde. Os valores de viscosidade relativa foram ajustados a uma equação de segunda ordem para a obtenção do coeficiente B, que está relacionado com o tamanho e a forma da molécula de soluto.
A dependência do coeficiente de viscosidade B com a temperatura é discutido em termos da posição dos grupos hidroxila na estrutura da água.
Palavras-chave: Viscosidade, coeficiente B, parâmetros de ativação, hexanodiol, hidratação.
INTRODUCCIÓN
Las propiedades fisicoquímicas de soluciones acuosas de no electrólitos son de interés en la dilucidación de la naturaleza de las interacciones entre grupos no polares y el agua, en especial en la hidratación hidrofóbica o solvatación hidrofóbica. Estas propiedades se ven afectadas por la configuración estérica de los grupos alquilo y la fuerza relativa de los puentes de hidrógeno entre el soluto y el agua (1).
En los alcanodioles, la cooperatividad de los puentes de hidrógeno, la posibilidad de formar puentes intramoleculares entre las moléculas de los dioles y puentes intermoleculares entre éstos y el agua, se refleja en un comportamiento termodinámico complejo que depende fuertemente de la concentración, y del número y la posición de los grupos hidroxilo.
Los estudios sobre la viscosidad de soluciones acuosas de alcanodioles son limitados. Varios trabajos han sido realizados con dioles de cadena corta a 298,15 K (2-11). Sin embargo, muy pocos datos han sido registrados en la literatura para alcanodioles de cadena larga y a otras temperaturas diferentes (9-11).
En este trabajo presentamos el efecto de la temperatura sobre las propiedades viscosimétricas de soluciones acuosas diluidas de 1,2-hexanodiol (1,2-HD); 1,5-hexanodiol (1,5-HD); 1,6–hexanodiol (1,6-HD) y 2,5-hexanodiol (2,5-HD). Los dioles seleccionados tienen seis átomos de carbono y cambia la posición del grupo OH de modo que el efecto de su posición sobre el coeficiente B de viscosidad puede ser analizada de una manera sistemática.
Los resultados experimentales se discuten en términos de las interacciones soluto- solvente y del balance entre interacciones hidrofóbicas e hidrofílicas.
MATERIALES Y MÉTODOS
Los materiales usados en este trabajo fueron los siguientes: 1,2-hexanodiol Aldrich 98%, 1,6-hexanodiol Aldrich 99%, 2,5-hexanodiol Aldrich 99% (mezcla de isómeros), y 1,5-hexanodiol Aldrich 99%. En todos los casos se determinó el contenido de agua por el método Karl Fischer. El agua fue doblemente destilada, desionizada y desgasificada antes de usarse de acuerdo con las recomendaciones de la literatura (12). Todas las soluciones se prepararon por pesada en una balanza OHAUS con sensibilidad de 10-4 g. Las concentraciones finales fueron corregidas de acuerdo con el contenido de agua establecido. La incertidumbre estimada en fracción molar para las soluciones más diluidas es ± 2 10-4.
Las medidas de viscosidad fueron realizadas en dos viscosímetros Ubbelohde. Los tiempos de flujo fueron determinados para el agua y las soluciones acuosas de dioles a 283,15 K, 288,15 K, 293,15 K, 298,15 K, 303,15 K y 308,15K. Todas las determinaciones fueron efectuadas en un baño de temperatura constante controlado a ± 0,005 K. Los tiempos de flujo son el promedio de, al menos, cinco medidas independientes. Los viscosímetros fueron calibrados con agua a cada temperatura para evaluar sus constantes. La densidad y la viscosidad del agua a cada temperatura se tomaron de la literatura (13).
La densidad de las soluciones fue medida usando picnómetros de tipo Wood- Brusie con un volumen de bulbo de 80 cm3. Los datos experimentales fueron reportados en un trabajo previo (14). La reproducibilidad en todos los casos fue superior al 0,05%. En estas condiciones la incertidumbre en las determinaciones de viscosidad es de ± 0,001 mPa s.
Los datos de viscosidad η fueron obtenidos con la ecuación:

donde α y β son las constantes de los viscosímetros, d es la densidad y t el tiempo de flujo.
RESULTADOS Y DISCUSIÓN
Los datos experimentales para las viscosidades de las soluciones acuosas diluidas de 1,2-hexanodiol, 1,5- hexanodiol, 1,6- hexanodiol y 2,5- hexanodiol en función de su fracción molar se presentan en las Tablas 1,2,3 y 4.
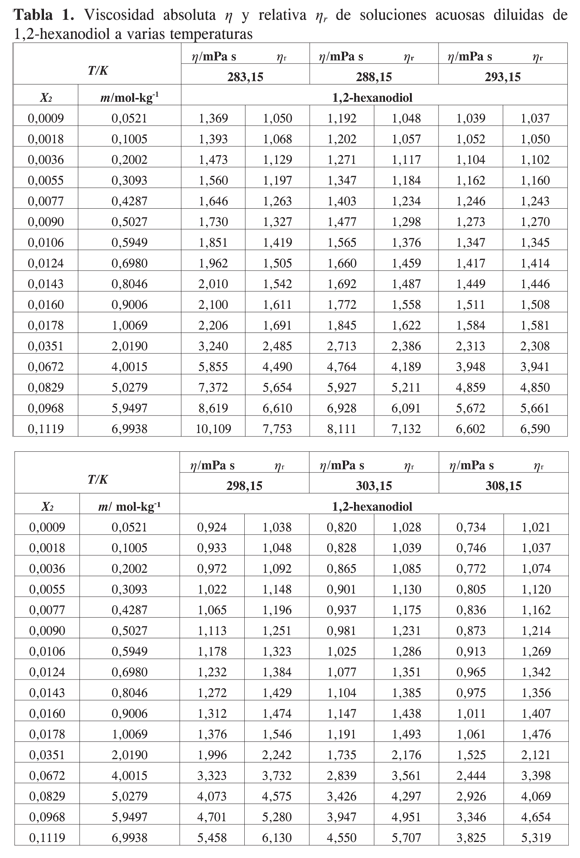
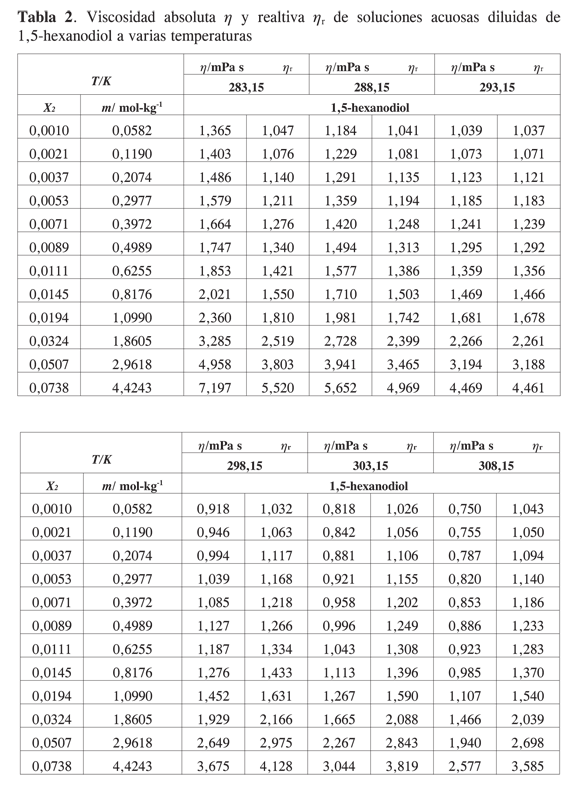
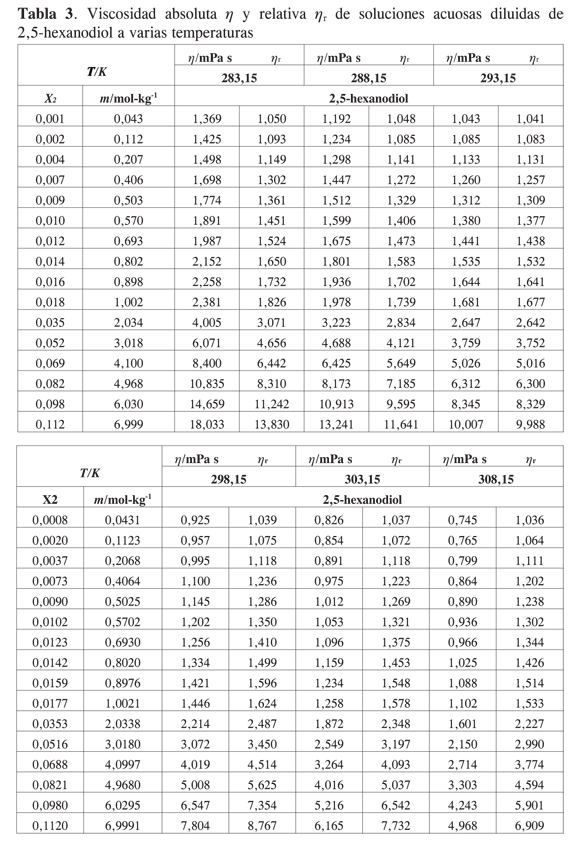
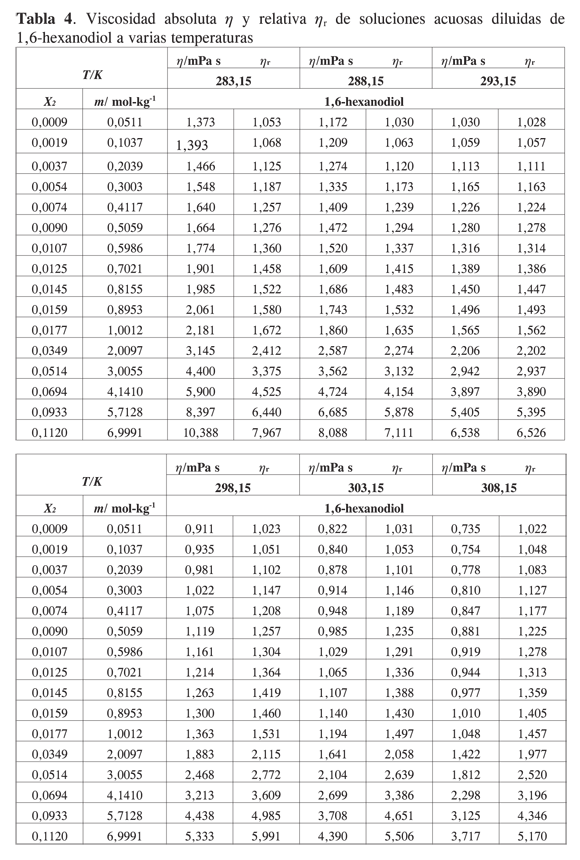
El efecto del soluto sobre la viscosidad de la solución depende de su propia velocidad intrínseca de movimiento y su efecto sobre el flujo de las moléculas de solvente. Para todos los solutos considerados en este trabajo la viscosidad aumenta con la concentración del diol y disminuye con la temperatura. Las tendencias observadas están de acuerdo con las reportadas para sistemas similares (2-11). No se han encontrado resultados en la literatura para los sistemas acuosos presentados en este trabajo.
Las viscosidades relativas μr = μ/μo fueron calculadas a partir de la viscosidad de la solución μ y del solvente μo. Las curvas de viscosidad relativa en función de la molalidad m para cada alcanoliol a las temperaturas seleccionadas se presentan en las Figuras 1,2,3 y 4. Los datos experimentales fueron ajustados por mínimos cuadrados a una ecuación de segundo orden como la propuesta por Tsangaris-Martin para solutos mixtos como aminoácidos (15) y otros no electrolitos (16).

A pesar del carácter empírico del coeficiente B se ha asumido que depende del tamaño y de la forma de la molécula de soluto y da información sobre la interacción soluto-solvente, la solvatación del soluto y sobre su efecto en la estructura del agua. El signo y la magnitud de los coeficientes D se han relacionado con interacciones soluto- soluto; sin embargo, sus valores generalmente son muy pequeños y debido a la incertidumbre implicada, el análisis se restringe al coeficiente B (16).
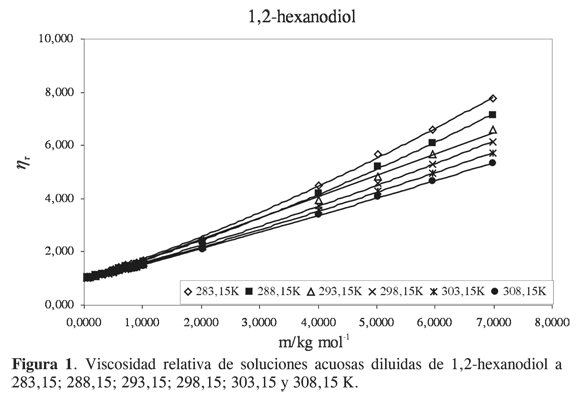
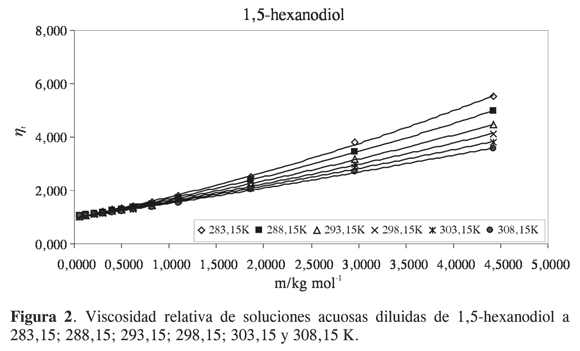
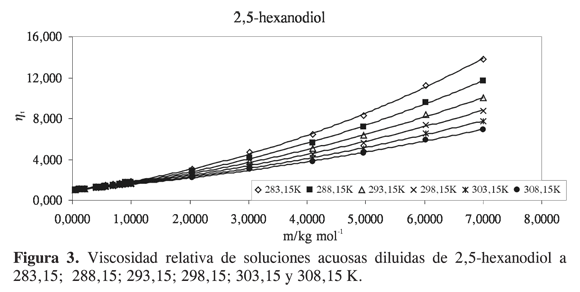
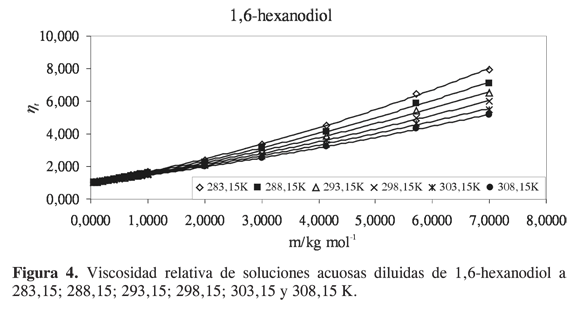
Para analizar el efecto del soluto sobre la estructura del agua se han utilizado dos parámetros relacionados con el coeficiente B. El primero es el término correspondiente al coeficiente B dividido por el volumen molar parcial a dilución infinita V∞2. Se ha observado que valores altos de B/V∞2 se asocian a hidratación hidrofóbica, sin embargo, en muchos casos los cambios son pequeños y no reflejan el incremento de la superficie hidrofóbica. El segundo factor es la derivada del coeficiente B con respecto a la temperatura dB/dT. Experimentalmente se ha encontrado que el signo de dB/dT refleja bien el efecto de los solutos en la estructura del agua, y es un mejor indicador del comportamiento hidrofóbico que el signo o la magnitud del coeficiente B. El signo negativo se atribuye a que el soluto tiene un efecto formador sobre la estructura del agua, y el signo positivo a que el soluto tiene un efecto disruptor (16).
La Tabla 5 muestra los valores obtenidos para los coeficientes B y D, los volúmenes molares parciales a dilución infinita presentados en un trabajo previo, y el término B/V∞2 a 283,15 K; 288,15 K; 293,15 K; 298,15 K; 303,15 K y 308,15K para los sistemas estudiados.
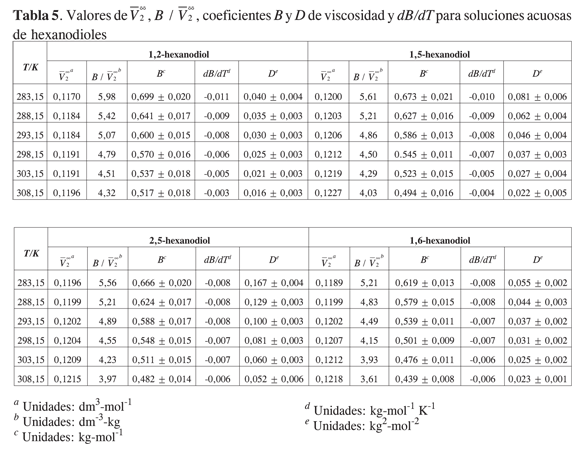
Los coeficientes B de viscosidad para todos los dioles son positivos y de magnitud relativamente grande en comparación con otros alcoholes (17). La magnitud del coeficiente B a las temperaturas estudiadas sigue el siguiente orden: 1,2-hexanodiol> 1,5-hexanodiol>2,5-hexanodiol > 1,6-hexanodiol.
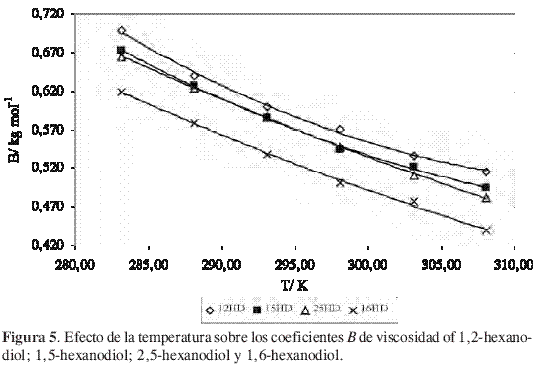
La Figura 5 muestra que el coeficiente B disminuye sensiblemente con la temperatura. La pendiente dB/dT es pequeña y negativa para todos los hexanodioles estudiados. De acuerdo con el significado dado al signo de la pendiente, los hexanodioles considerados tienen un efecto formador sobre la estructura del agua, indicando que el efecto de la cadena apolar sobrepasa la contribución de la hidratación hidrofílica (16-17).
Según la teoría de las velocidades absolutas de Eyring (4, 5, 18), la viscosidad de un fluido newtoniano está dada por la siguiente ecuación:
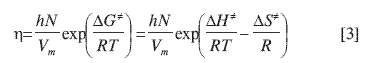
donde h es la constante de Planck, N es el número de Avogadro, Vm es el volumen molar del fluido, ΔG≠, ΔH≠, ΔS≠ son la energía libre de Gibbs, la entalpía y la entropía de activación para el proceso de flujo respectivamente, y T es la temperatura absoluta. La ecuación (3) es válida para líquidos puros y mezclas líquidas.
ΔH ≠ y ΔS ≠ se obtienen de la gráfica de ln(ηV/hN) contra 1/T, siendo la pendiente ΔH≠/R y el intercepto −ΔS≠/R (4, 5).
Para todos los sistemas estudiados las gráficas obtenidas son rectas. ΔG ≠ se obtiene a partir de la ecuación:
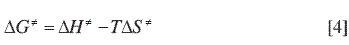
Los parámetros de activación de flujo viscoso calculados para los hexanodioles se presentan en las Tablas 6,7,8 y 9.
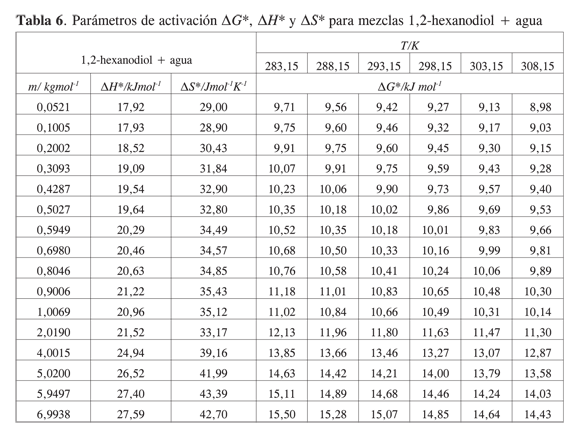
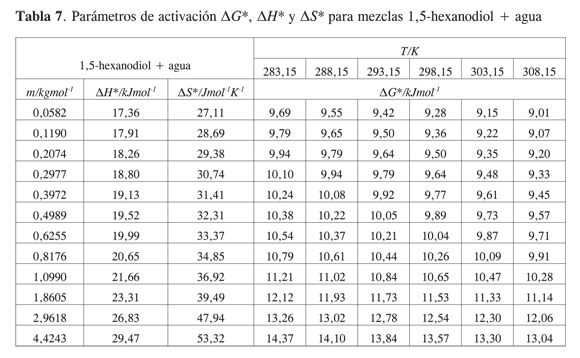
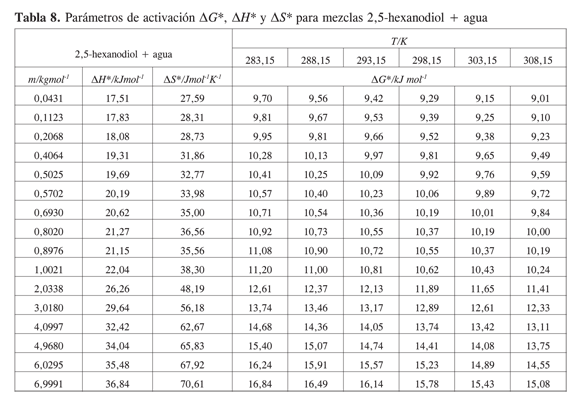
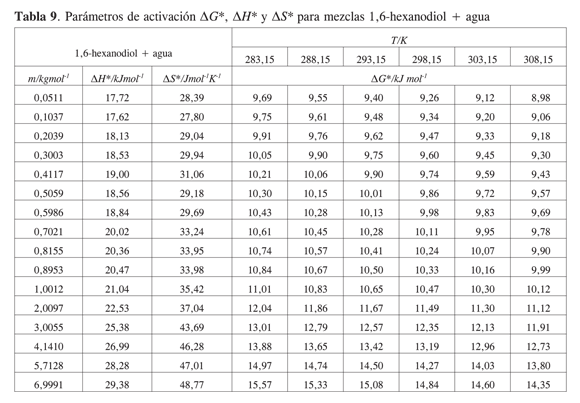
Para las soluciones acuosas de hexanodioles la energía libre, la entropía y la entalpía de activación tienen valores positivos que aumentan con la concentración de soluto. Este comportamiento se explica considerando que las interacciones específicas por unión hidrógeno entre el diol y el agua se favorecen, en comparación con las interacciones diol-diol o agua-agua.
Los parámetros de activación no muestran una diferencia importante entre los distintos hexanodioles. De acuerdo con ello, la posición de los grupos OH no se refleja claramente en el comportamiento de los parámetros de activación.
AGRADECIMIENTOS
Este trabajo fue realizado con el apoyo de la Universidad de Córdoba y la Universidad Nacional de Colombia.
REFERENCIAS BIBLIOGRÁFICAS
1. Origlia, M. L.; Woolley E. M. Apparent Molar Volumes and Apparent Molar Heat Capacities of Aqueous Solutions of Isomeric Butanols at Temperatures from 278.15 K to 393.15 K and at the Pressure 0.35 MPa. J. Chem. Thermodyn. 2001. 33 (4):451-468. [ Links ]
2. George, J.; Sastry, N. V. Densities, Dynamic Viscosities, Speeds of Sound, and Relative Permittivities for Water + Alkanediols (Propane- 1,2- and -1,3-diol and Butane- 1,2-, -1,3-, -1,4-, and -2,3-Diol) at Different Temperatures. J. Chem. Eng. Data. 2003. 48 (6): 1529-1539. [ Links ]
3. Yang, C.; Ma, P.; Zhou, Q. Excess Molar Volume, Viscosity, and Heat Capacity for the Mixtures of 1,4-Butanediol + Water at Different Temperatures. J. Chem. Eng. Data. 2004. 49 (3): 582-587. [ Links ]
4. Kapadi, U.R.; Hundiwale, D.G.; Patil, N.B.; Lande, M.K.; Patil, P.R. Studies of viscosity and excess molar volume of binary mixtures of propane-1,2 diol with water at various temperatures. Fluid Phase Equilib. 2001. 192 (1-2): 63-70. [ Links ]
5. Kapadi, U.R.; Hundiwale, D.G.; Patil, N.B. Thermodynamic interactions of 2,3 butanediol with water. Fluid Phase Equilib. 2003. 208 (1-2): 91-98. [ Links ]
6. Sun, T.F.; Teja, A.S. Density, Viscosity and Thermal Conductivity of Aqueous Solutions of Propylene Glycol, Dipropylene Glycol, and Tripropylene Glycol between 290K and 460 K. J. Chem. Eng. Data. 2004. 49 (5): 1311-1317. [ Links ]
7. Hawrylak, B.; Andrecyk, S.; Gabriel, C.; Gracie, K.; Palepu, R. Viscosity, Surface Tension, and Refractive Index Measurements of Mixtures of Isomeric Butanediols with Water. J. Solution Chem. 1998. 27 (9): 827-841. [ Links ]
8. Tsierkezos, N. G.; Molinou, I. E. Thermodynamic Properties of Water + Ethylene Glycol at 283.15, 293.15, 303.15, and 313.15 K. J. Chem. Eng. Data. 1998. 43 (6): 989-993. [ Links ]
9. Lech, T.; Czechowski, G.; Jadzyn, J. Viscosity of the Series of 1,n-Alkanediols. J. Chem. Eng. Data. 2001. 46 (3): 725-727. [ Links ]
10. Jadzyn, J.; Czechowski, G.; Stefaniak, T. Viscosity of a Series of 1,2-Alkanediols. J. Chem. Eng. Data. 2002. 47 (4): 978-979. [ Links ]
11. Bleazard, J.G.; Sun, T.F.; Johnson, R.D.; DiGuilio, R.M.; Teja, A.S. Transport Properties of Seven Alkanediols. Fluid Phase Equilib. 1996. 117 (1-2): 386-393. [ Links ]
12. Weissberger, A. (Ed.) Physical Methods of Chemistry; Vol. 1 Part 4, 4 ed. New York: Wiley. 1972. [ Links ]
13. Riddick, J. A.; Bunger, W. B.; Sakano, T. K. Organic Solvents: Physical Properties and Methods of Purification, 4th ed., New York: Wiley. 1970. [ Links ]
14. Romero, C. M.; Páez, M. S.; Arteaga, J. C.; Romero, M. A; Negrete, F. Effect of temperature on the volumetric properties of dilute aqueous solutions of 1,2-hexanediol, 1,5-hexanediol, 1,6-hexanediol and 2,5- hexanediol. J. Chem. Thermodyn. 2007. 39 (8): 1101-1109. [ Links ]
15. Tsangaris, J. M.; Martin, R. B. Arch. Viscosities of aqueous solutions of dipolar ions. Biochem. Biophys. 1965. 112 (2): 267-272. [ Links ]
16. Zhao, H. Viscosity B-coefficients and standard partial molar volumes of amino acids, and their roles in interpreting the protein (enzyme) stabilization. Biophys. Chem. 2006. 122 (3): 157-183. [ Links ]
17. Romero, C. M.; Páez, M. S. Thermodynamic properties of aqueous alcohol and polyol solutions. J. Thermal Anal. Calorim. 2002. 70 (1): 263-267. [ Links ]
18. Glasstone, S.; Laidler, K. J.; Eyring, H. The Theory of Rate Process; New York: McGraw-Hill. 1941. [ Links ]














