Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804On-line version ISSN 2357-3791
Rev.Colomb.Quim. vol.37 no.2 Bogotá May/Aug. 2008
NUEVO ALCALOIDE OXOAPORFÍNICO Y OTROS CONSTITUYENTES QUÍMICOS AISLADOS DE Pleurothyrium cinereum (LAURACEAE)
NOVEL OXOAPORPHINE ALKALOID AND OTHER CHEMICAL CONSTITUENTS ISOLATED FROM Pleurothyrium cinereum (LAURACEAE)
NOVO ALCALÓIDE OXOAPORFINÓIDE E OUTROS CONSTITUINTES QUÍMICOS ISOLADOS DE Pleurothyrium cinereum (LAURACEAE)
Ericsson D. Coy, Luis E. Cuca1
1 Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia, sede Bogotá, Cra. 30 No. 45-03, Bogotá, D.C., Colombia. lecucas@unal.edu.co
Recibido: 09/05/08 – Aceptado: 03/08/08
RESUMEN
Del extracto etanólico de las hojas de Pleurothyrium cinereum (Lauraceae) fue aislado el nuevo alcaloide oxoaporfínico oxiprenilado 1,2-metilendioxi-9,10-dimetoxi- 3-isopreniloxi-7H-dibenzo[de, g]quinolin-7-ona (Pleurotirina) , el cual fue purificado por métodos cromatográficos y cuya elucidación estructural se realizó mediante técnicas espectroscópicas (RMN-1H, RMN-13C, RMN-2D y EM). Junto al alcaloide fueron aislados los compuestos thalicminina , ácido (-)-ent-16-kauren-19-oico , alloxantoxiletina , xantiletina , dihydroflavokawina B , 3’-metoxi-3,4-metilendioxi- 4’,7-epoxi-nor-8.5’-neolignan-7.8’-dieno y friedelina , los cuales se reportan por primera vez para la especie y para el género.
Palabras clave: Pleurothyrium cinereum, Lauraceae, alcaloides, cumarinas, diterpeno, norneolignano.
ABSTRACT
A new oxyprenylated oxoaporphine alkaloid 1,2-methylendioxy-9,10-dimethoxy- 3-isopentenyloxy-7H-dibenzo[de,g]quinolin- 7-one (Pleurotirine) was isolated from the ethanolic extract of leaves of Pleurothyrium cinereum (Lauraceae), which was purified using chromatographic methods. Its structure was elucidated by means of spectroscopic techniques (1H-NMR, 13C-NMR, 2D-NMR and MS). Together with this alkaloid were isolated thalicminine , ent-kaurenoic acid , xanthyletin , alloxanthoxyletin , dihidroflavokawin B , 3’-methoxy-3, 4-methylendioxy-4’, 7-epoxynor- 8.5’- neolignan-7.8’-diene and friedelin 8 They are reported for the first time for this species and genus.
Key Words: Pleurothyrium cinereum, Lauraceae, alkaloids, coumarins, diterpene, norneolignan.
RESUMO
Do extrato etanólico das folhas de Pleurothyrium cinereum (Lauraceae) foi isolado o novo alcalóide oxoaporfinóide oxiprenilado 1,2-metilendioxi- 9,10- dimetoxi- 3-isopreniloxi-7H-dibenzo[de,g]quinolin- 7-ona (Pleurotirina) , quais foram isolados por métodos cromatograficos e o elucidación estrutural foi feito por meio das técnicas espectroscopicas (RMN-1H, RMN-13C, RMN-2D, EM). Ao lado do alcalóide foram isolados os compostos thalicminina , ácido (-)-ent-16-kauren- 19-óico , alloxantoxiletina , xantiletina , dihidroflavokawin B , 3’-metoxi- 3,4-metilendioxi-4’,7-epoxi-nor-8.5’- neolignan-7.8’-dieno e friedelina , quais são relatados para a primeira vez para a espécie e a sorte.
Palavras-chave:Pleurothyrium cinereum, Lauraceae, alcalóides, cumarinas, diterpeno, norneolignana.
INTRODUCCION
La familia Lauraceae es muy conocida, no solo por su protagonismo en la medicina tradicional, sino porque en estudios fitoquímicos realizados a especies que pertenecen a esta familia se han encontrado varios tipos de metabolitos, que incluyen alcaloides, lignanos, neolignanos y flavonoides (1-3) con importantes actividades comprobadas (4-5). Entre los alcaloides, los más representativos son del tipo bencilisoquinolínico, especialmente de tipo aporfínico (6).
El género Pleurothyrium (LAURACEAE) está presente desde Guatemala hasta Bolivia y posiblemente al suroeste de Brasil (7). No obstante, el género está mejor representado en Perú, Ecuador y Colombia, especialmente en los Andes (por debajo de los 1000 m.s.n.m). En Colombia se conocen once especies, distribuidas especialmente en los departamentos de Antioquia, Boyacá, Valle del Cauca, Putumayo, Nariño y Amazonas (8). P. cinereum puede encontrarse al sur del territorio nacional, en zonas limítrofes con Perú y Ecuador. Es muy usado por la tribu awá en Nariño, Colombia, por su madera dura y resistente. Esta especie, al igual que el género, no posee antecedentes en cuanto a estudios fitoquímicos se refiere; por tanto, todos los compuestos aislados se reportan por primera vez para los mismos. En este trabajo se presentan los resultados obtenidos en el estudio fitoquímico realizado en las hojas de la especie Pleurothyrium cinereum, con el aislamiento del nuevo alcaloide oxoaporfínico prenilado Pleurotirina , junto con los compuestos conocidos thalicminina (9), ácido (-)-ent-16-kauren- 19-oico (10), alloxantoxiletina (11), xantiletina (12), dihidroflavokawina B (13), 3’-metoxi-3,4-metilendioxi- 4’,7-epoxi-nor-8.5’-neolignan- 7.8’-dieno (14) y friedelina (15).
PARTE EXPERIMENTAL
Materiales y Equipos
La cromatografía en columna (CC) se realizó utilizando sílica gel (Merck, 40-63 µm) y la cromatografía en capa delgada (CCD) empleando cromatoplacas Merck de sílica gel HF254 de 0,3 mm de espesor; los solventes utilizados fueron purificados antes de su utilización, y fueron éter de petróleo (EdP), acetato de isopropilo (AcOiPr), metanol (MeOH), hexano (Hex), tolueno (Tol) y acetato de etilo (AcOEt). Los espectros RMN-1H, RMN-13C y HMBC fueron tomados en un espectrómetro BRUKER Avance 400, empleando CDCl3 como solvente; los desplazamientos químicos (δ) fueron referenciados a TMS como patrón interno (1H400 MHz y 13C 100 MHz). Los espectros NOESY fueron registrados en un instrumento BRUKER Avance 500 con iguales condiciones. Los espectros IR fueron tomados con KBr en un espectrómetro Thermo Nicolet 6700. Los espectros de masas por impacto electrónico (EM-IE) fueron tomados en un instrumento Finnigan SSQ 710 a 70eV. Los datos de masa exacta fueron determinados por medio de un instrumento QToFmicro Micromass Manchester Waters Inc. con interfaz ESI en modo positivo; y de composición elemental fueron determinados en un analizador Elementar modelo Vario EL III.
Material Vegetal
Las muestras de hojas de Pleurothyrium cinereum (van der Werff) fueron colectadas en noviembre de 2005 en el resguardo indígena awá del Alto Albi, en el municipio de Tumaco (departamento de Nariño, Colombia) por la bióloga Ayda Lucía Patino. Una muestra del espécimen fue depositado en el Herbario Nacional Colombiano, del Instituto de Ciencias Naturales de la Universidad Nacional de Colombia bajo el número de colección COL518334.
Extracción y aislamiento
Las hojas secas y molidas de P. cinereum (250 g) fueron maceradas con etanol a 18 °C. El extracto etanólico fue evaporado a sequedad (21 g), y fraccionado por soxhlet usando diferentes solventes: EdP (5,2 g), CHCl3 (3,9 g), AcOEt (1,1 g) y MeOH (9,0 g). El extracto de EdP fue sometido a cromatografía en columna (CC) en sílica gel eluyendo en gradiente con una mezcla Tol:AcOiPr (95:5 a 3:7) obteniendo quince fracciones. De la fracción 3 (128,7 mg) se obtuvo el compuesto (7,0 mg), purificado por CC en sílica gel usando Tol:AcOiPr 8:2 como mezcla de elución. Los compuestos (4,2 mg) y (7,3 mg) fueron purificados de la fracción 6 (256,5 mg) por CC en sílica gel usando como eluyente una mezcla Tol:AcOEt 7:3. El compuesto (22,2 mg) se purificó de la fracción 10 (218,3 mg) por CC usando como eluyente Tol:AcOiPr 6:4. El extracto de cloroformo fue sometido a CC en sílica gel eluyendo en gradiente con una mezcla Tol:AcOiPr (9:1 a 1:1), obteniendo nueve fracciones. De la fracción 1 (323,8 mg) fueron obtenidos los compuestos (5,3 mg) y (8,3 mg) mediante purificación en CC en sílica gel con el sistema de elución Hex:Me2CO (6:4). La fracción 2 (235,7 mg) fue sometida a CC en sílica gel con una mezcla Tol:AcOEt (7:3), de la cual se obtuvieron tres fracciones, de cuya primera (44,5 mg) se purificó por CCD preparativa (Hex:AcOEt:MeOH 6:4:0.5) el compuesto (9,2 mg) y en la segunda (35,6 mg) se purificó por CCD preparativa (Tol:Me2CO:MeOH 7:2.5:0.5) el compuesto (12,3 mg).
1,2 - metilendioxi - 9,10 - dimetoxi - 3 - isopreniloxi - 7H - dibenzo[de,g]quinolin - 7 - ona (Pleurotirina) Cristales blancos (MeOH), Pf=150-152 °C; 1H-RMN (400 MHz, CDCl3 ): ver tabla 1. 13C-RMN (100 MHz, CDCl3 ): ver tabla 1. IR (KBr) í: 1716 (C=O) cm-1. IE-EM m/z (%): 419 (M+,100), 351 (61), 336 (68), 322 (30.), 308 (45), 294 (40), 167 (49), 109 (54), 95 (67). EMARESI- QToFmicro 420,1450 [M+H]+ ; calculado para C24H22NO6 420,1447. Análisis elemental: encontrado C, 68,75; H, 5,04; N, 3,34; O, 22,88 (calculado C, 68,73; H, 5,05; N, 3,34; O, 22,89).
RESULTADOS Y DISCUSION
El compuesto 1 fue obtenido como un sólido blanco cristalino (MEOH). Su fórmula molecular fue establecida como C24H21NO6 a partir del análisis EMARESI- QToFmicro (420,1450 [M+H]+ ; calculado para C24H22NO6 420,1447) y por análisis elemental C, 68,75; H, 5,04; N, 3,34; O, 22,88 (calc. C, 68,73; H, 5,05; N, 3,34; O, 22,89). Por las determinaciones de masa exacta y análisis elemental, se puede apreciar que el compuesto tiene nitrógeno en su estructura. El espectro IR muestra la presencia de un grupo carbonilo (1716 cm-1).
El espectro RMN-1H muestra la presencia de señales de dos grupos metoxilo (δH 4,05 y 4,14), un metilendioxi (δH 6,18), cuatro señales de hidrógenos unidos a sistemas aromáticos como dos singletes (δH 8,50 y 7,93) y dos dobletes (δH 8,96 y 8,20; J = 5,6 Hz). Estas dos últimas señales doblete, por su desplazamiento, multiplicidad y constante de acoplamiento, son características del doble enlace en alcaloides isoquinolínicos (16). Presenta también señales singlete de dos grupos metilo (δH 1,71 y 1,73), una señal doblete de un grupo metileno (δH 4,94; J =7,0) y una señal multiplete de un grupo metino de olefina (δH 5,60). Estas tres señales son características de un grupo isopentenilo unido a heteroátomo (17).
Con el espectro RMN-13C y los experimentos DEPT 90 y 135 (tabla 1) es posible establecer que el compuesto tiene 24 carbonos discriminados en cuatro grupos metilo, dos de ellos metoxilo (δc 18,1; 25,8; 56,1; 56,6), dos grupos metileno, uno de ellos como grupo metilendioxi (δC 70,1; 101,3), cinco metinos (δC 110,5; 116,5; 119,0; 119,8; 145,0) y trece carbonos cuaternarios (δC 115,4; 122,6; 126,1; 131,2; 131,6; 139,7; 145,5; 146,5; 147,4; 148,6; 154,7; 155,2; 180,4) (tabla 1). Esta información, al compararla con datos espectroscópicos reportados de 1H-RMN y 13C-RMN de compuestos relacionados (18), sugiere que el compuesto posee un esqueleto oxoaporfínico y un grupo isopenteniloxi. Esto está soportado por evidencias espectrales en HMBC y NOESY.
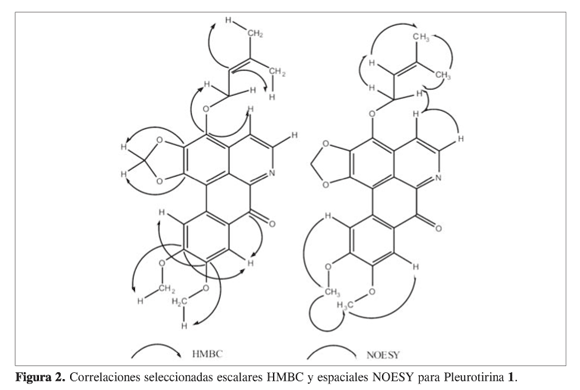
El espectro HMBC permitió establecer las posiciones de los protones cuyas señales están a δH 7,93 y 8,50 ppm, ya que la señal a δH 7,93 ppm presenta una correlación HMBC a tres enlaces con el carbono a δC 180,4 ppm, que corresponde al carbono del grupo carbonilo. Esta última señal muestra una correlación a tres enlaces con la señal a δC 154,7 ppm, la cual a su vez presenta correlación con la señal a δH 4,05 ppm (s, 3H), correspondiente a los hidrógenos de un grupo metilo unido a un heteroátomo formando un grupo metoxilo. Así mismo, la señal a δC 146,5 ppm presenta dos correlaciones en el espectro HMBC: la primera, con la señal a δH 4,14 ppm (s, 3H), correspondiente a los hidrógenos del otro grupo metoxilo; y la segunda, con la señal a δH 8,50 ppm (s, 1H), correspondiente al otro hidrógeno unido a carbono en anillo aromático.
La posición del grupo isopenteniloxi fue establecida gracias al espectro NOESY. En este experimento es posible apreciar la correlación espacial entre la señal a δH 4,94 ppm (d, 2H), correspondiente al grupo metileno en la posición 1’ del grupo isopenteniloxi, y la señal a δH 8,96 ppm, perteneciente al hidrógeno en posición beta al nitrógeno del anillo isoquinolínico. Además, esta última señal presenta en el espectro HMBC una correlación con la señal a δC 154,6 ppm, la cual a su vez posee una correlación a larga distancia a través de heteroátomo con la señal a δH 4,94 ppm, lo que permite establecer adecuadamente la posición del grupo isopenteniloxi. En la figura 2 se muestran correlaciones seleccionadas escalares HMBC y espaciales NOESY para el compuesto .
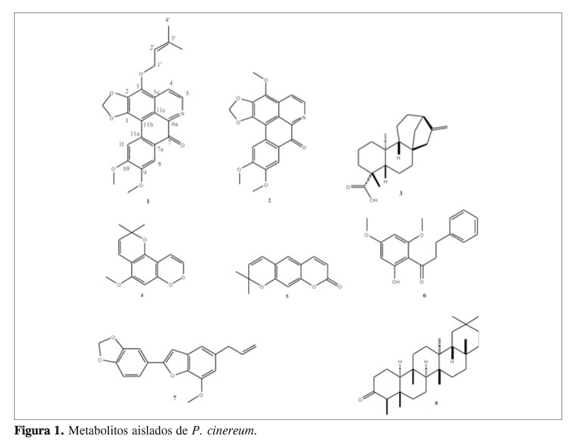
Los compuestos conocidos fueron identificados por el análisis de los datos 1H-RMN, 13C-RMN, 2D-RMN, EM y comparación con datos reportados en la literatura (9-15).
Aunque existen numerosos reportes de alcaloides aporfínicos (18), a la fecha no existe precedente alguno respecto a alcaloides de tipo aporfínico con sustitución oxiprenilada como producto natural, lo que hace a P. cinereum una especie interesante desde el punto de vista químico, y probablemente farmacológico, por la presencia del compuesto como constituyente químico de la misma.
Sobre las cumarinas, pese a que no son tan comunes en la familia Lauraceae, existen reportes de este tipo de compuestos como constituyentes químicos de especies de esta familia (22). El norneolignano 3’-metoxi- 3,4- metilendioxi- 4’,7- epoxi-nor-8.5’-neolignan-7.8’-dieno corresponde al producto de demetanación de isolicarina, un neolignano dihidrobenzofuránico, cuya presencia está bien marcada en especies pertenecientes a la familia Lauraceae (3).
AGRADECIMIENTOS
Agradecemos al Departamento de Química de la Universidad Nacional de Colombia, sede Bogotá, por la financiación de este trabajo. Al Laboratorio de Resonancia Magnética Nuclear de la Universidad Nacional de Colombia, por el registro de los espectros RMN. Al Institut fur Chemie de la Universidad de Potsdam, por la toma de IR, EMAR, EMIE, RMNNOESY y análisis elemental. Y al DAAD (Deutscher Akademischer Austausch Dienst) por la financiación de una estancia de investigación en la Universidad de Potsdam.
REFERENCIAS BIBLIOGRÁFICAS
1. Guinaudeau, H.; Shamma, M.; Tantisewie, B.; Pharadai, K. Aporphine Alkaloids Oxygenated at C-7 J. Nat. Prod. 1982. 45 (3): 355-357. [ Links ]
2. Ma, W. W.; Kozlowski, J. F.; McLaughlin, J. L. Bioactive Neolignans from Endlicheria dysodantha. J. Nat. Prod. 1991. 54 (4): 1153-1158. [ Links ]
3. Rossi, M. H.; Yoshida, M.; Soares, M. J. G. Neolignans, styrylpyrones and flavonoids from an Aniba species. Phytochemistry. 1991. 45 (6): 1263-1269. [ Links ]
4. Céspedes, C. L.; Marín, J. C.; Domínguez, M.; Ávila, J. G., Serrato, B. Plant growth inhibitory activities by secondary metabolites isolated from Latin American flora. Advances in Phytomedicine. 2006.2 : 373-410. [ Links ]
5. Tsai, T.-H.; Wang, G.-J.; Lin, L.-C. Vasorelaxing Alkaloids and Flavonoids from Cassytha filiformis. J. Nat. Prod. 2008. 71 (2): 289-291. [ Links ]
6. Liscombe, D. K.; MacLeod, B. P.; Loukanina, N.; Nandi, O. I.; Facchini, P. J. Evidence for the monophyletic evolution of benzylisoquinoline alkaloid biosynthesis in angiosperms. Phytochemistry. 2005.66 (11): 1374-1393. [ Links ]
7. van der Werff, H. A Revision of the Genus Pleurothyrium (Lauraceae). Ann. Missouri Bot. Gard. 1993.80 : 39-118. [ Links ]
8. Ideam, 2001. Distribución de 15 familias forestales en Colombia. Atlas Interactivo. Sitio web: http://www.ideam.gov.co/atlas/mecosis. htm [ Links ]
9. Baralle, F.; Schvarzberg N.; Vernengo M. J.; Moltrasio, G. Y.; Giacopello, D. Thalicminine from Ocotea puberula. Phytochemistry. 1973. 12 (4): 948-949. [ Links ]
10. Batista, R.; García, P. A.; Castro, M. A.; del Corral, J. M.; San Feliciano, A.; de Oliveira, A. B. New oxidized ent-kaurane and ent-norkaurane derivatives from kaurenoic acid. J. Braz. Chem. Soc. 2007. 18 (3): 622-627. [ Links ]
11. Amaro-Luis, J. M.; Massanet, J. M.; Pando, E.; Rodríguez, Luis, F.; Zubia, E. New Coumarins from Pilocarpus goudotianus. Planta Medica. 1990.56 : 304-306. [ Links ]
12. Wang, S.; Ju, Y.; Chen, X. G.; De Hu, Z. Separation and determination of coumarins in the root bark of three citrus plants by micellar electrokinetic capillary chromatography. Planta Medica. 2003.69 : 483-486. [ Links ]
13. Itokawa, H.; Morita, M.; Mihashi, S. Phenolic compounds from the rhizomes of Alpinia speciosa. Phytochemistry. 1981.20 (11): 2503-2506. [ Links ]
14. Puentes de Díaz, A. M. Neolignans from Anaxagorea clavata. Phytochemistry. 1996. 44(2): 345-346. [ Links ]
15. Mahato, S. B.; Nandy, A.; Roy, G. P. Triterpenoids. Phytochemistry. 1992.31 (7): 2199-2249. [ Links ]
16. Chen, J.-J.; Tsai, I.-L.; Chen, I.-S. New Oxoaporphine Alkaloids from Hernandia nymphaeifolia. J. Nat. Prod. 1996.59 (2): 156-158. [ Links ]
17. Epifano, F.; Genovese, S.; Menghini, L.; Curini, M. Chemistry and pharmacology of oxyprenylated secondary plant metabolites. Phytochemistry. 2007.68 (7): 939-953. [ Links ]
18. Guinaudeau, H.; Leboeuf, M.; Cavé, A. Aporphinoid Alkaloids, V. J. Nat. Prod. 1994. 57 (8): 1033-1135. [ Links ]
19. Garcez, W. S., Garcez, F. R.; da Silva, G. E. L. M.; Shimabukuro, A. A. Indole Alkaloid and other Constituents from Ocotea minarum. J. Braz. Chem. Soc. 2005. 16 (6B): 1382-1386. [ Links ]














