Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804On-line version ISSN 2357-3791
Rev.Colomb.Quim. vol.37 no.2 Bogotá May/Aug. 2008
FLAVONOIDES AISLADOS DE LAS INFLORESCENCIAS DE Piper hispidum Kunth (PIPERACEAE) Y DERIVADOS ACETILADOS
ISOLATED FLAVONOIDS FROM INFLORESCENCES OF Piper hispidum Kunth (PIPERACEAE) AND ACETYLATED
DERIVATIVES FLAVONOIDES ISOLADOS DAS INFLORESCÊNCIAS DE Piper hispidum Kunth (PIPERACEAE) E DERIVADOS ACETILADOS
Erika A. Plazas G.1, Luis E. Cuca S.1,2, Wilman A. Delgado A.1
1 Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia, sede Bogotá, Bogotá, Colombia. eaplazasg@unal.edu.co
2 lecucas@unal.edu.co
Recibido: 14/04/08 – Aceptado: 22/08/08
RESUMEN
A partir del extracto etanólico de las inflorescencias de la especie Piper hispidum Kunth (Piperaceae) fueron aislados tres flavonoides: 5-hidroxi-7-metoxiflavanona, 5-hidroxi-4’,7-dimetoxiflavanona y 2’,4’,6’-trimetoxidihidrochalcona. De las flavanonas aisladas fueron obtenidos los derivados acetilados: 5-acetoxi- 7-metoxiflavanona y 5-acetoxi-4’,7- dimetoxiflavanona. Las estructuras fueron elucidadas empleando técnicas espectroscópicas y por comparación con datos de literatura. Los compuestos naturales y sus derivados fueron sometidos al bioensayo de letalidad frente a Artemia salina. El flavonoide 5-hidroxi-7-metoxiflavanona presenta la mayor actividad tóxica frente a los microcrustáceos CL50 1.8 µg/ml.
Palabras Clave: Piper hispidum kunth, Piperaceae, flavanonas, dihidrochalconas, derivados acetilados y ensayo de letalidad frente a Artemia salina.
ABSTRACT
From the ethanolic extract of the inflorescences of Piper hispidum Kunth (Piperaceae) were isolated three flavonoids 5-hydroxy-7-methoxyflavanone, 5-hydroxy-4’,7-dimethoxyflavanone and 2’,4’,6’-trimethoxydihydrochalcone. The acetylated derivatives 5-acetoxy- 7-methoxyflavanone and 5-acetoxy- 4’,7- dimethoxyflavanone were synthesized from the isolated pure flavanones. Characterization was mainly achieved by spectroscopic techniques and compared with literature data. Natural compounds and derivatives were subjected to brine shrimp lethality bioassay. The most toxic compound was the flavonoid 5-hydroxy- 7-methoxyflavanone with a LC50 1,8 µg/ml.
Key Words:Piper hispidum Kunth, Piperaceae, flavanones, dihydrochalcones, acetylated derivatives and brine shrimp lethality assay.
RESUMO
A partir do extracto etanólico das inflorescências da especie Piper hispidum Kunth (Piperaceae) foram isolados três flavonóides: 5-hidroxi-7-metoxiflavanona, 5-hidroxi-4’,7-dimetoxiflavanona y 2’,4’,6’-trimetoxidihidrochalcona. Das flavanonas isoladas foram sintetizados os derivados acetilados 5-acetoxi-7-metoxiflavanona y 5-acetoxi-4’,7-dimetoxiflavanona. As estruturas foram elucidadas empregando técnicas espectroscópicas e por comparasaõ com dados da literatura. Os compostos naturais e seus derivados foram submetidos a bioensaíos de letalidade frente a Artemia salina. O flavonoide 5-hidroxi-7-metoxiflavanona presenta uma major atividad tóxica frente aos microcrustáceos CL50 1,8 µg/ml.
Palavras-Chave:Piper hispidum Kunth, Piperaceae, flavanonas, dihidrochalconas, derivados acetilados e ensaios de letalidade frente a Artemia salina.
INTRODUCCION
La familia Piperaceae es originaria del sudoeste de la India y constituye una de las más antiguas. La pimienta (Piper nigrum) es la especie más representativa de esta familia. La historia de su uso se remonta al siglo IV a.C., época en la cual se conocía por su nombre en sánscrito Pippali (1).
En Colombia las especies del género Piper se conocen popularmente como cordoncillos o anises y son empleadas en el tratamiento de diversas enfermedades, entre ellas diarrea, disentería, dolores de estómago, caries dentales, y como cicatrizante (1). Los indígenas de las tribus motilones y bari en Norte de Santander mastican los tallos de Piper erithroxyloides (Achikaira) para prevenir la caries y como estimulante, produciendo un efecto narcótico que duerme la lengua y se dice que tiene una acción similar a la de la coca (5). Uno de los departamentos con mayor profusión de usos etnobotánicos es el Chocó: allí las comunidades indígenas embera emplean las diversas especies como antiinflamatorios, analgésicos, antirreumáticos y contra picadura de serpientes (6).
Los estudios fitoquímicos realizados en diferentes especies del género Piper han permitido aislar una gran variedad de metabolitos: amidas, lignanos, neolignanos, terpenos y flavonoides (7). Los flavonoides de mayor abundancia en el género Piper son chalconas, dihidrochalconas, flavanonas y algunas flavonas. Las chalconas y dihidrochalconas se caracterizan por no poseer sustituyentes en el anillo B, con excepción de algunas aisladas de las hojas de Piper aduncum y Piper methysticum (figura 1) (8).
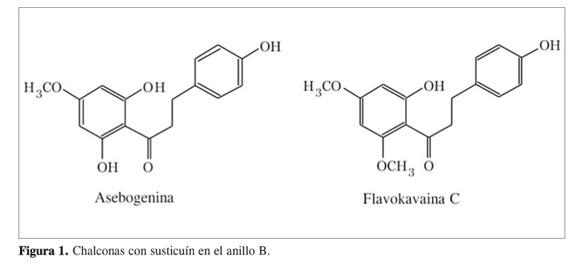
Las dihidrohalconas aisladas del género Piper han mostrado actividad antiparasitaria frente a especies de Leishmania sp. (9) y Plasmodium falciparum (10). Por otra parte las flavanonas han presentado actividad antifúngica (11) y citotóxica (12).
La especie Piper hispidum se encuentra ampliamente distribuída en las Antillas, Centroamérica y la mayor parte de Suramérica. Es un arbusto nodoso, de tamaño y forma variable. Las características morfológicas de esta especie son muy diversas lo cual ha permitido diferenciarla en más de seis variedades, entre ellas P. hispidum SW, P. hispidum C.CD, P. hispidum H.B.K. y P. hispidum Kunth (13). La especie P. hispidum SW se encuentra distribuida principalmente en las Antillas y Centroamérica, mientras las variedades P. hispidum C.CD y P. hispidum Kunth (especie de estudio) se encuentran principalmente en Suramérica (14).
Los estudios fitoquímicos reportados para la especie Piper hispidum se han realizado principalmente sobre las hojas de las variedades P. hispidumSWy P. hispidum H.B.K. Se han aislado amidas pirrolidínicas N-[7-(3’,4’-metilendioxifenil)- 2(Z)-4(Z)-heptadienoil]-pirrolidina y N- [5-(3’,4’-metilendioxifenil)-2(E)-pentadienoil]- pirrolidina con actividad antifúngica contra el hongo Cladosporium sphaerospermu (15). También se han aislado flavonoides tipo charcona, como 2’,3’-dihidroxi-4’, 6’-dimetoxichalcona, dihidrochalconas 2’,6’-dihidroxi-4’-metoxidihidrochalcona y 2’,4’,6’-trihidroxidihidrochalcona que han presentado actividad frente a Plasmodium falciparum, el parásito causante de la malaria (16), y flavanonas como 6-hidroxi-5,7-dimetoxiflavanona, 8-hidroxi-5,7-dimetoxiflavanona, pinostrobina y 5,7,8-trimetoxiflavanona (7).
MATERIALES Y METODOS
General
Los puntos de fusión fueron determinados en un fusiómetro Fischer-Johns. Los espectros infrarrojo IR fueron tomados en el equipo Perkin Elmer FTIR Panagon 500 serie 1000 en película. Los espectros de resonancia magnética nuclear RMN 1H, 13C, experimentos DEPT y bidimensionales COSY, HMQC y HMBC, fueron tomados en el equipo Bruker Avance 400, a 400 MHz para 1H y a 100 MHz para 13C, utilizando el solvente deuterado (CDCl3) como estándar interno. Para la cromatografía en columna CC se empleó sílica gel 60 (Merck). En la cromatografía en capa fina CCF se utilizó sílica gel 60 GF254, 0,3 mm espesor (Merck) y reveladores universales: luz UV de λ 254 y 365 nm y vapores de yodo. Los espectros de masas de EM (IE) 70 eV fueron tomados en un equipo Shimadzu QP5050.
Material Vegetal
La especie Piper hispidum Kunth fue recolectada en el municipio Nocaima, Cundinamarca, en marzo de 2005, por el profesor Wilman Delgado, y clasificada por la bióloga Laura Clavijo en septiembre del mismo año. Un espécimen reposa en el Herbario Nacional Colombiano del Instituto de Ciencias de la Universidad Nacional de Colombia con el número de colección COL-510518.
Extraccion y aislamiento
Las inflorescencias de Piper hispidum Kunth secas y troceadas (160 g) se sometieron a extracción por maceración con etanol del 96%. El extracto etanólico resultante se concentró a presión reducida, obteniendo 16,1 g de extracto crudo. Se sometieron 14,9 g de extracto a fraccionamiento por CC (sílica gel, solventes de polaridad creciente EdP, CH2Cl2, CHCl3, iPrOH y MeOH), obteniendo 135 fracciones que fueron agrupadas en 38 fracciones finales de acuerdo con su perfil en cromatografía en capa delgada.
Las fracciones 9-11 (583 mg) se sometieron a purificación por CC (sílica gel; C6H5CH3-AcOiPr 9:1), obteniendo cuatro fracciones. La fracción 3 se sometió a lavados sucesivos con MeOH y cristalización en C6H5CH3 para obtener el compuesto (350,6 mg) en forma de láminas blancas con punto de fusión 92-93 ºC. Las fracciones 13 y 14 de la columna fraccionamiento se sometieron a CC (sílica gel; C6H5CH3-AcOiPr 8:2), obteniendo cuatro fracciones finales. Las fracciones 2-3 se reunieron y recristalizaron con MeOH, obteniendo cristales blancos en forma de agujas y p.f. 112-113 ºC, compuesto (509,2 mg). A las fracciones 18-25 (1129,2 mg) se les realizó CC (sílica gel; n-hexano-acetona 7:3), obteniendo doce fracciones. La fracción 7 de esta columna se sometió nuevamente a CC con sílica gel y hexano/acetona 6:4; la fracción 7-3 fue recristalizada con metanol obteniendo el compuesto (722,6 mg) como un sólido amarillo en forma de agujas con p.f. 156-158 ºC.
Obtención de los derivados acetilados
En un experimento típico de acetilación (17) se adicionó 1 mL de anhídrido acético y 0,4 mL de piridina a 40,9 mg del compuesto y 52,4 mg del compuesto . La mezcla de reacción se sometió a reflujo con agitación constante a 80 ºC. La reacción fue monitoreada por CCF. A las 24 horas se suspendió el calentamiento, y a la mezcla de reacción se le adicionó hielo y HCl al 5% (3*2 mL) hasta pH 5. Se realizaron extracciones con CHCl3 (3*10 mL). Las fases orgánicas se reunieron y secaron con CaCl2, se filtró y el solvente se eliminó por destilación a presión reducida. Los compuestos se purificaron por CC (sílica gel; C6H5CH3-AcOiPr 8:2), obteniendo el compuesto (35,4 mg) como un aceite amarillo que cristalizó rápidamente, y el compuesto (38,9 mg) que se obtuvo como cristales blancos en forma de agujas.
Ensayo de letalidad con artemia salina
El ensayo de letalidad en A. salina se realizó de acuerdo con el protocolo sugerido por McLaughlin y colaboradores (18). Los huevos de A. salina se incubaron durante 24 horas a una temperatura de 28 ºC en un medio de cultivo consistente en una solución acuosa de sal marina a una concentración de 38 g/L. Los compuestos se solubilizaron inicialmente en DMSO (250-500µl) y se prepararon soluciones a concentraciones de 100, 50, 10 y 1 µg/mL usando medio de cultivo. Se realizó un control negativo empleando DMSO a la concentración máxima 2% en medio de cultivo. Los ensayos se realizaron por triplicado empleando 10 nauplios por pozo. Al cabo de 24 horas se hicieron las lecturas, y se registró el número de sobrevivientes en cada pozo.
Los datos obtenidos fueron procesados con el programa estadístico “Epa probit analysis program” con el fin de determinar la concentración letal 50 (CL50) y un rango de confianza de 95%.
RESULTADOS Y DISCUSION
Las cantidades aisladas de (350,6 mg), (509,2 mg) y (722,6 mg) evidencian la importante presencia de estos compuestos en el extracto etanólico, lo cual permite considerarlos como componentes mayoritarios de las inflorescencias de la especie Piper hispidum Kunth. Los rendimientos del aislamiento y purificación de estos compuestos a partir del material vegetal seco son de 0,22%, 0,32% y 0,45%, respectivamente.
Los compuestos - en CCF presentaron coloraciones amarillas en la luz visible y verdes fluorescentes en el UV 365 nm por exposición a vapores de amoníaco. Este comportamiento es característico para compuestos de tipo flavonoide (19). Los compuestos y dan prueba positiva al revelar con FeCl3 en CCF; esto indica la presencia de OH fenólicos en sus estructuras (19).
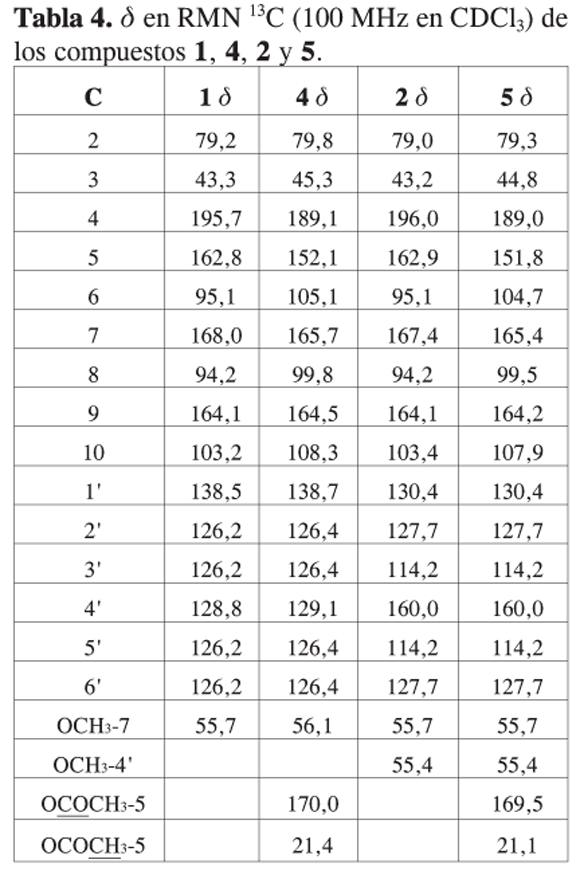
La caracterización de los compuestos - se realizó empleando técnicas espectroscópicas como IR, RMN 1H, 13C, experimentos DEPT y bidimensionales.
El compuesto fue identificado como 5-hidroxi-7-metoxiflavanona, conocido como pinostrobina, por comparación con datos de literatura (20). Esta flavanona ha sido aislada de diferentes especies como Boesenbergia rotunda (Zingiberaceae), en la familia Piperaceae y específicamente en el género Piper de las especies Piper aduncum y Piper hispidum Sw (hojas) (7).
El compuesto fue caracterizado como 5-hidroxi-4’,7-dimetoxiflavanona. Esta flavanona ha sido encontrada en especies de las familias Annonaceae (21), Lauraceae (22) y Zingiberaceae (23). Sin embargo, este flavonoide no ha sido reportado en la familia Piperaceae.
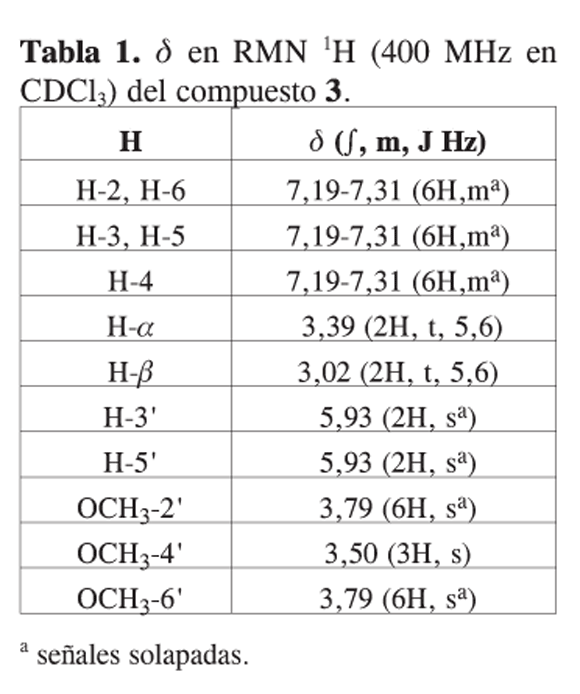
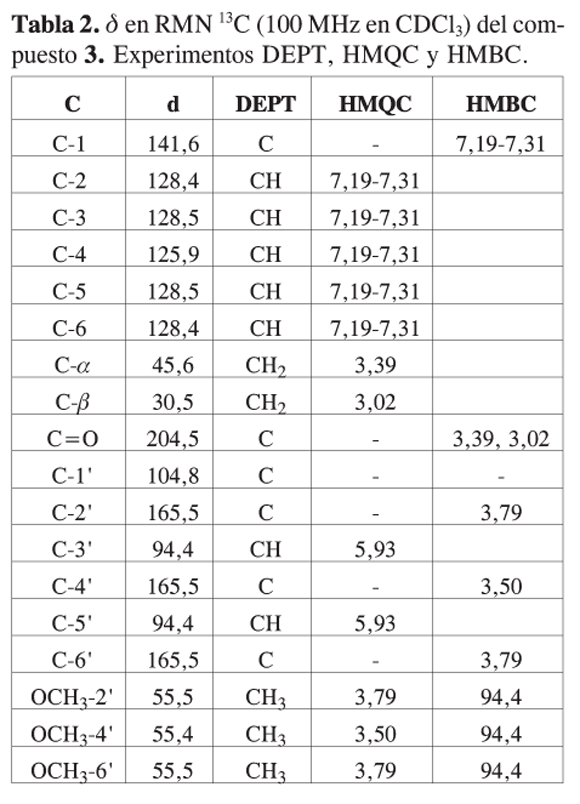
El compuesto fue identificado como 2’,4’,6’-trimetoxidihidrochalcona. No existen muchos reportes del aislamiento de esta dihidrochalcona. En la literatura aparece como aislada del helecho Woodsia scopulina (24). Sin embargo no se reportan los datos de caracterización del compuesto. Los autores hacen referencia a otro artículo, pero en este se sintetizan chalconas y no dihidrochalconas (25). Teniendo en cuenta que no se posee un reporte de los datos de RMN para la identificación de este compuesto, a continuación se presentan los resultados obtenidos.
Compuesto 3: IR nmáx cm-1: 3022, 3004, 2971, 2849, 1691, 1645, 1594, 1446, 1213, 1116; RMN 1H: ver tabla 1; RMN 13C: ver tabla 2; EM (IE) m/z: 300 (M+), 272, 255, 193, 167.
A los compuestos Rf 0,7 (C6H5CH3- AcOiPr 9:1) y Rf 0,6 (C6H5CH3- AcOipR 9:1) se les realizó una acetilación para obtener los respectivos derivados Rf 0,5 (C6H5CH3-AcOiPr 9:1) y Rf 0,4 (C6H5CH3-AcOiPr 9:1), con el fin de observar su toxicidad frente a Artemia salina. La comparación de los Rf de los compuestos y con y permiten inferir la obtención de los derivados acetilados. Se evidencia un aumento en la polaridad de los compuestos sintetizados respecto a los compuestos naturales, que se debe a la introducción en la molécula de un grupo acetoxi y a la pérdida de un grupo hidroxilo que se encuentra quelatado con el carbonilo de la benzopirona. La confirmación de la obtención de los compuestos y se realizó empleando las técnicas espectroscópicas de IR, RMN 1H y 13C, y por comparación con los datos obtenidos para los compuestos y . En el espectro IR de los compuestos y se observa la desaparición de la banda de estiramiento de O-H (3400 cm-1) y la aparición de una banda hacia 1769 cm-1 característica para el estiramiento C=O en carbonilos de éster que se puede confirmar con la banda en 1158 cm-1 correspondiente a la banda del estiramiento C-O de éster. En el espectro de 1H-RMN del compuesto se observa la desaparición de la señal en δ 12,00 (1H, s) correspondiente al protón del OH en la posición 5 que se encuentra quelatado con el grupo carbonilo de la benzopirona. De igual forma se observa la presencia de una señal cerca en δ 2,39 (3H, s) correspondiente a los protones del grupo CH3 unidos al carbonilo del grupo acetilo. Este comportamiento se presenta también para el compuesto (tabla 3).
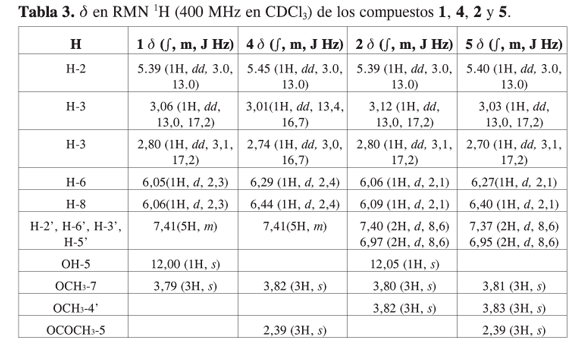
En el espectro de 13C-RMN de los compuestos y se observa la presencia de las señales características para el grupo acetoxi (13): el carbonilo de éster en δ 170 y el CH3 unido al carbonilo en δ 21,4. También se presentan diferentes desplazamiento de las señales respecto a los compuestos y (tabla 4).
Los compuestos - fueron sometidos al bioensayo de letalidad frente a Artemia salina. En los resultados (tabla 5) se muestra la concentración letal para la mitad de la población de microcrustáceos o concentración letal 50 (CL50). El compuesto pinostrobin, presenta la mayor actividad tóxica frente a los nauplios (CL50 1,8 µg/mL). Esta flavanona ha demostrado tener muy buena actividad cito tóxica frente a células cancerígenas de mama (26) y leucemia (12). Los resultados del bioensayo de toxicidad frente a Artemia salina han evidenciado tener correlación directa con los resultados en ensayos de actividad citotóxica en células cancerígenas. Por ejemplo de la especie Piper gibbilimbum se aislaron 4 alquenilfenoles (gibbilimbol A-D) que presentaron CL50 cercanas a 5,0 µg/mL frente a Artemia salina. En el bioensayo de citotoxicidad frente a células KB (carcinoma de nasofaringe) se obtuvieron DE50 entre 7,8 y 2,1 µg/mL (27). Esta correlación se observa igualmente en los resultados de Artemia salina y la marcada actividad citotóxica de pinostrobina.
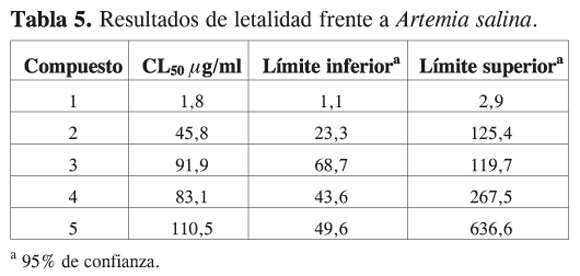
El compuesto , 5-hidroxi- 4’,7-dimetoxiflavanona, que se diferencia de pinostrobina por la presencia de un metoxilo en la posición 4’, posee una actividad moderada frente a Artemia salina (CL50 45,8 µg/mL) y por lo menos 40 veces menor que la de pinostrobina. Este compuesto no posee reportes de citotoxicidad en células cancerígenas. La dihidrochalcona 2’, 4’, 6’-trimetoxidihidrochalcona y los derivados acetilados: 5-acetoxi- 7-metoxiflavanona y 5-acetoxi- 4’,7-dimetoxiflavanona poseen baja actividad tóxica. La acetilación de los compuestos y hace que se disminuya la actividad frente a Artemia salina. Este efecto es más notorio para pinostribina, puesto que su derivado acetilado es 80 veces menos activo. Este resultado implica una importancia en la presencia de hidroxilos para la bioactividad.
AGRADECIMIENTOS
Al grupo de Productos Naturales Vegetales del Departamento de Química de la Universidad Nacional de Colombia (sede Bogotá) y al químico Sebastián Gómez Robles del Laboratorio de RMN por la toma de espectros.
REFERENCIAS BIBLIOGRAFICAS
1. De la Rúa, A. El poder curativo de las hierbas. Bogotá: Círculo de lectores. 1999. p. 145. [ Links ]
2. Mahecha, G. Fundamentos y metodología para la identificación de plantas. Colombia: Proyecto Biopacifico. 1997. p. 165. [ Links ]
3. Clouatre, D. L. Kava kava: examining new reports of toxicity. Toxicology Letters. 2004.150 (1): 85-96. [ Links ]
4. Bolívar, H.; Betancourt, F. Etnobotánica de las comunidades huaorani en el norocidente ecuatoriano. Lyonia. A Journal of ecology and application. 2006.10 (2): 7-17. [ Links ]
5. Piñeres, J. Plantas medicinales (compendio de farmacología vegetal). Bogotá: Escuela de Medicina. Fundación Universitaria Juan N. Corpas. 1991. pp. 202-207. [ Links ]
6. Simposio sobre plantas tóxicas. Especies medicinales utilizadas por las comunidades indígenas embera del Chocó. Herbario Universidad de Antioquia (HUA). 1994. pp. 125-127. [ Links ]
7. Parmar, S.; Jain, C.; Bisht, S.; Jain, R.; Taneja, P.; Jha, A.; Tyagi, O. D.; Prasad, K.; Wengel, J.; Olsen, E.; Boll, M. Phytochemistry of the genus Piper. Phytochemistry. 1997. 46(4): 597-673. [ Links ]
8. Portet, B. Recherche Bioguidee de molecules antipaludiques dune plante guyanaise Piper hostmannianum var. Berbicense. Ph.D. These. Universite Paul Sabatier Tolouse III. 2007. p. 16. [ Links ]
9. Hermoso, A.; Jiménez, A.; Mamani, Z.; Bazzocchi, I.; Piñero, J.; Ravelob, A.; Valladaresa, B. Antileishmanial Activities of Dihydrochalcones from Piper elongatum and Synthetic Related Compounds. Structural Requirements for Activity. Bioorganic and Medicinal Chemistry. 2003. 11: 3975-3980. [ Links ]
10. Portet, B.; Fabre, N.; Roumy, V.; Gornitzka, H.; Bourdy, G.; Chevalley, S.; Sauvain, M.; Valentin, A.; Moulis, C. Activity-guided isolation of antiplasmodial dihydrochalcones and flavanones from Piper hostmannianum var. Berbicense. Phytochemistry. 2007. 68(2): 1312-1320. [ Links ]
11. Daneluttea, A.; Lago, J.; Young, M.; Katoa, M. Antifungal flavanones and prenylated hydroquinones from Piper crassinervium Kunth. Phytochemistry. 2003.64 : 555-559. [ Links ]
12. Smolarza, H.; Mendykb, E.; Bogucka- Kockaa, A.;Kockic, J. Pinostrobin An Anti-Leukemic Flavonoid from Polygonum lapathifolium L. ssp. Z. Naturforsch. 2006.61 : 64-68. [ Links ]
13. Steyermark, J. Flora de Venezuela. Piperaceae. Caracas. Venezuela. Instituto Nacional de Parques. Educación Ambiental. 1990.2 : 440. [ Links ]
14. Trelease, W.; Yuncker, T. The Piperaceae of northem South America. Illinois: University of Illinois Press. 1950. pp. 271-277. [ Links ]
15. Alecio, C.; da Silva, V.; Marx, M. C.; Kato, M.; Furlan, M. Antifungal Amide from leaves of Piper hispidum. Journal Natural Products. 1998. 61: 637-639. [ Links ]
16. Jenett-Siems, K.; Mockenhaupt, F.; Bienzle, U.; Gupta, M.; Eich, E. In vitro antiplasmodial activity of Central American medicinal plants. Tropical Medicine and International Health. 1999.4 : 611-615. [ Links ]
17. Cano, A.; Espinoza, M.; Ramos, C.; Delgado, G. New prenilated flavanones from Esenbeckia berlandieri ssp Acapulsensis. Journal of the Mexican Chemical Society. 2006. 50(2): 71-75. [ Links ]
18. McLaughlin, J.; Rogers, L.; Anderson, J. The use of biological assays to evaluate botanicals. Drug Information Journal. 1998.32 : 513-524. [ Links ]
19. Domínguez, X. Métodos de investigación fitoquímica. México: Limusa. 1979. p. 85. [ Links ]
20. Li Ching, A.; Wah, T.; Aspollah Sukari, M.; Cheng, G.; Rahmanil, M.; Khalid, K. Characterization of flavonoid derivatives from Boesenbergia rotunda (L.). The Malaysian Journal of Analytical Sciences. 2007. 11 (1): 154-159. [ Links ]
21. Kamperdick, C.; Hong Van, N.; Van Sung, T. Constituents from Miliusa balansae (Annonaceae). Phytochemistry. 2002. 61(8): 991-994. [ Links ]
22. Rossi, M.; Yoshida, M.; Maia, J. Neolignans, styrylpyrones and flavonoids from Aniba species. Phytochemistry. 1997. 45 (6): 1263-1269. [ Links ]
23. Gu, J.; Park, E.; Vigo, J.; Graham, J.; Fong, H.; Pezzuto, J.; Kinghorn, A. Activity-Guided Isolation of Constituents of Renealmia nicolaioides with the Potential to Induce the Phase II Enzyme Quinone Reductase. Journal of Natural Products. 2002. 65 (11): 1616-1620. [ Links ]
24. Economides, C.; Adam, K-P. Lipophilic flavonoids from the fern Woodsia scopulina. Phytochemistry. 1998.49 (3): 859-862. [ Links ]
25. Batt, G.; Goodman, R.; Jones, G.; Kerr, S.; Mantegna, R.; McAllister, C.; Newton, C.; Nurnberg, S.; Welch, K.; Covington,M. B. 2 substituted chalcone derivatives as inhibitors of interleukin-1 biosynthesis. Journal of Medicinal Chemistry. 1993.36 1434-1442. [ Links ]
26. Sukardiman, S.; Darwanto, A.; Tanjung, M.; Oka Darmadi, M. Cytotoxic mechanism of flavonoid from Temu Kunci (Kaempferia pandurata) in cell culture of human mammary carcinoma. Clinical Hemoheology and Microcirculation. 2000.23 : 185-190. [ Links ]
27. Orjala, J.; Mian, P.; Rali, T.; Sticher, O. Gibbilimbols A-D, Cytotoxic and Antibacterial Alkenylphenols from Piper gibbilimbum. Journal Natural Products. 1998.61 : 939-941. [ Links ]














