Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804On-line version ISSN 2357-3791
Rev.Colomb.Quim. vol.37 no.3 Bogotá Sept./Dec. 2008
Juan D. Guzmán V., Luis E. Cuca S.1
1 Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia, sede Bogotá, Bogotá, Colombia. lecucas@unal.edu.co
Recibido: 9/05/08 – Aceptado: 7/10/08
RESUMEN
A partir del extracto etanólico de la corteza del árbol colombiano en peligro de extinción Dugandiodendron argyrotrichum (Magnoliaceae) se aisló por cromatografía en columna un aceite compuesto mayoritariamente por sesquiterpenos, así como dos sesquiterpenoides, torreyol y partenólido, y el alcaloide aporfínico N-acetilanonaina. Los compuestos se identificaron por cromatografía de gases acoplada a espectrometría de masas CG-MS y resonancia magnética nuclear (RMN) de 1H y 13C. Los sustancias aisladas se sometieron al ensayo de letalidad en Artemia salina.Aquellos que resultaron más tóxicos fueron el aceite de sesquiterpenos (CL50 = 4,49 mg/ml) y los lignanos dibencilbutánicos (1) (CL50.~ 50 mg/ml).
Palabras Clave: sesquiterpenos, lignanos, alcaloides, citotoxicidad.
ABSTRACT
From the ethanolic extract of the bark of the colombian endangered tree Dugan- diodendron argyrotrichum (Magnoliaceae) was isolated an oil in which major compounds were sesquiterpenes. Two sesquiterpenoids torreyol and parthenolide and the aporphine alkaloid N-acetylanonaine were isolated by column chromatography (CG-EM) and characterized by 1H and 13C nuclear magnetic resonance (NMR) spectroscopy. The isolated substances were subjected to brine shrimp lethality bioassay. The most toxic compounds were sesquiterpene oil (LC50 = 4,49 mg/ml) and dibenzylbutane lignans (1) (LC50 ~ 50 mg/ml).
Key Words: sesquiterpenes, lignans, alkaloids, citotoxicity.
RESUMO
A partir do extracto etanólico da casca da árvore colômbiano em perigo de extinção Dugandiodendron argyrotrichum (Magnoliaceae) isolou-se um óleo composte maioritariamente por sesquiterpenos. Duos sesquiterpenoides, torreyol e partenólido e o alcalóide N-acetilanonaina se isolaram por cromatografía de coluna e foram caracterizados por meio de espectroscopía de resonância magnêtica nuclear (RMN) 1H e 13C. Os compostos foram evaluados en el bioensaio letalidade do Artemia salina. Os compostos que resultaron mais tóxicos foram o oléo de sesquiterpenos (CL50=4,49 mg/ml) e os lignanos dibencilbutanicos (CL50 ~ 50 mg/ml).
Palavras-Chave: sesquiterpenos, lignanos, alcalóides, citotoxicidad.
INTRODUCCION
Desde 1983, se llamó la atención hacia la urgente necesidad “para la toma de medidas efectivas que detengan la acelerada destrucción de los recursos naturales antes de su pérdida irreversible” (2). En efecto, el panorama, para algunas especies maderables de reconocida distribución en el pasado, como el Arenillo caobo (Ocotea caparrapi), el Palo de rosa (Ani- ba roseadora), elMolinillo (Talauma gil- bertoi), el Canelo de los Andaquíes (Oco- tea quixos), el Cedro (Cedrela odorata) o el Amarillo (Nectandra sp.), es desolador (3). El aprovechamiento insostenible de los recursos maderables ha degradado y fragmentado los bosques nativos a tal punto que la extinción de ciertas especies es una amenaza real. Hoy en día, aunque ubicados en el lugar donde son endémicas, encontrar individuos de algunas especies puede ser difícil.
El uso principal de las especies de la familia Magnoliaceae es maderable. La madera de las magnoliáceas es generalmente blanda, de textura fina, generalmente granulada, fácil de trabajar, y por tanto apropiada para enchapes y trabajo general de carpintería (2). En Tumaco y Barbacoas (Nariño) son muy apreciadas para la fabricación de muebles especies conocidas como Cucharillo (Dugandio- dendron calophyllum, Dugandiodendron striatifolium, Taluma narinensis), y en las zonas aledañas al río Cauca, el Molinillo (Talauma hernandezii, Talauma gil- bertoi) (2). En cuanto al fitónimo “Alma negra” (Dugandiodendron sp.), este se refiere al veteado de color negro que presenta el centro del tronco de estas especies, apreciadas por su belleza (2).
Gustavo Lozano Contreras estudió las plantas colombianas de la familia Magnoliaceae durante más de dos décadas e identificó los géneros Talauma y Dugan- diodendron (2, 4). El género Dugandio- dendron posee una distribución restringida, y la mayoría de especies son endémicas de Colombia (4). Su clasificación taxonómica ha sido controversial (5, 6). Recientemente, Nooteboom y Figlar (7) incluyen a las especies de género Ta- lauma y Dugandiodendron como subsecciones de la sección Talauma, incluida dentro del género Magnolia. En este trabajo se utiliza la clasificación original propuesta por el taxónomo colombiano G. Lozano Contreras (2, 4).
A diferencia de Magnolia, las especies americanas Talauma y Dugandiodendron poseen carpelos dehiscentes circuncísiles. Talauma posee una cicatriz en el pecíolo, y Dugandiodendron (como Mag- nolia) no la posee (2). Los últimos reportes describen 33 especies nativas (Talauma y Dugandiodendron) de la familia Magnoliaceae en el territorio colombiano, de las cuales 29 son endémicas (8, 9). Todas las especies poseen algún grado de amenaza (8, 9). Once especies se encuentran en peligro crítico (CR): Dugandiodendron calimaensis y D. cara- rensis y Talauma chimatensis, T. cespe- desii, T. espinalii, T. katiorum, T. polyhypsophylla, T. narinensis, T. viroli- nensis, y T. wolfii y una especie aparentemente no nombrada (8, 9). En peligro (EN) se encuentran 19 especies: Dugan- diodendron argyrotrichum, D. ca- lophylla, D. colombianum, D. guatapen- sis, D. lenticellata, D. magnifolia, D. mahechae, D. urraoense y D. striatifolia y Talauma arcabucoana, T. caricifra- grans, T. chocoensis, T. georgii, T. gil- bertoi, T. henaoii, T. hernandezii, T. san- tanderiana, T. silvioi y T. yarumalensis (8, 9). Vulnerable (VU) es la especie Ta- lauma neilli y la especie de la zona fronteriza con Panamá, Talauma sambuensis, se registra dentro de la categoría de amenaza cercana (NT) (8, 9).
La familia Magnoliaceae se caracteriza por poseer alcaloides, lignanos y neolignanos y sesquiterpenoides. Se han reportado alcaloides aporfínicos y oxoaporfínicos en Magnolia obovata (10) y en Talauma gitingensis (11). También se han descrito bencilisoquinolinas y bis-bencilisoquinolinas (12). Los neolignanos de tipo bifenilo, honokiol y magnolol, aislados de la corteza de Magnolia of- ficinalis, son importantes por su marcada actividad biológica (13). Se han reportado, en especies de género Magnolia, lignanos ciclobutánicos, furánicos, furofuránicos, arilnaftalénicos y neolignanos benzofuránicos, 1,2-diarilpropánicos y de tipo de la espirociclohexadienona, así como neolignanos híbridos con unidades terpénicas y oligómeros de neolignano (14). De la corteza de la especie americana Talauma ovata se han aislado lignanos dibencilbutánicos y algunos derivados oxigenados (14). Los terpenos aislados de la familia Magnoliaceae son en su mayoría sesquiterpenoides. Se han reportado sesquiterpenoides acíclicos, como las kobusiminas A y B de Magnolia kobus (15), sesquiterpenoides cíclicos como ciclocolorenona de Magnolia grandiflora (16) y sesquiterpenlactonas, siendo el costunólido y el partenólido ampliamente distibuidos en la familia (17, 18).
De las especies colombianas Talauma hernadezii y Dugandiodendron yaruma- lense se ha reportado la actividad antioxidante de los extractos diclorometánicos (19). Las fracciones más polares de la última de ellas poseen la mayor actividad.
Este es el segundo reporte del aislamiento y caracterización de metabolitos secundarios de una magnoliácea colombiana (1). Se incluye la evaluación de citotoxicidad contra Artemia salina.
MATERIALES Y METODOS
General
Los puntos de fusión se determinaron en un fusiómetro Fischer-Johns. Los espectros infrarrojo IR fueron registrados en el equipo Perkin Elmer FTIR Panagon 500 serie 1000 en pastilla de KBr. Los espectros de resonancia magnética nuclear RMN 1H, 13C, experimentos DEPT y bidimensionales COSY, HMQC y HMBC, fueron registrados en el equipo Bruker Avance 400, a 400 MHz para 1H y a 100 MHz para 13C, utilizando cloroformo deuterado (CDCl3) como disolvente y estándar interno. Para la cromatografía de gases acoplada a la espectrometría de masas se usó el equipo Shimadzu GCMS-QP2010. Se empleó la columna WCOT Restek RTX-5Sil Ms (5% difenil 95% dimetilpolisiloxano) 30 m x 0,25 mm x 0,50 mm. La fase móvil fue helio, y el disolvente usado cloroformo. El flujo de la fase móvil se mantuvo a 1 ml/min. El split ratio fue de 100:1. Para la cromatografía en columna (CC) se empleó sílica gel 60 (Merck) y alúmina neutra (Riedel- de-Haën). En la cromatografía en capa fina (CCF) se utilizó sílica gel 60 GF254, 0,3 mm de espesor (Merck), alúmina neutra (Merck) y se usó luz UV de l 254, 365 nm y vapores de yodo como reveladores.
Material Vegetal
El material vegetal de la especie Dugan- diodendron argyrotrichum Lozano fue colectado en el municipio de Arcabuco (Boyacá), cerca de la reserva Rogitama, por Juan David Guzmán en febrero de 2007. La muestra fue identificada y clasificada con el número de colección COL-510518 por el botánico Adolfo Jara Muñoz del Instituto de Ciencias Naturales de la Universidad Nacional de Colombia (sede Bogotá).
Extracción y aislamiento
Por percolación con EtOH al 96%, a partir de 1974,8 g de corteza seca y molida, se obtuvieron 304,8 g de extracto etanólico. Usando 200 g de extracto, se realizó un fraccionamiento por reparto con agua y extracción exhaustiva con disolventes de polaridad creciente. Se obtuvieron extractos bencénico (25,0 g), acetato de isopropilo (5,70 g), clorofórmico (1,00 g) y butanólico (95 g). También se obtuvo un extracto alcaloidal (1,07 g) por extracción ácido base a partir de 54,5 g de extracto etanólico. El extracto bencénico se sometió a cromatografía en columna (CC) en sílica gel (420 g) en una columna de 6,1 cm de diámetro y 86 cm de largo. La elución se realizó con tolueno inicialmente, y luego se aumentó paulatinamente la polaridad usando mezclas de tolueno- AcOiPr (9:1 v/v), (8:2), (7:3), (6:4) y (1:1). Se colectaron 76 fracciones de 50 ml que fueron reunidas en 19 fracciones finales de acuerdo con su perfil en CCF. La fracción 1, menos polar, se sometió a CC en Al2O3 neutra y elución con una mezcla de n-hexano/tolueno (3:1 v/v) para obtener un aceite transparente (1,163 g) con olor frutal característico que se denominó aceite . A partir de la fracción 6 del extracto bencénico, se purificaron los compuestos (25 - 26) y (25 - 26). Una fracción obtenida de la CC de la fracción 6 se sometió a CC en sílica gel y elución con n-hexano-acetona (8:2 v/v) para purificar un sólido blanco (18,1 mg) que cristaliza en agujas con p.f. 128-130 ºC, denominado compuesto (25 - 26). De la fracción 9 se aislaron los compuestos (25 - 26) y (25 - 26) (1). A partir de la fracción 13 de la primera columna de fraccionamiento, se realizó una CC en sílica gel y elución con CH2Cl2-acetona (25:1 v/v). Una subfracción se purificó por CC en sílica gel y elución con CH2Cl2-acetona (50:1 v/v), obteniendo algunos cristales que fueron finalmente purificados por CC en Sephadex LH-20 y elución con metanol para obtener cristales transparentes en forma de agujas (14,3 mg) de p.f. 226-228 ºC, que corresponde al compuesto (25 - 26). A partir de 15 g de extracto etanólico y por CC en sílica gel y elución con CH2Cl2 en primera instancia y luego con CH2Cl2-acetona (99:1 v/v) se purificó un sólido blanco (22,8 mg) con p.f. 108-110 ºC, denominado compuesto (25 - 26).
Ensayo de letalidad con Artemia Salina
El ensayo de letalidad en A. salina se realizó de acuerdo con el protocolo de McLaughlin (20). Los huevos de A. sali- na se incubaron durante 24 horas a una temperatura de 28 ºC en un medio de cultivo oxigenado artificialmente y salino (38 g/l de salmarina en agua). Los extractos se solubilizaron inicialmente en DMSO (500 μl) y se prepararon soluciones a concentraciones de 1000, 500, 250, 100 y 10 μg/ml usando medio de cultivo. Las concentraciones empleadas para evaluar los compuestos fueron 100, 50, 10 y 1 μg/ml. Se realizó un control negativo empleandoDMSOa la concentración máxima 2% en medio de cultivo. El ensayo se realizó por triplicado empleando 10 nauplios por pozo. Al cabo de 24 horas se hicieron las lecturas anotando el número de sobrevivientes en cada pozo. Los datos obtenidos fueron procesados con el programa estadístico EPA Probit Analysis Program con el fin de determinar la concentración letal 50 (CL50) con un intervalo de confianza de 95%.
RESULTADOS Y DISCUSION
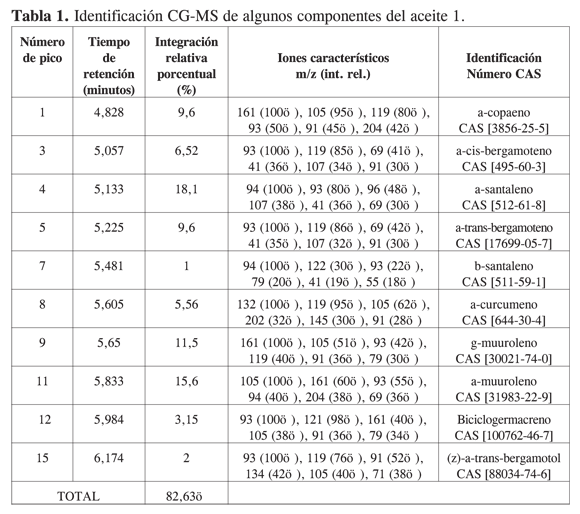
Por métodos cromatográficos se obtuvo el aceite , que corresponde a la fracción menos polar del extracto bencénico, dada su elución con el frente de disolvente n-hexano-tolueno (3:1) en Al2O3. La caracterización se realizó por CG-MS (21). El cromatograma TIC (Total Ion Cu- rrent) presentó la separación de 19 componentes. Se obtuvieron los espectros de masas por impacto electrónico (70 eV) para cada componente. Por medio de una comparación con los espectros de la biblioteca Wiley7N2 y teniendo en cuenta el orden de elución, según los índices de Kovats reportados para la columna DB-5 (22, 23), fue posible identificar 10 compuestos (82,63% del aceite) (Tabla 1). El 87,3% del aceite corresponde a hidrocarburos sesquiterpénicos, y el resto, 12,6%, a sesquiterpenoides mono y poli-oxigenados. Los compuestos más abundantes son el a-santaleno (18,1%) (Figura 1), a-muuroleno (15,6%) y g-muuroleno (11,5%). Los sesquiterpenos obtenidos presentan una estructura particular con sustitución C-prenilo unida a un biciclo (bergamotenos) o a triciclo (a-santaleno, Figura 1).
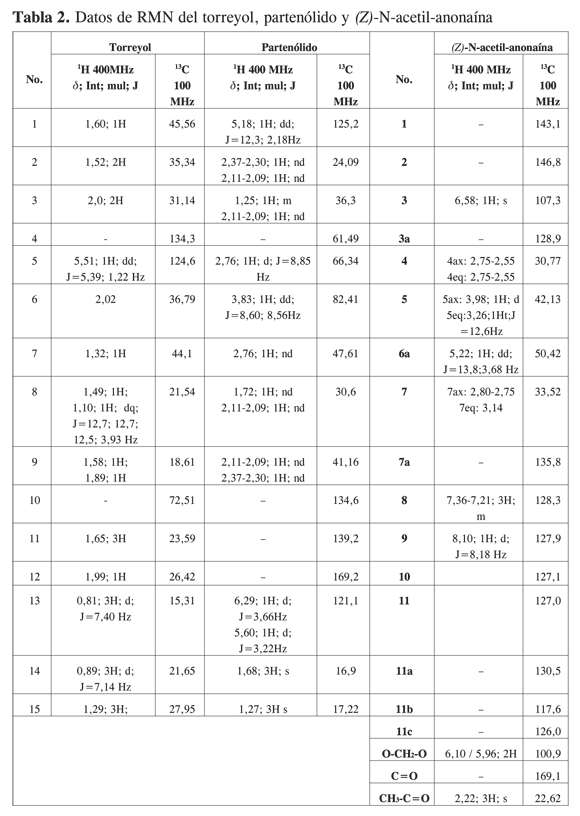
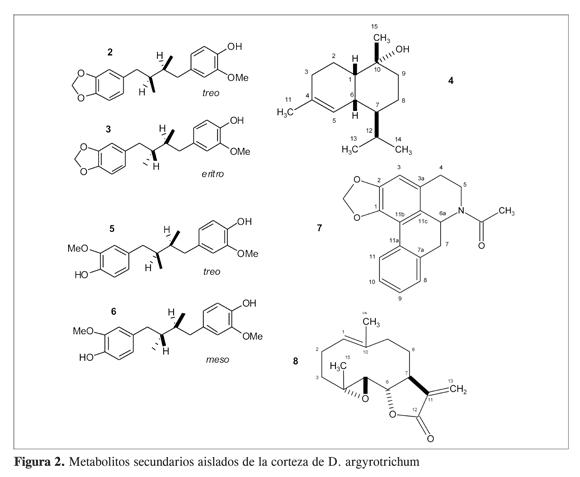
Se purificó una mezcla de isómeros treo (25 - 26) y eritro (25 - 26) de austrobailignano-6 (1). El alcohol sesquiterpénico, torreyol (25 - 26), se purificó por cromatografía en columna y se estableció su estructura por medio de la espectroscopía de RMN 1H, 13C, experimentos DEPT y bidimensionales COSY, HMBC, HMQC. Las señales experimentales coinciden con las señales reportadas en la literatura (24). Se purificó una mezcla de isómeros treo (25 - 26) y meso (25 - 26) del ácido dihidroguaiarético (1). El alcaloide aporfínico (Z)-N-acetil-anonaína (25 - 26) también se obtuvo por métodos cromatográficos a partir del extracto bencénico. La elucidación estructural se realizó por medio de la RMN 1H y 13C. Los datos experimentales coinciden con las señales reportadas para los isómero (E) y (Z), que se encuentran en equilibrio conformacional en solución (10). A partir del extracto etanólico y por medio de técnicas cromatográficas se obtuvo la lactona sesquiterpénica, partenólido (25 - 26). Se estableció su estructura por comparación de las señales de RMN 1H y 13C experimentales con las reportadas en la literatura (25, 26). Los datos de RMN experimentales de los compuestos (25 - 26), (25 - 26) y (25 - 26) se resumen en la Tabla 2. En la Figura 2 se presentan las estructuras químicas de las sustancias (25 - 26), (25 - 26), (25 - 26), (25 - 26), (25 - 26), (25 - 26), y (25 - 26). El extracto etanólico posee una concentración letal 50 (CL50) de 167,7 mg/ml (Tabla 3). En general, valores inferiores a 100 ìg/ml son considerados promisorios en la búsqueda de sustancias citotóxicas (27). Este resultado indica la existencia de compuestos tóxicos, y hace suponer la presencia de metabolitos inactivos y abundantes. Al realizar el fraccionamiento del extracto etanólico fue posible observar, efectivamente, la presencia de compuestos tóxicos que se disolvieron en la fase bencénica (CL50 = 72,62 mg/ml). La fracción enriquecida en alcaloides (CL50 = 327 mg/ml) y la fracción en acetato de isopropilo (CL50=316 mg/ml) resultaron moderamente activas. El extracto clorofórmico fue poco activo (CL50 = 513 mg/ml). El extracto butanólico fue inactivo a la mayor concentración (CL50 >1000 mg/ml). No se evaluó la letalidad del residuo acuoso.
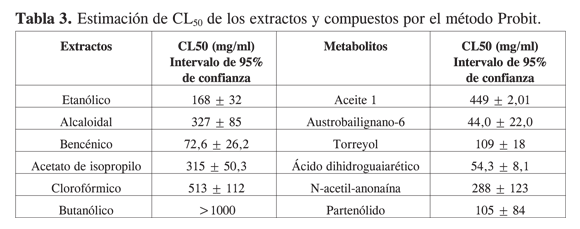
Se estimó la letalidad del aceite y de los compuestos en Artemia salina. Los resultados se presentan en la Tabla 3. El aceite , compuesto principalmente por sesquiterpenos, mostró ser la fracción más potente frente a Artemia salina (CL50 = 4,50 mg/ml). La mezcla de los isómeros treo (25 - 26) y eritro (25 - 26) de austrobailignano- 6 mostró una letalidad alta (CL50 = 44,0 mg/ml). El compuesto (25 - 26) presentó una letalidad moderada (CL50 = 109 mg/ml). La mezcla de los isómeros treo (25 - 26) y meso (25 - 26) de austrobailignano- 6 mostró una alta letalidad (CL50 = 54,4 mg/ml). El alcaloide aporfínico N-acetilado, N-acetilanonaina (25 - 26), presentó una baja letalidad (CL50 = 288 mg/ml). El compuesto (25 - 26), la lactona sesquiterpénica partenólido, mostró una letalidad moderada (CL50 = 105 mg/ml).
La colchicina fue el primer antimitótico descubierto que actúa inhibiendo la polimerización de la tubulina (28). Es una molécula que ha sido considerada promisoria como medicamento anticancerígeno, a pesar de su alta toxicidad (28). La CL50 de la colchicina en Artemia salina es de 25 mg/ml (29). El aceite compuesto principalmente por santalenos, bergamotenos y muurolenos es alrededor de cinco veces más activo que la colchicina frente a Artemia salina. Se ha reportado la actividad antitumoral de sesquiterpenoides de tipo santalano (30); sin embargo, no se poseen reportes de la actividad citotóxica de los sesquiterpenos mayoritarios a-santaleno, a-muuroleno y g-muuroleno. Los lignanos de tipo dibencilbutano presentan una letalidad considerable frente a Arte- mia salina (CL50~50 mg/ml). Poseen la mitad de la potencia de la colchicina. Estos metabolitos presentan una tendencia de toxicidad que indica la existencia de un mecanismo de acción particular. Puede ser interesante explorar la manera como actúan estos lignanos dibencilbutánicos. Los sesquiterpenoides, el alcohol torreyol y la lactona partenólido presentan una letalidad moderada frente a Arte- mia salina (CL50~110 mg/ml). Cabe señalar que, aunque el partenólido es muy activo frente a Leishmania amazonesis (26) y Mycobacterium tuberculosis (31), presenta una actividad moderada frente al microcrustáceo. Hay que precisar que el partenólido no ha presentado toxicidad en mácrofagos de murino (26), lo que indica que posiblemente exista una correlación positiva entre citotoxicidad en macrófagos y letalidad en Artemia salina. El alcaloide aporfínico N-acetilanonaina presentó una baja letalidad (CL50~290 mg/ml) a pesar de su actividad ictiotóxica reportada frente al pez Pimephales promelas (32).
AGRADECIMIENTOS
Agradecemos a los profesores José Hipólito Isaza Martínez y Wilman Antonio Delgado Ávila por su colaboración en el análisis CG-EM y en los bioensayos. Igualmente a Fernando Echeverri, investigador principal del proyecto Búsqueda de moléculas antituberculosas de la flora colombiana (Colciencias 1115-12- 17822) que financió esta investigación.
REFERENCIAS BIBLIOGRAFICAS
1. Guzmán, J. D.; Cuca, L. E.; Isaza, J. H. Fragmentación diastereoespecífica en NCI de dos lignanos dibencilbutánicos de la corteza de Dugan diodendron argyrotrichum (Magnoliaceae). Revista Productos Natura- les. 2008. (1): 6-12. [ Links ]
2. Lozano C., G. Flora de Colombia 1. Magnoliaceae. Bogotá: Instituto de Ciencias Naturales, Universidad Nacional de Colombia. 1983. pp. 3-104. [ Links ]
3. Cárdenas, D.; Salinas, N. R. editores. Libro rojo de las plantas de Colombia. Especies maderables amenazadas Volumen 4. Bogotá: Instituto Humboldt. 2007. pp.11-232. [ Links ]
4. Lozano C., G. Dugandiodendron y Talauma (Magnoliaceae) en el Neotrópico. Bogotá: Academia Colombiana de Ciencias Exactas, Físicas y Naturales, Colección Jorge Álvarez Lleras. 1994. No. 3. [ Links ]
5. Nooteboom, H. P. Dugandioden- dron (Magnoliaceae) erroneously described. Taxon. 1984. (4): 696-698. [ Links ]
6. Lozano C., G. Consideraciones sobre el género Dugandiodendron (Magnoliaceae). Taxon. 1984. (4): 691-696. [ Links ]
7. Nooteboom,H. P.; Figlar, R. B.Notes of Magnoliaceae IV. Blumea. 2004. : 87-100. [ Links ]
8. Cicuzza, D.; Newton, A.; Oldfield, S. Red list of Magnoliaceae. Fauna and Flora International. UK. 2007. pp. 17-52. [ Links ]
9. Calderón, E.; Cogollo, A.; Velásquez Rúa, C.; Serna González, M.; García, N. Las magnoliáceas. Nestor García Editor. Libros rojos de plantas de Colombia. Volumen 5. Bogotá. 2007. pp.45-154. [ Links ]
10. Pyo, M. K.; Yun-Choi, H. S.; Hong, Y. J. Antiplatelet activities of aporphine alkaloids isolated from leaves of Magnolia obovata. Planta med. 2003. : 267-269. [ Links ]
11. Nonato, M. G.; Garson, M. J.; Truscott, R. J. W.; Carver, J. A. 1H-NMR assignments of anonaine and xylopine derivatives from Talau- ma gitingensis. J. Nat. Prod. 1990. (6): 1623-1627. [ Links ]
12. Shamma, M.; Slusarchyk, W. A. The aporphine alkaloids. Chemical Reviews. 1964. : 59-79. [ Links ]
13. Song, Q.; Fischer, N. H.; Biologically active lignans and neolignans from Magnolia species. Rev. Soc. Quim. Mex. 1999. (6): 211-218. [ Links ]
14. Stefanello,M. A. A.;Alvarenga,M. A.; Toma, I. N. New neolignans from Talauma ovata. Fitoterapia. 2002. : 135-139. [ Links ]
15. Iida, T.; Nakano, M.; Ito, K. Hydroxyperoxysesquiterpene and lignans constituents of Magnolia ko- bus. Phytochemistry. 1982. (3): 673-675. [ Links ]
16. Jacyno, J.M.;Montemurro, N.; Bates, A. D.; Cutler, H. G. Phytotoxic and antimicrobial properties of cyclocolorenone from Magnolia grandiflora L. J. Agric. Food. Chem. 1991. : 1166-1168. [ Links ]
17. Jacobsson, U.; Kumar, V.; Saminathan, S. Sesquiterpene lactones from Michelia champaca. Phytoche- mistry. 1995. (4): 839-843. [ Links ]
18. Song, Q.; Gómez Barrios, M.; Fronczec, F. R.; Vargas, D.; Thien, L. B.; Fischer, N. H. Sesquiterpenes from southern Magnolia virginiana. Phytochemistry. 1998. (2): 221-226. [ Links ]
19. Puertas, M. A.; Mesa, A. M.; Sáez J. A. In vitro radical scavenging activity of two columbian Magnoliaceae. Naturwissenschaften. 2005. : 381-384. [ Links ]
20. McLaughlin, J.; Rogers, L.; Anderson, J. The use of biological assays to evaluate botanicals. Drug Inf. J. 1998. : 513-524. [ Links ]
21. Guzmán, J. D. Estudio fitoquímico y búsqueda de compuestos de interés terapeútico de Dugandiodendron argyrotrichum (Magnoliaceae). MSc Thesis, Universidad Nacional de Colombia, Bogotá, 2008. [ Links ]
22. Adams, R. P. Identification of essential oil components by gas-chromatography/ mass spectrometry. Chicago: Allured Publishing Corporation. 1995. [ Links ]
23. Joulain, D.; König,W. A. The Atlas of spectral data of sesquiterpene hydrocarbons. Hamburg, Germany: E.B.-Verlag. 1998. [ Links ]
24. Egli, V. S.; Gfeller, H.; Bigler, P.; Schlunegger, U. P. Isolierung und identifikation des sesquiterpenalkohols torreyol aus reinkulturen des ektomykorrhizapilzes Cortinarius odorifer Britz. Eur. J. For. Path. 1988. (6): 351-356. [ Links ]
25. Tiuman, T. S.; Ueda N., T.; García, D. A.; Dias, B. P.; Morgado D., J. A.; Souza, W.; Nakamura, C. S. Antileishmanial activity of parthenolide, a sesquiterpene lactona isolated from Tanacetum parthenium. Anti- microbial Agents and Chemothe- rapy. 2005. (1):176-182. [ Links ]
26. Ruangrungsi, N.; Rivepiboom, A.; Lange, G. L.; Lee, M.; Decicco, C. P.; Picha, P.; Preechanukool, K. Constituents from Paramichelia bai- lloni: a new antitumor germacranolide alkaloid. J. Nat. Prod. 1987. (5): 891-896. [ Links ]
27. Pisutthanan, S.; Plianbangchang, P.; Pisutthanan, N.; Ruanray, S.; Muanrit, O. Brine shrimp lethality activity of Thai medicinal plants in the family Meliaceae. Naresuan Uni- versity Journal. 2004. (2): 13-18. [ Links ]
28. Baudoin, O.; Guéritte, F. Natural bridged biaryls with axial chirality and antimitotic properties. Studies in Natural Products Chemistry. 2003. : 355-417. [ Links ]
29. Déciga, M.; Rivero, I.; Arriaga, M.; Castañeda, G.; Ángeles G.; Navarrete, A.; Mata, R. Acute toxicity and mutagenic activity of mexican plants used in traditional medicine. J. of ethnopharmacology. 2007. : 334-342. [ Links ]
30. Kim, T. H.; Ito, N.; Hatano, T.; Takayasu, J.; Tokuda, H.; Nishino, H.; Machiguchi, T.; Yoshida, T. New antitumor sesquiterpenoidsfrom Santalum albun of indian origin. Tetrahedron. 2006. : 6981-6989. [ Links ]
31. Franzblau, S. G.; Lu, T.; Cantrell, C. L.; Castañeda, J.; Quijano, L.; Fischer, N. H. Antimycobacterial evaluation of germacranolides in ho- nour of professor G. H. Neil Towers 75th birthday. Phytochemistry. 1998. (2): 559-564. [ Links ]
32. Rao,K.V.;Davies, R. The ichtyoto- xic principles of Zanthoxylum cla- va-herculis. J. Nat. Prod. 1986. (2):340-342. 28 [ Links ]














