Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804On-line version ISSN 2357-3791
Rev.Colomb.Quim. vol.37 no.3 Bogotá Sept./Dec. 2008
Ivonne J. Nieto1 , Iris M. Ávila C.1
1 Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia, sede Bogotá, Bogotá, Colombia. imavilac@unal.edu.co
Recibido: 28/08/08 – Aceptado: 17/12/08
RESUMEN
Del cuerpo fructífero de Suillus luteus se extrajeron e identificaron, con base en el análisis de sus espectros de masas, dieciséis compuestos, los cuales corresponden al ácido palmítico, oléico, linolénico y linoléico, octadecanoato de etilo, ergosta- 7,22-dien- 3b-ol, ergosta-7-en-3b-ol, estigmasterol, ergosta-3,5,7,9(11),22-pentaeno, ergosta-2,5,7,9(11),14,22-hexaeno, 23-metil-estigmast-3,5,7,22-tetraeno, 23-metil-estigmast-3,5,7,9(11),22-pentaeno, ergosta-4,6,15(16),22-tetraen-3- ona, ergosta-1,5,7,9(11),22-pentaen-3- ona, ergosta-5,7,9(11),22-tetraen-3b-ol y ergosta-5,6,7-trihidroxi-7,22-dien-3b-ol. Dado que este hongo ha sido tan poco estudiado, todos los compuestos, a excepción de los ácidos grasos, se reportan aquí por primera vez.
Palabras Clave: esteroles, ácidos grasos, hongo comestible, Suillus luteus.
ABSTRACT
From the fruiting body of Suillus luteus were extracted and identified sixteen compounds, which were identified by mass spectre analysis; these were: palmitic, oleic, linolenic and linoleic acids, ethyl octadecanoate, ergosta-7,22-dien-3b-ol, ergosta- 7-en-3b-ol, stigmasterol, ergosta- 3,5,7,9(11),22-pentaene, ergosta- 2,5,7, 9(11),14,22-hexaene, 23-methyl-stigmast- 3,5,7,22-tetraene, 23-methyl-stigmast- 3,5,7,9(11),22-pentaene, ergosta-4, 6,15(16),22-tetraen-3-one, ergosta-1,5, 7,9(11),22-pentaen-3-one, ergosta-5,7, 9(11),22-tetraen-3b-ol and ergosta-5,6, 7-trihydroxy-7,22-dien-3b-ol. Because this mushroom has been scarcely studied, all compounds, with the exception of the fatty acids, are reported here for the first time.
Key words: sterols, fatty acids, edible mushroom, Suillus luteus.
RESUMO
Do corpo frutífero de Suillus luteus foram extraídos e identificados, combase na análise dos seus espectros de massas, dezasseis compostos, os quais correspondem ao ácido palmítico, oleico, linolénico y linoléico, octadecanoato de etilo, ergosta- 7,22-dien-3b-ol, ergosta-7-en-3b-ol, estigmasterol, ergosta-3,5,7,9(11),22-pentaeno, ergosta-2,5,7,9(11),14,22-hexaeno, 23-metil-estigmast-3,5,7,22-tetraeno, 23-metil-estigmast-3,5,7,9(11),22-pentaeno, ergosta-4,6,15(16),22-tetraen-3- ona, ergosta-1,5,7,9(11),22-pentaen-3- ona, ergosta-5,7,9 (11),22-tetraen- 3b-ol e ergosta- 5,6,7-trihidroxi-7,22- dien-3b-ol. Sendo este um fungo muito pouco estudado, todos os compostos, à excepção dos ácidos gordos, são reportados aqui pela primeira vez.
Palavras-chave: esteróis, ácidos gordos, fungo comestível, Suillus luteus.
INTRODUCCION
Los hongos han tenido un papel muy importante a través de la historia de la humanidad, pues han formado parte de la alimentación de muchas culturas debido a su agradable sabor y su alto valor nutricional, ya que presentan los aminoácidos esenciales lisina y leucina, bajo contenido de grasas y alto contenido de ácidos grasos poliinsaturados, vitaminas (tiamina, riboflavina, niacina, ácido ascórbico), minerales y proteínas. De igual manera, contienen dentro de sus metabolitos secundarios compuestos con acción antitumoral, inmunomoduladora, hipocolesterolémica, antiviral, antibiótica, entre otras, lo que los convierte en verdaderos alimentos funcionales (1-4).
Con respecto al hongo Suillus luteus, los estudios químicos son bastante limitados y sólo se han encontrado reportes sobre el contenido de ácidos grasos (5, 6). En el presente artículo se exponen los resultados obtenidos del estudio químico de los metabolitos secundarios, ácidos grasos y compuestos triterpenoidales, contenidos en el extracto en metil etil cetona (MEK) de dicho hongo, del cual fueron identificados cuatro ácidos grasos, un éster, siete esteroles, dos triterpenos y dos cetoesteroides.
MATERIALES Y METODOS
La recolección del material fúngico se realizó en el parque natural represa del Neusa (Colombia), zona de alta pluviosidad, con una temperatura promedio de 16,5 °C y una altura de 2978 msnm. Fue identificado por el ingeniero agrónomo Luis Guillermo Henao de la Fundación Inguedé.
Una muestra de 70,18 g del hongo molido y seco fue sometida a maceración con MEK con remoción diaria de solvente, por un periodo de ocho días. El extracto obtenido fue filtrado, concentrado al vacío y saponificado con KOH en EtOH, a 80 °C, por espacio de cuatro horas, según el procedimiento descrito por Cunha, et ál. (7). Después de saponificar se neutralizó con HCl 5% hasta pH neutro, se extrajo con éter etílico, y se concentró la fase orgánica en rotavapor. El nuevo extracto ( ) se sometió a partición con AcOEt:Agua 1:1, obteniéndose 2,76 g de un producto de color café oscuro y consistencia de jarabe, el cual se separó y purificó por cromatografía de columna (CC) en sílica gel, empleando una relación muestra:sílica 1:15 y CH2Cl2:MEK como eluyente, desde 0% hasta 90% de MEK, obteniéndose tres fracciones denominadas , y .
Seguidamente se lavó la columna con MeOH para retirar el remanente de para su posterior separación y purificación en CC, con una relación extracto:silica 1:20, y eluyendo con AcOEt:MeOH desde 0% hasta 70% de MeOH, obteniéndose dos fracciones, y , las cuales fueron repurificadas por CCDP en fase normal y fase reversa empleando cromatofolios de sílica gel 60 F254 MERCK y ALUGRAM® nano Sil NH2/ UV254, y como fases móviles: AcOEt:MeOH 8: 2 y: AcOEt: MeOH 9: 1, respectivamente.
Todos los compuestos obtenidos se caracterizaron por CG-EM en un cromatógrafo de gasesHewlett Packard 6890, con las siguientes condiciones cromatográficas: columna capilar HP 5 de 30mde longitud, 0,33mmde d.i y 25 mmde espesor, helio 4,5 como gas de arrastre con velocidad de flujo de 1,2 mL/min, detector FID, temperatura del inyector 280 °C, inyección modo Split 1:5. La temperatura inicial fue de 200 °C y se mantuvo por 1 minuto; posteriormente se aumentó hasta 300 °C a 4 °C/min.
RESULTADOS Y DISCUSION
Fraccion A
Está constituida por cuatro ácidos grasos y un éster, que fueron identificados con base en su patrón de fragmentación destacándose los picos correspondientes a [M-agua]+, [M-OH]+, [M-CO2H]+ y los iones en m/z 60 para los primeros y 88 para los últimos, correspondientes al rearreglo de McLafferty, así como las pérdidas sucesivas de 14 unidades de masa, debidas a la fragmentación de la cadena hidrocarbonada. En la Tabla 1 se presentan los constituyentes de esta fracción.

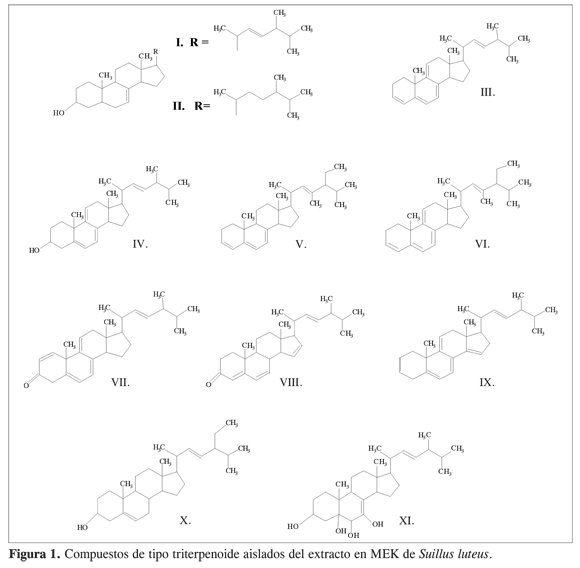
Fracción B
Esta fracción está constituida por cuatro compuestos – , que en el cromatograma de gases aparecen en la región de los triterpenoides más simples.
Compuestos I y II
Presentan en el EM 70 eV (in. Rel) un [M]+ de 398 (28) y 400 (73) uma, que se ajustan a las fórmulas moleculares C28H46O y C28H48O, respectivamente, y un patrón de fragmentación típico de esteroles con núcleos D7-3-hidroxiandrosteno con picos a m/z 383 [M-CH3]+ (13), 380[M-H2O]+ (18), 365 [M-CH3-H2O]+, 300 [M-C3H7]+, con transferencia alílica de H de esteroles insaturados en C22, 255 [M-cadena lateral –H2O]+ (7), 229 [fisión del anillo D – cadena lateral–H]+ (27) y 145 [M-H2O-fisión C-CH3]+ (33) para , y los iones con m/z 385 [M-15]+ (28), 273 [M -CL]+ (47), 255 [M-cadena lateral- H2O]+ (100), 246 [fisión del anillo D]+ (17), 231 [fisión D– CH3]+ (32), 213 [fisión D-H2O]+ (36), y 145 [fisión C-CH3]+ (28) para . Con base en lo anterior y lo reportado en literatura, se identificaron como ergosta-7,22-dien-3b-ol y ergosta-7-en-3b-ol (7-9).
Compuestos III y IV Sus EM presentan el pico de ion molecular en 376 (57) y 394 (16) u.m.a, concordantes con las fórmulas moleculares C28H40O y C28H42O, así como los iones con m/z 251 [M-cadena lateral]+ (100), 236 [M-cadena lateral-CH3]+ (18), 209 [fisión del anillo D]+ (13), 156 [fisión del anillo C]+ (6) y 141 [fisión del anillo C-CH3]+ (12) para el y los iones con m/z 376 [M- H2O]+ (14), 251 [M-cadena lateral- H2O]+ (64), 236 [M-cadena lateral- CH3]+ (15), 209 [fisión del anillo D-H2O]+ (33), 143 [fisión del anillo C-CH3]+ (12) para el . Sin embargo, la ausencia del ion correspondiente a [M - H2O]+ en el EM del compuesto , hace suponer que se trata de un triterpeno. Las fragmentaciones mencionadas coinciden en su totalidad con lo reportado para el ergosta- 3,5,7,9(11),22-pentaeno y el ergosta- 5,7,9(11),22-tetraen-3b-ol (8).
Fracción C
El cromatograma de gases evidencia la presencia de cuatro compuestos
Compuestos V y VI
Presentan en sus EM los [M]+ a 406 (77) y 404 (48) uma, concordantes con las fórmulas condensadas C30H44, y C30H46 respectivamente. Su patrón de fragmentación presenta los iones con m/z 391 (100) [M- CH3]+, 253 (26) [M-cadena lateral]+, 209 (14) [fisión del anillo D]+, 154 (13) [fisión C]+ y 141 (17) [fisión C-CH3]+ para el primero y 389 (24) [MCH3]+, 251 (17) [M-cadena lateral]+, 207 (16) [fisión del anillo D]+, y 154 (15) [fisión C]+ para el segundo, lo que lleva a proponer que los compuestos corresponden al 23-metil-estigmast-3,5,7,22-tetraeno y al 23-metil-estigmast-3,5,7,9 (11),22-pentaeno.
Compuesto VII
Su EM muestra un [M]+ de 390 (8) uma, que coincide con la fórmula condensada C28H38O. Se observan los iones con m/z 265 (100) [M-cadena lateral]+, 249 (4) [M-cadena lateral-CH3]+, 237 (5) [fisión del anillo D], 157 [fisión C – CH3]. La ausencia del pico correspondiente a [M+ - H20] y la pérdida de 28 uma desde el ion con m/z 281 indica la presencia en la molécula de un grupo CO. Con base en el análisis anterior, se propone como estructura la correspondiente al ergosta-1,5, 7,9(11),22-pentaen-3-ona.
Compuesto VIII
Su EM presenta el [M]+ a 392 (11) uma consistente con la fórmula molecular C28H40O. Dentro de sus fragmentaciones se observan, entre otros, los iones a m/z 293 (5) [M+-C6H12]+, 268 (100) [M+-cadena lateral], 253 (33) [M+-cadena lateral- CH3], 240 (2) [fisión del anillo D] y 173 (15) [fisión del anillo C]+. El espectro concuerda en su totalidad con la fragmentación reportada para la ergosta- 4,6,15(16),22-tetraen-3-ona (9).
Fracción D
Según el cromatograma de gases, la fracción D está constituida por dos compuestos a pesar de que en CCD aparece, en diferentes sistemas cromatográficos, como una sola mancha.
Compuesto IX
En su EM muestra un [M]+ a 374 (38) uma, concordante con la fórmula molecular C28H38 y los iones a m/z 249 (27) [Mcadena lateral]+, 231(25) [M - cadena lateral- H2O]+, 213 (34) [fisión D–CH3]+. De su patrón de fragmentación y comparación con literatura fue identificado como ergosta-2,5,7,9(11),14,22-hexaeno (9).
Compuesto X
Este compuesto presenta en su EM un ion molecular de 412 (12) uma, que corresponde a la fórmula condensada C29H48O, y se observan los iones con m/z 397 (10) [M-CH3]+, 394 (15) [M-H2O]+, 273 (22) [M-cadena lateral]+, 253 (49) [M-cadena lateral – H2O]+, 231 (44) [fisión D]+, y 160 (28) [fisión C]+. Su patrón de fragmentación concuerda en su totalidad con el reportado para el estigmasterol (9).
Fracción E
Esta fracción corresponde a un solo compuesto .
Compuesto XI
El espectro de masas muestra un [M]+ a 446 uma, que se ajusta a la fórmula molecular C28H46O4, y presenta los iones con m/z, 395(1) [M -2H20-CH3]+, 376 (100) [M-4H20-2H]+, 287 (1) [M-2H20-cadena lateral]+, 269 (2) [M -2H20-cadena lateral- CH3]+ y 233 (2) [M -cadena lateral- 4H20-CH3]+. Del análisis realizado al EM, se propone como estructura probable para este compuesto la correspondiente al ergosta-5,6,7-trihidroxi-7,22- dien- 3b-ol. Esteroles polihidroxilados ya han sido reportados en hongos basidiomicetos (9, 10).
Con base en los resultados obtenidos se puede señalar que el hongo en estudio presenta los ácidos grasos comunes a los basidiomicetos, siendo los compuestos mayoritarios el palmítico, el oléico y el linoléico, lo cual concuerda con lo reportado por Brondz (6), quien ha estudiado el empleo de los ácidos grasos como marcadores quimiotaxonómicos en hongos. En lo referente a los triterpenoides, la gran mayoría de los compuestos aislados corresponden al tipo “ergosta”, algunos de los cuales, como es el caso de los compuestos , y , se encontraron también en el hongo micorrizico Laccaria laccata (9, 10), y en hongos del género Pleurotus (9).
Cabe resaltar la ausencia del ergosterol y la presencia de estigmasterol. En cuanto al primero (componente mayoritario en los basidiomicetos), es posible que la ausencia de este se deba a su baja solubilidad en el solvente extractante y no a la no producción de él por el hongo, a no ser que esta seta en particular presente una biosíntesis similar a la reportada para zigomicetos, en los cuales el ergosterol se encuentra como un componenteminoritario, o incluso no lo contienen (11). En lo relativo a la presencia de estigmasterol, no reportado antes en basidiomicetos, pudiera ser que sí lo contenga el hongo o que, debido al carácter micorrízico del mismo, lo hubiese incorporado del árbol sobre el que se reproduce, ya que dicho esterol se encuentra en todas las plantas superiores (12-14). De igual manera, se encontraron compuestos como el y , que poseen un grupo etilo en C24. Este tipo de compuestos ha sido reportado en microalgas (15), en las esponjas Agelas sceptrum y Neofibularia nolitangere (16-19), así como también en algunos basidiomicetos como el hongo Poliporaceo Trametes menziezii (20) y el Tricholomataceo Lentinus edades (10). Aunado a lo anterior, se reporta por primera vez el polihidroxiesterol ergosta-5,6,7-trihidroxi- 7,22-dien-3b-ol. Cabe anotar aquí que compuestos de este tipo ya han sido aislados en basidiomicetos (9, 10, 21).
REFERENCIAS BIBLIOGRAFICAS
1. Chang, S.; Miles, P. Biología de las setas. Fundamentos básicos y acontecimientos actuales. Singapore, New Jersey: World Scientific. 1ª. edición en español. Bogotá: Instituto Zeri para Latinoamérica. 1999. pp. 5-7. [ Links ]
2. Teichmann, A.; Dutta, P.; Staffas, A.; Jagerstad, M. Sterol and vitamin D2 concentrations in cultivated and wild grown mushrooms: Effects of UV irradiation. LWT-Food. Sci. and Tech. 2007. (5): 815. [ Links ]
3. Mattila, P.; Suonpää, K.; Piironen, V. Functional properties of edible mushrooms, Nutrition. 2000. 16 (7): 694. [ Links ]
4. Rivera, A. Producción de vitamina D2 a partir de hongos macromicetos: aspectos científicos, técnicos y económicos. Bogotá, D.C.: Colciencias. 1998. [ Links ]
5. Karliñski, L.; Ravnskov, S. B.; Kieliszewska Rokicka, B.; Larsen, J. Fatty acid composition of various ectomycorrhizal fungi and ectomycorrhizas of Norway spruce. Soil. Biol. Biochem. 2007. (4): 854. [ Links ]
6. Brondz, I.; Klaus Høiland, K.; Ekeberg, D. Multivariate analysis of fatty acids in spores of higher basidiomycetes: a new method for chemotaxonomical classification of fungi. J. Chromatogr. B. 2004. : 303. [ Links ]
7. Cunha, S.; Fernández, J.; Olivieira, P. Quantification of free and esterified sterols in Portuguese olive oils by solid-phase extraction and gas chromatography-mass spectrometry, J. Chromatogr. A. 2006. (1): 220. [ Links ]
8. Coy, E. Estudio químico de los metabolitos secundarios del hongo macromiceto Laetiporus sulphureus. Universidad Nacional de Colombia. Facultad de Ciencias. Departamento de Química. Bogotá. 2000. pp. 29-35. [ Links ]
9. Chegwin, C. Estudio de la influencia del sustrato en la cantidad y clase de triterpenoides de Pleurotus ostreatus así como en el contenido de estatinas si dicho hongo las presenta. Universidad Nacional de Colombia. Facultad de Ciencias. Departamento de Química. Bogotá. 2007. [ Links ]
10. Cucaita, E. Estudio químico comparativo de metabolitos secundarios de los hongos comestibles Laccaria Laccata y Lentinula Edodes y determinación de su variación respecto al estadio del hongo. Universidad Nacional de Colombia. Facultad de Ciencias. Departamento de Química. Bogotá. 2007. [ Links ]
11. Grandmougin Ferjani, A.; Dalpe, Y.; Hartmann, M.; Laruelle, F., Sancholle, M. Sterol distribution in arbuscular mycorrhizal fungi. Phytochem. 1999. (6): 1027. [ Links ]
12. Deshmane, S.; Sukh, D. Higher isoprenoids- II Triterpenoids and steroids of Saccharum officinarum linn. Tetrahedron. 1971. (6): 1109. [ Links ]
13. Georges, P.; Sylvestre, M.; Ruegger, H., Bourgeois, P. Ketosteroids and hydroxyketosteroids, minor metabolites of sugarcane wax. Steroids. 2006. : 647. [ Links ]
14. Johnson, J.; Grostic, M.; Jensen, A. Anal Chem. 1957. (4): 468. [ Links ]
15. Rauter, A.; Filipe, M.; Prata, C.; Noronha, J.; Sampayo, M.; Justino, J.; Bermejo, J. A new dihydroxysterol from the marine phytoplankton Diacronema sp. Fitoterapia. 2005. (5): 433. [ Links ]
16. Yaoita, Y.; Endo,M.; Tani, Y.;Machida, K.; Amemiya, K.; Furumura, K.; Kikuchi, M. Sterol constituents from seven mushrooms. Chem. Pharm. Bull. 1999. (6): 847. [ Links ]
17. Yaoita, Y.; Amemiya, K.; Ohnuma, H.; Furumura, K.;Masaki, A.;Matsuki, T.; Kikuchi, M. Sterol constituents from five edible mushrooms. Chem. Pharm. Bull. 1998. (6): 944. [ Links ]
18. Constantino, V.; Fattorusso, E.; Mangoni, A.; Pansini, M., Sterols from the Caribbean sponge Neofibularia nolitangere. Isolation of two novel polyhydroxysteroids. Steroids. 1995. 60 (11): 768. [ Links ]
19. Feng Hu, J.; Kelly, M.; Hamann, M. 26-Nor-25-isopropyl-ergosta- 5,7,22E-trien-3b-ol: a new C29 sterol from the sponge Agelas sceptrum from Jamaica. Steroids. 2002. (9): 743. [ Links ]
20. Acosta, A. Estudio químico del ex- tracto en Acetato de etilo del hongo poliporaceo Trametes menziezii. Universidad Nacional de Colombia. Facultad de Ciencias. Departamento de Química. Bogotá. 2001. [ Links ]
21. Benavides, O. Estudio químico de la fracción insaponificable del hongo macromiceto Lentinula edades (Shii- take). Programa de Posgrado. De- partamento de Química. Facultad de Ciencias. Universidad Nacional de Colombia. Sede Bogotá. 2004. [ Links ]














