Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804On-line version ISSN 2357-3791
Rev.Colomb.Quim. vol.37 no.3 Bogotá Sept./Dec. 2008
Francy L. Forero R.1 , Blanca L. Ortiz Q.1, Cecilia Anzola V.1
1 Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia, sede Bogotá, Bogotá, Colombia. blortizq@unal.edu.co
Recibido: 09/06/08 – Aceptado: 02/12/08
RESUMEN
En este trabajo se estudió el papel del factor de crecimiento similar a la insulina tipo I (IGF-I) como factormodulador del estrés inducido por una restricción proteica en la dieta, en linfocitos T de bazo de rata. Se encontró que la restricción proteica disminuye el peso corporal en un 15%, el peso del bazo en un 32% y la población total de linfocitos T en un 42%. Igualmente, se observó en la población restringida un incremento en los porcentajes de las subpoblaciones T-CD4, T-CD8 y linfocitos B, y una relación T-CD4/T-CD8 disminuida, lo que sugiere una función inmune afectada por la malnutrición. También se halló que los cultivos de linfocitos provenientes de bazo de ratas en restricción proteica presentanmenor proliferación que los provenientes de ratas bien alimentadas; dicha proliferación se incrementa al adicionar IGF-I de manera dependiente de la dosis. Esta respuesta depende, también, del contenido de proteína en la dieta, observándose una mayor y más pronta respuesta a IGF-I en el grupo bien nutrido. La concanavalina A incrementó, igualmente, la proliferación en ambos grupos de animales, y al combinarla con IGF-I se presentó un sinergismo en la respuesta. En este trabajo se encontró, también, que la restricción proteica incrementa la apoptosis de los linfocitos T, y que la adición de IGF-I logra proteger dichas células de la apoptosis soportando el papel inmunomodulador de esta hormona en estrés nutricional.
Palabras Clave: factor de crecimiento similar a la insulina tipo I (IGF-I), finfocitos, restricción proteica, apoptosis, inmunomodulador.
ABSTRACT
In this work we studied the role of Insulin- like Growth Factor-I (IGF-I) as stress modulator in spleen T-lymphocytes from protein restricted rats. In protein restriction we found 15% lowered body weight, 32% lowered spleen weight and a reduction of 42% in total T-cell population. Also, increased percentages of T-CD4, T-CD8 and B cell populations and lowered T-CD4/T-CD8 ratio was observed, suggesting an impaired immune function due to malnutrition. Cultures of spleen T-lymphocytes from protein restricted rats showed less proliferation than the ones from well fed rats, this proliferation was increased after the addition of IGF-I in a dose depending manner. This answer depends, also, from the protein content of the diet, since the well fed animals showed a higher and faster answer. Concanavaline A, also, increased proliferation in both groups of rats and when combined with IGF-I a synergistic answer was found. In this work we also found that protein restriction increased apoptosis of T-lymphocytes, and the addition of IGF-I helped in the recovery of those cells supporting the immunomodulator role of IGF-I in nutritional stress.
Key Words: Type I Insulin-like Growth Factor (IGF-I), lymphocytes, protein restriction, apoptosis, immunomodulator.
RESUMO
Neste trabalho foi estudado o papel de Factor de Crescimento Similar à Insulina Tipo I (IGF-I) como factor modulador do stress induzido por uma restrição proteica em linfócitos T de baço de rato. Encontrou- se que a restrição proteica diminui o peso corporal em 15%, o peso do baço dos animais em 32% e a população total de linfócitos T em 42%. Igualmente, se observou uma alteração nas percentagens das subpopulações T-CD4, T-CD8 e linfócitos B, e uma relação T-CD4/T-CD8 diminuída que sugere uma função imune afectada pela má nutrição. Foi encontrado que os cultivos de linfócitos provenientes do baço de rato em restrição proteica apresentam menor proliferação que os provenientes de ratos bem alimentados; dita proliferação incrementa ao adicionar IGF-I de maneira dependente da dose. Esta resposta depende, também, do conteúdo de proteína na dieta, observando- se uma maior e mais rápida resposta a IGF-I no grupo bem nutrido. A concavalina A incrementou, igualmente, a proliferação em ambos grupos de animais, e ao combiná-la com IGF-I apresentou-se um sinergismo na resposta. Nesta investigação também foi encontrado que a restrição proteica incrementa a apoptose dos linfócitos T e que a adição de IGF-I permite proteger estas células da apoptose dando suporte ao papel imunomodulador desta hormona em stress nutricional.
Palavras-chave: factor de crescimento similar à insulina tipo I (IGF-I), Linfócitos, restrição proteica, apoptose, imunomodulador.
INTRODUCCION
Los factores de crecimiento similares a la insulina tipo I (IGF-I) y tipo II (IGF-II) son péptidos estructuralmente relacionados con la insulina. Las concentraciones de IGF-I en la sangre están controladas por la hormona de crecimiento (GH) y por cambios en el estado nutricional (1).
Su función es mediada por el receptor de membrana (IGF-IR), altamente específico, asociado con tirosina quinasas intracelulares (2). En células de órganos linfoides se ha evidenciado, a través de citometría de flujo, la existencia del IGF-IR, planteando su posible regulación en la función del sistema inmune (3, 4).
Una de las funciones principales del IGF-I es la supervivencia e inhibición de la apoptosis (muerte celular programada), a través de vías de señalización de su receptor que involucran a la vía PI3K/Akt (fosfatidil-inositol 3 quinasa/proteina quinasa B), la cual desempeña un papel importante en la prevención de la apoptosis en muchos tipos de células incluyendo linfocitos T (5). Aunque los efectos del IGF-I sobre el desarrollo de las células T no están bien caracterizados, se ha demostrado que las células T tímicas proliferan en respuesta al IGF-I, antes de responder al estímulo por citoquinas, protegiéndose de la apoptosis (6, 7).
Algunas investigaciones han mostrado que el estrés nutricional induce cambios moleculares en el eje local GH/IGF-I en varios órganos linfoides. La restricción proteica lleva a un incremento en la expresión de los receptores de GH e IGF-I en diferentes poblaciones linfocitarias, interpretándose esto como una activación del eje GH/IGF-I para compensar los efectos deletéreos de la desnutrición sobre el sistema inmune y preservar la homeostasis del tejido, revelándose, de esta forma, una nueva función para estas hormonas en la adaptación al estrés nutricional (8, 9).
El presente trabajo busca demostrar que, en condiciones de estrés nutricional proteico, el IGF-I estimula células linfoides, involucrando efectos antiapoptóticos y proliferativos.
MATERIALES Y METODOS
Animales
Se emplearon ratas Wistar macho (n = 16) de 7 semanas de edad y un peso promedio de 107 g, obtenidas del Bioterio de Experimentación del Departamento de Farmacia de la Universidad Nacional de Colombia, las cuales fueron ubicadas en jaulas individuales y mantenidas bajo condiciones controladas (ciclos de luz/oscuridad de 12/12 horas y temperatura constante de 23 °C), en las instalaciones de dicho bioterio.
Dietas
Las ratas fueron alimentadas con dos dietas isocalóricas (3,7 kcal/g) de diferente contenido de proteína: 0% o carente de proteína (ICN Biomedicals, Inc.) y 12% o con contenido normal de proteína (Nutrir S.A.), la cual se tomó como dieta control. Después de tres días de adaptación con la dieta control, los animales fueron distribuidos aleatoriamente en dos grupos (n = 8 y alimentados con la respectiva dieta de estudio durante diez días, con libre acceso al alimento y al agua.
Reactivos
Concanavalina A (Sigma), IGF-I (Gropep), RPMI-1640 (Sigma), buffer de lisis (NH4Cl 150 mM, EDTA 0,1 mM, NaHCO3 10 mM (Pharm lyse BD, Bioscience), etopósido (Sigma), DMSO (Carlo Erba), anticuerpos monoclonales para rata (BD Bioscience), yoduro de propidio (Sigma), MTT (bromuro de 3-(4,5-dimetil-2-tiazol)-2,5-difeniltetrazolio) (Sigma).
Consideraciones Eticas
Los protocolos y procedimientos quirúrgicos cumplieron con las normas de utilización y manejo de animales de experimentación del Bioterio del Departamento de Farmacia de la Universidad Nacional de Colombia.
Sacrificio y extracción de linfocitos
Al finalizar el periodo experimental, los animales fueron sacrificados por dislocación cervical y los bazos removidos, pesados y colocados en medio RPMI-1640. Las células del bazo fueron extraídas por perfusión y los eritrocitos eliminados con buffer de lisis en dilución 1:10. Después de centrifugar a 1000 rpm durante 5 minutos, los linfocitos fueron resuspendidos en medio RPMI-1640 suplementado con L-glutamina (1 mM), BSA (0,1%), citrato de sodio (0,6%), penicilina-estreptomicina (100 U/ml), determinando la viabilidad celular en el hemocitómetro mediante exclusión con azul de tripán.
Identificaciones de las subpoblaciones celulares
Las células del bazo de ratas (5 x 105 por tubo), provenientes de los dos grupos dietarios y obtenidas al momento del sacrificio, fueron marcadas mediante incubación por 1 h con los siguientes anticuerpos monoclonales para rata: anti- CD4-PE (ficoeritrina) para linfocitos T-CD4 o T ayudadores, anti-CD8- PERCP (peridina clorofila) para linfocitos T-CD8 o supresores citotóxicos, anti-CD3-FITC (isotiocianato de fluoresceína) para linfocitos T totales y anti-CD45-FITC para linfocitos B. Las subpoblaciones celulares fueron evaluadas por citometría de flujo (citómetro de flujo Beckton Dickinson) (10).
Evaluación de la proliferación celular
Después de incubar linfocitos extraídos del bazo de rata de cada grupo dietario, por 1 h en medio RPMI – 1640 suplementado con L-glutamina, penicilina-estreptomicina, las células se colocaron en placas de 96 pozos (2 x 105 cel/pozo) en presencia de estímulos mitogénicos como concanavalina-A (2 mg/ml), IGF-I (10 nM) o mezcla de estos e incubadas a 37 ºC y 5% CO2 durante 24, 48 y 72 h. Posteriormente se realizó la reacción de MTT (0,5 mg/ml) (3) durante la noche, pasada la cual los cristales de formazán se diluyeron en DMSO y se realizaron lecturas de absorbancia a 570 nm (lector de microplacas Biorad, modelo 540). Para cada tiempo evaluado se colocó un control de células sin estímulo, el cual sirvió de referencia para calcular los porcentajes de proliferación en cada caso.
Evaluación de la apoptosis
Linfocitos provenientes de bazos de ratas bajo los dos regímenes nutricionales (1 x 106 células/pozo), se colocaron en placas de 24 pozos en presencia o no de IGF-I (10 nM y 50 nM) y se incubaron durante 24 y 48 h, tiempo al cual se determinó el estado apoptótico de las células por medio de una incubación de 30 s con yoduro de propidio (1 mg/ml) y análisis por citometría de flujo (11); el mismo análisis se realizó para el control con etopósido (50 mM), inductor conocido de apoptosis, que genera muerte celular programada sobre linfocitos luego de incubación con las células de ambos grupos nutricionales por 5 h, tiempo suficiente para que el etopósido provoque alrededor del 90% de apoptosis en los linfocitos (12).
Análisis Estadístico
Los resultados se analizaron por ANOVA. Las diferencias entre medias individuales se estimaron usando una prueba t. Un valor de P<0,05 se consideró estadísticamente significativo.
RESULTADOS Y DISCUSION
Estudio del efecto de la restricción proteica en ratas
Efecto sobre el peso corporal, peso del bazo y linfocitos totales
El protocolo experimental desarrollado bajo condiciones controladas y suministrando dietas isocalóricas para asegurar un estrés netamente proteico, mostró una pérdida de peso corporal del 15% en los animales alimentados con dieta del 0% de proteína, significativamente diferente (P <0,05) comparado con los animales alimentados con dieta del 12% de proteína, los cuales incrementaron su peso en un 30%. Igualmente, la restricción proteica disminuyó el peso del bazo en un 32% y el número de linfocitos totales en un 42%, cifras de disminución significativa (P < 0,05) respecto al grupo bien nutrido (Figura 1), tal como se había reportado previamente (13).
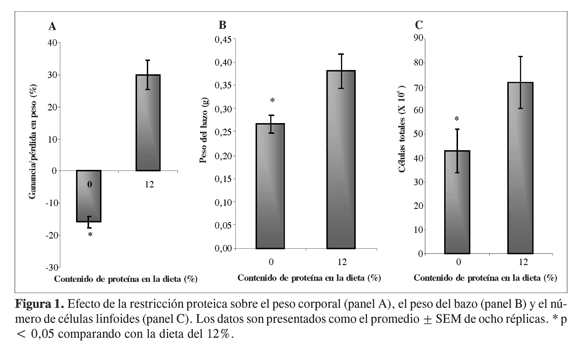
Efecto sobre las subpoblaciones celulares
Los linfocitos son producidos principalmente en órganos linfoides primarios como timo ymédula ósea. El bazo se considera un órgano linfoide secundario junto con los ganglios linfáticos. El efecto de la restricción proteica sobre células linfoides se evidenció no sólo con la disminución en la cantidad total de linfocitos sino también con variaciones en los porcentajes de las subpoblaciones celulares comparado con las células provenientes de los animales control. El porcentaje de células T-CD4, T-CD8 y células B presentó un incremento en respuesta a la restricción proteica, como se observa en la figura 2A, comparado con las subpoblaciones de los animales alimentados con contenido normal de proteína, posiblemente como reacción del organismo a la malnutrición para mantener un equilibrio en su sistema inmune, ya que los linfocitos que presentan en su membrana la molécula CD4 ayudan a otros linfocitos T a producir citoquinas y a estimular a los linfocitos B a generar más anticuerpos, y gracias a los CD8 la inmunidad celular ataca y destruye directamente células malignas (14).
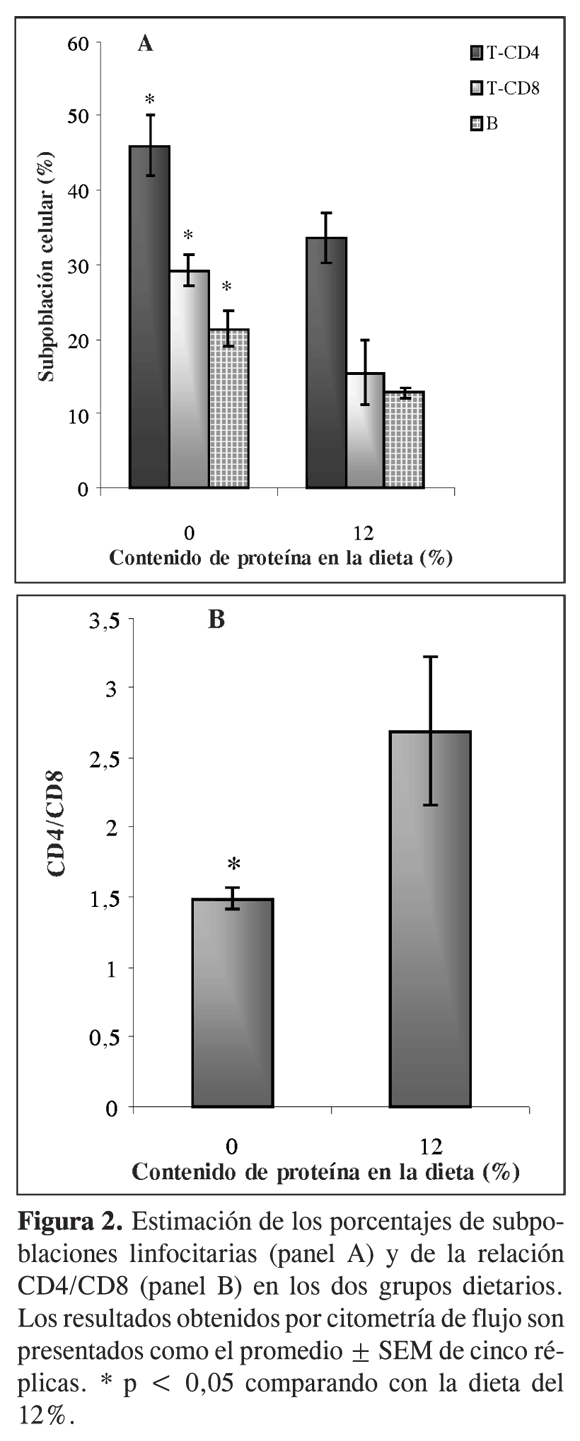
Sabiendo que una función inmune normal se caracteriza por una relación CD4/CD8 mayor que la que presentan animales inmunosuprimidos, en este experimento se pudo comprobar que la restricción proteica afecta al sistema inmune ya que dicha relación en los animales restringidos es menor, lo cual indica que posiblemente las células CD4 no se están diferenciando en el timo llevando a un incremento en el porcentaje de células CD8 (Figura 2B).
Efecto del IGF-I sobre la proliferación celular de linfocitos T de bazo de rata
Como se observa en la Figura 3, el IGF-I ejerce un efecto proliferativo sobre los linfocitos pero su acción depende del contenido de proteína, ya que en los diferentes tiempos (24, 48 y 72 h) se presenta una mayor proliferación para las células provenientes de animales con 12% de proteína en la dieta que para las provenientes de ratas sometidas a restricción proteica. Investigaciones previas han demostrado que los niveles circulantes de IGF-I disminuyen por reducción de la proteína en la dieta (13); por esto al estimular con IGF-I, linfocitos en cultivo provenientes de ratas sometidas a restricción proteica, no se observó efecto proliferativo a las 24 h ya que este tiempo es empleado por las células para adaptarse a nuevas condiciones y proliferar posteriormente ante el estímulo.
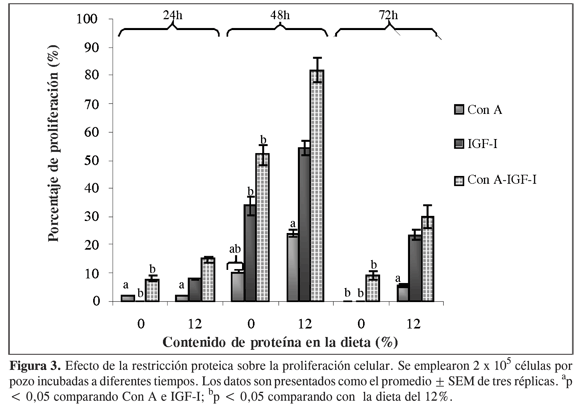
En la Figura 3 se observa que la máxima proliferación se alcanzó a las 48 h con los diferentes estímulos en los linfocitos de ambos grupos de animales, y a las 72 h hubo una disminución de tal efecto; también se observó el efecto proliferativo de la Con A, del IGF-I y el efecto sinergístico que logra la mezcla de estos mitógenos. En las células de los animales sometidos a restricción proteica es posible que debido a la mayor expresión de receptores de IGF-I en su membrana, al ser estimuladas con este ligando después de un periodo de adaptación, la proliferación se incremente de forma más pronunciada que cuando se tienen niveles circulantes normales de IGF-I, lo cual explicaría lo que se observa en la figura.
Según los resultados obtenidos se puede afirmar que la restricción proteica disminuye la proliferación de los linfocitos T, puesto que las células con un contenido normal de proteína alcanzan mayores porcentajes de proliferación ante los diferentes estímulos.
La restricción proteica causa un retardo en la reacción de las células ante el IGF-I, necesitando un tiempo de adaptación de 24 h, para luego presentar una proliferación ante el estímulo, por lo que es posible que organismos desnutridos tengan problemas en la proliferación de los linfocitos T, y por ende su respuesta inmune se vea disminuida. Otros trabajos han considerado la posibilidad de que este retardo sea del ciclo celular de los linfocitos T, y por consiguiente las células de animales en restricción proteica tardan más en concluir el proceso de mitosis (3).
Efecto del IGF-I como agente asntiapoptótico en células de bazo de ratas sometidas a estrés nutricional
La apoptosis de células T ha sido sugerida como un mecanismo importante en la pérdida de la respuesta inmune efectiva, y un amplio número de mecanismos alternativos de apoptosis han sido definidos en células T de sangre periférica (15, 16, 17).
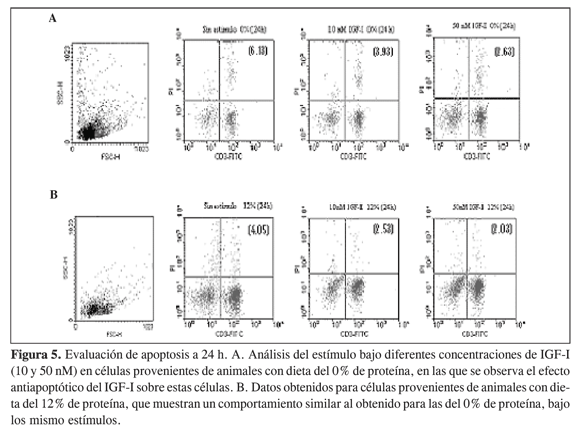
En el presente estudio se encontró que las células de bazo de ratas sometidas a restricción proteica en un estado basal (al momento del sacrificio) presentan mayor apoptosis que las células provenientes de animales alimentados con dieta del 12%, como se observa en la Figura 4, donde se muestran los diagramas de puntos obtenidos del análisis por citometría de flujo, en los que la región 1 (R1, Figura 4A) representa la población linfocitaria de interés; a partir de ella se hace el análisis para determinar qué porcentajes de células tiñen con yoduro de propidio y a la vez con el fluorocromo CD3-FITC, lo que se observa en el cuadrante superior derecho de cada figura e indica el porcentaje de células apoptóticas en esemomento. En la figura 4B se observa que para los linfocitos provenientes de animales alimentados con dieta del 0% se obtuvo 11,51% de células apoptóticas, y para la dieta con contenido normal de proteína 1,40%(figura 4C), lo que confirma lo antes mencionado.
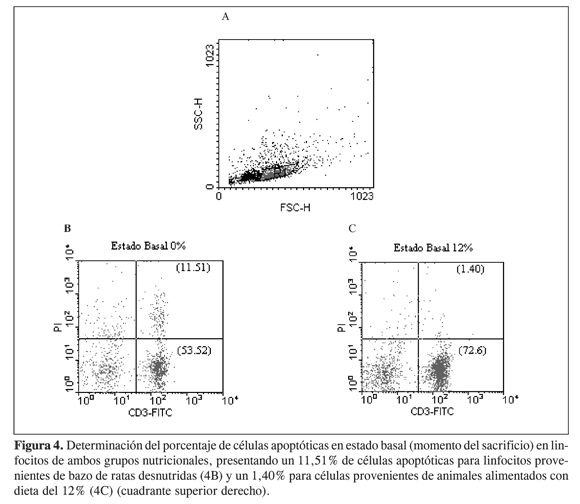
La Figura 5 señala el comportamiento de los linfocitos provenientes de los animales en estudio, después de 24 horas de incubación con IGF-I en diferentes concentraciones (10 y 50 nM). La Figura 5A muestra el comportamiento de los linfocitos provenientes de animales sometidos a estrés nutricional, después de 24 horas de incubación sin estímulo, presentando un porcentaje de apoptosis de 6,13%. Al aumentar la concentración del IGF-I la apoptosis va disminuyendo pues se observa que con una concentración 10 nM de IGF-I el porcentaje de apoptosis es 3,93% mientras que si la concentración es 50 nM en IGF-I, el porcentaje es 2,63%. En células provenientes de animales alimentados con dietas del 12% de proteína se encuentra la misma tendencia aunque los porcentajes de apoptosis son menores: 4,05%de apoptosis para linfocitos sin estímulo, 2,53% al adicionar IGF-I 10 nM y 2,03% con IGF-I 50 nM (Figura 5B). Este ensayo se realizó también a las 48 h.
En la Figura 6 se representan los resultados de porcentaje de apoptosis obtenidos por citometría de flujo a las 24 y 48 h de incubación en presencia de cantidades variables de IGF-I. Para linfocitos provenientes de animales con dieta del 12%, la apoptosis en condiciones basales (1,4%) (Figura 4) es menor que la obtenida a las 24 h (2,03% ± 0,56) y 48 h (3,72% ± 0,34) en células estimuladas con IGF-I 50 nM (Figura 6), lo cual lleva a pensar que al estimular los linfocitos, más que una disminución de apoptosis ocurre una recuperación celular.
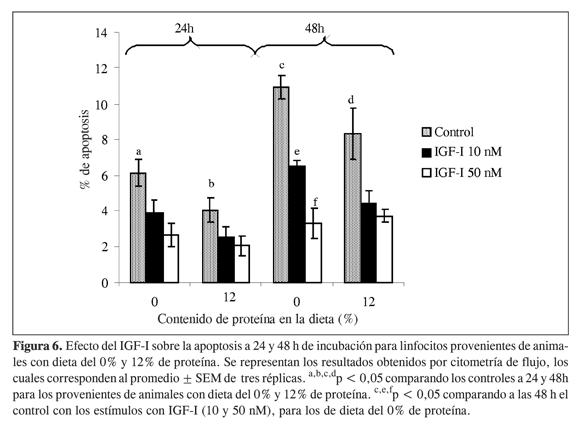
Los linfocitos provenientes de animales sometidos a restricción proteica presentan mayor apoptosis que los linfocitos de animales con 12% de proteína en la dieta, lo cual nos indica que la desnutrición en estos animales causa no sólo un retardo en la proliferación de las células T del sistema inmune ante el IGF-I, sino que además provoca un mayor porcentaje de células apoptóticas. A las 48 h el porcentaje de apoptosis aumenta tanto para células provenientes de animales alimentados con dieta del 0% de proteína (10,94% ± 0,671) como para células de la dieta del 12% (8,31% ± 1,43); al estimular con IGF-I, a las 48 h se observa una disminución significativa en dicho porcentaje a mayor concentración de IGF-I (Figura 6).
El sistema endocrino participa en varias vías de regulación a través de la acción de IGF-I manteniendo la supervivencia y la inhibición de apoptosis en células T (6). En el presente estudio el IGF-I ayuda a la proliferación tanto de las células provenientes de animales con restricción proteica como de las células de animales con dieta del 12% de proteína, además de disminuir los porcentajes de apoptosis para linfocitos T en cultivos provenientes de ambos regímenes nutricionales. La inhibición de la apoptosis por IGF-I es dependiente de su concentración, ya que, como se observa en la Figura 6, las células apoptóticas disminuyen con el aumento de concentración de IGF-I en el medio.
En conclusión, en este trabajo se encontró que la restricción proteica no sólo afecta el peso corporal y el peso del bazo de los animales, sino que también altera la función del sistema inmune, en razón de que el número de linfocitos totales se ve disminuido afectando su capacidad proliferativa y aumentando su actividad apoptótica; así mismo los porcentajes de las subpoblaciones linfocitarias se incrementan cuando se provoca un estrés nutricional comparado con los obtenidos para animales alimentados con dieta del 12% de proteína . En estas condiciones el estímulo con IGF-I logra contrarrestar dichos efectos de manera dependiente de la dosis, manifestándose así el papel inmunomodulador de este factor en condiciones de estrés nutricional.
AGRADECIMIENTOS
Los autores agradecen a la Dirección de Investigación, sede Bogotá por la financiación del proyecto DIB-803956, al Laboratorio de Hormonas del Departamento de Química, al Bioterio del Departamento de Farmacia y al Departamento de Química, de laUniversidadNacional deColombia.
REFERENCIAS BIBLIOGRAFICAS
1. Sánchez Gómez, M.; Malmlöf, K.; Mejía, W. Insulin-like growth factor- I, but not growth hormone, is dependent on a high protein intake to increase nitrogen balance in the rat. Br. J. Nutr. 1999. (2): 145-152. [ Links ]
2. Clark, R. The Somatogenic Hormones and Insulin-Like Growth Factor- 1: Stimulators of Lymphopoiesis and Immune Function. Endocr. Rev. 1997. : 157-179. [ Links ]
3. Cortés, C.; Acevedo, O. Efecto de la restricción proteica sobre la proliferación celular y la activación de la vía de señalización de hormona de crecimiento (Vía JAK-STAT) en linfocitos. Trabajo de grado, Departamento de Química, Universidad Nacional de Colombia. Bogotá. 2003. [ Links ]
4. Le Roith, D. Regulation of proliferation and apoptosis by insulin -like growth factor I receptor. Growth Hormone & IGF Research. 2000. Supplement A. S12-S13. [ Links ]
5. Dunn, S.; Kari, F. Dietary restriction reduces Insulin-like growth factor I levels, which modulates apoptosis, cell proliferation, and tumor progression in p53-deficient mice. Advances in Brief. 1997. : 4467-4672. [ Links ]
6. Liu, E.; Law, H. K.; Lau, Y. L. Insulin-like Growth Factor I promotes maturation and inhibits apoptosis of immature cord blood monocyte- derived dendritic cells through MEK and PI 3 Kinase pathways. Pediatr. Res. 2003. (6): 919-925. [ Links ]
7. Isgaard, J.; Tivesten, A. The role of growth hormone and insulin-like growth factor I in the regulation of apoptosis. Growth Hormone & IGF Research. 1999. : 125-28. [ Links ]
8. Mejía, W. Estudio del papel paracrino/ autocrino del eje hormona de crecimiento (GH)/Factor de Crecimiento similar a la insulina (IGF-I) y su regulación por la proteína dietaria en células linfoides. Tesis de Doctorado. Departamento de Química. Universidad Nacional de Colombia. Bogotá, 2003. [ Links ]
9. Kelley, KW.; Arkins, S.; Minshall, C.; Liu, Q.; Dantzer, R. Growth hormone, growth factors and hematopoiesis. Horm. Res. 1996. 38-45. [ Links ]
10. Recktenwald, D. Multicolor Immunofluorescence Analysis. En: Radbruch, A. Flow Cytometry and Cell Sorting. Berlin: Springer-Verlag. 1992. pp. 47-52. [ Links ]
11. Martinsson, P.; Liminga, G.; Nygren, P.; Larsson, R. Characteristics of etoposide-induced apoptotic cell death in the U-937 human lymphoma cell line. Anticancer drugs. 2000. 699-705. [ Links ]
12. Wang, Y.; Zheng, X. A flow cytometer- based assay for quantitative analysis of cellular proliferation and cytotoxicity in vitro. J. Immunol. Methods. 2002. 8: 179-188. [ Links ]
13. Mejía, W. Cambios bioquímicos en el receptor de la hormona de crecimiento hepático y de linfocitos y niveles séricos de IGF-I en ratas sometidas a restricción proteínicocalórica. Tesis de Maestría. Departamento de Química, Universidad Nacional de Colombia. Bogotá. 1994. [ Links ]
14. Rojas, W. Inmunología. 13a. ed. Medellín, Colombia: Corporación para Investigaciones Biológicas. 2004. pp. 130-139. [ Links ]
15. Mejía, W.; Sánchez Gómez, M.; Le Roith, D. The growth hormone- Insulin - like growth factor-I axis and immunity. En: Growth and Lactogenic Hormones. Neuroimmune Biology. Vol. 2. Amsterdam. Ed. L. Matera & R. Rapaport Elsevier. 2002. p. 9-25. [ Links ]
16. Jiménez Del Río M.; Vélez Pardo, C. Insulin-like growth factor-1 prevents Abeta[25-35]/(H2O2)- induced apoptosis in lymphocytes by reciprocal NF-kappab activation and p53 inhibition via PI3K-dependent pathway. Growth Factors. 2006. (1): 67-78. [ Links ]
17. Jiménez Del Río, M.; Vélez Pardo, C. Monoamine neurotoxins-induced apoptosis in lymphocytes by a common oxidative stress mechanism: involvement of hydrogen peroxide (H2O2), caspase-3, and nuclear factor kappa-b (NF-kappab), p53, c-Jun transcription factors. Biochem. Pharmacol. 2002. 677-88. [ Links ]














