Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Colombiana de Química
versión impresa ISSN 0120-2804versión On-line ISSN 2357-3791
Rev.Colomb.Quim. v.37 n.3 Bogotá sep./dic. 2008
Edith M. Erira D., Luca Fadini1
1 Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia, sede Bogotá, Bogotá, Colombia. lfadini@unal.edu.co
Recibido: 22/02/08 – Aceptado: 02/12/08
RESUMEN
Los líquidos iónicos son excelentes medios para reacciones catalíticas, debido a que pueden ser utilizados para optimizar o reciclar los catalizadores homogéneos. En este trabajo se describe el uso de varios líquidos iónicos de bajo punto de fusión (-30 – -34 °C), basados en derivados de la piridina, para utilizarlos en la hidroaminación de olefinas activadas, catalizada por complejos de Ni(II). El catalizador [Ni(Pigiphos)(NCCH3)](ClO4)2 presenta buena actividad cuando el medio de reacción es un líquido iónico (TON hasta 172) y el sistema catalizador/líquido iónico se puede reciclar por lo menos dos veces.
Palabras clave: líquidos iónicos, catálisis homogénea, hidroaminación, níquel( II), química verde, Pigiphos.
ABSTRACT
Ionic liquids are excelent solvents for catalytic reactions because they can optimize and/or recycle the homogeneous catalysts. In this work we describe the use of ionic liquids with low melting point (-30 – -34 °C) –based on pyridine derivatives– in the hydroamination reaction of activated olefins catalyzed by Ni(II) complexes. The catalyst [Ni(Pigiphos) (NCCH3)](ClO4)2 allows good activity in ionic liquids (TON up to 172) and the catalyst/ ionic liquid system can be recycled at least 2 times.
Key words: ionic liquids, homogeneous catalysis, hydroamination, nickel( II), green chemistry, Pigiphos.
RESUMO
Os líquidos iónicos são exelentes meios para reacçãos catalíticas, devido a que podem ser utilizados para otimizar y/ou reciclar os catalisadores homogêneos. Neste trabalho descrive-se a aplicação de varios líquidos iónicos de baixo ponto de fusão (-30 – -34 °C) –baseados em derivados de piridina– para ser utilizados na hidroaminação de olefinas activadas, catalisada por complexos de Ni(II). O catalisador [Ni(Pigiphos)(NCCH3)](ClO4)2 apresenta boa actividade quando em meio de reacção e um lìquido iónico (TON hasta 172) e o sistema catalizador/líquido iónico se pode reciclar pelo menos 2 vezes.
Palavras-chave: líquidos iónicos, catálisis homogênea, hidroaminação, niquel( II), química verde, Pigiphos.
INTRODUCCION
El interés y uso de los líquidos iónicos (LI), sales orgánicas líquidas a temperatura ambiente con punto de fusión <100 ºC (1, 2) en los últimos años se debe a la utilidad de estos como medios de reacción o como solventes en numerosas reacciones químicas (3). Las propiedades de los líquidos iónicos (2) –sobre todo la alta movilidad iónica, la miscibilidad selectiva con muchos compuestos orgánicos e inorgánicos y la presión de vapor mínima– los hacen interesantes para usarlos en reacciones de catálisis homogénea (4). Además, el uso de los líquidos iónicos basados en sales de amonio y fosfonio cuaternarias ha sido enfocado en la separación y en el reciclaje de varios tipos de catalizadores. Así, los líquidos iónicos son opciones concretas para remplazar los compuestos orgánicos volátiles y, por ende, para disminuir la contaminación debida a los compuestos orgánicos volátiles (COV) (5). Como las propiedades físicas y químicas varían dependiendo de la combinación del catión y del anión, esto permite el diseño de estos solventes según el uso particular en un tipo de reacción. Los líquidos iónicos, como medio de reacción, también permiten la destilación directa de los productos y el reciclaje del sistema solvente/catalizador; por eso son considerados una manera efectiva de mejorar el impacto ambiental (química verde) (5) y de superar una de las limitaciones de la catálisis en fase homogénea (6).
Uno de los campos donde el catalizador homogéneo desempeña un papel fundamental son las heterofuncionalizaciones de olefinas (7). Los estudios para la generación directa del enlace C-Y (Y = N, O, Si, S, etc.) a partir de derivados de los hidrocarburos son de absoluta actualidad. La hidroaminación de olefinas es una de estas reacciones y une la economía atómica con la viabilidad termodinámica (8). Adicionalmente, es una ruta directa para la formación de aminas, iminas y enaminas, e incluso de aminoácidos y b-aminoácidos (9). La alta energía de activación de la reacción supone el uso de catalizadores, y varios tipos de catalizadores homogéneos han sido reportados para las reacciones de hidroaminación (10). En la actualidad, los catalizadores más utilizados para la hidroaminación intramolecular de olefinas están basados en compuestos con metales de los grupos 9 y 10, como es propuesto por los estudios ab initio de Senn y Togni (11). Además, se reportó que catalizadores de Ni(II) con ligantes fosfínicos tridentados quirales unen excelentes actividades con alta enantioselectividad (hasta el 96% ee) para la adición de aminas alifáticas a olefinas pobres electrónicamente (activadas con grupos electroaceptores) como los derivados de acrilonitrilo (Figura 1) (12).
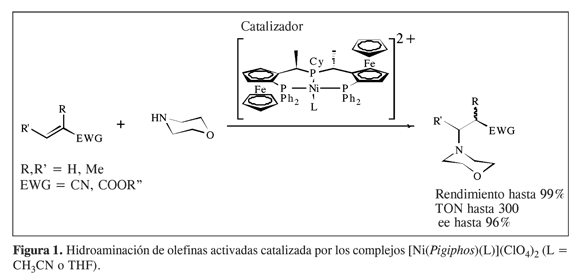
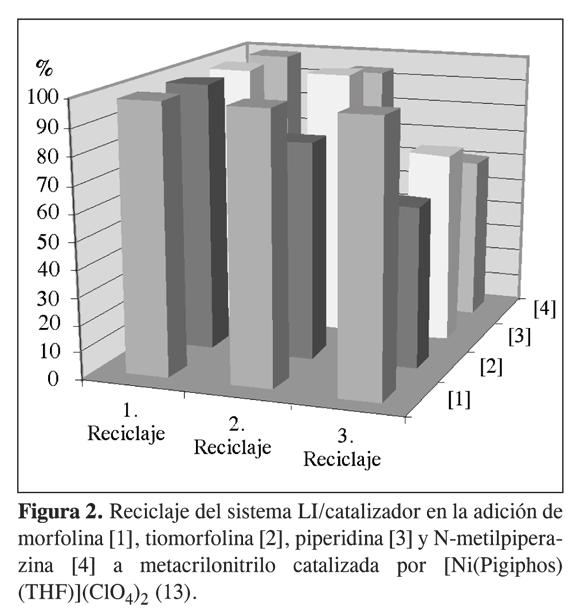
Para el caso de las catálisis enantioselectivas, muy a menudo se diseñan racionalmente catalizadores quirales. Los complejos de Ni(II) como el complejo [Ni(Pigiphos)(NCCH3)](ClO4)2 (Figura 1) con ligantes ferrocenílicos (en este caso: Pigiphos)* han mostrado que catalizan la adición asimétrica de aminas alifáticas y aromáticas a olefinas activadas, y pueden ser reciclados y estabilizados en diferentes líquidos iónicos. Resultados preliminares con diferentes LI mostraron que el uso de estos medios de reacción permite aumentar el TON (hasta 300). Además, el reciclaje del sistema LI/catalizador se pudo realizar hasta más de tres veces (Figura 2) (13). Como la enantioselectividad de estos compuestos ha sido mejorada a bajas temperaturas (hasta 96% ee a -80 °C) (14), proponemos la síntesis de líquidos iónicos basados en la piridina con bajo punto de fusión, con el fin de aumentar la actividad y la selectividad del catalizador, y al mismo tiempo reciclar el sistema catalizador/LI.
PARTE EXPERIMENTAL
Todas las metodologías de síntesis desarrolladas se llevaron a cabo bajo condiciones inertes, mediante técnicas Schlenk en atmósfera de N2 o en caja seca (15). El catalizador [Ni(Pigiphos)(NCCH3)] (ClO4)2 (13) y los líquidos iónicos [PPIR]Br, [HPIR]Br fueron sintetizados según literatura (1, 16). Los líquidos iónicos [BPIC]BF4, [OPIC]PF6 fueron donados por el profesor A. Togni del ETHZ (Suiza) y utilizados sin ulteriores purificaciones. Los solventes de trabajo se purificaron por medio de técnicas de destilación, y secados con los correspondientes agentes secantes antes de usarse (17). Los espectros de 1H, 13C y 31P-RMN se determinaron en un espectrómetro Bruker Avance 400 (400 MHz). En 1H y 13C-RMN los desplazamientos químicos en ppm se reportan versus TMS, y en 31P-RMN se reportan versusH3PO4. Los espectros IR son obtenidos en un espectrómetro Perkin- Elmer FT-IR 2000 con pellets deKBr.
Sintesis de hexafluorofosfato de N-pentilpiridinio [PPIR]PF6
1,0 g (0,0043 moles) de la sal del bromuro de N-pentilpiridinio [PPIR]Br se disuelven en metanol (50 ml) y se adicionan 0,7 g (0,0043 moles) deNH4PF6. La solución se calienta suavemente durante 24 h (50 °C). El solvente se evapora a presión reducida hasta obtener el respectivo líquido iónico. La formación de sal de NH4Br fue eliminada completamente por extracciones con MEC y adición de CH2Cl2, con lavados hasta final de bromuro.
Rendimiento:
64,3%, mp = -34 °C.
1H-RMN (Acetona-d6): d 0,89 (t, 3H de CH3), 1,40 (m, 2H de CH2), 2,13 (q, 2H de CH2), 5,01 (t, 2H de NCH2), 8,29 (t, 1H de CH), 8,76 (tt, 1H de CH), 9,55 (d, 1H de NCH).
13C-RMN DEPT-135 (Acetona-d6): d 13,27 (CH3), 21,92 (CH2), 27,88 (CH2), 31,19 (CH2), 61,35 (NCH2), 128,35 (CH), 145,22 (CH), 145,72 (NCH).
31P-RMN (Acetona-d6): d -144,16 (hepteto, JP-F 711 Hz).
IR: 3149 (vs), 2927 (m), 1639 (m), 1490 (w), 1383 (m), 1180 (m), 834 (w) cm-1.
Sintesis de hexafluorofosfato de N-pentilpiridinio [HPRI]PF6
1,8 g (0,007 moles) de la sal de bromuro de N-heptilpiridinio [HPIR]Br se disuelven en 20 ml de metanol y se adicionan 0,9 g (0,0066 moles) de NH4PF6.La solución se calienta suavemente durante 24 h (50 °C). El solvente es evaporado a presión reducida hasta obtener el líquido iónico. La formación de sal de NH4Br fue eliminada completamente por extracciones con MEC y adición de CH2Cl2, con lavados hasta final de bromuro.
Rendimiento:
54,8 %, mp = -30 °C.
1H-RMN (Acetona-d6): d 0,84 (t, 3H de CH3), 1,25 (m, 2H de CH2) 1,38 (m, 2H de CH2), 2,12 (q, 2H de CH2), 5,01 (t, 2H de NCH2), 8,30 (t, 1H de CH), 8,77 (tt, 1H de CH), 9,55 (d, 1H de NCH).
13C-RMN DEPT-135 (Acetona-d6): d 13,49 (CH3), 22,31 (CH2), 25,77 (CH2), 28,57 (CH2), 31,51 (CH2), 61,39 (NCH2), 128,42 (CH), 145,20 (CH), 145,79 (NCH).
31P-RMN (Acetona-d6): d -144,05 (hepteto, JP-F 707 Hz).
IR: 3135 (w), 2930 (vs), 1634 (w), 1488 (w), 1379 (m), 1172 (m), 842 (w) cm-1.
Hidroaminación: adición de morfolina a metilmetacrilato y acrilonitrilo en líquidos iónicos
En un balón Schlenk se colocan 1-5 mol% de [Ni(Pigiphos)(NCCH3)](ClO4)2) suspendidos en 2 ml de líquido iónico. Se adicionan 2-4 ml de acetonitrilo hasta la completa disolución del catalizador. Lamezcla se burbujea con N2 durante 30 min a temperatura ambiente con agitación constante, y el solvente orgánico se remueve a presión reducida. A la solución rojo-púrpura resultante se adiciona la olefina (2,0 mmol) y esta mezcla se deja en agitación por 20-30min. Luego se adiciona la amina (1,0 mmol) y la mezcla de reacción es agitada durante 24 h. Los sustratos orgánicos son extraídos con hexano/acetato de etilo 2:1. Los productos son purificados por cromatografía en columna.
RESULTADOS Y DISCUSION
Los líquidos iónicos (LI) se sintetizaron según los procedimientos estandarizados reportados en literatura (1, 16). Los puntos de fusión de los LI sintetizados estuvieron en un rango entre -30 °C y -34 °C, siendo todavía líquidos a -78 °C cuando se prepararon mezclas 1:1 de líquido iónico:THF. Esto claramente permite el uso de estos LI para reacciones a baja temperatura.
Para ensayar otros sustratos de catálisis y los líquidos iónicos sintetizados a diferentes temperaturas, se realizaron las reacciones de adición demorfolina a acrilonitrilo y metilmetacrilato, dando como únicos productos las aminas terciarias resultadas de una adición anti-Markovnikov, como fue reportado previamente para sustratos similares (14). En la Tabla 1 se resumen los resultados de las catálisis. El rendimiento usando este catalizador homogéneo es bueno, con buena productividad del catalizador (TON de hasta 99), y actividad moderada (TOF de hasta 4,17 h-1). Aunque en este trabajo no se compara el efecto del medio contra solventes orgánicos, estudios anteriores han reportado que el efecto positivo del líquido iónico conlleva mayor actividad del catalizador (13). Esto se puede explicar porque los medios de reacción muy polares como los LI permiten estabilizar posibles intermediarios y estados de transición catiónicos (efecto solvente).
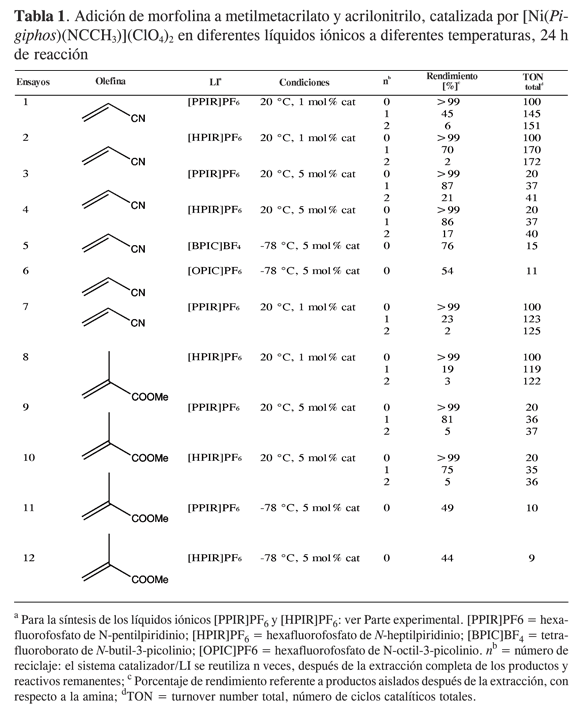
La adición de la amina alifática a acrilonitrilo y metilmetacrilato presenta buen rendimiento del producto correspondiente, utilizando 1-5mol%de catalizador a 20 °C (ensayos 1-4, 7-10). Cuando se recicla el sistema LI/catalizador (n =1-2) se obtienen mayores valores de conversión con 5 mol% de catalizador (ensayos 3-4 y 9-10) pero con TON bastante bajo (hasta 41 ciclos totales, ensayo 3). Sin embargo, el descenso en los datos de rendimientos obtenidos en el segundo o tercer reciclaje del catalizador* indica que el sistema LI/catalizador se está envenenando. Esto puede deberse a la presencia de agua en los solventes de extracción, que coordina al centro metálico y compite con la activación del sustrato. Una opción concreta para superar este problema es el uso de CO2 supercrítico como medio extractante: reportes recientes han demostrado la eficiencia del uso de sistemas LI/CO2 (sc) en procesos catalíticos (18, 19).
En estas catálisis, gracias al uso de los líquidos iónicos y al reciclaje del catalizador homogéneo, se alcanza unTONtotal de hasta 172 (ensayo 2),mostrando el efecto benéfico del uso de los líquidos iónicos en la hidroaminación de olefinas activadas (13).
La diferencia en los rendimientos de la reacción entre el sistema usando como sustrato acrilonitrilo (ensayos 1-6) y el sistema con metilmetacrilato (ensayos 7-12) se explican gracias a la facilidad de coordinación al centro metálico (Ni2+) del átomo de nitrógeno del acrilonitrilo comparado con el oxígeno presente en el metilmetacrilato. El nitrógeno es una basemás blanda que el oxígeno, y durante el ciclo catalítico se forman intermediarios y estados de transición más estables para la coordinación del sustrato con el Ni2+, como ha sido demostrado por estudios cinéticos y mecanísticos reportados previamente (29, 21).
La síntesis de líquidos iónicos de bajo punto de fusión se realizó con el fin de obtener no solamente un aumento de la actividad del catalizador y la posibilidad de reciclar el sistema IL/catalizador, sino también para una eventual mejoría de la enantioselectividad a bajas temperaturas. Por eso se realizaron ensayos catalíticos preliminares a -78 °C en los líquidos iónicos sintetizados (ensayos 11 y 12) y en [BPIC]BF4 y [OPIC]PF6 (líquidos iónicos comerciales derivados de la picolina, ensayos 5 y 6). Los resultados indican que el sistema es una opción para obtener aminas sin subproductos, pero infortunadamente el sistema muestra rendimientos moderados y no se puede reciclar.
CONCLUSIONES
Pese a que en las últimas décadas se ha visto un vertiginoso aumento de reacciones en líquidos iónicos, es necesario seguir proponiendo nuevos compuestos y estrategias que permitan alcanzar mejores rendimientos y mejor actividad de los sistemas LI/catalizador. En este trabajo se sintetizaron y caracterizaron dos LI con bajo punto de fusión (menor a -30 °C). La mezcla de estos LI con THF (1:1) sigue siendo líquida a -80 ºC, y esta característica permite utilizarlos como solventes para procesos catalíticos a bajas temperaturas. Se ensayaron entonces los líquidos iónicos sintetizados en la reacción de hidroaminación de morfolina con metilmetacrilato y acrilonitrilo, catalizadas por el complejo [Ni(Pigiphos) (NCCH3)]2+. El uso de estos LI presentó un aumento en la actividad del catalizador, con TON hasta 172, debido probablemente a la estabilización del catalizador y de los intermediarios en el ciclo catalítico. Adicionalmente, el sistema catalizador/ LI se pudo reciclar, superando así una de las limitantes de los catalizadores homogéneos. De igual manera, la posibilidad de realizar las catálisis a baja temperatura con rendimientos aceptables (hasta 76%) abre el camino hacia la obtención de aminas quirales con alta enantioselectividad.
* Después de la extracción completa de los productos y reactivos remanentes, el sistema catalizador/ LI se reutiliza, añadiendo primero la olefina (2,0 mmol), luego la amina (1,0 mmol) y dejando la mezcla de reacción durante otras 24 h en agitación constante (v.parte experimental).
REFERENCIAS BIBLIOGRAFICAS
1. Wasserscheid P.; Welton, W. Ionic Liquids in Synthesis, Weinheim: Wiley-VCH Verlag. 2002. [ Links ]
2. Dupont, J.; Suárez, P. A. Z. Physico- chemical processes in imidazolium ionic liquids. Phys. Chem. Chem. Phys. 2006. 2441-2452. [ Links ]
3. Dyson, P. Transitionmetal chemistry in ionic liquids. Transition Metal Chemistry. 2002. (4): 353-358. [ Links ]
4. Dupont, J.; De Souza, R. F.; Suárez P. A. Z. Ionic liquid (molten salt) phase organometallic catalysis. Chemical Reviews. 2002. (10): 3667-3691. [ Links ]
5. Cole Hamilton, D. J. Homogeneous catalysis - new approaches to catalyst separation, recovery, and recycling. Science 2003. (5613): 1702-1706. [ Links ]
6. Kralisch, D.; Stark, A.; Körsten, S.; Kreisel, G.; Ondruschka, B. Energetic, environmental and economic balances: Spice up your ionic liquid research efficiency. Green Chemistry. 2005. (5): 301-309. [ Links ]
7. Togni, A.; Grützmacher, H. Catalytic Heterofunctionalization. Weinheim: Wiley-VCH Verlag GmbH. 2001. [ Links ]
8. Taube, R. En B. Cornils,W.A.Hermann (Eds.). Reaction with Nitrogen compounds: Hydroamination, Vol. 1. Weinheim: Wiley-VCH. 1996. pp. 50-520. [ Links ]
9. Fadini, L.; Togni, A. Ni(II)-PPP complexes: From the hydroamination of activated olefins to the synthesis of beta-amino acids. Chimia 2004. (4): 208-211. [ Links ]
10. Hultzsch, K. C. Transition Metal- Catalyzed Asymmetric Hydroamination of Alkenes (AHA). Advanced Synthesis & Catalysis. 2005. 367-391. [ Links ]
11. Senn, H. M.; Blöchl, P. E.; Togni, A. Toward an alkene hydroamination catalyst: static and dynamic ab Initio DFT Studies. J. Am.Chem.Soc. 2000. (17): 4098-4107. [ Links ]
12. Fadini, L.; Togni, A. Ni(II) complexes containing chiral tridentate phosphines as new catalysts for the hydroamination of activated olefins. Chemical Communications. 2003 (1): 30-31. [ Links ]
13. Fadini, L.; Togni, A. Asymmetric Catalytic Hydroamination of Activated Olefins in Ionic Liquids. Helvetica Chimica Acta. 2007. (2): 411-424. [ Links ]
14. Fadini, L.; Togni, A. Asymmetric hydroamination of acrylonitrile derivatives catalyzed by Ni(II)-complexes. Tetrahedron Asymmetry. 2008. 19, 2555-2562. [ Links ]
15. Shriver, D. F.; Drezdzon, M. A. The Manipulation of air sensitive compounds. New York: JohnWilley and Sons. 1986. [ Links ]
16. Wasserscheid, P.; Keim, W. Ionic liquids - New solutions for transition metal catalysis. Angewandte Chemie-International. 2000. (21): 3773-3789. [ Links ]
17. Perrin, D. D.; Armarego, L. F. Purification of Laboratory Chemicals. Oxford: Pergamon Press. 1992. [ Links ]
18. Leitner,W. Catalysis - A greener solution. Nature 2003. (6943): 930-931. [ Links ]
19. Dzyuba, S. V.; Bartsch R. A. Recent advances in applications of room-temperature ionic liquid/supercritical CO2 systems. Angew. Chem. Int. 2003. (2): 148-150. [ Links ]
20. Sadow, A.; Haller, I.; Fadini, L.; Togni, A. Nickel(II)-Catalyzed Highly Enantioselective Hydrophosphination of methacrylonitrile. J. Am. Chem. Soc. 2004. 14704-14705. [ Links ]
21. Sadow, A. D.; Togni, A. Enantioselective Addition of Secondary Phosphines to Methacrylonitrile: Catalysis and Mechanism. J. Am. Chem. Soc. 2005. (48): 17012-17024. [ Links ]














