Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804On-line version ISSN 2357-3791
Rev.Colomb.Quim. vol.38 no.1 Bogotá Jan./Apr. 2009
CARACTERIZACIÓN BIOLÓGICA DE VARIANTES DE PLACA DE LA CEPA VACUNAL 17D CONTRA LA FIEBRE AMARILLA
BIOLOGICAL CHARACTERISATION OF YELLOW FEVER 17D STRAIN PLAQUE VARIANTS
CARACTERIZAÇÃO BIOLÓGICA DAS VARIANTES DA PLACA CEPA DA VACINA 17D CONTRA A FEBRE AMARELA
María O. Rojas1,2, Marcela Camacho1,3, María V. Grosso1
1 Facultad de Medicina, Universidad Militar Nueva Granada, Bogotá, Colombia. mariaorfarojas@yahoo.com
2 Grupo de Bioquímica, Facultad de Medicina y de Ciencias Naturales y Matemáticas, Universidad del Rosario, Bogotá, Colombia.
3 Estudiante Programa de Maestría en Microbiología, Universidad Nacional de Colombia, sede Bogotá.
Recibido: 25/06/08 - Aceptado: 04/03/09
RESUMEN
La vacuna colombiana 17D contiene por lo menos cuatro fenotipos, denominados pequeño (0,3-1,2 mm), mediano (1,3 -2,1 mm), grande (2,2 - 3,0 mm) y extra-grande (>3,1 mm). La composición y distribución porcentual de esos fenotipos variaron entre lotes y entre ampolletas de un mismo lote. Cada variante fue clonada por dilución de la vacuna y su efecto virulento fue analizado en ratones; el fenotipo de placa pequeño estuvo ligeramente sub representado en los lotes analizados y mostró una virulencia similar a la de la cepa silvestre neurotrópica francesa (DL50 >10-6), mientras que el fenotipo predominante y más atenuado fue el mediano (DL50:10-4). Los fenotipos grande y extragrande mostraron una virulencia intermedia (DL 50:10-5) con relación a los anteriores. Los análisis de secuencia de las variantes sobre una región comprendida entre el extremo 3'NS5 y el inicio de 3'NCR mostró la cercanía entre aquellas variantes con algún grado de virulencia, y entre la variante atenuada y la vacuna colombiana. La heterogeneidad de la vacuna 17D constituye una evidencia de la estructura de cuasiespecies propia de los virus RNA, y señala cómo los casos de reacciones pos vacunales adversas pueden estar asociados con la aplicación de vacunas fabricadas a partir de cepas virales atenuadas.
Palabras clave: virus fiebre amarilla, vacuna 17D, flavivirus, efectos adversos de la vacuna.
ABSTRACT
The Colombian 17D vaccine contains at least four phenotypes denominated small (0.3 - 1.2 mm), medium (1.3 - 2.1 mm) large (2.2 - 3.0 mm) and extra-large (>3.1 mm). These phenotypes composition and percentage distribution vary between different production lots and between ampoules from a particular lot. Each variant was cloned by diluting the vaccine and its virulent effect was analysed in young mice. The small plaque phenotype was slightly under represented in the lots analysed and showed similar virulence to the neurotropic French wild strain (LD50 >10-6), whilst the medium- sized phe-notype predominated and was the most attenuated (LD50:10-4). The large and extra-large phenotypes showed intermediate virulence (LD50:10-5) regarding the others. Sequence analysis of variants within the region between the 3'NS5 end and the beginning of 3'NCR showed the closeness between those variants having some degree of virulence and between the attenuated variant and the Colombian vaccine. The 17D vaccine's heterogeneity constitutes evidence of RNA virus quasi-specie structure and shows how adverse yellow fever vaccine reaction can be associated with applying vaccines produced from attenuated viral strains.
Key words: yellow fever virus, 17D vaccine, Flavivirus, adverse vaccine events.
RESUMO
A vacina colombiana 17D, contém pelo menos quatro fenótipos, denominados pequeno (0.3 - 1.2 mm), médio (1.3 -2.1mm), grande (2.2 - 3.0mm) e extra grande (>3.1 mm). A composição e distribuição percentual destes fenótipos, variou entre lotes e ampolas do mesmo lote. Cada variante foi clonada por diluição da vacina e seu efeito viral foi analisado em ratos; o fenótipo da placa pequena, esteve ligeiramente sub-representado nos lotes analisados e mostrou uma virulência similar a da cepa silvestre neurotrópica francesa (LD50 >10-6), enquanto que, o fenótipo predominante e mais atenuado foi o médio (LD50:10-4). Os fenótipos grande e extra grande mostraram um estado viral intermediário (LD50:10-5) com relação aos anteriores. As análises da seqüência das variantes sobre uma região compreendida entre o extremo 3'NS5 e o início de 3'NCR, mostrou a proximidade entre aquelas variantes com algum grau de virulência, e entre a variante atenuada e a vacina colombiana. A heterogeneida-de da vacina 17D, constitui uma evidência da estrutura de qualquer espécie própria do vírus RNA e assinala como os casos de reações pós vacinação adversas, podem estar associadas com a aplicação das vacinas fabricadas a partir das cepas virais atenuadas.
Palavras-chave: vírus febre amarela, vacina 17D, flavivius, efeitos adversos da vacina.
INTRODUCCIÓN
La fiebre amarilla es una enfermedad viral que produce disfunción hepática y renal, choque circulatorio y hemorragia. El virus pertenece a la familia flaviridae,y su transmisión selvática y urbana en áreas subtropicales la efectúan mosquitos de los géneros hemagogus y Aedes aegypty, respectivamente (1).
El virus parental de la fiebre amarilla fue aislado en Ghana en 1928 (2, 3) y atenuado por pases sucesivos en cultivo de tejidos de ratón y de pollo, dando lugar a la cepa vacunal 17D (4), a partir de la cual se derivaron las subcepas 17D 204 y 17D.
Colombia fue uno de los países autorizados por la Organización Mundial de la Salud (OMS) para producir la vacuna. Inicialmente, utilizó como semilla la subcepa Colombia 88 derivada de la 17D 204; sin embargo, posteriormente el Instituto Nacional de Salud estuvo produciendo la vacuna hasta el año 2003 a partir de una semilla importada de Biomanguin-hos, Brasil.
La vacuna viva atenuada desarrollada en 1937 por Theiler y Smith en la Fundación Rockefeller (5) ha sido considerada como una de las más seguras y eficaces, con algunos casos esporádicos de reacciones adversas (6) y un solo caso fatal en 1966 (7); sin embargo, entre 1996 y 2001 se reportaron 16 casos reconocidos como falla multisisté-mica asociada a la vacunación (8-13); dos casos adicionales de enfermedad viscero-trópica (YEL-VD) y cuatro casos de enfermedad neurotrópica (YEL-ND) fueron reportados en el año 2002 (14); desde finales de los noventa hasta 2006, se han registrado en el mundo 36 casos de enfermedad visce-rotrópica asociada a la aplicación de la vacuna producida en diferentes países (15, 16), y como consecuencia la seguridad de la vacuna se comenzó a cuestionar (9, 12, 15, 17, 18).
El análisis de los informes de vigilancia pos-vacunal en Europa después de la distribución de más de tres millones de dosis de ARILVAXTM permitió conocer que entre 1991 y 2001 se presentaron cuatro casos de efectos adversos relacionados con viscerotropismo y cuatro con neurotropismo (19); posteriormente, se informó un caso de enfermedad vis-cerotrópica en una mujer joven, quien murió después de haber sido vacunada con la subcepa 17D 204 en España (18).
Mientras la enfermedad neurotrópica asociada a la vacunación ha sido reconocida desde hace 60 años, la enfermedad viscerotrópica sólo lo ha sido muy recientemente (15, 18-20).
Lo anterior sugiere que no se puede desconocer una relación directa entre la vacuna misma y sus efectos adversos, y que el número de casos muy seguramente está subestimado por falta de control pos-vacunal.
La mayoría de los investigadores considera que los efectos adversos asociados a la vacuna están ligados a factores genéticos o a reacciones idiosincráticas del huésped (9, 12, 21, 22); sin embargo, nosotros pensamos que la heterogeneidad de la vacuna (23-26) es un factor importante que debe ser considerado.
Aunque Liprandi mencionó que la cepa utilizada en Suramérica era homogénea en cuanto a sus características fenotípicas (23), no hay datos reportados hasta la fecha. En este estudio, se caracterizó biológicamente (tamaño en placa, virulencia en ratones y secuencia genómica) la vacuna producida en Colombia, como un primer paso para validar la hipótesis que se plantea sobre el compromiso de la preparación vacunal con los problemas que está produciendo.
MATERIALES Y MÉTODOS
Células y virus
Para el cultivo del virus se utilizaron células Vero (ATCC - CCL 81); paralos análisis morfológicos del virus se partió de ampolletas liofilizadas procedentes de los lotes 685 y 771 producidos en el Instituto Nacional de Salud (INS) en los años 1998 y 2000, respectivamente. La vacuna procedente del lote 685, considerada como de referencia por el INS, tenía un título de 1,7x106 UFP/mL y la del lote 771, 1,9x104UFP/mL.
Las cepas silvestres Neurotrópica francesa (B-569) y Asibi (B-570) se emplearon como controles positivos de crecimiento e infección viral, tanto en los experimentos de análisis morfológicos como en los de virulencia en ratones.
Infección y detección del virus
Básicamente se utilizó el mismo método recomendado por la Organización Mundial de la Salud para probar la potencia de la vacuna (27). Brevemente, los cultivos confluentes de células Vero (células de ri-ñón de mono), se crecieron en cajas de Petri de 90 mm2 o en cajas de cultivo de 24 pozos, y se inocularon con la suspensión viral (1 mL y 100 ,«L, respectivamente). Después de permitir la adsorción del virus por 1 h a 37 oC en una atmósfera de 5% de CO2, la monocapa de células se cubrió con 10 mL de 0,5% de agarosa (Sigma A4018) en medio M-199 (Gibco- BRL) suplementado con 4% de suero fetal bovino (SFB). Después de 8 días de incubación, las células se fijaron por 30 minutos con formal-dehido al 8% y se tiñeron con cristal violeta al 1% en metanol al 70%.
Análisis morfológico de la subcepa vacunal colombiana
De cada lote de producción constituido por 10.000 ampolletas, se analizaron 25 escogidas aleatoriamente (n = 25) mediante el programa estadístico Statistical Analisis System (SAS), fijando un nivel de confianza de 90% y una prevalencia de 0,9. Cada ampolleta se resuspendió en 1 mL de medio M-199, se diluyó hasta 1024 (factor 1:4) con el mismo medio, y se inoculó sobre células Vero confluentes en cajas de Petri de 90 mm, las cuales se cultivaron como se describió anteriormente. Como control positivo de infección se utilizó la cepa silvestre Asibi (B-570), y como control de crecimiento celular se utilizaron monocapas de células Vero sin infectar. El diámetro en mm de las placas virales se midió a través de un estereoscopio Zeiss (Stem 2006, objetivo 10X, zoom 1X) equipado con una re-glilla en el ocular; para el análisis de los datos se utilizó el programa SAS.
Aislamiento de las variantes y confirmación de tamaños
El aislamiento de las variantes de placa a partir de la vacuna se hizo por dilución límite hasta obtener placas individuales; la vacuna fue resuspendida en 1 mL de medio M-199, y diluida serialmente (factor 1:4), como recomienda el protocolo de la OMS para la determinación de la potencia de la vacuna (27). De la dilución 1:4096, se utilizaron por duplicado 25, 50 y 100 µL en cada ensayo.
Después de 8 días de cultivo, se separó el sobrenadante de cada pozo y se mantuvo en hielo hasta definir la presencia de una sola placa, por coloración con cristal violeta. Los sobrenadantes de los cultivos con placas individuales (Figura 1), fueron crio-preservados en DMSO al 7%, FSB al 10%, por 1 hora a 4 oC, seguido de 1 hora a -20 oC, y finalmente almacenados a -70 oC. Siguiendo el criterio de Liprandi (23), cuando la infectividad de los cultivos mostró placas individuales (Figura 1), los sobrenadantes se consideraron "variantes purificadas". Para confirmar los rangos de tamaño, cada variante se pasó una vez en cultivo siguiendo el procedimiento ya descrito.
Pruebas de virulencia
Siguiendo las recomendaciones de la OMS, se utilizaron familias de seis ratones (cepa ICR Swiss albino), hembras de cuatro semanas, las cuales fueron inoculadas intracranealmente y por duplicado con 0,02 mL de las diluciones 10-4,10-5 y 10-6 de cada variante. Se utilizaron títulos del orden de 106 UFP/mL. Además de los controles de infección, se utilizó, como control de inocuidad, una mezcla del medio criopreservante (DMSO, SFB, medio M-199) y BSA (diluyente de la cepa silvestre liofilizada), y como control negativo se mantuvo una familia de seis ratones sin infectar.
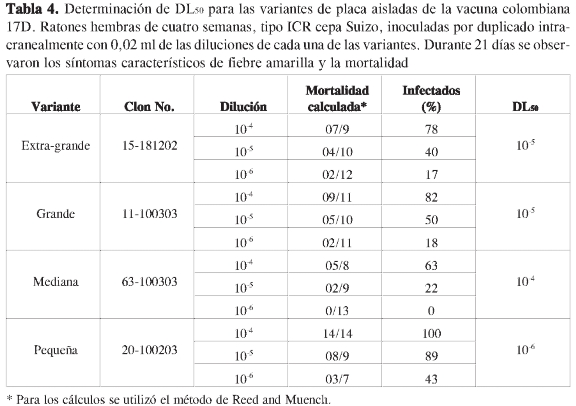
Durante 21 días se controló la aparición de síntomas de la enfermedad (postración, adinamia, pérdida de peso, temblor, incordinación motora y parálisis de miembros posteriores), así como el número de ratones muertos. Se calculó la dosis letal 50 (DL50) utilizando el método de Reed and Muench (28), y se estableció la significancia estadística de los resultados mediante la prueba de comparación de medias de Tukey (29).
Obtención de RNA viral
La extracción y purificación del RNA viral se hizo utilizando el Kit High Pure Viral Nucleic Acid (ROCHE), de acuerdo con las recomendaciones del fabricante. Brevemente, se tomaron 200 µL de la preparación viral y se mezclaron con 200 µL de solución de lisis (6 M guanidina HCl, urea 10 mM, Tris-HCl 10 mM, triton X100 20%, 4mg/mL poli A-RNA) y 1,8 mg/mL de proteinasa K. La mezcla, se incubó a 72 oC por 10 minutos, se mezcló con 100µL de isopropanol al 100% y se filtró a través de una membrana de fibra de vidrio permitiendo un tiempo de contacto de un minuto. Se centrifugó a 8000xg por 1 minuto y se lavó una vez con 500 µL de tris-HCl 20 mM, guanidina HCl 5 M, pH 6,6, y dos veces con 450 µL de NaCl 20 mM, Tris HCl 2 mM, pH 7,5. El RNA, se eluyó con agua libre de nucleasas y se congeló a -70 oC.
Amplificación y análisis de secuencias específicas
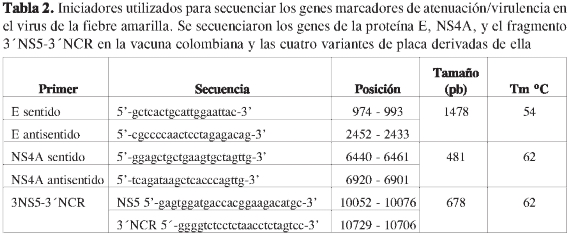
Los genes completos de las proteínas E y NS4A, y parte de la proteína NS5 y de la región 3' no codificadora (fragmento CS2), se amplificaron utilizando las secuencias iniciadoras que aparecen en la Tabla 2. Para la transcripción reversa y la síntesis de cDNA, se usó el Kit ThermoS-criptTM RT-PCR System (Invitrogen). Se tomaron 0,5 µL de la preparación de RNA obtenida a partir de 106 UFP/mL; para la proteína E, se usó como iniciador un E antisentido, y para NS4A y el fragmento CS2, hexámeros construidos al azar (provistos por el kit).
Las reacciones de PCR se realizaron utilizando 2 µL de la preparación de cDNA, 1,5u DNA polimerasa (High Platinum Taq Polimerasa, Invitrogen), 2,5 mM de MgSO4,0,2 µM de cada uno de los iniciadores específicos y 5 µLde solución tampón (600 mM Tris-SO4 pH 8,9, 180 mM sulfato de amonio). La de-naturación inicial fue a 94 oC por 5 minutos, seguida de 30 ciclos de amplificación (95 oCpor1min,54o62oC, por 1 miny72oC por 1,5 min) y de una extensión a 72 °C por 5 minutos. Los productos de amplificación se separaron por electroforesis en geles de agarosa (sigma 9539) al 1%, se purificaron y se secuen-ciaron en ambos sentidos con los mismos iniciadores utilizados en las reacciones de PCR y mediante un sistema comercial (MACROGEN Inc.).
Las secuencias de nucleótidos de los genes E, NS4A y la región 3'NCR fueron comparadas con las reportadas para cepas prototipo de fiebre amarilla: Asibi (Gen Bank K02749) y 17DD (Gen Bank U17066) por alineamientos múltiples con el programa Clustal W 1.6 (30). Los parámetros de alineamiento fueron por defecto, de acuerdo con lo preestablecido por el programa. La secuencia deducida de aminoácidos se obtuvo mediante el programa TransSeq de EMBOSS, e igualmente se compararon con las reportadas para las cepas parentales.
Las diferencias de secuencia entre las poblaciones derivadas de la vacuna con las cepas Asibi y 17D original, se analizaron mediante algoritmos UPGMA (Mega 2 program) (31) construidos con base en una secuencia de 302 nucleótidos del extremo 3'terminal del gen NS5, seguida de 375 nucleótidos de la región 3' no codificadora (fragmento CS2) para las cuatro variantes de placa.
La distancia genética se determinó por el método de la distancia proporcional (Dis-tancia-p) dando igual peso a las transiciones y transversiones para las tres posiciones del codón. La construcción de los árboles filogenéticos se hizo de acuerdo con Saitou, 1987 (32).
RESULTADOS Y DISCUSIÓN
Caracterización morfológica de la semilla vacunal 17D
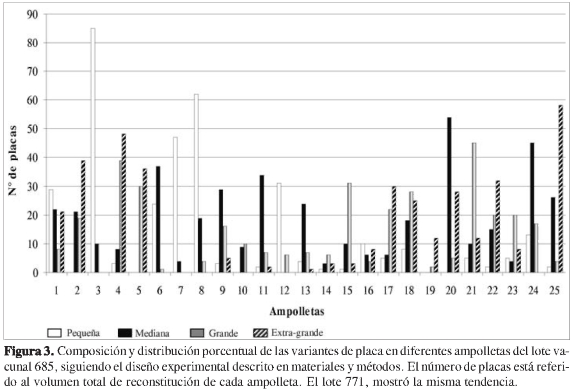
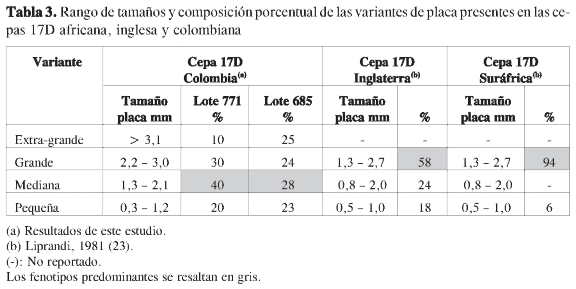
El cultivo in vitro del virus procedente de los dos lotes de vacuna producidos en Colombia mostró placas de lisis de tamaños diferentes, lo cual indica la presencia de por lo menos cuatro variantes fenotípicas; el diámetro en mm de las placas varió entre 0,3 y 4,0 mm. Según los análisis estadísticos, la distribución por tamaño de esas variantes en la vacuna fue heterogénea y permitió distinguir placas pequeñas (0,3-1,2 mm), medianas (1,3-2,1 mm), grandes (2,2-3,0 mm) y extra-grandes (>3,1 mm). La composición porcentual de cada variante fue diferente por lote, entre lotes y aun entre ampolletas del mismo lote (Figuras 2 y 3).
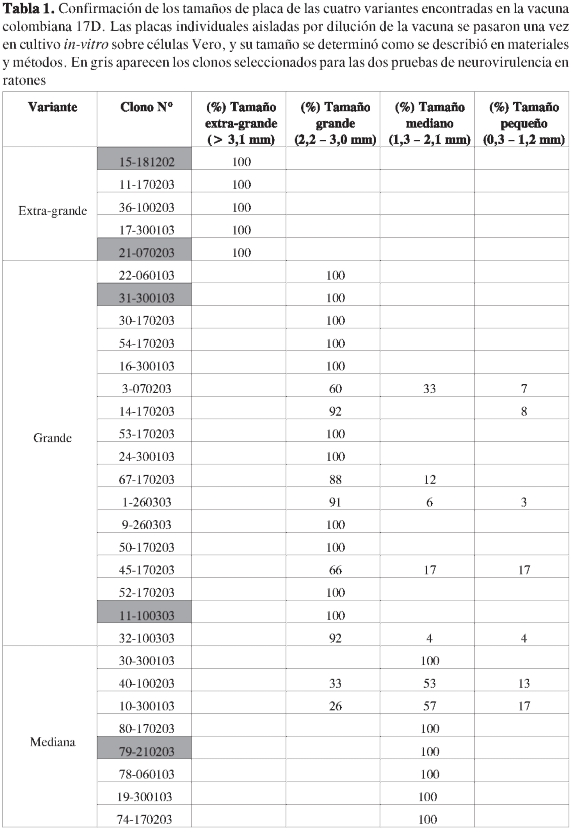
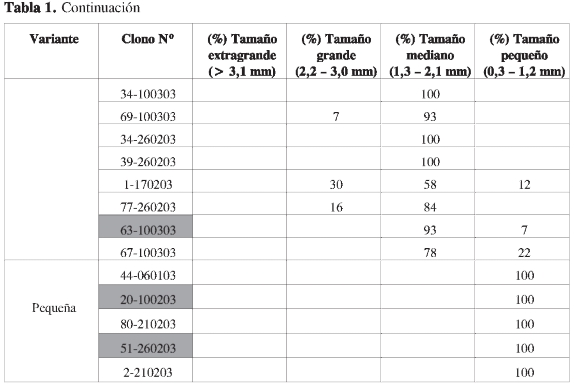
El tamaño de cada variante fue confirmado por re-infección de células Vero. Con las variantes pequeñas y extra-grandes, el tamaño de las variantes obtenidas después de un solo pase en cultivo correspondió al establecido previamente (Tabla 1). Con las placas grandes, la progenie correspondió a una mezcla de placas medianas y pequeñas, y a su vez el fenotipo de placas medianas originó una mezcla de placas grandes y pequeñas, cuyo porcentaje fue variable en los diferentes ensayos (Tabla 1); sin embargo, en todos los casos hubo un predominio superior al 50% del fenotipo inicialmente definido.
En 1981, Liprandi había reportado la presencia de variantes de placa en las preparaciones 17D Inglesa y Surafricana, las cuales diferían en virulencia, y había señalado que la cepa usada en Suramérica tenía una distribución homogénea en cuanto al tamaño de placa (23). Sin embargo, en este estudio, en dos lotes de la vacuna que se produjo en Colombia con una diferencia de dos años, se demostró que existen por lo menos cuatro variantes fenotípicas representadas por diferentes tamaños de placa producidos en cultivo in vitro, que van desde muy pequeñas a extra-grandes de acuerdo con los rangos establecidos.
Los rangos de tamaño reportados por Liprandi para la subcepa 17D son similares a los encontrados en la vacuna colombiana, mas no la composición porcentual, la cual es diferente entre los dos lotes analizados (Tabla 3); el fenotipo predominante en las cepas 17D analizadas por Li-prandi fue el grande (23), mientras que en la vacuna colombiana fue el mediano.
Adicionalmente, en la vacuna colombiana se advirtió la presencia de un fenotipo de mayor tamaño (>3,1 mm) no reportado anteriormente, que se reconoció como tal bajo un estricto control de las condiciones de cultivo, para descartar la posibilidad de artefactos experimentales.
Después de casi tres décadas desde las primeras observaciones de Liprandi, y a pesar de los reportes de estabilidad de las cepas vacunales, no se puede descartar que esta población corresponda a una variante seleccionada del virus o a un producto de mutaciones en el genoma (23, 33), que desde luego tendría que comprobarse por otros estudios.
La gran variabilidad encontrada en la distribución y composición viral entre ampolletas de un mismo lote (Figura 3), fue evidente en 84% de las ampolletas analizadas. Es importante señalar que aunque en los dos lotes predominó ligeramente la variante de placa más atenuada (fenotipo mediano) (Figuras 2 y 3), en algunas ampolletas (Nos. 1, 3, 7, 8 y 12) (Figura 3) la variante más virulenta (fenotipo de placa pequeña) mostró el mayor crecimiento con respecto a las otras. Estos resultados establecen la posibilidad de que en el huésped pueda llevarse a cabo una selección preferencial de alguna de esas poblaciones que por sus características biológicas potencie la enfermedad, lo cual explicaría por qué con los mismos lotes se pueden obtener respuestas diferentes en individuos susceptibles vacunados con "la misma preparación". Sin embargo, para confirmar esta hipótesis es preciso continuar con la caracterización de las subcepas virales utilizadas en la fabricación de la vacuna.
En el proceso de aislamiento y confirmación de tamaños de las variantes, en algunos casos aparecieron poblaciones mezcladas, posiblemente como resultado de fallas en el procedimiento de aislamiento más que de mutaciones ocurridas durante la amplificación en cultivo (Tabla 1).
Neurovirulencia en ratones de las variantes de placa
Para los ensayos de virulencia se utilizaron aquellas placas que en el primer pase en cultivo dieron una progenie fenotípica-mente igual a la de origen (Tabla 1, sombreados en gris). Las variantes virales presentaron títulos en un rango entre 106y 108 UFP/mL, correspondiendo los más bajos al fenotipo de placa pequeña y el más alto al mediano. Para los otros dos fenotipos, los títulos fueron similares (106 a 108 UFP/mL). Esporádicamente se obtuvieron títulos por debajo de 104 UFP/mL o por encima de 109 UFP/mL.
La obtención de títulos mayores en la población atenuada con respecto a la virulenta, en la cual el crecimiento mostró un orden de magnitud menor, puede estar relacionada con la generación de partículas defectuosas durante la replicación.
En los ratones inoculados con la cepa silvestre, al cuarto día se observaron los primeros síntomas de decaimiento, inactividad, postración, pérdida del apetito, erizado del pelaje (pilorización), en algunos casos temblores, incoordinación motora, afección de los ojos y hasta parálisis de uno de los miembros posteriores. Al quinto día, empezaron a producirse las muertes, y al octavo, ya habían fallecido todos.
Generalmente, al sexto día de inoculación, se presentaron los primeros síntomas de enfermedad, como inapetencia y pilorización; el fenotipo de placa pequeña exacerbó los síntomas al séptimo día, generando postración, temblor e incoordinación motora, y produciendo las primeras muertes al octavo día, en una mayor proporción que para las otras variantes. Esta tendencia de mayor letalidad (83%) se mantuvo durante los días siguientes, hasta que prácticamente se eliminó 80% de los animales. Los fenotipos de tamaño grande y extra-grande mostraron un comportamiento muy similar (58% y 51%, respectivamente) mientras que el de placa mediana fue el más benigno permitiendo síntomas leves y una menor letalidad (35%). La comprobación de estos resultados mediante un segundo experimento mostró tendencias similares.
Los ratones de los controles negativos, una vez terminado el experimento, fueron retados con la cepa silvestre para confirmar su susceptibilidad al virus de la fiebre amarilla, obteniéndose una mortalidad de 100% entre el día quinto y octavo después del reto. Los controles de inocuidad permanecieron normales.
En la Tabla 4 se muestran los valores calculados de DL50. Los más altos (10-4) correspondieron a la variante de tamaño mediano, y los más bajos (10-6) a la de tamaño pequeño, mientras que para el extra-grande y el grande estuvieron en el mismo orden de magnitud (10-5). Las diferencias en la virulencia así calculadas (método de Reed and Muench) fueron estadísticamente significativas, lo cual permitió establecer tres categorías de virulencia: atenuada (variante mediana), virulenta (variante pequeña) y medianamente virulenta (variantes grande y extragrande).
Puesto que los virus del género flavivirus, familia Flaviviridae, son generalmente neurotrópicos y exhiben varios grados de neurovirulencia en roedores y en primates (33, 34), es posible distinguir diferencias entre las cepas del virus de la fiebre amarilla, precisamente con base en esas características. La Organización Mundial de la Salud apoyada en esos criterios, establece los procedimientos para los estudios de potencia y la determina-cióndelaDL50delavacuna, dentrodelos cuales, la utilización de familias de animales, así como el número para utilizar por experimento están indicados; aquí, se establecieron las diferencias en virulencia entre las variantes encontradas en la vacuna colombiana, siguiendo esas directrices (27, 33, 34).
Con la utilización de las progenies que en un solo pase en cultivo generaron los tamaños predeterminados para cada una de ellas, se buscó asegurar que la patología provocada en el huésped correspondiera a cada variante específica, y con el manteniendo de los mismos títulos para todas se quiso asegurar que el efecto virulento no estuviera influido por la cantidad de virus inoculado.
Los resultados de dos experimentos permitieron establecer que el fenotipo de placa mediana se comportó en forma similar al virus vacunal, el de placa pequeña a la cepa silvestre, mientras que los grandes y extra-grandes tuvieron un comportamiento intermedio entre los anteriores.
En los dos lotes analizados hubo un ligero predominio del fenotipo atenuado; sin embargo, es importante tener en cuenta que la variante más virulenta, aunque solo representó 20% de la población viral total, no se debe considerar despreciable, máxime si se tiene en cuenta que laposibi-lidad de selección preferencial durante la replicación del virus puede ser favorecida por el huésped en virtud de su idiosincrasia. Esto podría ser una causa potencial de los problemas adversos de la aplicación de una vacuna heterogénea como la que se tiene hasta el momento.
Amplificación de regiones específicas y análisis de secuencia
El análisis de secuencia de cada variante de placa se hizo sobre tres regiones del genoma, en las cuales se han reportado eventos de mutación asociados con atenuación/virulencia (35-40). Los tres fragmentos de DNA amplificados para los genes de las proteínas E, NS4 y la región NS5-3'NCR (CS2) correspondieron en tamaño a lo esperado para las variantes analizadas. Las comparaciones de secuencia de nucleótidos y su respectiva secuencia de aminoácidos, deducida de la secuencia de las proteínas E y NS4A, no evidenciaron cambios entre la vacuna colombiana y las cuatro variantes fenotípicas aisladas. La región denominada CS2, constituida por la porción terminal del gen de la proteína no estructural NS5 y parte de la región 3'no codificadora (41), permitió encontrar diferencias en el agru-pamiento de las variantes derivadas de la vacuna colombiana, que se muestran en la Figura 4.
Los alineamientos múltiples para los genes E y NS4, no mostraron mutaciones que pudieran asociarse con reversión a virulencia, como se hubiera esperado especialmente para las variantes de placa pequeña.
El hecho de que la secuencia de la vacuna colombiana, al igual que la de otras vacunas, corresponda al promedio de todas las variantes que contienen, disminuye la posibilidad de encontrar diferencias entre ellas después de su aislamiento. Sin embargo, no se puede descartar que haya cambios en otras regiones del genoma que expliquen el comportamiento virulento o atenuado de las variantes, y por ello proponemos continuar los estudios sobre otros genes y sobre el material aislado de los ratones después de la infección.
Los análisis de distancias genéticas obtenidos para las variantes de placa, las cepas parentales (Asibi y 17D) y la vacuna colombiana (Figura 4A), muestran un agrupamiento entre ellas de acuerdo con su efecto virulento en ratones y la cercanía con la vacuna colombiana. La separación entre la cepa parental Asibi y la vacuna 17D original (tomada de la literatura) se mantiene como era de esperarse. El análisis molecular de las cuatro variantes de placa presentes en la vacuna colombiana basado en el fragmento CS2 muestra las distancias que existen entre ellas, el agrupamiento alrededor de la vacuna colombiana analizada y la lejanía que han ido ganando con respecto a la preparación original (Figura 4), lo cual podría asociarse con la aparición de nuevos fenotipos.
Vale la pena destacar que en los dos casos, la variante atenuada está más cerca de la cepa vacunal que aquella que presentó la mayor virulencia en ratones. El hecho de que los fenotipos atenuados (CS2-63-1 y CS2- 79-1) estén más cercanos a la vacuna que aquellos con algún grado de virulencia, establece la posibilidad de trabajar en la selección de variantes con características óptimas que puedan sustituir la semilla heterogénea actual y evitar posiblemente los problemas que está originando. Desde luego, debe tenerse especial cuidado en escoger variantes que conserven la eficacia de la vacuna actual, de tal forma que pueda obviarse el argumento de mantener la heterogeneidad para preservar la eficacia de acuerdo con lo expuesto por Barret (42).
CONCLUSIONES
1. Sedemostróquelacepavacunaluti-lizada para la fabricación de la vacuna colombiana contra la fiebre amarilla posee por lo menos cuatro variantes fenotípica-mente diferenciadas por el tamaño de placa producido en cultivo in vitro.
2. Se definió un fenotipo de gran tamaño (placas extra-grandes) presente en los dos lotes analizados, no reportado anteriormente.
3. Se demostró una correlación con significancia estadística entre las variantes aisladas y su efecto de virulencia en ratones, lo cual sugiere que la heterogeneidad de la vacuna puede ser un factor determinante en la aparición de efectos adversos, debido a la posibilidad de amplificación selectiva de una variante por un huésped determinado.
AGRADECIMIENTOS
Este trabajo fue financiado por la Universidad Militar Nueva Granada, el Banco de la República (Contrato No. 200229), la Universidad del Rosario y Aventis Pasteur Colombia.
REFERENCIAS BIBLIOGRÁFICAS
1. Burke, D. S.; Monath, T. P. Flavivi-ruses. In: D. M. Knipe, P. M. How-ley, D. E. Griffin, R. A. Lamb, M. A. Martin, B. Roizman, S. E. Straus (Eds.). Fields Virology. 2001. pp. 1043-1126. [ Links ]
2. Stokes, A.; Bauer, J. H.; Hudson, N. P. The transmition of yellow fever to Macacus rhesus, preliminary note. J. A. Med Assoc. 1928. 90: 253-254. [ Links ]
3. Mathis, C.; Sellards, A. W.; Lai-gret, J. Sensibilité du Macaca rhesus au virus de la fièvre jaune. Comptes Rendus deL'Academie des Sciences. 1928. 188: 604-606. [ Links ]
4. Lloyd, W.; Theiler, M.; Ricci, N. I. Modification of the virulence of yellow fever virus by cultivation in tissues. Trans. R. Soc. Trop. Med. and Hygiene. 1936. 29: 481-529. [ Links ]
5. Theiler, M.; Smith, H. H. The use of yellow fever virus modified by in vitro cultivation for human immunization. J. Exp. Med. 1937. 65: 787-800. [ Links ]
6. Stuart, T. Reactions following vaccination against yellow fever. Yellow fever vaccination. World Health Organization Monograph Series No. 30. 1956. pp. 143-189. [ Links ]
7. Anonymus. Fatal virus encephalitis following 17D yellow fever vaccine inoculation. J. Am. Med. Assoc. 1966. 198: 671-672. [ Links ]
8. Adhiyaman, V.; Oke, A.; Cefai, C. Effects of yellow fever vaccination. Lancet 2001. 358: 1907-1908. [ Links ]
9. Chang, R. C.; Penny, D. J.; Little, D.; Caarter, I. W.; Roberts, J. A. et al. Hepatitis and death following vaccination with 17D-204 yellow fever vaccine. Lancet 2001. 358: 121-126. [ Links ]
10. Martin, M.; Tsai, T. F.; Cropp, B.; Chang, G.-J. J.; Holmes, D. A. etal. Fever and multisystem organ failure associated with 17D-204 yellow fever vaccination: a report of four cases. Lancet 2001. 358: 98-104. [ Links ]
11. Troillet, N.; Laurencet, F. Effects of yellow fever vaccination. Lancet 2001. 358: 1908-1909. [ Links ]
12. Vasconcelos, P. F. C.; Luna, E. J.; Galler, R.; Silva, L. J.; Coimbra, T. L. et al. Serious adverse events associated with yellow fever 17D vaccine in Brazil: a report of two cases. Lancet 2001. 358: 91-97. [ Links ]
13. Werfel, U.; Popp, W. Effects of yellow fever vaccination. Lancet 2001 . 358: 1909. [ Links ]
14. Levy, S.; Mullane, K.; Millar, M. et al. Adverse events associated with 170 derived yellow fever vaccination. United Status, MMWR. 2002. 51: 983-989. [ Links ]
15. Belsher J.; Gay, P.; Brinton, M.; Della Valla, J.; Didenour, R. et al. Fatal multiorgan failure due to yellow fever vaccine-associated visce-rotropic disease. Vaccine. 2007. 25: 8480-8485. [ Links ]
16. Vellozzi, C.; Mitchell, T.; Miller, E. et al. Yellow fever vaccine associated viscetropic disease (YEL-AVD) and corticosteroid therapy: eleven United States case, 1996-2004. Am. J. Trop. Med. Hyg. 2006. 75(2): 333-336. [ Links ]
17. Marianneau, P.; Georges-Courbot, M.-C.; Deubel, V. Rarity ofadverse effects of 17D yellow fever vaccination. Lancet. 2001. 358: 84-85. [ Links ]
18. Doblas, A.; Domingo, C.; Bae, H. G.; Bohôrquez, C. L.; Ory, F. de; Niedrig, M.; Mora, D.; Carrasco, F. J.; Tenorio, A. Yellow fever vaccine-associated viscerotropic disease and death in Spain. Journal of Clinical Virology. 2006. 36(2): 156-158. [ Links ]
19. Kitchener, S. Viscerotropic and neurotropic disease following vaccination with the 17D yellow fever vaccine, ARILVAX. Vaccine. 2004. 22: 2103-2105. [ Links ]
20. Engel, A.; Vasconcelos, F.; McArthur, M. and Barret, A. Characterization of a viscerotropic yellow fever vaccine variant from a patient in Brazil. Vaccine. 2006. 24(15): 2803-2809. [ Links ]
21. Galler, K. V.; Pugachev, et ál. Phe-notypic and molecular analysis ofye-llow fever 17D vaccine viruses associated with seriuos adverse events in Brazil. Virology. 2001. 290: 309-319. [ Links ]
22. Monat, T. P.; Cetron, M. S.; McCarthy, K. et ál. Yellow fever vaccine safety an immunogenicity in the eldery. Human vaccine. 2005. 1(15): 207-214. [ Links ]
23. Liprandi, F. Isolation of plaque variants differing in virulence from the 17D strain of yellow fever virus. J. Gen. Virol. 1981. 56: 363-370. [ Links ]
24. Post, P.; Santos, C.; Carvalho, R.; Lopes, O.; Galler, R. Molecular analisis of yellow fever virus 17D vaccine strain. Mem. Inst. Oswaldo Cruz. 1991. 86(2): 239-246. [ Links ]
25. Galler, R.; Post, P.; Santos, C.; Ferreira, I. Genetic variability among yellow fever virus 17D substrain. Vaccine. 1998. 16 (9/10): 1024-1028. [ Links ]
26. Pugachev, K.; Ocran, S.; Guirakoo, F.; Furby. D.; Monath, T. Heterogeneous nature of the genome of the ARILVAX yellow fever 17D vaccine revealed by consensus sequencing. Vaccine. 2002. 20: 996-999. [ Links ]
27. WHO. Expert committee on biological standardization. Requirements for yellow fever vaccine. 1976. Tech. Rep. Ser. No. 594. [ Links ]
28. Reed, L. J.; Muench, H. A simple method of stimating fifty per cent endpoints. A. J. Hygiene. 1938. 27(3): 493-497. [ Links ]
29. Cochran, W.; Cox, G. M. Experimental designs. Ed. John Wiley and Sons. 1974. p. 400. [ Links ]
30. Thompson, J. D.; Higgins, D.G.; Gibson, T.J. Clustal W: Improving the sensitivity of progressive multiple sequence alignment through sequence weighting, position-specific gap penalties and weight matrix choice. Nucleic Acids Res. 1994. 22: 4673-4680. [ Links ]
31. Kumar, S.; Tamura, K.; Jakobsen, I.; Nei, M. MEGA2: Molecular Evolutionary Genetics Analysis software. 2001. Arizona State University, USA. [ Links ]
32. Saitou, N.; Nei, M. The heigh-bor-joining method: a new method for reconstruction phylogenetic trees. Mol. Biol. Evol. 1987. 4: 406-425. [ Links ]
33. Fitzgeorge, R.; Bradish, C. J. The in vivo differentiation of strains of yellow fever virus in mice. J. Gen. Virol. 1980. 46: 1-1337. [ Links ]
34. Barrett, A.; Gould, E. Comparison of the neurovirulence of different strains of yellow fever virus in mice. J. Gen. Virol. 1986. 67: 631-637. [ Links ]
35. Galler, R.; Freire, M.; Jabor, A.; Mann, G. F. The yellow fever 17D vaccine virus: molecular bases ofvi-ral attenuation and its use as an expression vector. Brazilian Journal of Medical and Biological Research. 1997. 30: 157-168. [ Links ]
36. Xie, H.; Tyman, K. D.; Campbell, G. A.; Barret, A. Mutation in NS5 protein attenuates mouse neurovirulence of yellow fever 17D vaccine virus. J. Gen. Virol. 1998. 79: 1895-1899. [ Links ]
37. Ryman, K. D.; Ledger, T. N.; Campell, G. A.; Watowich, S. J.; Barret, A. Mutation in a 17D-204 vaccine substrain-specific envelope protein epitope alters the pathogenesis of yellow fever virus in mice. Virology. 1998. 244: 59-65. ' [ Links ]
38. Holbrook, M.; Li, L.; Suderman, M.; Wang, H.; Barret, A. The French neurotropic vaccine strain of yellow fever virus accumulates mutations slowly during passage in cell culture. Virus Research. 2000. 69: 31-39. [ Links ]
39. Arroyo, J.; Guirakoo, F.; Fenner, S.; Zhang, Z.; Monath, Th.; Chambers, T. Molecular bases for attenuation of neurovirulence of a yellow fever virus Japanese encephalitis virus chimera vaccine (ChimeriVax-JE). J. Virol. 2001. 75(2): 934-942. [ Links ]
40. Monath, T.; Arroyo, J.; Levenbook, I.; Zhang, Z.; Catalan, J.; Draper, K.; Guirakoo, F. Single mutation in the flavivirus envelope protein hinge region increases neurovirulence for mice and monkeys but decreasse vis-cerotropism for monkeys: relevance to development and safety testing of live, attenuated vaccines. Journal of Virology. 2002. 76(4): 1932-1943. [ Links ]
41. Fulop, L. D.; Barret, A. D. T. Rapid identification of flavivirus based on conserved NS5 gene sequences. J. Virol. Methods. 1993. 44: 179-188. [ Links ]
42. Barret, A. D. Yellow fever vaccines. Biologicals. 1997. 25: 17-25. [ Links ]