Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Colombiana de Química
versión impresa ISSN 0120-2804versión On-line ISSN 2357-3791
Rev.Colomb.Quim. v.38 n.1 Bogotá ene./abr. 2009
ß (1,3) GLUCANASAS DE LOS ESPACIOS INTERCELULARES DE HOJAS DE TOMATE LYCOPERSICON ESCULENTUM CERACIFORME DESPUÉS DE INFECCIÓN CON PHYTOPHTHORA INFESTANS
ß (1,3) GLUCANASE FROM INTERCELLUAR SPACE OF TOMATO LEAVES (LYCOPERSICON ESCULENTUM CERACIFORME) AFTER INFECCIÓN WITH PHYTOPHTHORA INFESTANS
ß (1,3) GLUCANASAS DOS ESPACIOS INTERCELULARES DE FOLHAS DE TOMATE LYCOPERSICON ESCULENTUM CERACIFORME DEPOIS DE INFECCAO COM PHYTOPHTHORA INFESTANS
Carolina Salas, Humberto M. Zamora1
1 Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia, sede Bogotá, Bogotá, Colombia. hmzamorae@unal.edu.co
Recibido: 10/11/08 - Aceptado: 27/03/09RESUMEN
En este trabajo se analizó el líquido de lavado intercelular de Lycopersicon escu-lentum ceraciforme L1568 perteneciente al germoplasma nacional con resistencia en campo a P. infestans el cual mostró la presencia de cuatro ß (1,3) glucanasas después de infección con el patógeno.
Para tal efecto las plantas se inocularon con el patógeno con el fin de inducir aumento en la concentración de las proteínas PR y otras sustancias relacionadas con defensa; 15 días después de la inoculación con el parásito, se extrajo el líquido de lavado intercelular de las hojas de tomate utilizando agua. Las proteínas con actividad de ß (1,3) glucanasa extraídas se liofilizaron, se resuspendieron en búfer, se purificaron utilizando cromatografía de exclusión, intercambio iónico y electroforesis preparativa.
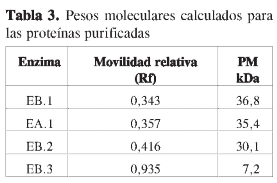
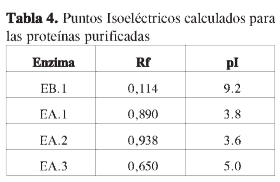
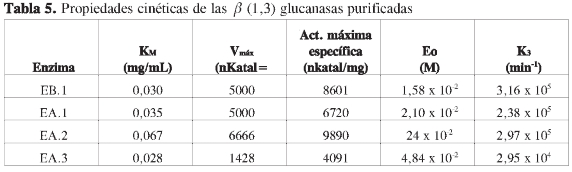
Los resultados de caracterización parcial, mostraronlaexistenciadeuna ß (1,3) glucanasa básica con peso molecular de 36,8 kDa y pI 9,2 y tres ß (1,3) glucanasas ácidas de 35,4; 30,1 y 7,2 kDa con puntos isoeléctricos de 3,8; 3,6 y 5,0 respectivamente. Adicionalmente se determinaron las propiedades cinéticas de cada enzima, KM, Vmáx,Eo yK3 encontrando, de acuerdo con los resultados obtenidos, que la proteína básica no ha sido reportada en la literatura relacionada con tomate.
Palabras clave: espacios intercelulares, ß (1,3) glucanasas, proteínas PR relacionadas con patogenicidad, hojas, tomate.
ABSTRACT
In this paper was analysed the intercellular washing fluid of Lycopersicon esculentum ceraciforme L1568 belonging to the national germplasm with resistance to P. infestans in field which showed the presence of four ß (1,3) glucanases after infection with the pathogen.
For this purpose the plants were inoculated with the pathogen to induce a concentration increase of PR proteins and other defence-related substances, 15 days after inoculation with the parasite was extracted the intercellular washing fluid of tomato leaves using water.
The proteins with ß(1,3) glucanase activity were extracted, freeze-dried and re-suspended in buffer solution and were purified using exclusion chromatography, ion exchange chromatography and preparative electrophoresis.
The results of partial characterization showed the presence of a basic ß (1,3) glucanase with a molecular weight of 36.8 kDa and pi 9.2 and three ß (1,3) glu-canase acid 35.4, 30.1 and 7.2 kDa with isoelectric points of 3.8, 3.6 and 5.0 respectively. Additionally it was determined the kinetic properties of each enzyme, KM,Vmax, and Eo,K3, according to the results, the basic protein has not been reported in the literature related to tomato.
Key words: intercellular space, ß (1,3) glucanases, PR (pathogenesis related) proteins, leaves, tomato.
RESUMO
Este trabalho analisou o líquido de lavado intercelular de Lycopersicon esculentum ceraciforme L1568 pertencente ao ger-moplasma nacional com resistência em campo a P. infestans, mostrau a presença de quatro ß (1,3) glucanase despois a infecção com o agente patogênico.
Para este efeito as plantas foram inoculadas com o agente patogénico para induzir um aumento na concentração das proteínas PR y outras substâncias relacionadas com defesa, e 15 dias mais tarde se extraiu o líquido de lavado intercelular de folhas de tomate utilizando água. As proteínas extraídas foram liofilizadas, resuspendidas em solução tampão, purificadas utilizando cromatografia de exclusão, de intercambio iónico e electroforesepreparativa,. Os resultados da caracterização paracial revelou a existência de uma ß(1,3) glucanasa basica com peso molecular de 36,8 kDa e PI 9,2, e três ß(1,3) glucanasas ácidas de 35.4, 30.1 e 7.2 kDa com pontos isoeléctricos de 3.8, 3.6y 5.0, respectivamente. Adicionalmente, foi possível determinar as propriedades cinéticas KM,Vmax,Eo yK3 de cada enzima, encontrando de acordo com os resultados que a proteína básica não havia sido reportada na literatura.relacionada com tomate.
Palavras-chave: espacios intercelulares, ß (1,3) glucanasas, proteínas PR relacionadas con patogenicidad, folhas, tomate.
INTRODUCCIÓN
Algunos factores como estrés ambiental, infección con virus, hongos o interacciones con insectos, inducen aumentos en la actividad de algunas enzimas como las ß (1,3) glucanasas, quitinasas, peroxida-sas, las cuales participan en la defensa de la planta (1).
Las ß (1,3) glucanasas se encuentran en múltiples formas y en un gran número de especies vegetales, incluidas papa, tomate, tabaco, arveja y fríjol. Su actividad en la regulación de las defensas es claramente distinta en las isoenzimas va-cuolares (básicas) y en las extracelulares ácidas (2).
Las ß (1,3) glucanasas se presentan tanto en especies susceptibles como en resistentes y después de infección con patógeno, se ha encontrado que es mayor el número y la actividad enzimática en la variedad resistente (3).
Las ß (1,3) glucanasas, quitinasas, actúan en forma sinérgica inhibiendo la actividad de algunos hongos (4). Experimentos realizados en nuestro laboratorio han confirmado que la inducción y posterior acumulación de estas enzimas en el espacio intercelular están relacionadas directamente con la resistencia a Phytophthora infestans, oomicete necrófilo agrupado dentro del linaje Stramenophile causante de la enfermedad del tizón tardío en plantas de tomate (Cohen et ál.) (5). El tizón tardío es una enfermedad que se da en muchas plantas, dentro de ellas la familia Solanacea. Esta enfermedad ha causado hambrunas en Europa debido a que ataca a la papa, el tomate, etc. Es un patógeno difícil de controlar, porque aunque existe un control químico, este es muy costoso, ya que la enfermedad ataca indistintamente y sus daños se presentan durante la cosecha en el campo, en la poscosecha durante el almacenamiento; además puede causar pérdidas hasta de 100% (6).
En este trabajo se aislaron, purificaron y caracterizaron parcialmente las ß (1,3) glucanasas presentes en los espacios intercelulares de hojas de una variedad colombiana de tomate resistente, Lycopersi-con esculentum coraciforme, que pertenece al germoplasma nacional, teniendo en cuenta que en estos espacios se presenta una de las primeras interacciones entre el hospedador y el patógeno.
MATERIALES Y MÉTODOS
El material vegetal fue suministrado por Corpoica, Estación La Selva, Rionegro, Antioquia, entidad encargada del manejo del germoplasma nacional, con número de accesión L 1568, y según esta institución, presenta resistencia en campo contra P. infestans.
El patógeno, denominado aislamiento M49, fue suministrado por el Laboratorio de Fitopatología de la Facultad de Agronomía de la Universidad Nacional de Colombia que dirige la profesora Celsa García.
Este patógeno se multiplicó en cajas de Petri en medio arveja-azúcar-agar (60: 20:20) y se incubó durante 15 días; parte del micelio obtenido se sembró en medio líquido (arveja: azúcar estéril) en tubos para cultivos, incubando en las mismas condiciones del medio anterior, y se cuantificó el número de esporangios con una cámara Newbauer.
Extracción de líquido de lavado intercelular
La extracción del líquido de lavado intercelular (LLI) se realizó según Leh-mann-Danzinger, publicado por Rohringer (7) y adaptado en nuestro laboratorio. El líquido extraido se guardó a -20 °C en tubos Eppendorf, y presentó una coloración clara, que indica que no hubo rompimiento de células, ya fuese por excesiva centrifugación, alto vacío o por un cambio fuerte de presiones. Se utilizó la determinación de clorofila en el LLI como criterio de control para verificar la ruptura celular.
Liofilización de las muestras
El LLI se fraccionó en volúmenes de 45 mL cada uno; y las muestras se liofiliza-ron durante un día y medio; el sólido contenido en cada tubo se disolvió en 2,5 mL de buffer Tris-HCl pH 8,0 (20 mM), y se centrifugó a 13000xg durante 15 minutos con el fin de separar el material no soluble. Por último se determinó proteína y actividad enzimática.
PURIFICACIÓN
Cromatografía de intercambio amónico
Se utilizó una columna tipo 10/20 Pharmacia con un volumen de lecho de 11 mL de Fraktogel TSK DEAE 650 (M). La columna se activó con NaCl 2 M en buffer de equilibrio, se ajustó un gradiente lineal con NaCl en buffer de equilibrio; finalmente se equilibró con Tris-HCl 20 mM pH 8,0, se midió la conductividad a la entrada y salida de la columna. Este valor se tuvo en cuenta para ajustar la conductividad de la muestra.
Las proteínas no retenidas se eluyeron con buffer de equilibrio, y las retenidas utilizando un gradiente lineal de 0 a 1 M de NaCl en Tris-HCl 20 mM pH 8,0 (8); se aplicó una velocidad de flujo de 316 mL/h, colectando fracciones de 1,5 mL, determinando a cada una, proteína y actividad enzimática.
Intercambio catiónico
Se utilizó una columna tipo 16/20 Pharmacia empacada con 70 mL de CM Sepharosa, se activó con 200 mL de NaCl 2M y se equilibró con buffer citrato de sodio pH 5,2. Las proteínas no retenidas se eluyeron con el mismo buffer, y las retenidas con un gradiente lineal de 0-1 M de NaCl en el mismo buffer. La muestra se ajustó a la misma conductividad del buffer de equilibrio. Se colectaron fracciones de 1,5 mL con un flujo de 18 mL/h. En ambas cromatografías se colectaron las fracciones que correspondían a un mismo pico, formando pooles para cada uno.
Electroforesis preparativa (10)
Se utilizaron geles de PAA al 15%; 1,5 mm de espesor y 18 cm de longitud; se aplicó un voltaje de 100 V durante 30 minutos y después 200 V hasta finalizar. El gel, una vez corrido, se desmontó, y se quitó una de las placas de vidrio; luego se colocó sobre un papel milimetrado. Con ayuda de un escarpelo se cortaron los dos carriles de los dos extremos, y se tiñeron con azul de Comassie (9) para visualizar las bandas de las proteínas del extracto, o en su defecto, aplicando coloración específica para localizar la proteína de estudio. Las fracciones de gel cortado correspondientes a las ß (1,3) glucanasas volvieron a ubicarse en el mismo lugar, completando el gel original, para extraerlas. La fracción de gel con las ß (1,3) glucanasas se maceró con 0,5 mL de buffer, y mediante elución mecánica se obtuvieron electroforéticamente puras. Al extracto obtenido se le determinó proteína y actividad enzimática (10).
Electroforesis en geles de poliacrilamida
Los análisis electroforéticos de los pooles obtenidos en las cromatografías, se realizaron utilizando geles de poliacrilamida al 15% en condiciones nativas, siguiendo la metodología Hammes y Rickwood (14).
Determinación de proteínas
La determinación de proteínas se hizo según el método de Bradford modificado por Zor y Selinger (12), preparando una curva con patrones de BSA entre 2-20 µg/mL.
Actividad enzimática
Se determinó siguiendo la metodología de Boller (13). Se utilizó laminarina como sustrato, reduciendo un complejo de neu-cuproina. La actividad se expresó en na-nokatales (nKatal definido como la cantidad de nmoles de azúcar reductor que se transforman por segundo).
Electroforesis en geles de PAA
Los análisis electroforéticos de cada uno de los pooles obtenidos se analizaron electroforéticamente utilizando geles de 15% a condiciones nativas, según Hammes y Rickwood (14). Con estos geles se realizó tinción específica para glucanasas y otras (11).
CARACTERIZACIÓN ENZIMÁTICA Determinación del peso molecular
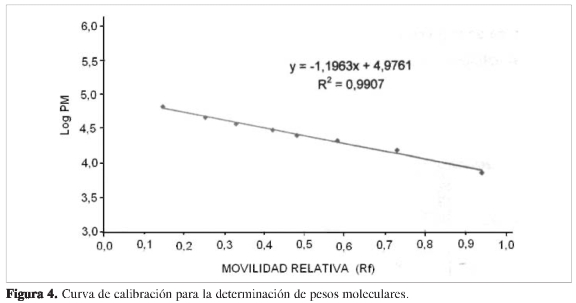
Se utilizaron geles de PAA discontinuos del 15% en condiciones denaturantes, según Laemmli (15), empleando marcadores de peso molecular SIGMA (Low Maker), y aplicando alrededor de 5 µg de proteína por caracterizar. Las muestras y los marcadores de peso molecular se trataron previamente con 2% SDS, 5% de ß mercap-toetanol, 10% de glicerol, 10% de buffer Tris-HCl pH 6,8,0,002 de azul de bromo-fenol incubando 15 minutos a ebullición, y luego se aplicaron al gel de PAA. Para la separación electrorética se aplicó un voltaje de 100 durante 30 minutos, luego 120; después de corrida la muestra, el gel se tiñó. El peso molecular se determinó con ayuda de una curva de calibración de logaritmo de peso molecular de cada uno de los patrones Vs Rf (migración de la proteína en cm dividido por la migración del frente electroforético en cm), interpolando en la curva el valor del Rf de la proteína problema y rectificando el valor obtenido con la ecuación de la recta.
Determinación del punto isoeléctrico
Se determinó electroforéticamente, utilizando geles en tubos capilares y un gradiente lineal de pH en un rango de 3-10 con anfolitos Fluka y marcadores de PI Sigma Markers Mix 3,6'-9,3. Con geles de PAA de 30%, 250 µL, PSA 1,5%, 3,5 mL de agua, desgasificando y agregando 270 µL de anfolitos y 3 µL de Temed, se llenaron los capilares y se dejaron poli-merizando durante 3 horas. Para la elec-troforesis se utilizó NaOH 1 M como ca-tolito y H3PO4 1 M como anolito previamente desgasificados.
El gel se estabilizó durante 10 minutos a 200 voltios; luego a 300 voltios durante 10 minutos y finalmente durante 5 horas más a 400 voltios; al final los geles se extrajeron a presión y se tiñeron con azul de Comassie según (12).
Propiedades cinéticas de ß (1,3) glucanasas
Se determinó la velocidad máxima de reacción, la constante de Michaelis Menten (KM), y el número de recambio (K3).
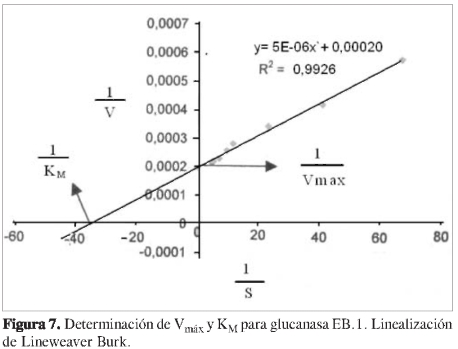
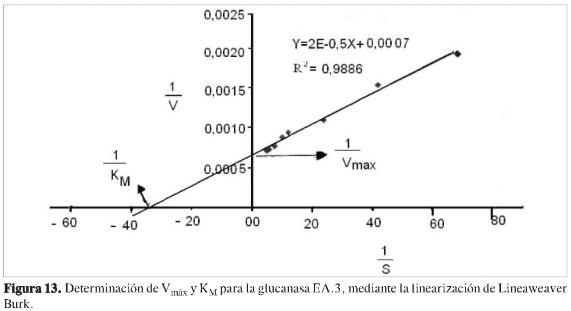
Para esto se evaluó la dependencia de la velocidad de reacción en función de la concentración de sustrato, manteniendo constante la concentración de enzima. Se incubó a 37 oC por 30 minutos con buffer de acetato 100 mM y pH 5,5; luego se graficó velocidad de reacción vs concentración de sustrato mg/mL. Los valores de KMy Vmáx se determinaron a partir de la linearizacion de los resultados, según Li-neweaver Burk graficando 1/V vs 1/S.
RESULTADOS Y DISCUSIÓN
Propagación del material vegetal
De las 300 semillas de Lycopersicum esculentum cerasiforme que se sembraron, germinaron 285 (95%); después de un mes se obtuvieron plantas, se trasplantaron, y las 285 se obtuvieron en condiciones óptimas para la inoculación.
El patógeno (aislamiento M49 de P. infestans) se sembró en cajas de Petri en medio agar arveja, y se obtuvo micelio blanco de textura algodonosa, después de 15 días. Se tomó parte del micelio y se pasó a tubos que contenían 7 mL de caldo nutritivo, el cual se incubó durante 15 días en oscuridad y a temperatura ambiente (14 a 18 oC), y se obtuvo una suspensión de 1x104 esporangios/mL. La pureza del patógeno se verificó por microscopía observándose esporangios típicos de P infestans enformadelimón. Al inocular con esta suspensión el material vegetal, después de 24 horas, las plantas mostraron síntomas, y después de 15 días de inoculadas se colectaron hojas de acuerdo con resultados obtenidos en trabajos anteriores realizados en nuestro laboratorio (3, 19). Las hojas inoculadas presentaron una coloración oscura, reacción típica de la HR; algunas de estas manchas se extendieron cubriendo completamente la hoja, produciendo necrosis.
La inoculación del material vegetal se hizo a baja temperatura y alta humedad relativa (16, 6), a fin de asegurar una infección rápida y total, promoviendo la apertura de los estomas. La cantidad de proteína determinada en el LLI es comparativamente igual o superior a la cantidad obtenida en otros trabajos realizados en nuestro laboratorio (17), debido a una infección exitosa.
En la extracción de LLI se utilizó agua destilada estéril como extractante, debido a que esta facilita la extracción de la mayor parte de las proteínas presentes en el espacio intercelular sin influir negativamente en su actividad enzimática (8); además, se ha utilizado con éxito en nuestro laboratorio en todos los trabajos realizados. Todos los extractos purificados se liofilizaron y concentraron 1:10 para obtener al final muy baja pérdida de la actividad enzimática, teniendo en cuenta todos los procesos a los que fueron sometidas las enzimas (cromatografía de intercambio aniónico, electrofo-resis preparativa, concentración, diálisis y resuspensión).
Extracción de líquido de lavado intercelular (LLI)
A partir de 2.420 g de hojas inoculadas se obtuvieron 425 mL de LLI. Se determinó proteína y actividad de glucanasas, obteniéndose 1,54 µg/µL y 889,0 nKata-les/mg de proteína, respectivamente. Se verificó la calidad del LLI cuantificando clorofila por el método de Rohringer (7), obteniendo una concentración del orden de 2x10-4mg/mL, lo cual indica que la ruptura celular durante la extracción del LLI fue mínima; además, se verificó que las impurezas provenientes del citoplasma de la célula vegetal no fueron significativas.
Liofilización
El liofilizado se resuspendió en 2,5 mL de buffer Tris-HCL, 20 mM, pH 8,0, con una concentración de proteína de 15,4 µg/µL y una actividad enzimática de 888,9 nKatal/mg. El extracto se distribuyó en alícuotas de 0,5 mL en tubos Eppendorf, que se congelaron a -20 oC para iniciar la purificación de las proteínas.
Purificación de ß (1,3) glucanasas
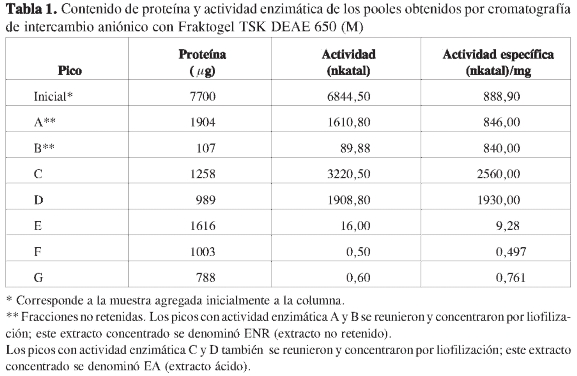
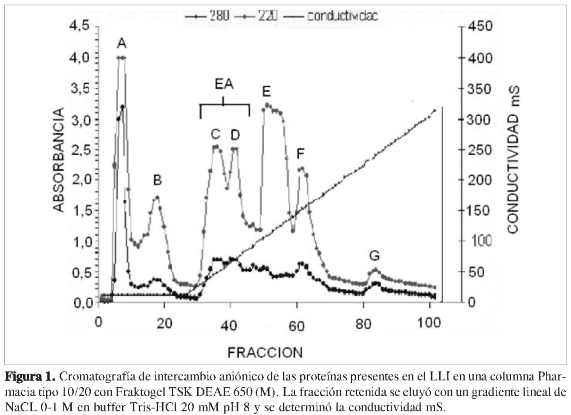
A cada columna de intercambio aniónico que contenía TSK DEAE 650 (M) se le agregaron 0,5 mL de extracto enzimático con 15,4 ug de proteína (denominada inicial* en la columna de Picos, Tabla 1). Durante la elusión se midió absorbancia a 280 y 220 nm, y conductividad (Figura 1).
Las fracciones que componían cada pico se mezclaron y concentraron 1:10 por liofilización; posteriormente se dializaron contra buffer Tris-HCldurante18hyse determinó la cantidad de proteína y actividad enzimática de cada una (Tabla 1).
En la fracción retenida se obtuvieron todas las enzimas ácidas con actividad de ß (1,3) glucanasas. Para este paso fue determinante el uso de membranas de 3,5 kDa en la diálisis de las proteínas retenidas, evitando la pérdida de las enzimas de bajo peso molecular. Además, se encontró actividad enzimática en la fracción no retenida, por lo que fue necesario continuar con la purificación de esta fracción utilizando cromatografía de intercambio catiónico, y determinando la cantidad de ß (1,3) glucanasas presentes en esta fracción.
Cromatografía de intercambio catiónico
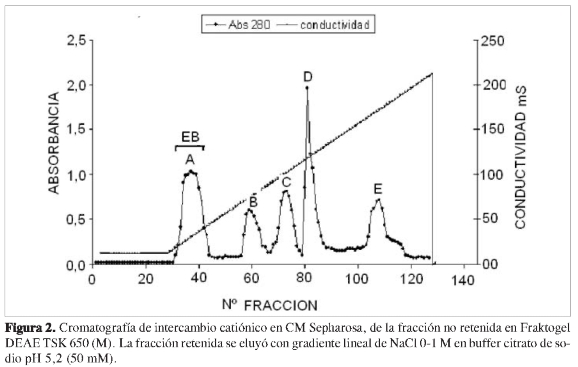
El extracto enzimático ENR, proveniente de los pooles no retenidos en el Fraktogel TSK DEAE 650 (M), se liofilizó para concentrarlo y se resuspendió en 8 mL de buffer citrato de sodio pH 5,2 (50 mM). Se corrieron cromatografías con 1 mL (20,1 µg/µL) de extracto enzimático de la misma concentración, eluyendo la fracción no retenida con 50 mM de buffer citrato de sodio pH 5,2, y la retenida con un gradiente lineal de buffer citrato NaCl a un flujo de 18 mL/h (Figura 2), determinando cantidad de proteína, actividad y actividad específica (Tabla 2).
Los pooles A, provenientes de todas las cromatografías de intercambio catió-nico con actividad ß (1,3) glucanasa, se reunieron y concentraron por liofilización, denominándose EB.
Electroforesis preparativa
Se determinó el número de ß (1,3) gluca-nasas presentes en EA y EB por medio de electroforesis preparativa, permitiendo al mismo tiempo separar las fracciones en forma selectiva, midiendo la actividad ß (1,3) glucanasa a cada banda obtenida.
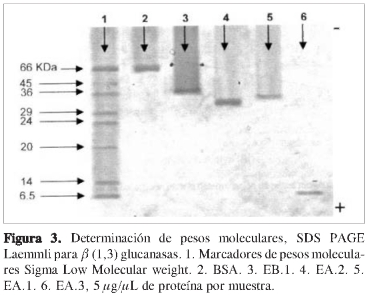
De la electroforesis preparativa realizada con EA se obtuvieron cinco bandas, de las cuales la primera, la segunda y la quinta, de menor a mayor migración, presentaron actividad enzimática, y se denominaron EA.1, EA.2 y EA.3, respectivamente.
De la fracción EB se obtuvieron tres bandas, de las cuales solamente la de menor migración, denominada EB.1, presentó actividad de ß (1,3) glucanasa.
Caracterización enzimática: determinación del peso molecular
Para la determinación del peso molecular se utilizó electroforesis con geles discontinuos de PAA del 15% a condiciones denaturantes, utilizando 5 µL de marcadores, 5 µgdeBSAy5µg de cada muestra (Figura 3). Se determinó movilidad relativa (Rf) de los patrones y muestras (Figura 4); además se determinó el peso molecular (PM) para cada una (Tabla3).
Determinación del punto isoeléctrico
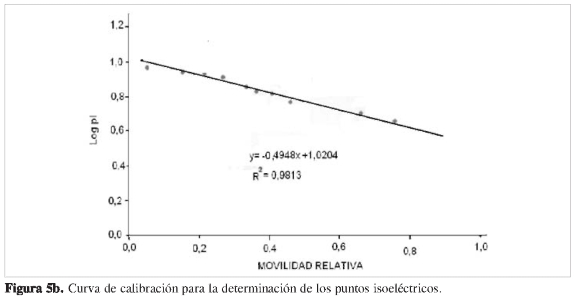
Para la determinación del pl se construyó una gráfica de Log pl vs Rf, utilizando patrones de pl (Figura 5 a). Por interpolación se determinaron los pl para cada enzima purificada (Tabla 4 y Figura 5b).
Cinética enzimática Km y Vmáx
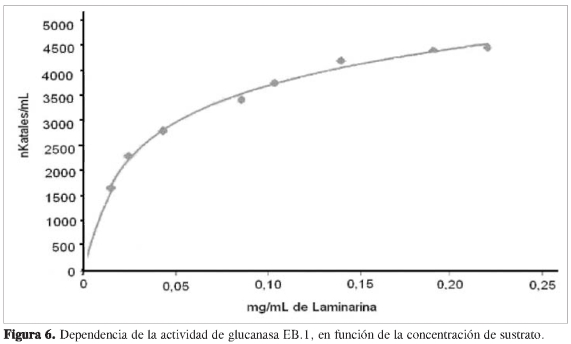
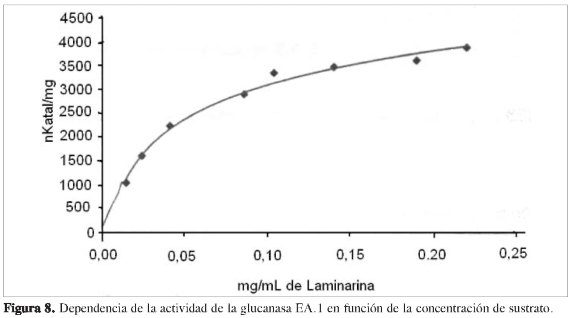
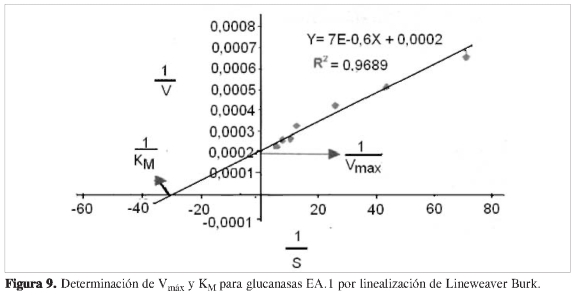
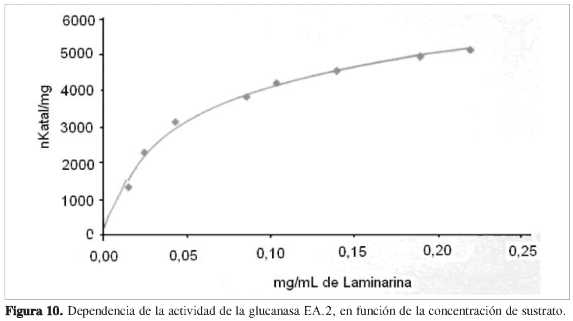
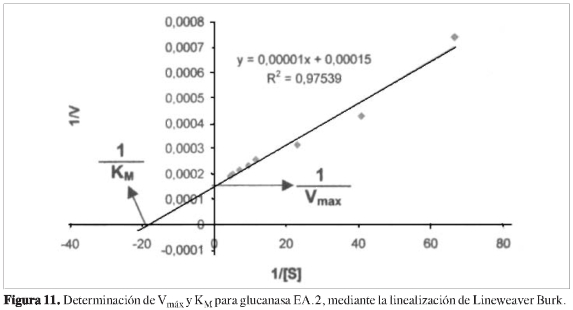
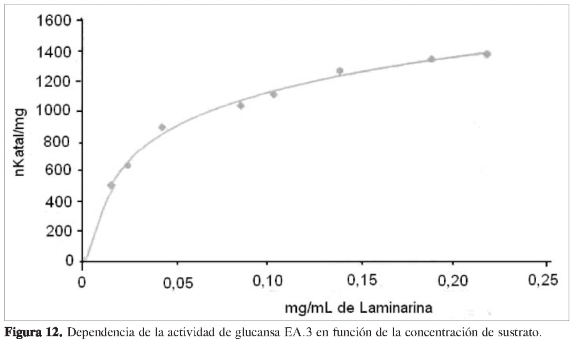
Se determinó la dependencia de la actividad en función de la concentración de sustrato a cada una de las proteínas purificadas, observando que las propiedades cinéticas de cada ß (1,3) glucanasa sigue el modelo de Michaelis y Menten (Figuras 6, 8, 10 y 12). Mediante análisis gráfico de Lineweaver Burk, se obtuvieron los valores de KM yVmáx, y a partir de estos, Eo (concentración en el centro activo) y K3 (número de recambio) (Figuras 7, 9, 11 y 13; Tabla 5).
Se purificaron cuatro enzimas que presentaron actividad de ß (1,3) glucanasas, de las cuales una es de carácter básico pI 9,2, aunque las proteínas presentes en los espacios intercelulares generalmente son de carácter ácido; lo más probable es que esta proteína provenga de las proteínas de reserva almacenadas previamente en vacuolas y transportadas al apoplasto, como respuesta al ataque patogénico. Dado que Mauch y Staehelin (4) propusieron un mecanismo por el cual los hongos fitopatógenos generan sustancias que actúan como elicitoras en la producción de una gran variedad de factores implicados en la defensa de las plantas, que muestran entre otros la acción de las enzimas básicas como las ß (1,3) glucanasas vacuolares y otras enzimas, que como respuesta a la acción de sustancias elicitoras, excretan estas enzimas al espacio intercelular, se justificaría la presencia de la glucanasa básica en los espacios intercelulares obtenida en la fracción EB.
De acuerdo con los resultados obtenidos por Hwang et ál. (1), que purificaron una ß (1,3) glucanasas de 34 kDa y pI 9,3 de pimienta, inducida por tratamiento con cloruro de mercurio y además con actividad antifúngica a fusarium oxisporum cucumerihum y P. Capsici, no es posible que se trate de la misma proteína básica, ya que la encontrada en este trabajo fue obtenida del líquido de lavado intercelular de Lycopersicon esculentum coraciforme, con peso molecular 38 kD y pl de 9,2, y Kim y Hwang (18) la encontraron en tallos de pimienta y no en el LLI de los foliolos de esta planta. De otra parte, la diferencia en peso molecular es de 4 kD y el pI es 0,1; además, el patógeno que teóricamente la induce es diferente. Trabajos realizados en nuestro laboratorio (20) mostraron la presencia de dos glucanasas de alto peso molecular provenientes de P. infestans previamente encontradas en literatura (21), halladas también por (19), y una de muy bajo peso molecular que participa en los procesos de infección con pesos moleculares muy diferentes a los encontrados en este trabajo. En razón de lo anterior, se puede confirmar que la ß (1,3) glucanasa básica encontrada no pertenece a P. infestans. Sin embargo, para poder asegurar que es una nueva proteína, es necesario secuenciar las dos proteínas para poderlas comparar y definir a qué familia pertenecen, además de elucidar si su secuencia es igual. Lo más relevante de este hallazgo es que la propuesta de Mauch y Staehelin (4) con respecto a que esta proteína proviene de la vacuola como respuesta a la infección sería reforzada con lo encontrado en este trabajo.
Las otras tres proteínas purificadas son de carácter ácido. Dos de ellas poseen pesos moleculares y puntos isoeléctricos similares de 35,4 kD y 30kDa, y pl 3,8 y 3,6, respectivamente. Además presentan propiedades cinéticas muy similares y siguen el modelo de Michaelis-Menten.
CONCLUSIONES
En la variedad de tomate Lycopersicum esculentum cerasiforme, resistente a P. infestans, se encontraron cuatro enzimas con actividad ß (1,3) glucanasa. Después de haber infectado las plantas con P. in-festans, tres de las cuales son ácidas y una básica, esta última, hallada en los espacios intercelulares de plantas de tomate resistentes al patógeno, después de infección con este, refuerza lo propuesto por Mauch y Staehelin (4).
Con la concentración por liofilización de todos los extractos obtenidos, se aseguró una menor desnaturalización de las proteínas y, por tanto, mínima pérdida de actividad posible. El peso molecular y el punto isoeléctrico de las cuatro enzimas con actividad ß (1,3) glucanasa, son para la básica de 36,8 kDa y pl 9,2, y para las tres ácidas de 35,4, 30,1 y 7,2 kDa, con puntos isoeléctricos de 3,8, 3,6 y 5,0, respectivamente.
AGRADECIMIENTOS
Los autores agradecen a la Dinain, sede Bogotá, a la GTZ, y al World University Service Deutsches Komite e.V por la financiación de este proyecto.
REFERENCIAS BIBLIOGRÁFICAS
1. Hwang, K.; Sunwooj, Y.; Kim, Y. J.; Kim, b. s. Accumulation of ß (1,3) Glucanase and chitinase iso-forms, and salicylic acid in DL ß-amino-n-butyric acid Induced resistance response of pepper steams to Phytophthora capsisi. Physiological and Molecular Plant Pathology 1997. 51: 305-322. [ Links ]
2. Van de Bulke, M.; Bauw, G.; Castresana, C.; Van Montagu Vanderckerhove, J.; Anfoka, G.; Buchenauer, H. Systematic acquired resistance in tomato against Phytoph-thora infestans by pre-inoculation with tobacco necrosis virus. Physiological and Molecular Plant Pathology. 1989; 86: 2673-2677. [ Links ]
3. Cerón Laura, E. Determinación y análisis comparativo de proteínas relacionadas con la patogénesis (PR) de los espacios intercelulares de plantas de tomate resistente (Lyco-persicon esculentum cerasiforme)y susceptible (Lycopersicon esculentum Mill) antes y después de la infección con Phytophthora infestans (Mont De Bary). Trabajo de Grado. Departamento de Química, Universidad Nacional de Colombia, Bogotá. 2000. [ Links ]
4. Mauch, F.; Staehelin, L. A. Functional implication of the subcellular localization of ethylene- induced chiti-nase and ß (1,3) Glucanase in bean leaves. The plant cell 1989. 1: 447-457. [ Links ]
5. Cohen, Y.; Niderman, T.; Mosinger, E.; Fluhr, R. (A-Aminobutiric Acid Induces The Accumulation of Proteins in Tomato (Lycopersicum esculentum) Plants and resistance to late Blight induction cased by P. infestans. Plant Physiology. 1994. 104:59-66. [ Links ]
6. Domínguez, F. Plagas y enfermedades de las plantas cultivadas. 3a. ed. Madrid: Dossan S. A. 1965. pp. 10-17. [ Links ]
7. Rohringer, R. Proteins in Intercellular washing fluid from leaves of barley. Journal Exp. Botanic. 1983. 34: 1589-1605. [ Links ]
8. Roulin, S.; Buchala, A. J. The introduction of ¡ (1,3) Glucanasas and others enzymes in groundnut leaves infected with Cercospora arachidicola. Physiological and Molecular Plant Pathology. 1995 . 46: 471-489. [ Links ]
9. Vesterberg, O. Biochemistry biophysics. Acta 1971. pp. 345-348. [ Links ]
10. Zamora, E. Humberto M. Rolle der Invertase in Zuckerstoffwechsel des Interzellularraumes der Blättern anfälliger und resistenter Bohnensorten gegenüber der Fettfleckenkrankheit (Pseudomonas syringae pv phaseolicola). Dissertation zur Erlangung des Doctorgrades der Georg-August-Universitát, Göttingen. 1988. [ Links ]
11. Pan, S. Q.; Ye, X. S.; Kue, J. A technique for detection of chitinase, ß (1,3) Glucanases and protein patterns after a single separation using polyacrylamide gel electrophoresis or isoelectro focusing. Phytopathology 1991. 81: 970-974. [ Links ]
12. Zor, T.; Sellinger, Z. Linearization of Bradford Proteins Assay Increase its Sensitivity: Theorical and Experimental Studies. Analytical Biochemistry. 1996. 236: 302-308. [ Links ]
13. Boller, T. Molecular Plant pathology. A Practical approach. New York: Oxford University Press. 1992. 2: 23-29. [ Links ]
14. Hammes, B. D.; Rickwood, D. Gel electrophoresis of protein: A Practical Approach Oirlpress. New York. 1996. [ Links ]
15. Laemmli U.K. Clearage of structural Proteins during the assembly of the heat of bacteriophage T4. Nature 1970; 224: 680-685. [ Links ]
16. Díaz Franco. Enfermedades infecciosas de los cultivos. México: Trillas. 1993: pp. 147 y 148. [ Links ]
17. Velásquez, E. Caracterización parcial de las quitinasas presentes en espacios intercelulares de plantas de tomate resistente Lycopersicun esculentum cerasiforme y susceptible Lycopersicon esculentum Mill a P. infestans. Trabajo de grado. Departamento de Química, Universidad Nacional de Colombia, 2003. [ Links ]
18. Kim, Y.; Hwang, B. K Isolation of Basic 34kD ß (1,3) Glucanase with Inhibitor activity against Phytophthora capsici from papper steam. Physiological and Molecular Plant Pathology 1997. 50: 103-105. [ Links ]
19. Moreno, P.; Giovanni, A. Análisis diferencial de las ß (1,3) glucanasas presentes en plantas de tomate Lycopersicum esculentum ceraciforme y su patógeno Phythopthora infestans. Tesis de grado. Departamento de Química. Universidad Nacional de Colombia, Bogotá, 2000. [ Links ]
20. Roa S., Ángela M. Purificación y caracterización de una ß (1,3)- glucanasa extracelular de bajo peso molecular presente en cultivo filtrado de Phytophthora infestans y evaluación de algunos de los efectos que provoca sobre Lycopersicum esculentum ceraciforme. Tesis de maestría en Ciencias Bioquímica. Universidad Nacional de Colombia, Bogotá. 2008. [ Links ]
21. Bodenmann Heinger, U.; Holh, H. Extracellar enzymes of Phytophthora infestans: endocellulase, ß glucosidases and ß (1,3)- glucanasescanj. Microbiol 1985. 31: 7582. [ Links ]