Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804On-line version ISSN 2357-3791
Rev.Colomb.Quim. vol.38 no.1 Bogotá Jan./Apr. 2009
ESTUDIO POR ESPECTROFOTOMETRÍA UV-Vis DE LA REACCIÓN ENTRE LOS IONES CIANURO Y PICRATO. UN EJEMPLO PRÁCTICO DE APLICACIONES ANALÍTICAS Y ESTUDIOS CINÉTICOS
UV-VIS SPECTROPHOTOMETRY STUDY OF THE REACTION BETWEEN CIANIDE IONS AND PICRATE. A PRACTICAL EXAMPLE OF ANALYTICAL APPLICATIONS AND KINETIC STUDIES
ESTUDO POR ESPECTROFOTOMETRIA UV-VIS DA REAÇÃO ENTRE OS IONS CIANETO E PICRATO. UM EXEMPLO PRÁTICO DE APLICAÇÕES ANALÍTICAS E ESTUDOS CINÉTICOS
Alberto de J. Oliveros-Bastidas1, Ceferino A. Carrera2 y David Marín2
1 Departamento de Química, Facultad de Ciencias, Universidad de Los Andes. Núcleo Universitario Pedro Rincón Gutiérrez. Mérida 5101-A. Venezuela. aloliver@ula.ve
2 Departamento de Química Orgánica, Facultad de Ciencias, Universidad de Cádiz. Departamento de Química Orgánica, Puerto Real, Cádiz, España.
Recibido: 20/08/08 - Aceptado: 04/03/09RESUMEN
La cinética de la reacción entre los iones cianuro y picrato se estudió por espectro-fotometría UV-Vis. Se observó una reacción de orden uno para ambos reactivos, así como un desplazamiento batocrómico de la señal de máxima absorbancia, incrementando la concentración de cualquiera de los reactivos, asociada a la formación de complejos de diferente estequiometría y resultando en los consiguientes cambios en los parámetros espectrométricos. Estos resultados sustentan una interacción de tipo π para el complejo resultante, resultado que se pudo generalizar utilizando otras moléculas donadoras que muestran las posibles interferencias de algunos compuestos químicos en las determinaciones cualitativas y cuantitativas de la frecuencia cianogénica y la determinación cuantitativa de glucósidos cianogénicos en plantas.
Palabras clave: UV-Vis, picrato de sodio, cinética, complejo, implicaciones analíticas.
ABSTRACT
The kinetics of the cianide-picrate reaction was studied on the basis of UV-Vis spectrophotometry. A first order reaction was found for each reagent. It was also observed a batocromic displacement of the maximum absorbance wavelength, by increasing the concentration of any of the reagents, this result is associated to the formation of different stoichiometry complexes and the subsequent spectrometric parameters change. These results support the existence of an interaction of the π kind for the resulting complex, and a parallel result was obtained by using other π electron donor molecules. This displays the evidence of plausible interferences of some chemicals in qualitative and quantitative analytical applications of this reaction, specially of those used in the cianogenic frequence and quantitaive cianogenic glycosides determination in plants.
Key words: UV-Vis, sodium picrate, kinetics, complex, analytical implications.
RESUMO
A cinética da reação entre o íon cianeto e o picrato de sódio foi acompanhada por espectrofotometria no UV/Vis. Foi observada uma reação de primeira ordem para ambos reagentes, bem como um deslocamento batocrômico no Dmax, aumentando-se a concentração de qualquer um dos reagentes, associa-se a ela, a formação de complexos de diferentes estequiometrias e, consequentemente, mudanças nos parâmetros espectrométricos. Estes resultados sustentam a possibilidade de uma interação do tipo π para o complexo resultante e que pode ser aplicada, de forma generalizada, para outras moléculas doadoras, evidenciando possíveis interferências de alguns compostos químicos com as determinações qualitativa e quantitativa de derivados cianogênicos, bem como a determinação quantitativa de derivados glicosilados cianogênicos em plantas.
Palavras-chave: UV-Vis, picrato de sódio, cinética, complexo, implicações analíticas.
INTRODUCCIÓN
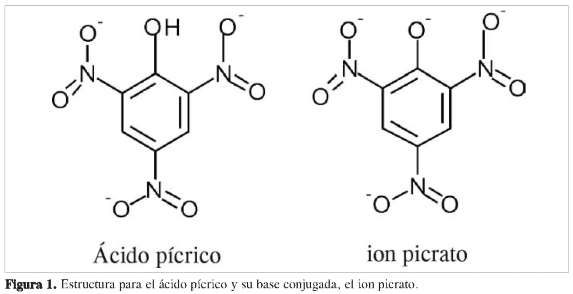
El ácido pícrico y su base conjugada, el anión picrato (Figura 1), ha sido usado como un reactivo con características de cierto valor en aplicaciones analíticas, lo cual ha permitido desarrollar métodos de laboratorio de detección y cuantificación de muchos sustancias, principalmente creatinina en suero y orina, fenotiazinas, metales y iones cianuro (1-4). El principal atractivo analítico del picrato como reactivo radica en los cambios de coloración que sufre durante la reacción, lo cual puede ser registrado fácilmente y correlacionado con la concentración del analito por determinar, principalmente por la técnica de absorción en el ultravioleta y visible (UV-Vis), debido a su alto grado de enlaces π, lo cual origina altos coeficientes de absortividad molar, y como consecuencia, es posible desarrollar métodos con bajos niveles de detección y cuantificación.
Los productos de estas reacciones se consideran complejos, formados a partir de interacciones no covalentes entre una molécula dadora y otra aceptora, denominados generalmente complejos de transferencia de carga o de adición. En general, estos compuestos se forman a partir de cantidades equimolares de los compuestos aceptores y dadores, generando normalmente complejos con estequiometría 1:1; sin embargo, otras este-quiometrías son conocidas y en muchos casos indeterminadas (5-7), como es el caso de la reacción entre picrato e iones cianuro.
Existen varios tipos de compuestos de adición donde se pueden encontrar aquellos obtenidos con la formación de enlaces covalentes regulares y aquellos en los que interviene la superposición de un orbital con pares de electrones desapareados con uno vacío, como es el caso del amoniaco y el trifluoruro de boro. Otro tipo de estos compuestos tienen como rasgo característico el hecho de que el material de partida o molécula de partida permanece en el producto sin aparente cambio importante, con un enlace débil uniendo a dos o más moléculas reactivas. Dentro de una subclase de estos compuestos se encuentran los complejos de transferencia de carga (8-10), donde existe una molécula que actúa como donadora de electrones, pertenecientes a pares de electrones desapareados, electrones de sistemas tt de un doble enlace o sistemas aromáticos (11, 12), y otra molécula que actúa como aceptor, tales como un ion metal, los compuestos orgánicos insaturados y los halógenos, principalmente I2,Cl2 y Br2 (13-15).
La importancia de estos tipos de compuestos, como se indicó inicialmente, radica en las coloraciones particulares que presentan, característica esta que ha sido utilizada para la separación, purificación y determinación cualitativa de hidrocarburos aromáticos (11, 12, 16). Un ejemplo típico de estos compuestos se encuentra en los complejos formados a partir de ácido pícrico como aceptor (3, 17-19). Estos complejos son denominados comúnmente picratos hidrocarbonatos; sin embargo, complejos similares se forman a partir de trinitrobenceno, el cual, a diferencia del picrato, carece de grupos hidróxido sobre el sistema aromático. Un ejemplo de estos compuestos con interacciones con gran aplicabilidad analítica es el formado entre una solución de ácido pícrico, su base conjugada, el ion picrato y el ion cianuro (20-21).
Esta reacción toma lugar con un cambio de color que va desde el amarillo, correspondiente al ácido pícrico o el picrato de sodio, a una coloración roja, correspondiente al complejo formado. Este hecho ha sido aprovechado para el análisis del contenido de ion cianuro en muestras de diferentes naturaleza (4). A pesar de la aplicación tradicional de esta reacción, no existen registros en la literatura sobre sus parámetros fisicoquímicos, en especial sobre lo que ocurre entre los iones picrato y el cianuro. Características como orden de la reacción respecto a cada ion del complejo, indicadores energéticos de la reacción, estabilidad y la estequiometría del complejo formado, son, según nuestro conocimiento, desconocidos.
Con estos antecedentes, en este trabajo se tiene como objetivo principal aplicar la espectroscopia de UV-Vis para estudiar las características espectroscópicas, cinéticas y de formación de complejos para la reacción que tiene lugar entre la sal sódica del ácido pícrico y el cianuro.
Se pretende realizar un estudio estándar para estimar los parámetros cinéticos de la reacción, así como entender químicamente la naturaleza del complejo formado. Todos estos estudios, además de aportar datos novedosos al entendimiento del sistema picrato: CN-, podrían ser de utilidad para el estudio de los conceptos básicos de la espectrometría de UV- Vis, aplicándolos en la cinética de las reacciones, estudios analíticos y química de coordinación; todo esto utilizando la misma reacción y las mismas herramientas instrumentales.
MATERIALES Y MÉTODOS
Reactivos
Para llevar a cabo la reacción, se usó cianuro de sodio (J. T. Baker Chemical Co.), ácido pícrico (BDH, Poole KU), bicarbonato de sodio (Aldrich, Poole, KU), y tolueno (J. T. Baker), con pureza grado
reactivo (99,9%), para la preparación de las soluciones stock, a partir de las cuales, mediante dilución sucesiva, se obtuvieron todas las concentraciones utilizadas.
Instrumento
Para las medidas de la absorbancia se utilizó un espectrómetro de UV-Vis Hewlett-Packard (HP, Palo Alto, California) modelo 8453 bajo control computarizado mediante una PC Vectra 133 MHz Chem Station (HP). Los espectros fueron tomados utilizando una celda de cuarzo de 1 ± 0,1 cm de paso óptico. Los espectros fueron medidos entre 200 y 900 nm para la selección de la longitud de onda de trabajo. Para el ajuste de los pH de las soluciones se empleó un pHmeter Basic 20 CRISON.
Estudios analíticos
Construcción de las curvas de calibración
Las curvas de calibración fueron obtenidas usando soluciones de cianuro de sodio en agua y soluciones de picrato de sodio a pH 8 y 11,8. Se preparó una solución estándar de KCN de 0,2 M, a partir de la cual, mediante dilución sucesiva, se prepararon las diferentes concentraciones (0,002-0,01 mg mL-1). Para la formación del complejo, las soluciones de KCN y picrato de sodio (pH 8 o 11,8) se mezclaron hasta alcanzar la concentración final deseada. Para el estudio de posibles interferentes espectrales, la solución del interferente (2-metil-propa-nona) se mezcló con la solución de picrato de sodio (pH = 11,8), registrando de manera separada el espectro del complejo formado con CN- y con el interferente de estudio, usando como blanco la solución de picrato de sodio.
Estequiometría del complejo
Los estudios de la relación molar del complejo entre picrato de sodio y los iones cianuro se llevaron a cabo aplicando el método de las relaciones molares o gráficos de Job (22), midiendo la absorban-cia a una longitud de onda de 550 nm de cada una de estas soluciones. Se usaron concentraciones de partida de picrato de sodio 1,8 mM y cianuro de potasio 1,8 mM. Las diferentes fracciones molares respecto a CN- se obtuvieron mezclando diferentes volúmenes de la solución de CN-. En estas condiciones, la fracción en volumen es igual a la fracción molar. De esta manera se estudiaron las siguientes relaciones molares (CN-:Picrato): 1:9, 2:8,3:7,4:6,5:5,6:4,7:3,8:2, 9:1.
Estudio de la determinación de HCN en planstas
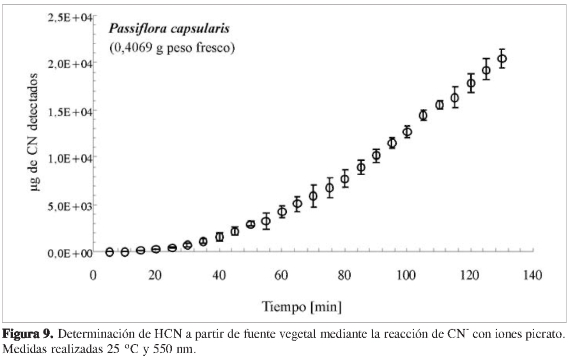
Para el estudio de la aplicabilidad de la reacción de formación de complejo para la determinación de HCN a partir de fuente natural, se recolectaron hojas individuales de Passiflora capsularis, una especie de plantaalacualselehademostradosuca-pacidad de liberar HCN cuando su tejido es perturbado (4). Para esto, una masa constante de hojas (0,4069 g de peso fresco), fue colocada en un envase, el cual fue sellado, previa adición de tolueno hasta cubrir toda la superficie de la hoja, logrando de esta manera la destrucción celular, y liberándose así el HCN. Este HCN liberado se arrastró con aire a un vial que contenía una solución de picrato de sodio (pH = 11,8), donde la absorbancia del complejo formado se registró a 550 nm, a intervalos de 5 minutos.
Estudio cinético
Medidas cinéticas
Las medidas cinéticas se estudiaron registrando el espectro y su máximo de absorción a diferentes concentraciones (0,2- 4,3 x10-5 Mol L-1) para analizar las longitudes de onda de trabajo y los posibles desplazamientos que se puedan presentar al variar las concentraciones de los reactivos.
Determinación de la ecuación cinética para la reacción entre los iones y el picrato
Para determinar la ley de velocidad de la reacción, se usaron los métodos de Har-court y Essen (23) y de vant'Hoff (24). Todas las medidas se realizaron a intervalos de un minuto, a una temperatura constante, usando para ello un baño termos-tatado (Caframo VV-micro).
Análisis de datos
El análisis estadístico de la calibración y la validación del método se realizaron con Alamin (25). Los datos para las determinaciones de medidas cinéticas se obtuvieron con Microcal Origin Profesional V 7.0 (Microcal Software, Northampton, MA).
RESULTADOS
Estudios espectroscopios y de aplicación analítica de la reacción espectro UV-VTS
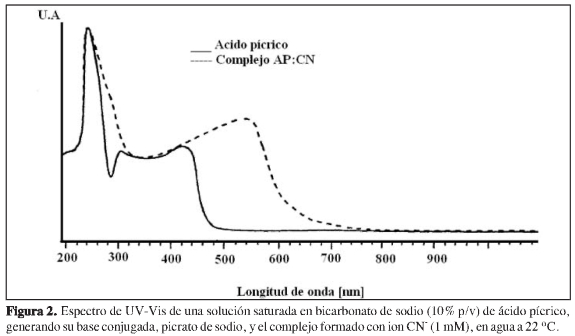
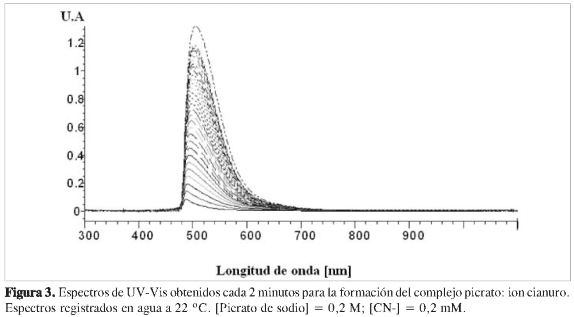
En la Figura 2 se muestran los espectros obtenidos para el ácido pícrico y el complejo picrato de sodio: ion cianuro. Se observa una superposición de absorbancia a longitudes de onda menores a 440 nm. El comportamiento del resto del espectro mostró una ventana que pudiera emplearse para el análisis de la cantidad de complejo formado entre 480 y 560 nm. Los estudios sobre el comportamiento del espectro UV-Vis respecto a la concentración o formación del complejo formado (Figura 3), muestra un desplazamiento a longitudes de ondas más altas al aumentar la concentración. Como se observa, dependiendo de la concentración del complejo en solución, existe un desplazamiento del máximo de absorción, estando a t = 2 min a 485 nm, y finalizando a un valor de 525 nm a tiempo de reacción de 60 min.
Este desplazamiento del máximo de absorción según la concentración, se puede deber a la formación de complejos de diferentes relaciones estequiométricas formados entre el ion picrato y el cianuro. Aunque, como se discutirá más adelante, los datos indican una relación 1:1 entre los dos reactivos, al aumentar la concentración del complejo, y al estar este en exceso de iones picrato, son posibles las interacciones electrónicas de tipo tt entre estas dos especies, y como consecuencia, se genera un desplazamiento del máximo de absorción.
Este resultado adquiere una relevancia especial al momento de emplear esta reacción en las estimaciones cuantitativas de HCN, puesto que las concentraciones usadas en la calibración, así como las existentes en la muestra de análisis, han de ser ajustadas de manera de que estos desplazamiento no generen variación significativa en el resultado del método y de las estimaciones cuantitativas.
Aplicaciones analíticas. Calibración absorbancia concentración
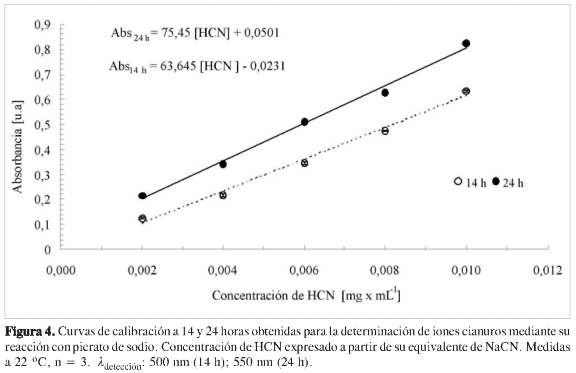
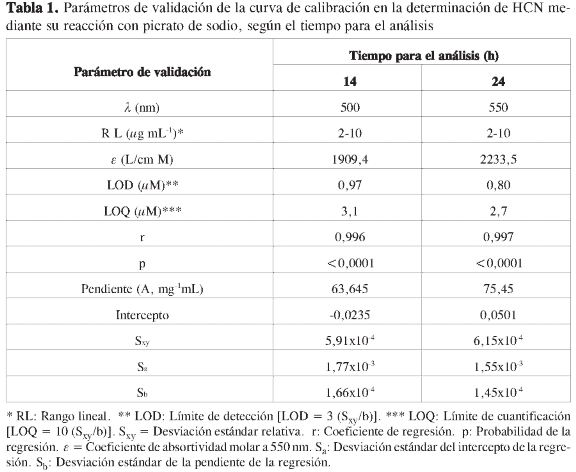
No sólo la dependencia del máximo de absorción con la concentración es un factor importante por tener en cuenta al momento de aplicaciones cuantitativas de esta reacción. El tiempo de formación del complejo para realizar la validación del método también surge como un factor para considerar. Como se muestra en la Figura 4, según la selección del tiempo de reacción de formación del complejo, antes de realizar las medidas de calibración y de las muestras generadoras de HCN, es posible encontrar diferentes propiedades de calibración, donde factores tales como la sensibilidad del método pueden ser afectados (Tabla 1).
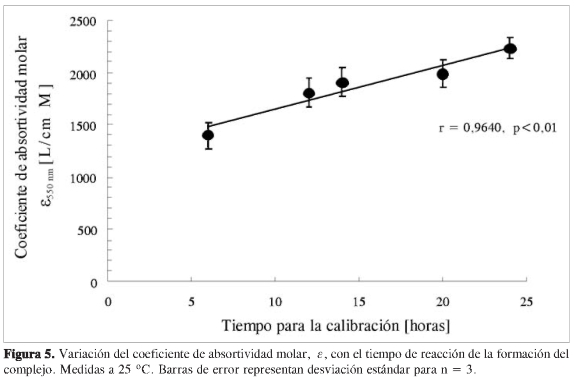
Para estudiar el efecto del tiempo de reacción de la formación del complejo picrato de sodio: ion cianuro, se determinaron los coeficientes de absortividad molar entre 6 y 24 h luego de adicionar los reactivos (Figura 5). Como se puede observar en esta figura, un mayor tiempo de reacción permite trabajar con un coeficiente de absortividad mayor, proporcionando una mayor sensibilidad en el análisis, y permitiendo de esta manera mejor LOD y LOQ.
De esta manera, para esta reacción -y en general, las que muestren un comportamiento similar en el tiempo-, el e es una función no solo de la longitud de onda, sino del tiempo de formación de complejo fijado antes de realizar el estudio de validación. Así, dos características de la reacción han de ser consideradas al momento de utilizarla en aplicaciones analíticas. Primero, la dependencia del máximo de absorción con la concentración usada en la calibración y la presentada por las muestras bajo análisis, pues existe un desplazamiento batocromico al aumentar la concentración de los reactivos y segundo, el tiempo de formación del complejo para la optimización del sistema analítico. Dependiendo del tiempo estimado, se puede obtener un mejor desempeño del sistema de análisis, al aumentar el tiempo previo a los análisis; claro está, todo esto trabajando dentro del límite de linealidad.
Estos resultados alertan de la restricción de la aplicación de la reacción de formación del complejo picrato:cianuro con fines analíticos, restringiendo básicamente el uso de concentraciones donde no existan desplazamientos batocrómicos de los máximos de absorción.
Análisis de interferentes
La reacción de picrato de sodio ha sido usada con éxito en la determinación de glicósidos cianogénicos (GC) en las plantas (26). En las condiciones de optimización del método, es conveniente estudiar posibles interferentes en el sistema de análisis, dirigiendo la atención a todos aquellos compuestos que pudieran formar complejo con el picrato de sodio.
Así, teniendo en cuenta que la principal aplicación de esta reacción es el análisis de GC en material de origen vegetal, la atención estaba dirigida a la presencia de compuestos que en su estructura presenten grupos con un sistema π capaces de formar complejo con el picrato y que al mismo tiempo sean volátiles, tal como lo es el HCN.
Los productos de origen natural que presentan esta característica estructural, son los que poseen bajo peso molecular y grupos carbonilos. Así, los aldehídos y las cetonas surgen como posibles interferentes para la utilización de esta reacción con fines analíticos.
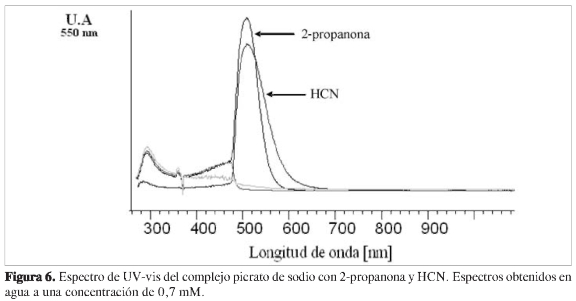
En consecuencia, se estudió la posible formación del complejo picrato:carboni-lo, usando para esto la 2-propanona. En la Figura 6 se muestra el espectro de UV-Vis comparativo entre el espectro obtenido del complejo picrato: cianuro, y el formado entre picrato: 2-propanona.
Como se observa, la presencia de grupos carbonilo puede generar complejos que pueden interferir en el análisis, presentando un máximo de absorbancia que coincide con el generado por el ion cianuro. Así, para la aplicación efectiva de este método, es necesario eliminar previamente de la muestra de análisis la presencia de todos aquellos compuestos que posean dentro de su estructura compuestos carbonilo.
Relación molar picrato: cianuro. Estequiometría del complejo
En general, las sales de derivados nitro de compuestos fenólicos son consideradas excelentes modelos para el estudio de la estructura molecular de complejos de transferencias de carga, en especial con sales alcalinas del ácido pícrico (3). En muchas estructuras de los complejos, el picrato puede actuar como ligando mono y bidentado, estando en el sitio de interacción principal el oxígeno fenólico, donde la interacción más importante es la generada por ion-ion.
El segundo sitio de interacción tiene origen en los grupos oxígenos de los grupos nitro, y se genera por la participación del grupo hidróxido del fenol y del grupo nitro, actuando como ligando bidentados; así es posible la actuación del picrato como tridentado, pues él mismo posee tres grupo nitro en su estructura.
Como se observa, son múltiples los complejos encontrados con participación del ion picrato, siendo numerosos los ejemplos de la capacidad del ácido pícrico en formar complejos de coordinación (17-19). Así, muchos son los estudios realizados dirigidos a caracterizar estos complejos, orientados hacia la determinación de la relación molar y constantes de formación del complejo. Sin embargo, para el sistema ion picrato:cianuro no se ha reportado información sobre la relación molar del complejo formado. Por esta razón se estudió la determinación de la relación molar en que se encuentran en el complejo para el caso de cianuro y picrato, aplicando el método de las variaciones continuas.
Como se indicó anteriormente, la longitud de onda de máxima absorción del complejo formado cambia según el tiempo de reacción o de equilibrio, registrándose igualmente un cambio en el coeficiente de absortividad molar (Figura 5).
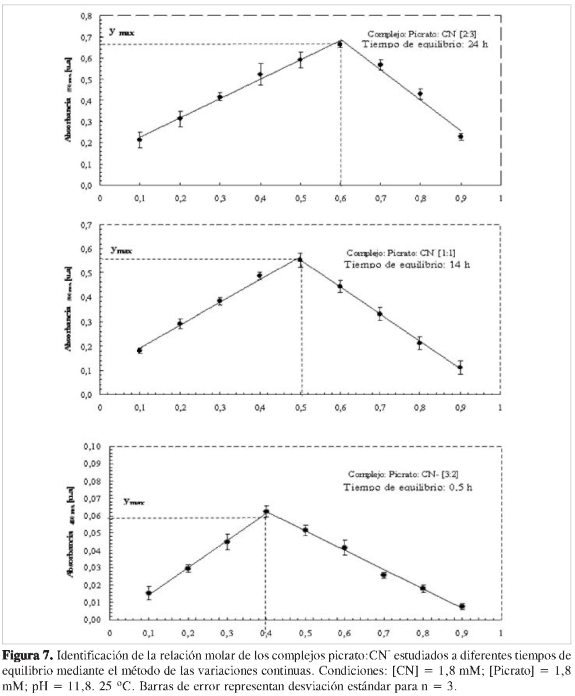
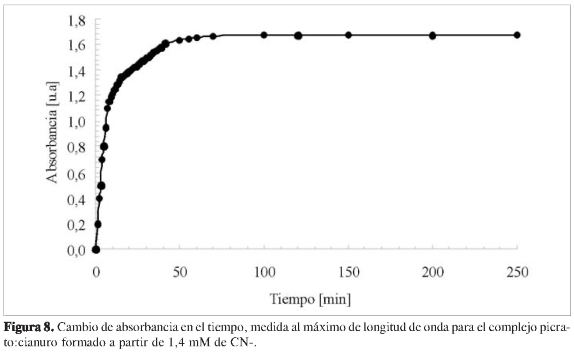
Estos resultados podrían indicar que la estructura o estequiometría del complejo formado pudiese estar variando en la medida en que la reacción ocurre, y por ello se estudió la estequiometría del complejo a diferentes tiempos de equilibrio o reacción. La Figura 7 muestra los resultados obtenidos para el estudio de la estequiometría del complejo mediante el método de las variaciones molares, para tiempo de reacción de 0,5, 14 y 24 h. Tal y como se observa en la figura, la estequiometría del complejo cambia según el tiempo de reacción, encontrándose una estequiometría picrato:CN- de 3:2, 1:1 y 2:3 para 0,5, 14 y 24 h, respectivamente. Así se demuestra que, para este sistema, la estequiometría del complejo es una función de la concentración y del tiempo de equilibrio o de reacción fijado.
Es posible realizar un estimado de los valores de las constantes de formación de los diferentes complejos, usando para ello la ecuación (27):
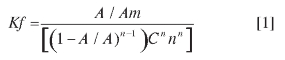
donde
A = máxima absorbancia medida
Am = absorbancia obtenida mediante extrapolación de las dos líneas del gráfico de las variaciones continuas.
n = estequiometría del complejo, por ejemplo relación 1:1, n = 0,5.
C: concentración molar de CN- usado en el método de las variaciones.
Usando esta ecuación, los valores de Kf obtenidos son 42,6, 6,53 y 8,7 x 104 para las estequiometrías de ion picra-to:CN- de 3:2 (0,5h), 1:1 (14h)y 2:3 (24 h), respectivamente.
De los valores obtenidos para Kf, la estequiometría 2:3 del complejo a 24 h de reacción es la que muestra mayor valor de Kf, y por tanto, se espera sea la estequio-metría de mayor estabilidad. Esta este-quiometría se considera el producto final de otras estequiometrías precedentes, que tienen lugar mediante etapas de adición de iones CN- a los complejos inicialmente formados.
Se puede caracterizar aun más la reacción, calculando el cambio de energía libre o función de Gibbs (AG°), según la ecuación:
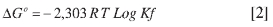
Donde
R = 8,3143 Joul K-1 mol-1;
T = temperatura absoluta (°C + 273).
Para los valores de Kf calculados, se encuentran valores de ΔG° de -9,16 KJoul mol-1; -4,43 KJoul mol-1 y -27,78 KJoul mol-1 para estequiometría del complejo de 3:2, 1:1 y 2:3 (Picrato:CN_), respectivamente. Así, se obtienen en los tres casos valores de ΔG° < 0, lo cual indica que las reacciones de formación de los complejos son espontáneas, siendo la más favorecida la estequiometría 2:3 (24 h).
Los estudios aquí realizados sólo abarcaron hasta un tiempo de equilibrio de 24 h; sin embargo, las medidas sobre la absorción del complejo a diferentes tiempos (Figura 8), muestran que sólo más allá de los 50 min, permanece una estequiometría constante.
Para estudios futuros se considera evaluar desde un punto de vista dinámico las diferentes estequiometrías del complejo, a tiempos aquí no considerados, incluyendo además el efecto de usar diferentes concentraciones de iones picrato y cianuro de partida.
Aplicación práctica. Determinación de HCN en las plantas
Para estimar la practicidad de esta reacción en los estudios de determinación de HCN a partir de fuente natural, en especial, de material de plantas, se estudió la reproducibilidad del método en la cuantificación de HCN a partir de láminas foliares provenientes de Passiflora capsularis, una especie de planta que posee la capacidad de liberar HCN cuando su tejido es perturbado (26). En este caso, la muestra de material de planta se coloca en un sistema cerrado, al cual se le añaden unas gotas de tolueno para provocar el daño celular, y de esta manera, la liberación de HCN.
El gas liberado (HCN) fue entonces arrastrado con aire a una solución de picrato de sodio saturado (pH = 11,8), donde la absorbancia se registró continuamente. Este experimento se realizó por triplicado, y sus resultados se resumen en la Figura 9, donde es posible observar un aumento gradual en la cantidad de CN detectado hasta las dos horas luego de agregar el tolueno al material vegetal. Los resultados demuestran la utilidad del método basado en esta reacción para los estudios de la cinética enzimática de la liberación de HCN en muestras vegetales, aunque cabe señalar que los potenciales interferentes que puedan también estar presentes en la muestra (aceites esenciales, compuestos carbonílicos en general) pueden limitar significativamente su aplicación.
ESTUDIOS CINÉTICOS 1. Efecto del pH
En general, la formación del complejo pi-crato:cianuro se lleva a cabo mediante la neutralización del ácido pícrico con bicarbonato de sodio, y esa es la condición normalmente usada para aplicar esta reacción con fines analíticos. Sin embargo, no existe estudio alguno sobre el efecto del pH sobre la formación del complejo, ni estudios cinéticos de esta reacción. Así, el primer paso de esta investigación fue estudiar la formación del complejo según el pH del medio.
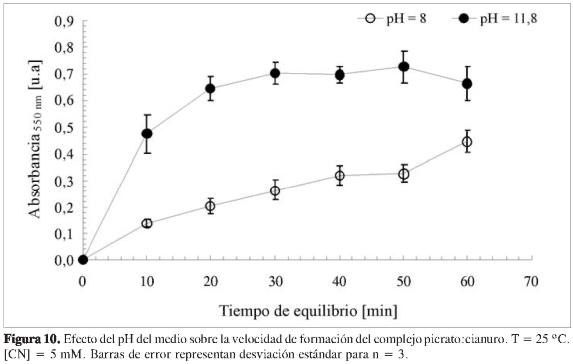
Se estudió la presencia del complejo en dos pH. A un pH = 8, ligeramente superior a la neutralidad del ácido pícrico, y a un pH = 11,8, suficientemente básico para asegurar una total neutralización del ácido pícrico, estando en forma de picrato de sodio, condición en la que es utilizada la reacción con fines analíticos. El resultado obtenido de este estudio se resume en la Figura 10, donde la formación del complejo se ve más favorecido a un pH = 11,8, aunque a pH = 8 se observa una respuesta más lineal con el tiempo de reacción.
Teniendo en cuenta que el desarrollo de un color rojo es la base de la utilización de esta reacción en aplicaciones cualitativas y cuantitativas, es lógico llevar a cabo la reacción en condiciones fuertemente básicas, y en general, se utiliza el ácido pícrico saturado en bicarbonato de sodio, De esta manera, los estudios de los parámetros cinéticos de la reacción son llevados a un pH de 11,8.
2. Estudio de la velocidad de reacción
En el estudio de cualquier sistema cinético, el conocimiento sobre el balance de sustancias que aparecen o desaparecen en el sistema es de vital importancia para el mecanismo por el cual ocurre este cambio. Una representación gráfica de la concentración en función del tiempo, es la metodología más frecuente en el estudio de las velocidades de las reacciones químicas (28).
En este trabajo se mide la absorción en el espectro del ultravioleta y el visible para determinar los cambios de masas de los productos formados.
El complejo obtenido es de una coloración roja, cuya intensidad es dependiente de la concentración de los reactivos. Se midió la absorbancia del complejo formado en referencia a los equivalentes de iones cianuros iniciales, y así todos los datos se representan en equivalente de NaCN.
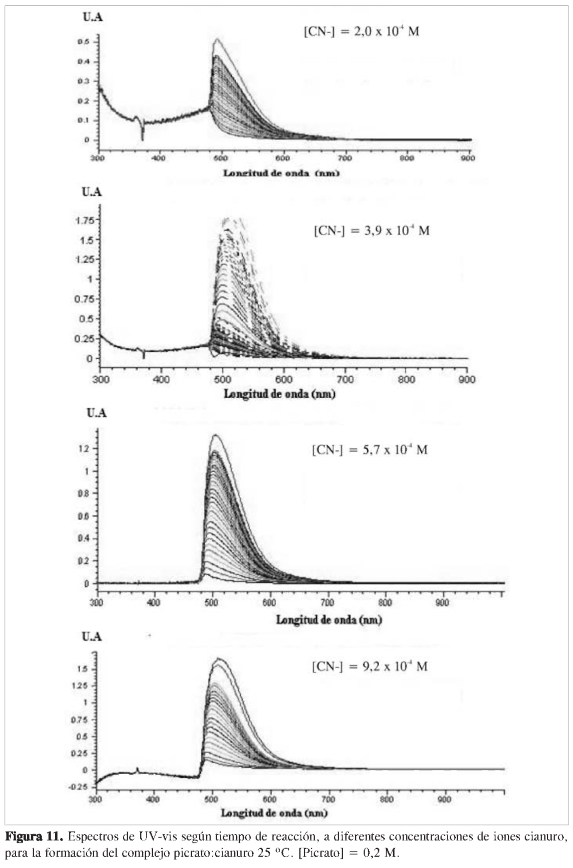
En la Figura 11 se muestran los espectros obtenidos a intervalos de 1 min para la reacción del ion cianuro en presencia de un exceso de picrato de sodio. Del mismo modo, se registraron los espectros al variar la concentración del picrato de sodio en presencia de un exceso de cianuro de sodio. Un total de cuatro concentraciones se utilizaron en cada caso. Todos estos ensayos permiten determinar los exponentes u orden de reacción para cada uno de los reactantes, donde se considera una ecuación cinética del tipo:
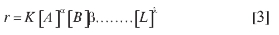
Con la presencia de uno de los reactivos en exceso, su concentración no cambia significativamente durante el proceso; así esta ecuación puede expresarse como:

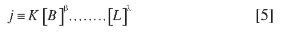
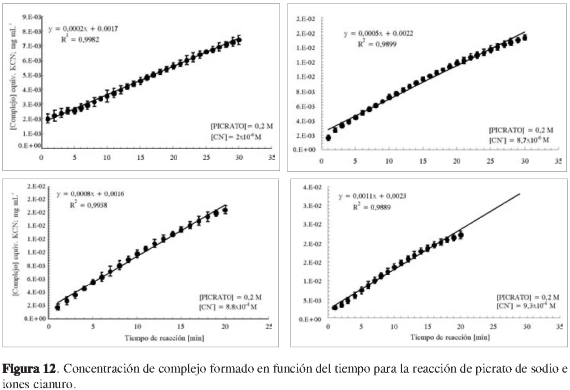
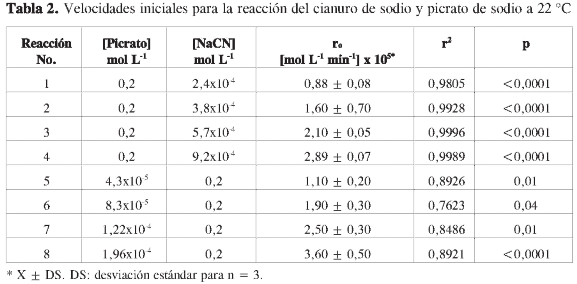
donde j permanece prácticamente constante durante la reacción. En estas condiciones, la reacción se considera como de pseudo orden α. De este modo, midiendo la velocidad inicial (ro) en cada caso, es posible determinar el orden de la reacción, α, respecto a A. La variación de la concentración del complejo en función del tiempo en presencia de un exceso de picrato en un caso y en cianuro en otro se muestra en la Figura 12. Los resultados del cálculo de velocidades iniciales (ro)se resumen en la Tabla 2.
Determinación del orden total de reacción. Ecuación de velocidad
Considerando la ecuación [4], se puede reordenar en función logarítmica para tomar la forma:
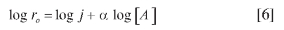
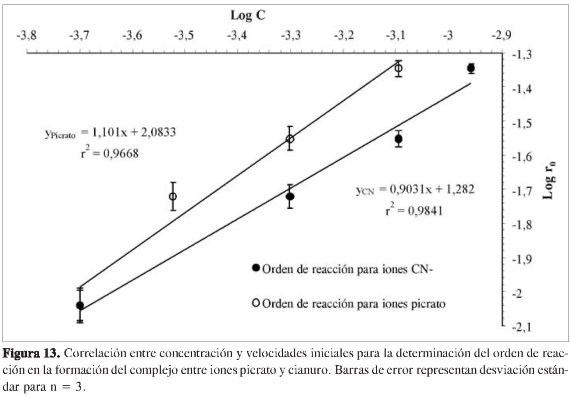
De esta ecuación, una representación del logaritmo de ro frente al log [A], se obtiene el orden inicial respecto a A, α.
Es decir, representando la velocidad obtenida manteniendo constante la concentración de picrato o la concentración de cianuro, en función de la concentración inicial de cianuro de sodio o picrato, según sea el caso, se pueden encontrar los coeficientes α y β, y el orden total de la reacción. En la Figura 13 se muestra la correlación entre ro y concentración para la determinación de los órdenes respecto a los iones cianuro y picrato. Los datos obtenidos indican un orden de reacción de 1 respecto a cada reactivo, siendo 2 el orden total de la reacción.
Con los resultados obtenidos es posible postular la expresión de velocidad general para la reacción bajo estudio, d[COMPLEJO]/dt = k [PICRATO]1 [CN-]1, donde k es la constante de velocidad de la reacción. Sin embargo, la ecuación podría contener otro factor relacionado con la concentración de iones OH-, puesto que se ha demostrado que el pH afecta de manera significativa la velocidad de la reacción (Figura 8), aumentando la velocidad con un incremento en el pH.
Así, la expresión de velocidad podría incluir otro componente, [OH-]x;deestama-nera, la expresión general toma la forma:
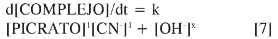
donde x representa el orden de reacción respecto a la concentración de OH-.
Determinación de la energía de activación
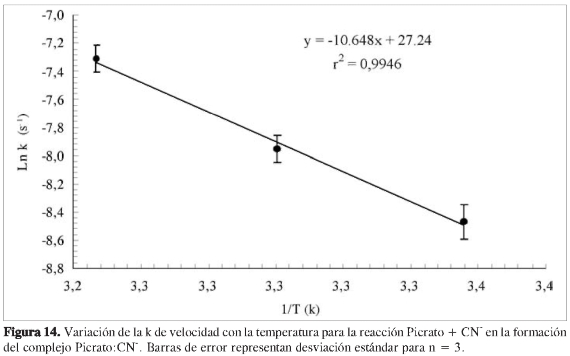
Es posible la determinación de la energía de activación del proceso midiendo la constante de velocidad a diferentes temperaturas, y graficando el Ln k en función de 1/T, es factible estimar, a partir de la pendiente de la curva, la energía de activación, según la ecuación de Arrhenius:
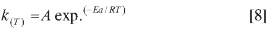
la cual puede ser arreglada en su forma logarítmica a la expresión
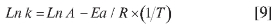
donde K representa la constante de velocidad, A, es el denominado factor pre exponencial, Ea, es la energía de activación, R es la constante universal de los gases y T la temperatura en grados K. Una gráfica de este tipo se muestra en la Figura 14, de cuya pendiente se obtiene un valor de energía de activación para el proceso global de 88,7 ± 6,7 KJoul Mol-1. No existen en la literatura datos sobre energía de activación para este proceso ni para ningún complejo formado entre el picrato y otra molécula donadora de electrones, siendo este resultado de cierta novedad para una caracterización completa de esta reacción.
Algunos resultados de cálculos de Ea para algunos complejos de ácido pícrico se encuentran dentro de los valores aquí obtenidos. Por ejemplo, para la reacción del ácido pícrico y la fenontiacina (1), se obtiene un complejo de estequiometría 1:1, donde se reporta un valor de Ea de 83,1 KJoul Mol-1. Para la reacción de cloruro de picril y el anión dietilmalonato (28), una reacción de sustitución aromática, que en principio debe poseer una energía de activación mayor a la formación de un complejo de transferencia de carga, se reporta un valor de Ea de 90,8 KJoul Mol-1.
CONCLUSIONES
El estudio mediante espectroscopia de UV-Vis de la reacción entre el ion picrato y cianuro representa un excelente ejemplo de aplicaciones analíticas, cinéticas y de química de coordinación, todo esto aplicando las mismas herramientas instrumentales y reactivos. Los estudios de las aplicaciones analíticas de esta reacción, aunque muy clásica en la determinación de HCN, revelan que la reacción tiene que ser cuidadosamente estudiada en cuanto a sus características espectroscó-picas, puesto que cambios en los máximos de absorción son observados. Así, la validación de algún método de análisis debe tener presente este hecho.
Por otra parte, aunque la reacción fue validada en cuanto a la determinación de HCN a partir de material vegetal, la misma puede ofrecer limitaciones por la presencia de compuestos que puedan también formar complejos con las mismas características espectrales que el formado con el ion cianuro. Así, es posible la presencia de interferencias espectrales, difíciles de eliminar instrumentalmente, siendo necesario un pre tratamiento de la muestra, como la posible precipitación de los interferentes volátiles mediante reacciones selectivas, donde no reaccione el HCN.
Los estudios cinéticos, como la determinación del orden de la reacción, cálculos de la energía de activación y de la energía libre, demuestran que la reacción entre los iones picrato y cianuro es de primer orden respecto a cada reactivo, siendo además dependiente del pH, favorecida por el aumento del mismo, razón por la cual la mayoría de las aplicaciones de la reacción del complejo con ácido pícrico son llevadas a cabo a pH alcalinos.
Los estudios sobre la caracterización estequiométrica del complejo formado muestran que los cambios observados en los máximos de absorción pueden ser debidos a la formación de complejos con diferente orden estequiométrico, donde una relación Picrato:CN- 2:3 parece la este-quiometría más estable, estando las formas estequiométricas 3:2 y 1:1 como especies intermedias.
REFERENCIAS BIBLIOGRÁFICAS
1. Ashok, M.; Achar, B. Thermal degradation kinetics and solid state, temperature dependent, electrical conductivity of charge-transfer complex of phenothiazine with chloranil and picric acid. Bull. Mater. Sci. 2008. 31: 29-35. [ Links ]
2. Vasiliades, J. Reaction of alkaline sodium picrate with creatinine: I. Kinetics and mechanism of formation of the mono-creatinine picric acid complex. Clin. Chem. 1976. 22:1664-1671. [ Links ]
3. Olsher, U.; Feinberg, H.; Frolow, F.; Shoham, G. The Picrate Anion as a Versatile Chelating counterion for the Complexation of Alkali and Alkaline Earth Metal Cations with Ionophores: The 'Pricate Effect'. Pure and Appl. Chem. 1996. 68: 1195-1199. [ Links ]
4. Brimer, L.; Christensen, S.; Molgaard, P.; Nartey, F. Determination ofcyanogenic compounds bythin-la-yer chromatography. 1. A densitometric method for quantification of cyanogenic glycosides, employing enzyme preparations (beta-glucuro-nidase) from Helix pomatia and pi-crate-impregnated ion-exchange sheets. J. Agrie Food Chem. 1983. 31: 789-793. [ Links ]
5. Nagata, Y.; Doi, M.; Ishida, T.; Wakahara, A. Imidazole-4-acetic Acid-Picric Acid (1/1) Complex. Acta Cryst. 1997. C53: 367-369. [ Links ]
6. Zaderenko, P.; Gil, M.; López, P.; Ballesteros, P.; Fonseca, I.; Albert, A. Diethyl 2-benzimidazol-1-ylsuc-cinate-picric acid (1/1): Aninclusion molecular complex. Acta Cryst. 1977. B53: 961-967. [ Links ]
7. You, Z.; Dai, W.; Hu, Y. 2-Hydroxypyridinium 2,4,6-trini-trophenolate. Acta Cryst. 2007. E63: 3735. [ Links ]
8. Kalyanasundaram, K. Photochemistry of Polypyridine and Porphyrin Complexes. New York: Academic. 1992. [ Links ]
9. Vogler, A.; Kunkely, H. Photochemistry induced by metal-to-ligand charge transfer excitation. Coord. Chem. Rev. 2000. 208: 321-329. [ Links ]
10. Shriver, D.; Atkins, P. Inorganic Chemistry, 3rd ed. New York: W. H. Freeman and Company. 1999. [ Links ]
11. Blaney, B.; Swing, G.; Van Der Waals. Molecules. Ann. Rev. Phys. Chem. 1976. 27: 553-584. ' [ Links ]
12. Hunter, C.; Lawson, K.; Perkins, J.; Urch, C. Aromatic interactions. J. Chem. Soc., Perkin Trans. 2001. pp. 651-669. [ Links ]
13. Eerny, J.; Hobza, P. Non-covalent interactions in biomacromolecules. Phys. Chem. Phys. 2007 . 9: 5291-2303. [ Links ]
14. Knorrs, C.; Gafney, H.; Baker, A.; Braunstein, C.; Strekas, T. Assignment of charge transfer bands for a bridged binuclear metal complex by resonance Raman excitation profiles. 2005. J. Raman Spectrosc. 14: 32-35. [ Links ]
15. Miyajima, N.; Akatsua, T.; Ikomab, T.; Itob, O.; Randa, B.; Tanabe, Y.; Yasuda, E. A role of charge-transfer complex with iodine in the modification of coal tar pitch. Carbon. 2000. 38: 1831-1838. [ Links ]
16. Han, F.; Inoue, T.; Wasai, T.; Ku-raochi, Y.; Ohga, K. Odor Sensor Based on the Information of colour. J. Eng Appl. Sci. 2006. 1: 1-6. [ Links ]
17. El-Mossalamy, E. Charge-transfer complexes of phenylephrine with nitrobenzene derivatives. Spectrochim Acta A Mol Biomol Spectrosc. 2004. 60: 1161-1167. [ Links ]
18. Refat, M.; Ahmedb, H.; Grabchev, I.; El-Zayat, L. Spectroscopic and structural characterization of the charge-transfer interaction of N,N'-bis-alkyl derivatives of 1,4,6,8-naphthalenediimide with chloranilic and picric acids. Spectro-chim Acta A Mol Biomol Spectrosc. 2008. 70: 907-915. [ Links ]
19. Gaballa, A.; Wagner, C.; Teleb, S.; Nour, E.; Elmosallamy, M.; Ka-luderovic, G.; Schmidt, H.; Stein-born, D. Preparation, spectroscopic and structural studies on charge-transfer complexes of 2,9-di-methyl-1,10-phenanthroline with some electron acceptors. J. Mol. Struct. 2008. 876: 301-307. [ Links ]
20. Guignard, L. Le haricot à acide cyanhydrique (Phaseolus lunatus). Ëtude historique, botanique et chimique. Nouveau procédé pour décelerer l'acidecyanhidrique. Bull. Sci. Pharmac. 1906. 13: 401-419. [ Links ]
21. Corkill, L. Cyanogenesis in white clover I Cyanogenesis in single plants. N.Z. J. Tech. 1940. 22B: 65-67. [ Links ]
22. Likussar, W.; Boltz, D. Theory of continuous variations plots and a new method for spectrophotometric determination of extraction and formation constants. Anal. Chem. 1971. 43:1265-1272. [ Links ]
23. Swinbourne, E. Analysis of Kinetic Data. Studies in Modern Chemistry. London, Great Britain: C. Tinling Co. Ltd. 1971. [ Links ]
24. Levine, I. Fisicoquímica. 3a. ed. McGraw-Hill Interamericana de España, S.A., 1991. [ Links ]
25. Campana, A.; Rodríguez, L.; Barrero, F.; Ceba, M.; Fernández, J. ALAMIN: a chemometric program to check analytical method performance and to assess the trueness by standard addition methodology. Trends Anal. Chem. 1997. 16: 381-385. [ Links ]
26. El-Enany, N.; Belai, F.; Rizk, M. Spectrophotometric Determination of Thioctic Acid in its Dosage Forms through Complex Formation with Pd(II). J. Chin. Chem. Soc. 2007. 54: 941-948. [ Links ]
27. Fischer, F.; Fung, S.; Lankhorst, P. 1982. Cyanogeneic compounds from Passiflora capsularis, P. warmingii and P. perfoliata. Pianta Medica. 45: 42-45. [ Links ]
28. Leffek, K.; Matinolopoulos-Scor-dou, A. Aromatic substitutions with carbanions nucleophiles. III. The kinetics of the reaction of picryl chloride with diethylmalonate anion. Can. J. Chem. 1977. 55: 2656-2663. [ Links ]