Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804On-line version ISSN 2357-3791
Rev.Colomb.Quim. vol.38 no.2 Bogotá May/Aug. 2009
SÍNTESIS DE ÓXIDOS TIPO PEROVSKITA MEDIANTE POLIMERIZACIÓN CON ÁCIDO CÍTRICO Y PROPIÓNICO
SYNTHESIS OF PEROVKITE TYPE OXIDES BY POLYMERIZATION WITH CITRIC AND PROPIONIC ACID
PEROVSKITAS TIPO ÓXIDO SÍNTESE POR POLIMERIZAÇÃO COM ÁCIDO CÍTRICO E PROPIÓNICO
Jairo A. Gómez-Cuaspud1, Jesús S. Valencia-Ríos1
1 Departamento de Química, Facultad de Ciencias. Universidad Nacional de Colombia, sede Bogotá. Bogotá, Colombia. jagomezcua@unal.edu.co
Recibido: 23/02/09 - Aceptado: 07/09/09
RESUMEN
En este trabajo se describe la preparación de la perovskita La0,75Sr0,25Co0,5Fe0,5O3 (LaSrCoFeO), empleando una ruta de química húmeda, mediante la polimerización con ácido cítrico y propiónico, con el propósito de obtener materiales para potenciales aplicaciones como membranas de purificación de oxígeno y como materiales electródicos en celdas de combustible de óxido sólido (SOFC). Para ello, los sólidos se caracterizaron mediante difracción de rayos X (DRX) y microscopia electrónica de barrido (SEM), con lo que se obtuvo información sobre la formación y pureza de fases, la morfología, la estructura y las propiedades superficiales de cada sistema, indicando que es posible obtener sólidos con una distribución de grano homogéneo, textura y relieve característicos, en cuyo contexto el método que involucra la polimerización con ácido cítrico mostró los mejores resultados. La composición global se determinó mediante microanálisis de rayos X de energía dispersiva (EDX), y se señaló una buena concordancia entre las composiciones propuestas y obtenidas. La caracterización realizada sugiere la presencia de pequeñas cantidades de carbono y algunos óxidos de lantano, estroncio y cobalto como principales contaminantes, específicamente en la muestra obtenida mediante la polimerización con ácido propiónico.
Palabras clave: citratos, propionatos, ferroeléctrico, multiferróico, perovskita.
ABSTRACT
This paper describes the preparation of La0,75Sr0,25Co0,5Fe0,5O3 (LaSrCoFeO) perovskite, using a wet chemical route, through polymerization with citric acid and propionic acid, to obtain materials for potential applications as membranes purification materials and oxygen electrodes in Solid Oxide Fuel Cells (SOFC). The solids were characterized by X-ray diffraction (XRD) and scanning electron microscopy (SEM), obtaining information on the formation and purity of phases, morphology, structure and surface properties of each system. This indicates that it is possible to obtain solids with a homogeneous distribution of grain, texture and relief features. In this context the method involving the polymerization with citric acid showed the best results. The overall composition was determined by X-ray microanalysis of energy dispersive (EDX), indicating a good correlation between the compositions obtained and the proposed. The characterization performed suggests the presence of small amounts of carbon and some oxides of lanthanum, strontium and cobalt as major pollutants, specifically in the sample obtained by polymerization withpropionic.
Key words: citrates, propionates, ferroelectric, multiferroic, perovskite.
SUMARIO
Este trabalho descreve a preparação do Perovskitas La0,75Sr0,25Co0,5Fe0,5O3 (LaSrCoFeO), utilizando uma via húmida química, através da polimerização do ácido cítrico e ácido propiônico, a obtenção de materiais para aplicações potenciais como membranas purificação materiais e eletrodos de oxigênio em células combustíveis Óxido Sólido (SOFC), pois o sólidos foram caracterizados por difração de raios X (XRD) ea microscopia eletrônica de varredura (MEV), obtendo informações sobre a formação ea pureza dos fases, morfologia, estrutura e propriedades superficiais de cada sistema, indicando que é possível obter sólidos com uma distribuição homogénea de grão, textura e relevo características, em cujo contexto, o método que envolve a polimerização com ácido cítrico apresentaram os melhores resultados. No seu conjunto, a composição foi determinada por microanálise de raios-X de energia dispersiva (EDX), indicando uma boa correlação entre as composições obtidas e propostas. A caracterização realizada, sugerem a presença de pequenas quantidades de carbono e alguns óxidos de lantânio, estrôncio e cobalto como principais poluentes, especialmente na amostra obtida por polimerização com ácido propiônico.
Palavras-chave: citratos, propionatos, ferroeléctrico, multiferróico, perovskita.
INTRODUCCIÓN
El método de la polimerización de ácidos carboxílicos que se deriva del proceso común de sol gel, es un método conveniente para la preparación de sólidos multicomponentes con un buen control estequiométrico, homogeneidad de fases y estructura cristalina (1-3). El método se basa en la formación de resinas poliméricas como resultado de la poliesterificación de los compuestos de coordinación de ácidos carboxílicos, con un alcohol polivalente; de esta forma se obtiene el producto deseado de los cationes metálicos trabajados con relativas bajas temperaturas. Obviamente el conocimiento de la naturaleza química de los principales procesos involucrados (la formación de compuestos de coordinación, esterificación y poliesterificación), son de gran significancia para una óptima aplicación del método en cuestión. Indudablemente diversos artículos tratan principalmente sobre los aspectos sintéticos del método por diferentes rutas (4-7), reportes más detallados del comportamiento en disolución de los
precursores poliméricos existen en baja cantidad. En este sentido, la presente investigación tiene como propósito sintetizar un sólido policatiónico tipo perovskita basada en el sistema La0,75Sr0,25Co0,5Fe0,5O3 (LaSrCoFeO), mediante el empleo de una ruta de química húmeda que involucre la conformación de quelatos tipo citrato y propionato, bajo condiciones específicas de pH y temperatura. Se busca establecer de forma comparativa cuál método ofrece mayores ventajas desde el punto de vista del agente quelante, propiedades morfológicas y texturales, característica de vital importancia en el diseño de dispositivos electroquímicos, en cuyo campo, las técnicas de síntesis de baja temperatura han realizado considerables aportes (8), permitiendo la obtención de materiales catalítica y electrocata-líticamente activos con buena estabilidad, selectividad y desempeño para la construcción de componentes electródicos en celdas de combustible de óxido sólido (SOFC) y hacia el desarrollo de materiales para aplicaciones como membranas para la purificación de oxígeno y componentes fotocatalíticos (9-11).
MATERIALES Y MÉTODOS
Para la síntesis del óxido (LaSrCoFeO) mediante polimerización con ácidos car-boxílicos, se emplearon los correspondientes nitratos de los cationes en disoluciones 1,0 M: de La(NO3)3 99,9%, Sr(NO3)2 99,8%, Co(NO3)3.9H2O 99,98% y Fe(NO3)3.9H2O99,98%, todos de la casa comercial Merck. De igual forma, se empleó ácido cítrico monohidrata-do Merck 99,99%, que se disolvió y ajustó a una concentración final 2,00 M. Las disoluciones precursoras de los nitratos se dosificaron en un reactor de vidrio dotado con agitación magnética (150 rpm), control de temperatura y reflujo a 80 °C, durante ocho horas. El orden de adición de los precursores fue: Sr, La, Co y Fe, establecido por sus correspondientes constantes de hidrólisis, asegurando una concentración total de nitratos en la mezcla de 0,01 moles.
Para la muestra obtenida por polimerización de ácido cítrico, se procedió a adicionar la correspondiente disolución en una proporción molar 2:1 en relación con la cantidad total de cationes metálicos, permitiéndose la continuación del reflujo por 30 minutos, después de lo cual, se agregó etilenglicol en una proporción molar 4:1 con respecto a la cantidad total de ácido cítrico para favorecer el desarrollo de reacciones de poliesterificación, fijando el pH en un valor de 2,00 con el propósito de promover la formación de los respectivos compuestos de coordinación, obteniéndose una disolución homogénea de apariencia cristalina. De esta forma, la concentración final de cada especie fue La3+ = 0,156 M, Sr2+ = 0,052 M, Fe3+ = 0,104 M, Co2+ = 0,104 M y ácido cítrico = 0,625 M, para un volumen final de disolución de 24,0 mL.
En el caso de la síntesis por polimerización con ácido propiónico, se realizó la misma dosificación que en el caso anterior, manteniendo las mismas condiciones y tiempos de agitación, temperatura y reflujo; una vez se ajustó una concentración de 0,01 moles de los respectivos nitratos, se procedió a adicionar ácido propiónico Merck 99,98% en una proporción molar 2:1, en relación con la cantidad total de cationes, ajustando una concentración final en disolución de 0,833 M, enunvolumende24,0mL, con el fin de asegurar la formación de los respectivos propionatos. Finalmente, y al igual que en el caso anterior, se agregó etilenglicol en una proporción molar 4:1 con respecto a la cantidad de ácido adicionado, fijando el pH en 2,0. El reflujo, en ambos casos, se mantuvo por un periodo de ocho horas, al cabo de las cuales, el sol resultante se trasvasó a recipientes apropiados para iniciar una etapa de secado a 120 °C por 24 horas, obteniéndose un líquido altamente viscoso, particularmente en el caso del ácido propiónico. Finalmente ambos precursores se dispusieron para iniciar los posteriores tratamientos térmicos.
En el caso de la muestra obtenida mediante polimerización con ácido cítrico, se realizaron tratamientos térmicos posteriores a 250 y 400°C por 30 minutos cada uno hasta la obtención de un sólido de apariencia carbonosa que se molturó y calcinó en crisol de platino a 900 °C por dos horas, usando una rampa de 5 °C min-1, hasta la consolidación de la fase cristalina buscada.
La muestra obtenida mediante polimerización con ácido propiónico, después del tratamiento inicial a 120 °C, fue sometida a un calentamiento controlado a 250 °C, con el fin de propiciar la obtención de un precursor sólido, debido a la dificultad que representó la eliminación de este precursor polimérico; después de diferentes etapas térmicas a 300 y 400 °C, se obtuvo un sólido que se molturó y calcinó en crisol de platino a 900 °C por 30 minutos, usando una rampa de 5 °C / min-1 con el fin de eliminar los residuos carbonosos remanentes de la etapa anterior.
A los sólidos obtenidos, se les evaluó la estructura cristalina (formación y pureza de fases) mediante difracción de rayos X, en un equipo PANalytical X'pert PRO MPD dotado con un detector Ultra-Fast X'Celerator, en disposición Bragg-Brentano, utilizando la radiación Cu Kα (λ = 1,54186 Å) sin rotación de muestra. Los difractogramas se corrieron entre 20 y 80 grados con pasos de 0,02 grados, con irradiaciones de 0,01 segundos por cada paso. Los resultados obtenidos fueron analizados y refinados empleando el programa X'Pert High Score®y Cellref3.0®. Finalmente, la morfología se estudió mediante microscopia electrónica de barrido, utilizando un equipo JEOL JSM-7400F en la modalidad de barrido de emisión de campo, operado a 30 kV, lo cual también permitió determinar la composición global de las muestras mediante microanálisis EDX.
RESULTADOS Y DISCUSIÓN
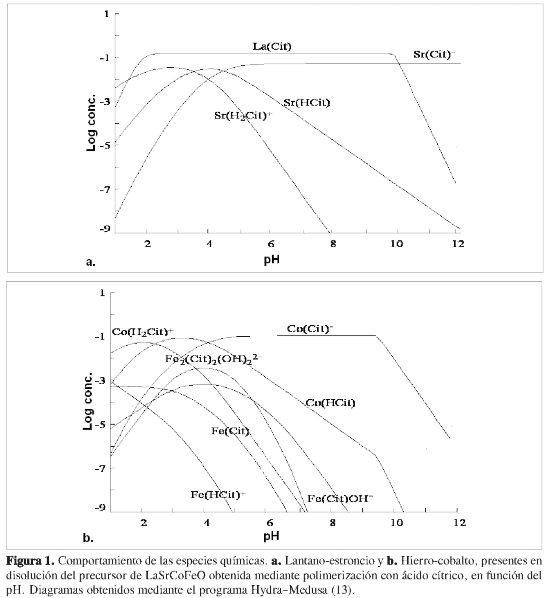
La preparación y la naturaleza de precursores del sistema LaSrCoFeO mediante el método de polimerización con ácido cítrico está sujeta inicialmente a la presencia en el medio de reacción de distintas especies complejas cuya existencia predomina y evoluciona en función del pH, de la concentración de ligandos y de la fuerza iónica, de forma que promueva el establecimiento de diferentes quelatos y la polimerización de los mismos (12); adicionalmente, se busca una distribución homogénea en el nivel molecular y atómico de los cationes en disolución que permita reducir las barreras difusionales asociadas con las reacciones bajo tratamiento térmico, y que promueva, a su vez, la reducción en los tiempos y temperaturas empleadas para conformar las fases cristalinas buscadas. De esta forma, los diagramas de equilibrio para las muestras obtenidas mediante polimerización con ácido cítrico y glicina mostraron que la prevalesencia de determinadas especies se ve favorecida en determinados rangos de pH, sugiriendo que el control de este parámetro es crucial en el establecimiento de las condiciones mínimas de reacción que permitan tener un control sobre la dinámica de los procesos, como se indica en las Figuras 1 y 2.
Los diagramas de distribución de especies a manera de representaciones de Pourbaix de la muestra sintetizada mediante polimerización con ácido cítrico, predicen la existencia de diferentes especies tipo citrato, hidroxilo y óxido, algunas de las cuales muestran una tendencia general a prevalecer en niveles específicos de pH; particularmente, las especies tipo citrato coexisten con valores 2,0 ≤ pH ≤ 5,0; sin embargo, es evidente que en el caso particular de los compuestos de coordinación de lantano y estroncio, dichas especies muestran ser estables con valores 2,0 ≤ pH ≤ 9,0 y 5,0 ≤ pH ≤ 12,0 respectivamente; de esta forma, bajo las condiciones de síntesis planteadas en el presente trabajo (pH = 2,0), se espera una presencia mayoritaria de especies tipo La(Cit) y Sr(H2Cit)+; por fuera de estos niveles de pH, se favorece la obtención de sustancias insolubles o no deseadas especialmente con pH alcalinos que podrían afectar la homogeneidad del medio de reacción (14). Por el contrario, los cationes cobalto y hierro poseen un comportamiento diferente, toda vez que la presencia de especies tipo CoO y Fe2O3 persisten en una amplia escala de pH, a pesar de ello, el predominio de las especies citrato de cobalto tiende a ser más fuerte en determinados rangos de pH, de forma que en condiciones de 1,0 ≤ pH ≤ 3,0, predominan especies de tipo Co(H2Cit)-, mientras que las de tipo Co(HCit) y Co(Cit)- se estabilizan en condiciones de menor acidez (3,0 ≤ pH ≤ 4,0 y 5,0 ≤ pH ≤ 9,5 respectivamente), sugiriendo que bajo las condiciones de síntesis desarrolladas se espera una presencia mayoritaria de Co(H2Cit)-. Para el caso del hierro, la situación es más compleja, ya que a partir de los diagramas de la Figura 1, es predecible la formación preferente de especies tipo Fe(Cit), al igual que de especies minoritarias tipo Fe(HCit)+, Fe(Cit)OH- yFe2(Cit)2 (OH)22-, las cuales coexisten en rangos de pH muy reducidos que limitarían el empleo de este catión en composiciones que requieran de su empleo en rangos de pH más variables, lo cual conduciría al establecimiento de hidróxidos y otras especies de tipo insoluble, según reportes de Sandstrõm (15). Cabe resaltar cómo bajo las condiciones de síntesis desarrolladas, los cationes trivalentes tienden a estabilizar principalmente compuestos de coordinación tipo M(Cit), mientras que los divalentes conforman compuestos tipo M(H2Cit)-, sugiriendo que las condiciones de pH en la mezcla inicial de los precursores son cruciales para la obtención de mezclas homogéneas y libres de precipitados.
Para la muestra sintetizada con ácido propiónico, no fue posible la determinación del diagrama de distribución de especies, debido a la falta de la respectiva base de datos para el establecimiento de las diferentes especies propionato; sin embargo, se realizaron diferentes pruebas con la disolución precursora para este sistema, mostrando que esta se mantiene homogénea en rangos de pH comprendidos entre 1,0 ≤ pH ≤ 5,5; una vez superado este valor, la disolución comienza a mostrar presencia de un precipitado copioso que no se disuelve incluso con niveles de pH superiores a 12,5, sugiriendo su reducida capacidad quelante a diferencia de la mostrada por el ácido cítrico.
Una vez concluida esta etapa de formación de los respectivos quelatos, los posteriores tratamientos térmicos realizados a cada una de las disoluciones precursoras, conducirán al desarrollo de diferentes procesos relacionados con la evolución química del material en función de la temperatura. La primera etapa está relacionada con la formación de los respectivos quelatos, la posterior pérdida de agua de disolución entre 50 y 60 °C y la eliminación de agua intramolecular que puede culminar con temperaturas entre 150 y 200 °C, esto inicia las etapas de esterificación y sugiere diferencias significativas en el modo de enlace de las moléculas de agua presentes (12). La evolución del sistema conduce a un proceso ligeramente endotérmico, relacionado con la formación de poliésteres por efecto del etilenglicol, al igual que dobles enlaces en los carboxilatos que dan origen a un precursor de apariencia resinosa, el cual se enmascara en medio de los fuertes procesos exotérmicos relacionados con las posteriores etapas del proceso entre 220 y 230 °C (24). El posterior paso corresponde con la destrucción del esqueleto orgánico a 470 °C y la eliminación de agua proveniente de la hidratación de los carbonatos. La naturaleza de los compuestos formados al final de esta etapa ha sido discutida en diversas investigaciones (12, 16), encontrándose principalmente especies tipo carbonato y óxidos a partir de los respectivos carboxilatos; en otros casos, se ha reportado la existencia de especies intermedias tipo oxicarbonato, lo cual se ha confirmado por espectroscopia infrarroja y difracción de rayos X (12), que sugieren la naturaleza amorfa me-taestable de este tipo de intermediarios incluso a 550 °C. La etapa final comienza una vez se supera esta temperatura, permitiendo la eliminación del carbón residual y la descomposición de los oxicarbonatos y precursores de los poliésteres formados; en este caso particular esta etapa culmina una vez la temperatura alcanza los 850 °C y se asegura la formación de la fase cristalina buscada.
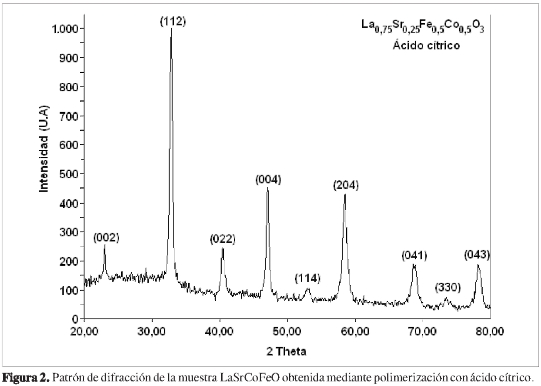
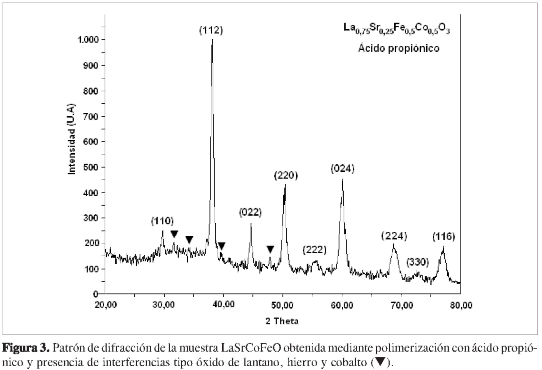
Los análisis de difracción de rayos X (DRX) indicaron que los sólidos LaSrCoFeO, obtenidos mediante polimerización con ácido cítrico y ácido propiónico, poseen una distribución y tamaño de grano propio del método de síntesis, con orientación cristalina preferencial en el plano (112), como se ilustra en las Figuras 2 y 3; con esta señal de mayor intensidad, se realizó la determinación del tamaño de partícula cristalina mediante la ecuación de Debye-Scherrer, tomando como referencia el valor de ancho de pico observado (3) y una constante de 0,89, con lo que se obtiene un tamaño de cristal 207 Å, consistente con la presencia de agregados nanométricos en ambos casos. Las micrografías electrónicas de barrido a 50 μm, evidencian la obtención de un material con una distribución de grano característico; la textura y el relieve observados son consecuencias del método de síntesis empleado, mostrando que esta técnica confiere al sólido características importantes en términos de área superficial, tamaño cristalino y forma de grano, para potenciales usos en aplicaciones catalíticas y electrocatalíticas (17), como se observa en las Figuras 4 y 5. El factor de tolerancia estructural para la composición estudiada, se determinó usando el programa SPuDS (9) (Structure Prediction Diagnostic Software), sugiriendo la estabilización de una estructura orto-rrómbica con un factor de tolerancia estructural de 0,9347 a 298 K, según parámetros de enlace de valencia, y un índice de inestabilidad global de 0,2352.
Los patrones de difracción para las muestras obtenidas sugieren la presencia minoritaria de óxidos de lantano (La2O3), hierro (Fe2O3) y cobalto (CoO); sin embargo, en el caso de la muestra obtenida mediante polimerización con ácido propiónico, es evidente la aparición de importantes líneas de difracción en 32,69;34,05; 39,48; y 47,86° 2 theta, relacionadas principalmente con la presencia de óxidos no estequiométricos de lantano, estroncio y cobalto (▼), como se indica en la Figura 3, relacionadas a su vez con la limitada acción quelante del ácido propiónico, lo cual conduciría al establecimiento de diferentes especies, muchas de ellas insolubles que, sumadas a la dificultad de eliminación de los precursores poliméricos, tendrían una notable influencia en la consolidación de la fase cristalina buscada.
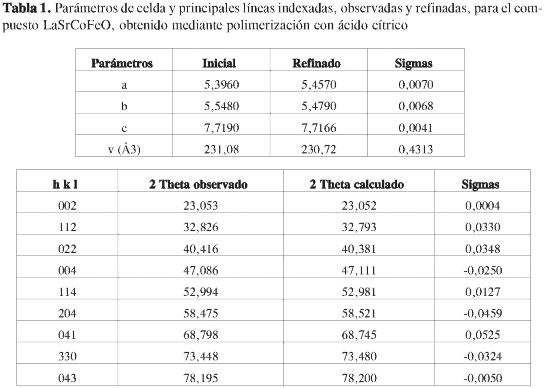
La posterior búsqueda realizada por el programa X'Pert High Score® en las bases de datos del ICCD, condujo a una clasificación de fase concordante con el compuesto de referencia La0,75Sr0,25Co0,5Fe0,5O3, correspondiente al código de colección de la ICSD número 086124, JCPDS: 00089-1267 con grupo espacial Pbnm (62), sistema cristalino ortorrómbico con parámetros de celda a = 5,396 Å, b = 5,548 Å y c = 7,719 Å, volumen de celda de 227,34 Å3 y una densidad calculada de 6,687 g.cm-3. El posterior refinamiento e indexado se realizó con el programa Cell-ref3.0®, bajo los parámetros anteriormente mencionados, empleando las nueve señales de mayor intensidad en ambos casos, cuyo resultado fue la existencia de pequeñas diferencias entre los parámetros de celda observados y calculados como se muestra en las Tablas 1 y 2. De esta forma, la variación en el volumen de celda se ajustó a una diferencia de 0,4313 Å3, para el caso de la muestra sintetizada mediante polimerización con ácido cítrico, y de 1,8645 Å3 para la obtenida mediante ácido propiónico, sugiriendo en este último caso, que la conformación del sólido pudo verse afectada por el efecto del pH de síntesis; esto favorecería la presencia de especies químicas diferentes a los propionatos que favorecieron la presencia de especies tipo propionato. En la Tabla 3, se muestran las distancias interatómicas estimadas de enlace para cada uno de los componentes estructurales de la perovskita La0,75Sr0,25Co0,5Fe0,5O3, sintetizada en este trabajo, los cuales guardan una estrecha relación con el sistema ortorrómbico demostrado por difracción de rayos X.
El estudio de difracción de rayos X, se complementó con el análisis por microscopia electrónica de barrido y microanálisis tipo EDX, con el fin de establecer un perfil de composición global de la muestra. En las Figuras 6 y 7, se muestran los espectros obtenidos con sus respectivas líneas de emisión características; en términos cualitativos, se destaca que el sólido no posee impurezas detectables distintas al carbono (transición Kα 0,270 keV), cuya presencia se justifica en virtud de la naturaleza de los precursores poli-méricos de citrato y propionato; las demás líneas son susceptibles de identificar plenamente en la medida en que corresponden a emisiones características del lantano, el estroncio, el cobalto, el hierro y el oxígeno (18).
CONCLUSIONES
Con estos resultados queda demostrado que el método de polimerización con ácido cítrico es el más apropiado para la preparación del óxido policatiónico La0,75Sr0,25Co0,5Fe0,5O3, bajo las condiciones de síntesis desarrolladas en este trabajo, lo cual, por su parte, permitió obtener un sólido con estructura tipo perovskita, cristalizado en el sistema ortorrómbico y orientado en el plano cristalino (112), con grupo espacial Pbnm (62), parámetros de red a = 5,502 Å, b = 5,544 Å, c = 7,846 Å, densidad calculada de 6,309 g.cm-3, volumen de celda de 239,33 Å3 y tamaño de cristalito de 207 Å, toda vez que el ligando citrato muestra un mayor rango de estabilidad en función del pH, con el fin de conformar especies solubles y estables que conduzcan a la obtención del material buscado. Por el contrario, el método que emplea ácido propiónico evidencia algunos inconvenientes en función de la naturaleza del precursor polimérico, que demostró ser menos eficaz desde el punto de vista de la fuerza de quelación, lo cual puede fomentar la aparición de impurezas en términos de óxidos de lantano, estroncio y cobalto, sumado a la desventaja que supone realizar extensos tratamientos térmicos con el fin de eliminar los residuos carbonosos. En este sentido, los análisis realizados confirman la obtención de un material con distribución de grano homogénea, textura rugosa y relieve, característicos de los métodos de síntesis de la ruta húmeda mediante la preparación de precursores de compuestos de coordinación, particularidades importantes en términos de área superficial, tamaño de cristalito y forma de grano para potenciales usos en aplicaciones catalíticas, eléctricas y electroquímicas.
REFERENCIAS BIBLIOGRÁFICAS
1. Sinquin, G.; Petit C.; Hindermann, J. P.; Kiennemann, A. Catalytic oxidation of chlorinated VOCs on perovskite type oxides. Catal. Today. 2001.70:183-96. [ Links ]
2. Berger, D.; Matei, C.; Papa, F.; Voicu, G.; Fruth, V. Pure and doped lanthanum cobaltites obtained by combustion method. J. Prog. in Solid State Chem. 2007. 35: 183-191. [ Links ]
3. Gómez-Cuaspud, J. A.; Valencia-Ríos, J. S. Síntesis de óxidos tipo perovskita mediante polimerización con ácido cítrico y combustión con glicina. Revista Energética. 2008. 41: 5-12. [ Links ]
4. Yang, Z.; Huang, Y.; Dong, B.; Lin L. H. Controlled synthesis of highly ordered LaFeO3 nanowires using a citrate based sol-gel route. J. Mater. Res. Bull. 2006. 41: 274-281. [ Links ]
5. Ngo, T. H.; Calderón Moreno, J. M.; Popa, M.; Crespo, D.; Hong, L. V.; Xuan, N. LaNiO3 nanopowder prepared by "amorphous citrate" route. J. European Ceram. Soc. 2006. 26: 403-407. [ Links ]
6. Nakayama, S.; Okazakib, M.; Aun-ga, Y.L.; Sakamoto, M. Preparations of perovskite-type oxides La-CoO3 from three different methods and their evaluation by homogeneity, sinterability and conductivity. J. Solid State Ionics. 2003.158:133-139. [ Links ]
7. Berger, D.; Fruth, V.; Jitaru, I.; Schoonman, J. Synthesis and Characterisation of La1-xSrxCoO3 with large surface area. J. Mater. Lett. 2004. 58: 2418-2422. [ Links ]
8. Berhanu, D.; Boyle, D.S.; Goven-der, K.; O'Brien, P. Novel wet chemical routes to highly structured semiconductor layers for improved efficiency photovoltaic devices. J. Mater. Sci.2003. 14: 579-582. [ Links ]
9. Klissurski, D.; Uzunova, E. Synthesis and features of binary cobaltite spinels. J. Mater. Sci. 1994. 29: 285-293. [ Links ]
10. Meixner, D. L.; Brengel, D. D.; Henderson, B. T.; Abrardo, J. M.; Wilson, M. A.; Taylor, D. M.; Cutler, R. A. Electrochemical oxygen separation using solid electrolyte ion transport membranes. J. Electrochem. Soc. 2002. 149 (9): 132-136. [ Links ]
11. Sitte, W.; Bucher, E.; Preis, W. Nonstoichiometry and transport properties of strontium substituted lanthanum cobaltites. J. Solid State Ionics. 2002. 154-155: 517-522. [ Links ]
12. Todorovsky, D. S.; Getsova, M. M.; Vasileva, M. A. Thermal decomposition of lanthanum titanium citric complexes prepared from eth-ylene glycol medium. J. Mater. Sci. 2002. 37: 4029-4039. [ Links ]
13. Puigdomenech, I. Make equilibrium diagrams using sophisticated algorithms Medusa. Vers. 29 Apr. 2002. Royal Institute of Technology. Stocholm, Sweden. [ Links ]
14. Tarancón, A.; Dezanneau, G.; Arbiol, J.; Peiró, F.; Morante, J. R. Synthesis of nanocrystalline materials for SOFC applications by acrylamide polymerisation. J. Power Sources. 2003. 118: 256-264. [ Links ]
15. Sandström, M.; Jalilehvand. F.; Persson, I.; Gelius. U. and Frank. P. Acity and salt precipitation on the Vasa; the sulfur problem. Proceedings of 8th ICOM-CC WOAM Conference. Stockholm. June, 2001. [ Links ]
16. Milanova, M. M.; Arnaudov, M. G.; Getsova, M. M.; Todorovsky, D. S. Preparation and characterization of solid state lanthanum titanium citrate complexes. J. Alloys Comp. 1998. 264: 95-103. [ Links ]
17. Weil, K. S.; Hardy, J. S. and Kim, J. Y. A new technique for joining ceramic and metal components in high temperature electrochemical devices. J. Advan. Mater. 2007. 2: 84-94. [ Links ]
18. Zschornack, G. Handbook of X-ray data. Berlín, Heidelberg: Springer-Verlag. 2007. [ Links ]