Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804On-line version ISSN 2357-3791
Rev.Colomb.Quim. vol.39 no.1 Bogotá Jan./Apr. 2010
EFECTO DEL SUSTITUYENTE SOBRE EL ANILLO PORFIRÍNICO Y EL AGENTE OXIDANTE EN LA FUNCIONALIZACIÓN DE COMPUESTOS ALIFÁTICOS
EFFECT OF PORPHYRIN SUBSTITUENTS AND OXIDIZING AGENT ON THE FUNCTIONALIZATION OF ALIPHATIC COMPOUNDS
ESTUDO DE SUBSTITUINTES SOBRE A PORFIRINA E O AGENTE OXIDANTE NA FUNCIONALIZAÇÃO DE OLIGÔMEROS ALIFÁTICOS
Luis F. Romero1, Carlos Amaya1 y César A. Sierra1,2
1 Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia, sede Bogotá, Bogotá, Colombia.
Recibido: 18/12/09 - Aceptado: 14/04/10
RESUMEN
En este trabajo se estudió la funcionalización de escualano y tetradecano al variar el efecto electrónico del sustituyente sobre los anillos aromáticos del núcleo porfirínico y el agente oxidante (KIO4,2KHSO5 ⋅KHSO4K2SO4,NaClO yH2O2). Se sintetizaron y caracterizaron tres metaloporfirinas: cloruro de meso-tetrakis-4-nitrofenil-porfirinato manganeso(III), cloruro de meso-tetrakis-2,4,6-trirnetoxifenirporfirinato manganeso(III) y cloruro de meso-tetrafenilporfirinato manganeso(III), con rendimientos del 40, 52 y 43%, respectivamente. Posteriormente se probaron 24 sistemas de funcionalización, que se cuantificaron empleando cromatografía de gases usando el método del patrón interno, y sus productos se identificaron por cromatografía de gases acoplada a espectrometría de masas e infrarrojo. Los resultados muestran que la adecuada selección del par porfirina-agente oxidante puede llevar a funcionalizaciones hasta del 42% para el tetradecano y del 80% para el escualano.
Palabras clave: funcionalización, porfirina, reacción de oxidación, tetradecano, escualano.
ABSTRACT
In this work was studied the functionalizations of squalane and tetradecane varying the electronic nature of the substituents over the porphyrinic ring and the oxidizing agent (KiO4,2KHSO5-KHS(VK2SO4, NaClO and H2O2). Three metallo-porphyrins (Mn(TTP)Cl, Mn ρ-NO2TPP) Cl and Mn(triMeOTPP)Cl) were synthesized and characterized with yields of 40, 52 and 43% respectively. Twenty four different functionalisation systems were carried out and quantified by gas chromatography using internal standard method and the products were identified by gas chromatography-mass spectroscopy. The functionalisations were quantified by CG and the products identified by GC-MS and FT-IR. The results showed that a good choice porphyirin-oxidizing agent pair can produce functionalization yields up to 42% for tetradecane and 80% for squalane.
Key words: functionalisation, porphyrins, oxidation, tetradecane and squalane.
RESUMO
O estudo da funcionalização de oligôme-ros orgânicos mediado por metalporfirinas como uma primeira aproximação em procura da post-funcionalização de polímeros como o polietileno e polipropileno tem despertado maior interesse nos últimos anos. Dentro deste contexto, no presente trabalho foi proposto o estudo da funcionalização de escualano e tetradecano para alterar a natureza química dos substituintes dos anéis aromáticos do núcleo porfirínico e do agente oxidante (KIO4, 2KHSO5KHSO4K2SO4, NaClO eH2O2). Foram sintetizados e purificados três diferentes metaloporfirinas, cloreto de meso-tetrakis-4-nitrofenirporfirinato manganês (III), cloreto de meso-tetrakis-2,4,6-trimetoxifenilporfirinato manganês (III) e cloreto de meso-tetrafenil-porfirinato manganês (III), com rendimentos do 40, 52 e 43%, respectivamente. Posteriormente, realizaram-se 24 funcionalizações, que foram quantificadas por cromatografia gasosa de alta resolução acoplada à espectrometria de massas (CGAR-EM), usando um oxidante, e levando em consideração as características químicas de cada composto, na qual obteve-se funcionalizações de até o 42% para o tetradecano e o 80% para o escualano.
Palavras-chave: funcionalização, por-firina, reação de oxidação, tetradecano, es-cualano.
INTRODUCCIÓN
Dentro de los plásticos, el polietileno y el polipropileno son los polímeros de mayor producción en el mundo, con más de 100 millones de toneladas por año, debido a su bajo costo de producción combinado con sus particulares propiedades mecánicas y fisicoquímicas, que los hacen muy atractivos para su aplicación industrial, aplicaciones que van desde bolsas de supermercado hasta textiles. No obstante, la estructura química de estas poliolefinas genera grandes limitaciones en procesos que involucren moléculas de mediana o alta polaridad como lo son la adhesión, el teñido, la impresión y el coloreado, entre otros. Esta incompatibilidad está regida por fenómenos de interfase y afinidad química, y para su solución han sido propuestas varias metodologías donde se busca introducir grupos funcionales a la cadena principal mediante técnicas denominadas como de funcionalización de poliolefinas (1, 2).
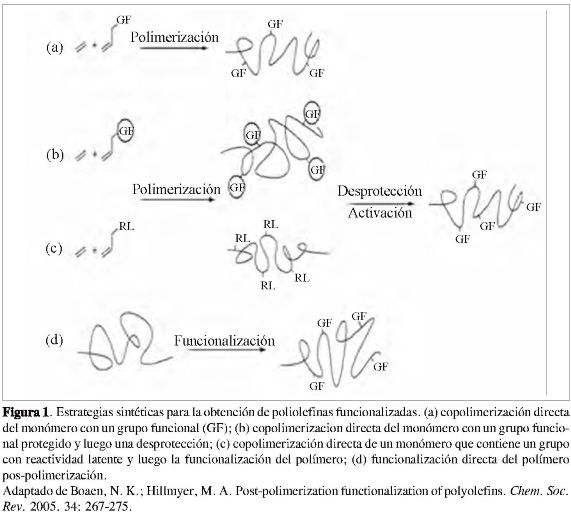
En la Figura 1 se muestran las diferentes estrategias sintéticas para obtener las poliolefinas funcionalizadas: (a) copolimerización de olefinas comunes (como etileno y propileno) con olefinas α-mono-sustituidas con el grupo funcional de interés (GF); (b) copolimerización de olefinas que contienen un grupo funcional protegido seguido de una desprotección de este para generar el polímero de interés; (c) copolimerizactón de un monómero que contiene sustituyentes con reactividad latente (RL), para posteriormente convertir el grupo con reactividad latente en el grupo funcional deseado. Por otra parte (d) propone la funcionalización pos-polimerización de la poliolefina, es decir se introduce el grupo funcional directamente al polímero (1, 3, 4) en un solo paso y tratando de no afectar las propiedades mecánicas del polímero.
Si bien las cuatro vías para lograr la funcionalización de las poliolefinas son aplicables, las estrategias (a), (b) y (c) mostradas en la Figura 1 presentan varios inconvenientes, especialmente en polimerizaciones catalizadas por metales de transición, como la desactivación o envenenamiento del catalizador debido a la alta reactividad de los monómeros con sustituyentes de polaridad diferente a la de una olefina no sustituida. Además, las diferencias en reactividad de los monómeros normalmente usados en síntesis de poliolefinas contra la de los comonómeros (monómero con un grupo funcional latente, protegido o el grupo funcional de interés) usados en estas copolimerizaciones hacen que para cada una de estas polimerizaciones las condiciones de reacción tengan que ser cuidadosamente ajustadas, lo que dificulta su aplicación industrial. Adicionalmente, las actividades catalíti
cas de los catalizadores empleados en este tipo de reacciones con comonómeros polares son sustancialmente más bajas que en las homopolimerizaciones, lo cual hace ineficiente este tipo de copolimerizaciones (2, 3). De manera particular para las estrategias (b) y (c), generar reacciones de desprotección o de activación posterior a la copolimerización es bastante difícil de llevar a cabo, pues una vez obtenido el co-polímero, es poco probable lograr que los reactivos encuentren dentro de la cadena polimérica cada uno de los grupos protegidos o latentes, debido al impedimento estructural de la cadena polimérica y a factores de difusión.
Por su parte, la funcionalización pos-polimerización de las poliolefinas (Figura 1d) presenta varios atributos deseables: se puede emplear una gran variedad de poliolefinas como material de partida, evitando todos los problemas de las copolimerizaciones, como se mencionó anteriormente; otra ventaja es que el nivel de grupos funcionales introducido en el polímero puede ser finamente ajustado mediante consideraciones estequiométricas, y finalmente, su mayor ventaja radica en que en principio cualquier funcionalización que pueda ser realizada en una molécula pequeña análoga a las poliolefinas puede ser llevada a cabo en el polímero (1), lo cual permite realizar investigación básica en moléculas pequeñas y de fácil manejo, para luego aplicar los desarrollos a sistemas más complejos y de mayor tamaño como los polímeros.
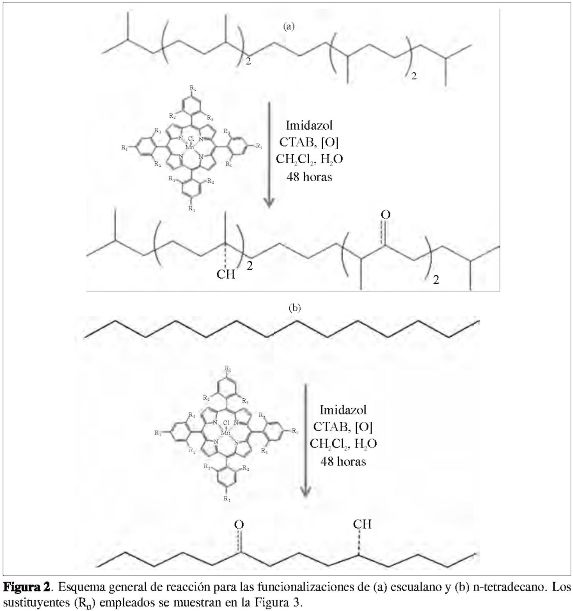
De manera que en la pos-funcionalización de poliolefinas, específicamente en la oxidación de estas, y teniendo en cuenta la bajísima reactividad de los enlaces conformantes, se ha buscado el uso de mediadores que emulan algunos sistemas biológicos, como la enzima metano monooxigenasa y el citocromo P-450, los cuales son responsables de catalizar la hidroxilación de sustancias toxicas e inertes presentes en los seres vivos para facilitar su excreción (5). Con una estructura similar a estos compuestos, las trifenilporfirinas de manganeso (TFPMn) son reconocidas como mediadores efectivos para la oxidación de alcanos en presencia de una especie donora de oxígeno o un oxidante y una base nitrogenada como estabilizante de la porfirina (1,6,7). En este trabajo se reporta la síntesis de tres diferentes TFPMn variando la naturaleza de los sustituyentes sobre el anillo porfirínico, y la funcionalización de dos compuestos alifáticos (n-tetradecano y escualano) catalizadas por las porfirinas sintetizadas, variando el agente oxidante (KIO4, 2KHSO5KHSO4K2SO4, NaClO y H2O2) (Figura 2), buscando así el sistema porfirina-agente oxidante más adecuado para la funcionalización de polímeros como el polietileno y el polipropileno.
MATERIALES Y MÉTODOS
General
La cromatografía en capa delgada (CCD) se realizó en cromatoplacas de sílica gel 60 F254,365 usando como eluentes acetato de etilo, diclorometano, metanol y mezclas de estos. Se revelaron en cámara de luz UV a 254 y 365 nm.
Para la cromatografía en columna al vacío (CC al vacío) se empleó sílica gel 60 (0,063-0,02 mm, Merck) y como eluentes se utilizaron benceno, tolueno, acetato de etilo, diclorometano, metanol y mezclas de estos, para finalmente analizar por espectroscopia UV-Vis las fracciones obtenidas. La cromatografía en columna clásica (CC) se realizó empleando sílica gel 60 (0,063-0,020 mm, Merck); como eluentes se usaron dicloro-metano y hexano.
Los espectros UV-Vis fueron tomados en un espectrofotómetro Thermo Scientific Evolution 300; los espectros FT-IR fueron tomados en un espectrofotómetro con transformada de Fourier Shimadzu IRprestige-21, y el análisis de CG-EM se llevó a cabo empleando un cromatógrafo de gases Shimadzu GC-2010 acoplado a un espectrómetro de masas Shimadzu QP-2010, en modo de ionización por impacto electrónico (70 eV). La columna empleada fue una Varian CP8944 (30 m de largo, 0,25 mm de diámetro, 0,25 mm de espesor de película), análoga a una DB-5. El equipo detectó los iones positivos entre 30-700 m/z.
Síntesis y purificación de metaloporfirinas
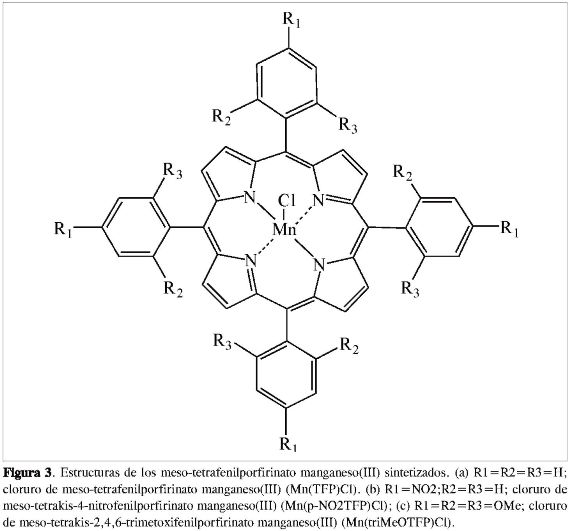
Las síntesis y purificación de las metaloporfirinas se llevaron a cabo adaptando la metodología propuesta por Mirafzal (8) empleando pirrol (10 mmol), cloruro de manganeso(II) (12,5 mmol) un aldehido aromático (10 mmol) (benzaldehído, 4-nitrobenzaldehido, 2,4,6-trimetoxiben-zaldehido), 2,4,6-triclorofenol como aditivo-disolvente y dejando la mezcla en reflujo por periodos de tiempo entre 30 y 60 min, según el aldehído empleado obteniendo las metaloporfirinas que se muestran en la Figura 3.
La purificación de las porfirinas es responsable, en la mayoría de casos, de los bajos rendimientos obtenidos, y adicionalmente varía según la naturaleza de los sustituyentes. La Mn(TFP)Cl se purificó mediante CC al vacío sobre sílica gel, recogiendo fracciones de 200 mL de los siguientes sistemas de disolventes: tolueno, tolueno:AcOEt 1:1, AcOEt, AcOEt: MeOH 9:1, AcOEt:MeOH 1:1 y MeOH. La purificación de la Mn(ρ-NO2TFP)Q se realizó mediante CC al vacío sobre sílica gel, recogiendo fracciones de 200 mL de los siguientes sistemas de disolventes: tolueno, tolueno: AcOEt 1:1, tolueno:AcOEt 9:1, AcOEt, AcOEt:MeOH 9:1, AcOEt: MeOH 1:1 y MeOH. La Mn(tri-MeOTFP)Cl se purificó mediante CC al vacío sobre sílica gel, recogiendo fracciones de 200 mL de los siguientes sistemas de disolventes: benceno, benceno:AcOEt9:1, benceno:AcOEt 1:1, DCM, DCM:MeOH 8:2, DCM:MeOH 1:1 y MeOH.
Posteriormente, para cada una de las fracciones se eliminó el disolvente, se tomaron los espectros UV-Vis; las fracciones con el producto (según UV-Vis) se reunieron y se les realizó CC al vacío eluyendo con un sistema de disolventes apropiado para cada porfirina, para finalmente reunir las fracciones con la porfirina pura, la cual fue caracterizada por IR y UV-Vis. Los rendimientos reportados son de producto sólido aislado después de la separación cromatográfica y caracterización.
Funcionalización de escualano y tetradecano
Las funcionalizaciones se realizaron siguiendo la metodología adaptada por el grupo (7) a partir del trabajo de Boaen y Hillmyer (6), empleando un hidrocarburo (1,91 mmol) (n-tetradecano o escualano), una porfirina (9,28x10-3 mmol) (Mn(TFP) Cl, Mn(ρ-NO2TFP)Cl o Mn(triMeOTFP) Cl), imidazol (8,1x10-2 mmol), bromuro de cetil trimetil amonio (CTAB) (0,278 mmol), un agente oxidante (KIO4,2KH SO5-KHSO4-K2SO4,NaClO óH2O2) (2,48 mmol), 5 mL de DCM y 15 mL de agua, dejando la mezcla de reacción en agitación durante 48 horas (Tabla 1).
Purificación de los productos de funcionalización de escualano y tetradecano
La mezcla de reacción fue sometida a una partición líquido-líquido DCM/agua, de la cual se concentró la fase orgánica. Esta se purificó por medio de CC eluida con 15 mL de DCM, recolectando una sola fracción que se concentró, para posteriormente repetir este procedimiento eluyen-do con 15 mL de n-hexano, confirmando por IR sobre cada una de la fracciones el éxito o no de la funcionalización.
Cuantificación e identificación de los productos de las funcionalizaciones
Para la cuantificación de las funcionalizaciones se empleó CG usando el método del estándar interno con decano como patrón para las funcionalizaciones del tetradecano, y eicosano para las funcionalizaciones del escualano. Las soluciones fueron preparadas colocando aproximadamente 3 mg de patrón interno y 3 mg de la mezcla de reacción purificada, llevándolos a 1 mL con DCM y luego realizando una dilución 1 a 10 de esta solución. Para la identificación de los productos de la funcionalización se utilizó CG-EM; para los productos del tetradecano se empleó como gas de arrastre helio a una velocidad de flujo en la columna de 0,76 mL/min; el inyector y la fuente de ionización se mantuvieron a 320 °C y 260 °C, respectivamente. Se usó un programa de temperatura iniciando a 100 °C durante 3 minutos, luego una rampa de 15 °C/min hasta una temperatura final de 300 °C, la cual se mantuvo durante 17 min, inyectando 2 µL, con una división de flujo de 10. En el caso del escualano se emplearon las condiciones previamente descritas, pero iniciando la rampa a una temperatura de 200 °C durante 3 minutos y al final manteniendo 300 °C durante 25 minutos.
RESULTADOS Y DISCUSIÓN
De la síntesis de las metaloporfirinas Mn(TFP)Cl, Mn(ρ-NO2TFP)Cl o Mn (triMeOTFP)Cl se obtuvieron rendimientos de 43, 40y 52%, respectivamente, los cuales resultan ser ligeramente menores a los reportados por Mirafzal (8), debido principalmente al grado de dificultad que se presenta en la purificación de estas, teniendo en cuenta el gran número de subproductos observados por cromatografía preparativa; adicionalmente el proceso de remoción del aditivo-disolvente (2,4,6-triclorofenol) dificulta la recuperación del producto de interés, aunque es de destacar que el uso de 2,4,6-triclorofenol mejora los rendimientos en más de un 50% en comparación a otros procesos convencionales de síntesis de porfirinas, donde la metalación se realiza en un segundo paso posterior a la síntesis del macrociclo (7).
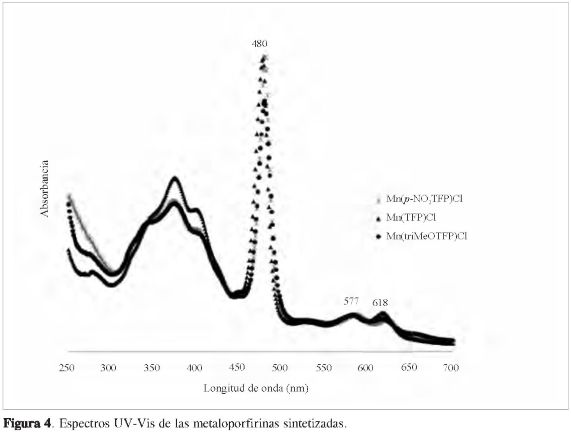
La caracterización de las metaloporfirinas se realizó mediante espectroscopia UV-Vis e infrarroja. En los espectros UV-Vis (Figura 4) se observan las bandas características de este tipo de compuestos, conformadas por las bandas entre 300 y 400 nm, que corresponden a las transiciones electrónicas de los anillos aromáticos. Las bandas Soret, las cuales son bandas agudas alrededor de 480 nm, que pertenecen a una transición a1u(π) →eg*(π)co-rrespondiente a los pares libres de los nitrógenos del núcleo porfirínico, presentes a esta longitud de onda para los electrones del par libre enlazados con el metal, y, por último, las bandas Q, que se encuentran aproximadamente entre 577 y 618 nm, correspondientes a una transición a2u(π)→ eg*(π) generada por los cuatro anillos pi-rrólicos conjugados (9).
En los espectros FT-IR, se observó en todos los casos el estiramiento del enlace metal-ligando como una banda cercana a 465 cm-1. Las otras bandas importantes fueron las de los sustituyentes de los diferentes núcleos porfirínicos. Para la Mn(p-NO2TFP)Cl se observaron bandas a 1524 y 1342 cm-1, correspondientes a los estiramientos N=O asimétrico y simétrico, respectivamente; adicionalmente, una banda correspondiente al estiramiento C-N a 848 cm-1.ParalaMn(tri-MeOTFP)Cl se encontraron bandas a 2927 cm-1, correspondientes a los estiramientos C-H de los metilos, una banda a 2850 cm-1 correspondiente a la tensión C-H en el grupo O-CH3, y finalmente dos bandas a 1215 y 1022 cm-1, correspondientes a la tensión asimétrica y simétrica de C-O-C respectivamente (10).
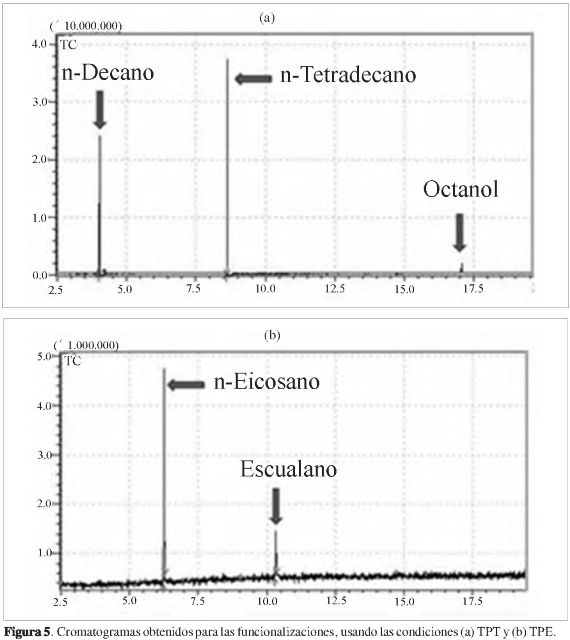
El seguimiento de las reacciones de funcionalización se realizó por CG-EM y FT-IR. La Figura 5 presenta los resultados típicos según CG-EM para las funcionalizaciones de tetradecano y escualano. La Figura 5a corresponde al cromatograma para la funcionalización con el sistema TPT, donde se usó el n-tetradecano (8,649 min) con Mn(triMeOTFP)Cl como mediador, H2O2 como agente oxidante, con n-decano (4,046 min) como estándar interno, y octanol (17,064 min) como uno de los productos obtenidos. En las demás funcionalizaciones para el n-tetradecano solo se observaron su señal y el pico del estándar interno. La identidad del octanol fue determinada por el análisis de su espectro de masas que presenta un ion [M-H2O]+ m/z 112 y los rompimientos característicos para una cadena saturada. En la Figura 5b se observa el cromatograma obtenido para el sistema TPE con señales para el n-eicosano (4,046 min) y escualano (8,649 min). En todos los análisis la identidad del n-decano, n-tetradecano, n-eicosano y escualano se determinaron por una previa inyección de una solución que contenía los patrones respectivos y sus espectros de masas. Como muestra la Figura 5, las funcionalizaciones del n-tetradecano y el escualano no presentan señales adicionales al sustrato, estándar interno y octanol (solo para el sistema TPT), lo cual no es inesperado y generalmente se encuentra en este tipo de reacciones, ya que los productos de la funcionalización presentan puntos de ebullición muy altos y son poco volátiles, como lo mostró el trabajo de Álzate (7), quienes encontraron que los productos de la funcionalización de n-heptano (heptanodiona y heptanol) presentaban tiempos de retención de 50 a 70 min, bajo las mismas condiciones cromatográficas (7), luego es de esperar tiempos extremadamente largos para los productos del n-tetradecano y el escualano, si es que lograran salir de la columna cromatógrafica. Para el análisis de los productos de estas funcionalizaciones está en desarrollo una metodología por cromatografía líquida acoplada a espectrometría de masas.
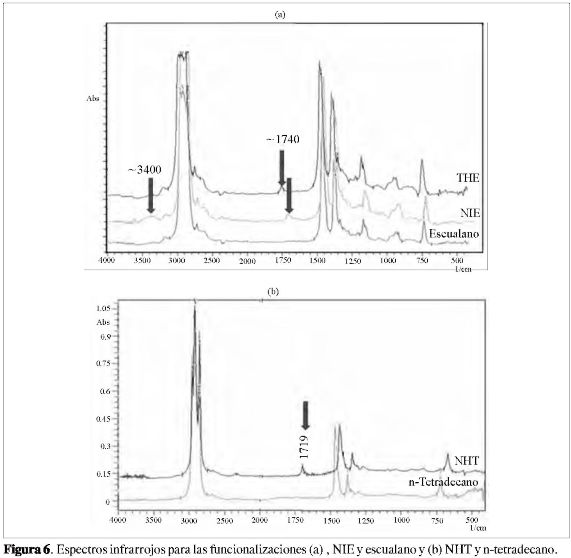
Otra forma de seguir las funcionalizaciones es por FT-IR, como lo muestra la Figura 6. Al comparar los espectros infrarrojos de los sustratos con los del producto purificado de las funcionalizaciones, se aprecia la aparición de una banda alrededor de 1700 cm-1 en el caso de NIE, NHT, NHE y THE, banda debida al estiramiento C=O de un grupo carbonilo, y la aparición de una banda de estiramiento O-H alrededor de 3400 cm-1 para el sistema NHE, NIE. La aparición de estas bandas coincide con los resultados reportados por Boaen y Hillmyer (1,6) para la formación del enlace carbono-oxígeno durante el proceso de funcionalización mediado por porfirinas. Cabe resaltar que las bandas tanto de C=O como de O-H, se observan con intensidades muy pequeñas a lo que comúnmente se encuentra para compuestos que contienen este tipo de grupos funcionales, esto debido a la cantidad relativa de enlaces C-C y C-H de metilos y metilenos, comparada con las cantidad de los enlaces anteriormente mencionados, ya que esta relación puede llegar a ser de varios cientos a uno. El seguimiento de estas bandas por FT-IR para C-O y O-H por largos periodos de funcionalización ha mostrado en nuestras investigaciones en curso un incremento progresivo en la intensidad hasta alcanzar una estabilización después de 6 días en las condiciones aquí reportadas y en tiempos mucho menores con condiciones experimentales optimizadas (11).
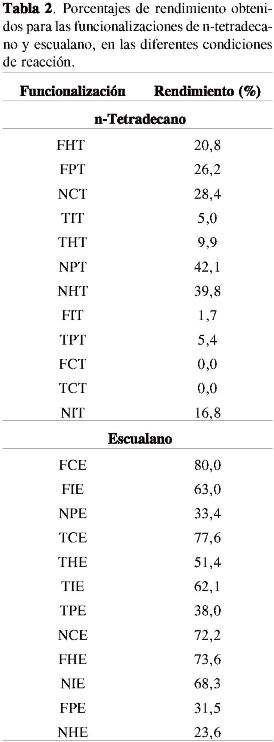
Adicionalmente al seguimiento de los productos de la funcionalización descrito antes, el análisis por CG-EM se usó como una medida de la eficiencia de cada uno de los sistemas ensayados en el proceso de funcionalización, mediante una determinación indirecta, cuantificando la cantidad de sustrato remanente mediante el uso de estándar interno. Como se observa en la Tabla 2, las condiciones de reacción que permitieron obtener los mayores rendimientos para las funcionalizaciones de n-tetradecano fueron aquellas en las que se empleó la Mn(ρ-NO2TFP)Cl como mediador, sin importar la naturaleza del agente oxidante, resultado que sugiere que grupos electroatractores sobre el macrociclo aumentan la estabilidad de la porfirina y, por tanto, extienden la vida útil de la misma incrementando el número de "ciclos catalíticos". Estos resultados son congruentes con el estudio descrito por Boaen (6), en donde se emplea otro grupo electroatractor, el cloro, sobre el anillo aromático de la metaloporfirina.
Los resultados para la funcionalización del escualano mostrados en la Tabla 2 presentan rendimientos mucho mayores a los obtenidos para el n-tetradecano, puesto que la molécula de escualano contiene carbonos terciarios, los cuales son más reactivos permitiendo una mejor funcionalización. Sin embargo, en este caso se observó el efecto del agente oxidante, ya que para todas las funcionalizaciones en los que se utilizó peróxido de hidrógeno se obtuvieron resultados muy bajos respecto a los otros procesos. Esto sugiere la presencia de radicales libres, los cuales destruyen rápidamente la metaloporfirina y, por tanto, disminuyen el tiempo de vida útil de esta en la mezcla de reacción, como lo sugieren trabajos previos (1, 6, 7). Es importante tener en cuenta este resultado cuando se aplican las condiciones de funcionalización aquí exploradas a poliolefinas de baja o alta densidad, donde la presencia o ausencia de ramificaciones implica mayores o menores reactividades, y la presencia de radicales libres puede provocar la escisión de la cadena polimérica y de esta manera afectar el peso molecular del polímero sustrato, al igual que las propiedades mecánicas.
En conclusión, este trabajo muestra que la síntesis de cantidades apreciables (500 mg) de metaloporfirinas con altos rendimientos en un solo paso es posible. Dos de las porfirinas obtenidas en este trabajo no están reportadas por Mirafzal (8) (Mn(triMeOTFP)Cl y Mn(ρ-NO2 TFP)Cl), cuyo eficiente uso en la funcionalización de compuestos alifáticos está altamente influido por la densidad electrónica sobre el macrociclo, donde grupos electro atractores aumentan la eficiencia de la metaloporfirina como mediador en la oxidación de carbonos secundarios (ver Tabla 2), aunque no es claro por el momento si el efecto está relacionado con la estabilidad o con la reactividad del macrociclo. Se hace de este tipo de metaloporfirinas compuestos promisorios para la pos-funcionalización de polietileno de alta densidad, lo cual no ha sido reportado hasta la fecha.
Finalmente, este trabajo muestra que es posible funcionalizar compuestos con enlaces tan estables como los alifáticos de manera sencilla usando como mediador una porfirina metalada. Se lograron funcionalizaciones hasta de un 42 % para tetradecano y un 80 % para escualano, observándose tanto la formación del enlace C-O, como grupos hidroxilo y carbonilo, mediante FT-IR. Los resultados sugieren que la naturaleza del agente oxidante no es determinante para llevar a cabo la fun-cionalización del n-tetradecano, pero sí lo es para la del escualano, mientras que la naturaleza química de la metaloporfirina es determinante en la funcionalización del n-tetradecano, pero no para el escualano. Esto puede ser debido a la presencia o ausencia de carbonos terciarios en los sustratos empleados.
La disminución del tiempo de reacción, condiciones menos drásticas (usar aire como agente oxidante), mayor estabilidad del sistema funcionalizante, extrapolación de condiciones experimentales hacia la funcionalización de poliolefinas, son todos aspectos en estudio actualmente dentro del Grupo de Macromoléculas.
REFERENCIAS BIBLIOGRÁFICAS
1. Boaen, N. K.; Hillmyer, M. A. Post-polimerization functionalizationof polyolefins. Chem. Soc. Rev. 2005. 34: 267-275. [ Links ]
2. Díaz-Requejo, M. M.; Wehrmann, P.; Leatherman, M. D.; Trofimenko, S.; Mecking, S.; Brookhart, M.; Pérez, P. J. Controlled, copper-catalyzed functionalization of polyolefins. Macromolecules. 2005 . 38: 4966-4969. [ Links ]
3. Boffa, L. S.; Novak, B. M. Copolymerization of polar monomers with olefins using transition-metal complexes. Chem. Rev. 2000. 100 (4): 1479-1494. [ Links ]
4. Chung, T. C. Functionalization of polyolefins. San Diego, CA: Academic Press. 2002. pp. 9-16, 63-77. [ Links ]
5. Munier, B. Metalloporphyrins as versatile catalysts for oxidation reactions and oxidative DNA cleavage. Chem. Rev. 1992. 92: 1411-1456. [ Links ]
6. Boaen, N. K.; Hillmyer, M. A. Selective and mild oxyfunctionalization of model polyolefins. Macromolecules 2003, 36: 7027-7034. [ Links ]
7. Alzate, J. A. Funcionalización de alcanos mediada por metaloporfirinas. Trabajo de grado. Departamento de Química, Facultad de Ciencias, Universidad Nacional, sede Bogotá. 2007. [ Links ]
8. Mirafzal, G. A.; Bosse, H. M.; Summer, J. M. An efficient method for synthesis of manganese (III) meso- tetraarylporphyrins. Tetrahedron Lett. 1999. 40: 623-626. [ Links ]
9. Zheng, W.; Shan, N.; Yu, L.; Wang, X. UV-Visible, fluorescence and EPR properties of porphyrins and Metalloporphyrins. Dyes and Pigments. 2008. 77: 153-157. [ Links ]
10. Silverstein R. M. Spectrometric identificationoforganiccompounds. New York: John Wiley. Sixth edition. 1998. [ Links ]
11. Alzate, J. A. Funcionalización de polietileno de alta densidad mediado por metaloporfirinas. Tesis de maestría. Departamento de Química, Facultad de Ciencias, Universidad Nacional, sede Bogotá. 2010. [ Links ]