Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804On-line version ISSN 2357-3791
Rev.Colomb.Quim. vol.39 no.1 Bogotá Jan./Apr. 2010
CARACTERIZACIÓN ESTRUCTURAL DE LA MATERIA ORGÁNICA DE TRES SUELOS PROVENIENTES DEL MUNICIPIO DE AQUITANIA-BOYACÁ, COLOMBIA
STRUCTURAL CHARACTERIZATION OF ORGANIC MATTER OF THREE SOILS FROM AQUITANIA-BOYACÁ, COLOMBIA
CARACTERIZAÇÃO ESTRUTURAL DA MATÉRIA ORGÂNICA DE TRÊS SOLOS PROVENIENTES DO MUNICIPIO DE AQUITANIA-BOYACÁ, COLOMBIA
Carmen S. Mosquera1, María J. Martínez1, Jairo A. Guerrero1 y Eddy W. Hansen2
1 Departamento de Química, Universidad Nacional de Colombia. Bogotá. csmosquerav@unal.edu.co
2 Departamento de Matemáticas y Ciencias Naturales, Universidad de Oslo, Noruega.
Recibido: 06/10/09 - Aceptado: 06/04/10
RESUMEN
La materia orgánica del suelo puede variar considerablemente en su estructura, composición y conformación, de acuerdo con el origen y la edad de los materiales que la constituyen. En la presente investigación se procedió a caracterizar, mediante el empleo de la espectroscopia infrarroja y la resonancia magnética nuclear en estado sólido, dos suelos inceptisoles (I01 y I02) y un histosol (H03) destinados al cultivo de cebolla larga, en el municipio de Aquitania-Boyacá, Colombia, a dos profundidades: 0 - 10 y 40 - 50 cm. Según los espectros infrarrojos, se detectó la presencia de grupos OH (debida posiblemente a fenoles, ácidos carboxílicos o alcoholes), grupos aromáticos y alifáticos. Los espectros de 13C-RMN en estado sólido con CPMAS evidenciaron el siguiente orden respecto a la cantidad de carbonos que conforman la materia orgánica del suelo: H03-0 =100 y H03 -40 = 88, I02-0 = 23 y I02-40 = 0, y finalmente I01-0 = 17 y I01-40 = 12, confirmándose la disminución de carbonos en la materia orgánica a través del perfil del suelo, y además se estableció que el carbón resonante en la región δ = 108-50 ppm de los espectros (N - y O-alquilos y acetales) dominó en toda la MOS obtenida; le siguió el carbón aromático (la cantidad de carbonos que conforman la materia orgánica del suelo: H03-0 =100 y H03 -40 = 88, I02-0 = 23 y I02-40 = 0, y finalmente I01-0 = 17 y I01-40 = 12, confirmándose la disminución de carbonos en la materia orgánica a través del perfil del suelo, y además se estableció que el carbón resonante en la región δ = 108-50 ppm de los espectros (N - y O-alquilos y acetales) dominó en toda la MOS obtenida; le siguió el carbón aromático (ó = 168-108 ppm) para los suelos I01-0 y H03-40, y el carbón alifático (δ = 0-50 ppm) para los suelos I01-40, I02-0 y H03-0. Finalmente, el carbón C = O (δ = 220-162 ppm) fue el menos dominante en la materia orgánica del suelo en todos los tres suelos caracterizados.
Palabras clave: materia orgánica del suelo, espectroscopia infrarroja, resonancia magnética nuclear, inceptisol e histosol.
ABSTRACT
Generally, soil organic matters may differ in structure, composition and conformation according to their origin and age. In the present work structural composition of three soil organic matters, as determined by IR and solid-state CPMAS 13C-NMR spectroscopy of two Inceptisol soils (I01 and I02) and one Histosol soil (H03) from the Aquitania-Boyacâ town in Colombia are presented (in these soils farmers have grown large onion crops). Measurements were performed at two different depths 0 - 10 and 40 - 50 cm, respectively. According to the IR spectra the presence of OH-groups (from phenols, carboxylic acids and alcohols), aromatic and aliphatic groups were identified. The 13C NMR spectra revealed a decreasing amount of organic matter with increasing depth in the following relative order: H03-0 = 100 and H03-40 = 88, I02-0 = 23 and I02-40 = 0, and finally I01-0 = 17 and I01-40 = 12. The carbon peaks resonating in the ô = 108-50 ppm region of the spectra (N- and O-alkyls and acetals) dominated in almost all the extracted soils, with aromatic carbon peaks (δ = 168-108 ppm) showing the second most intense peaks for the samples I01-0 and H03-40. The aliphatic carbon (δ = 0-50 ppm) revealed the second most intense peaks in samples I01-40, I02-0 and H03-0. Finally, carbonyl carbon (δ = 220-162 ppm) contributed the smallest signal intensity in all the three soil samples.
Key words: soil organic matter, infrared spectroscopy, nuclear magnetic resonance, inceptisol and histosol.
RESUMO
A matéria orgânica do solo pode variar consideravelmente em sua estrutura, composição e conformação. Na presente pesquisa procedeu-se à caracterização mediante o emprego da espectroscopia de infravermelho e ressonância magnética nuclear no estado solido dos solos inseptisoles (101 e 102) e um histosol (H03) destinados ao cultivo de cebola no município de Aquitania -Boyacá, Colômbia a duas profundidades diferentes 0 - 10 e 40 - 50 cm, respectivamente. Encontrou-se de acordo aos espectros de infravermelho a presença de grupos OH (devido possivelmente a fenóis, ácidos carboxílicos o álcool), grupos aromáticos e alifáticos. Os espectros de 13C-RMN em estado solido com CPMAS evidenciarão o seguinte ordem de acordo à quantidade de carbonos que conformam a matéria orgânica do solo: H03-0 = 100 e H03-40 = 88, I02-0 = 23 e I02-40 = 0, e finalmente I01-0 = 17 e I01-40 = 12, sugerindo que a quantidade total de carbonos na matéria orgânica decresce a través do perfil do solo e além de mais, estabeleceu-se que o carbono ressonante na região δ = 108-50 ppm dos espectros (N- y O-alquilos e acetales) dominó em tudo a MOS extraída, seguiu-se o carbono aromático (δ = 168-108 ppm) para os solos I01-0 e H03-40; e o carbono alifático (δ = 0-50 ppm) para os solos I01-40, I02-0 e H03-0, finalmente o carbono carbonilo (δ = 220-162 ppm) foi o menos dominante na matéria orgânica do solo em todos os três solos caracterizados.
Palavras-chave: matéria orgânica do solo, espectroscopia de infravermelho, ressonância magnética nuclear, inceptisol e histosol.
INTRODUCCIÓN
La materia orgánica en suelos agrícolas está constituida principalmente por residuos provenientes de los biopolímeros de las plantas (por ejemplo, polisacáridos, lignina, proteínas y materiales cuticulares), materiales generados durante los procesos de descomposición, células de los microorganismos y sustancias húmicas (1, 2).Elconocimientodelacomposición estructural de la materia orgánica es una herramienta útil para el entendimiento de las interacciones entre los contaminantes orgánicos e inorgánicos con el suelo y la formación de compuestos organominerales que afectan su estructura; sin embargo el entendimiento de las interacciones o relaciones de los contaminantes y otros componentes del suelo con la materia orgánica no ha sido bien desarrollados por las dificultades que existen en su caracterización estructural. La espectroscopia de resonancia magnética nuclear 13C con CPMAS puede ser usada cuantitativamente en la evaluación del ambiente de cada átomo de carbono que constituye la materia orgánica del suelo MOS, lo que no se traduce en una información directa sobre la estructura molecular de esta última (3). Sin embargo, con la información así obtenida se puede establecer el tipo de carbón que afecta notablemente la interacción de los contaminantes, por ejemplo, con los diferentes componentes de la materia orgánica del suelo.
También la espectroscopia infrarroja ha sido ampliamente usada para la caracterización general de los componentes que constituyen la materia orgánica de los suelos porque provee información valiosa sobre la estructura y los grupos funcionales presentes en ella (4-7), complementando de esta manera la información obtenida a partir de los espectros de 13C-RMN en estado sólido y de este modo caracterizar estructuralmente la MOS.
En la presente investigación se procedió a caracterizar mediante el uso de la espectroscopia infrarroja con transformada de Fourier y resonancia magnética nuclear 13C en estado sólido la materia orgánica de tres suelos provenientes del municipio de Aquitania-Boyacá, Colombia, destinados al cultivo de cebolla larga, a dos profundidades (0 - 10 y 40 - 50 cm), con el fin de generar información científica respecto a la composición estructural de la materia orgánica de dichos suelos.
MATERIALES Y MÉTODOS
Descripción de la zona de estudio
El municipio de Aquitania está ubicado en la región del lago de Tota, con una altura de 2.890 metros sobre el nivel del mar, una precipitación anual de 1.716,9 mm y una temperatura promedio de 12 °C. El origen lacustre de los altiplanos, la estratificación en capas arcillosas, arenosas y turbosas, y la característica de cuenca cerrada, convierten a la región en un reservorio de aguas subterráneas y superficiales, de las que hoy subsisten actividades como la agricultura, siendo el cultivo de cebolla larga el de mayor producción (8, 9).
Muestras de suelos
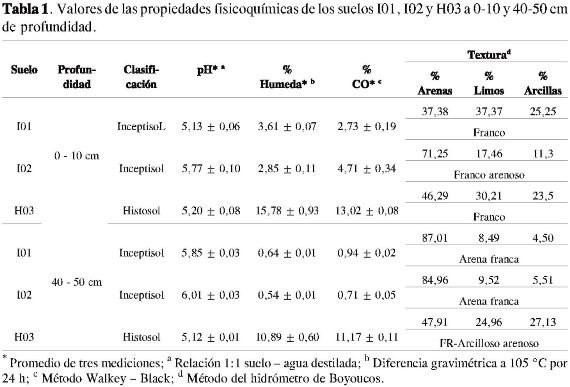
Las tres muestras de suelo se recolectaron en dos unidades de muestreo trazadas en dos fincas del municipio de Aquitania, departamento de Boyacá, a 3.044 y 3.054 metros sobre el nivel del mar, a una profundidad de 0 - 10 (0) y 40 - 50 (40) cm. Las muestras se obtuvieron de manera aleatoria y siguiendo un recorrido en zig-zag en cada unidad de muestreo. En la finca 1 (N 5°34 min 45,3 s y W 72°53 min 49,8 s) se tomaron dos de las muestras de suelos correspondientes a inceptisoles dedicados al cultivo de cebolla, denominados como: I01-0, I01-40, I02-0 y I02-40, y en la finca 2 (N 5°30 min 27,4 s y W 72°54 min 4,6 s) se tomó una muestra de suelo correspondiente a un histosol dedicado igualmente al cultivo de cebolla, denominado como H03-0 y H03-40. La clasificación taxonómica general de los suelos muestreados se obtuvo del "Mapa del estudio general de suelos de los municipios de Aquitania, Sogamoso, Cuitiva, Firavitoba, Topaga, Tota, Tibasosa, Iza, Nobsay Mongui" realizado por el IGAC (10). Las muestras de suelo se secaron a temperatura ambiente y se tamizaron a través de un tamiz malla N° 8 de 2,38 mm de apertura (U.S. Standar Sieve Series), para determinarles las propiedades físicas y químicas reportadas en la Tabla 1, y posteriormente obtener la materia orgánica total.
Obtención de la materia orgánica del suelo
Se pesaron 3,00000 g ± 0,00001 g de cada uno de los suelos muestreados a las dos profundidades en tubos de centrífuga de 50 mL. A cada tubo se le agregaron 50 mL de una solución de HF al 2% en agua desionizada Milli-Q y se agitaron por un tiempo de 1 h en un agitador orbital. Posteriormente se centrifugaron a 2000 rpm por 20 min y se retiró el sobrenadante; dicho procedimiento se repitió cinco veces; luego se agitaron tres veces más por un tiempo de 16 h y finalmente se agitaron durante 64 h con la solución de HF al 2%, centrifugando después de cada tiempo de agitación. Después del último tratamiento con HF al 2%, las muestras de suelo se lavaron cinco veces con 50 mL de agua desionizada Milli-Q hasta que el pH estuviera entre 6-7. Finalmente las muestras se liofilizaron para tomarles los espectros de resonancia magnética nuclear 13C en estado sólido (11) e infrarrojos, y evitar las interferencias del agua.
Caracterización de la materia orgánica de los suelos
Los espectros infrarrojo se tomaron en un equipo FT-IR Perkin Elmer Paragon 500 con un rango de 4.000-400 cm-1,empleando pastillas de KBr al 1% con 1 mg de muestra.
Los espectros de 13C-RMN en estado sólido se obtuvieron con un espectrómetro Bruker DMX 200 con CPMAS, una rampa de polarización durante el tiempo de contacto y un desacople protónico durante la adquisición. El número de escanes fue de 32 K, y el equipo se operó a una frecuencia de 50 MHz con un RT = 3,0 s; un LB = 5,0 Hz; un SW = 15 kHz; y un tiempo CP = 2 ms. Cada espectro se dividió en once regiones para la integración de las bandas de resonancia (12), las cuales se consignan en la Tabla 2.
RESULTADOS Y ANÁLISIS
Caracterización de la materia orgánica de los suelos
La composición, estructura y conformación de la materia orgánica del suelo puede variar considerablemente dependiendo del origen y la edad de los materiales que la conforman (13). Se ha encontrado que los ácidos húmicos como componentes de la materia orgánica del suelo poseen diferentes composiciones y estructuras químicas cuando son obtenidos a partir de diferentes suelos (14), por lo que posiblemente pueden generar ciertas variaciones en su comportamiento físico y químico respecto a la adsorción de contaminantes presentes en el suelo.
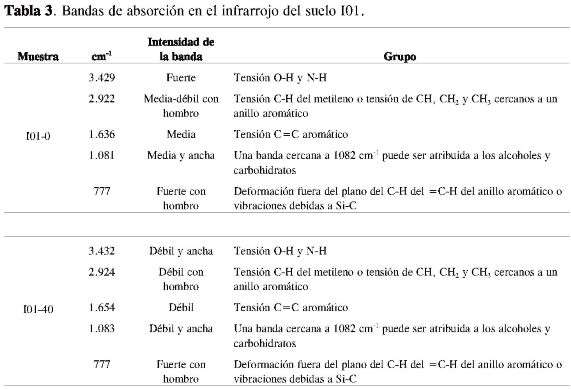
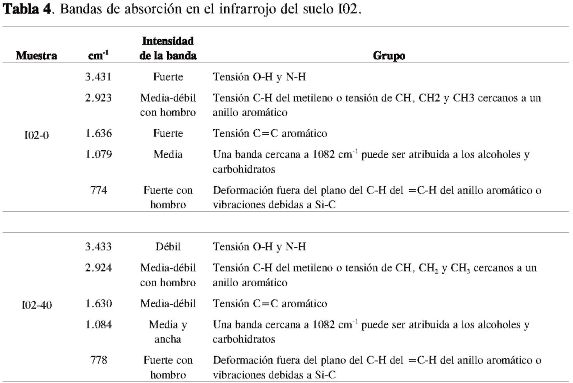
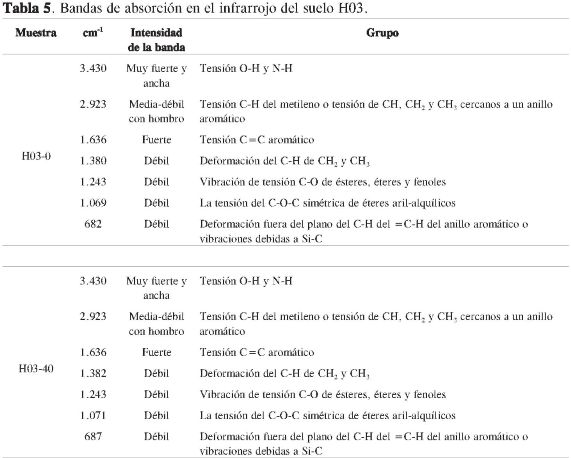
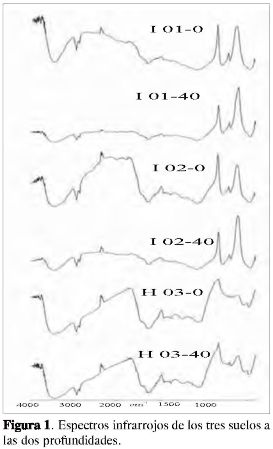
En las Tablas 3, 4 y 5 se consignan: el número de onda, las intensidades de las bandas de absorción y las agrupaciones atómicas, y en la Figura 1 los espectros infrarrojos para los tres suelos a las dos profundidades empleadas en la caracterización estructural de la materia orgánica del suelo.
De acuerdo con la intensidad observada de la banda cercana entre 1.654-1.630 cm-1, se pudo establecer posiblemente que todos los suelos empleados en la caracterización de la MOS presentan en su estructura molecular anillos aromáticos, los cuales pueden estar presentes en moléculas con diferentes grados de condensación, encontrándose una disminución de la intensidad de la banda según el siguiente orden: H03-0 = H03-40 > I02-0 > I01-0 > I01-40 = I02-40, la cual puede estar relacionada con la cantidad y complejidad de la fracción aromática.
Todos los suelos cuentan con una fracción alifática y la presencia de grupos OH debida posiblemente a fenoles, ácidos carboxílicos o alcoholes (Tablas 3, 4 y 5). Un aspecto importante es la ausencia de la banda de intensidad fuerte entre 1.900-1.650 cm-1 en los suelos H03-0 y H03-40, debida a la tensión del C=O de aldehídos, ácidos, cetonas, amidas, ésteres y anhídros, la cual se observó en los demás espectros pero con una intensidad muy débil.
La aparición de las bandas cercanas a 1.382 y 1.243 cm-1 en los suelos H03-0 y H03-40 se deben posiblemente a la deformación de C-H del CH2 yCH3 y a la vibración de tensión C-O de ésteres, éteres y fenoles, respectivamente (4, 15).
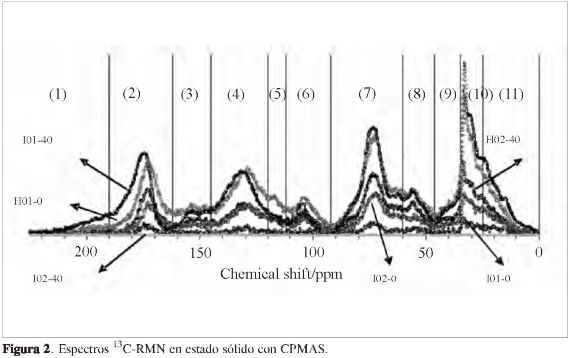
Respecto a los espectros de 13C-RMN en estado sólido con CPMAS empleados como herramienta analítica cuantitativa, no destructiva, para determinar el tipo de carbón presente en la o las estructuras moleculares que conforman la materia orgánica del suelo, se encontró que las bandas o picos presentaron características muy similares en las once regiones, excepto para el suelo I02-40, la cual no mostró bandas de resonancia debido posiblemente al bajo contenido de materia orgánica o a la presencia de algo de Fe2+/Fe3+(Figura 2).
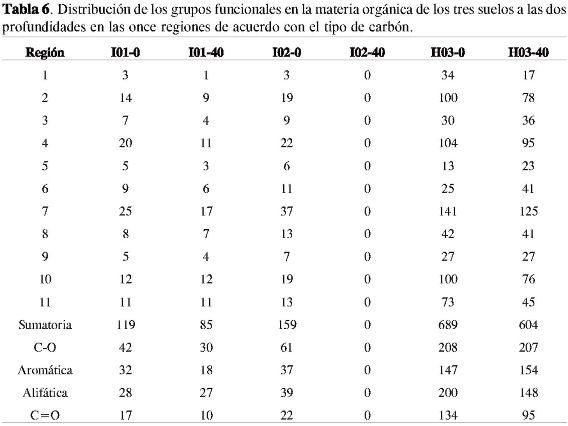
De la integración de cada una de las bandas observadas en los espectros se obtuvo la distribución aparente de los grupos funcionales según el tipo de carbón, las cuales son consignadas en la Tabla 6. La intensidad de la señal de la banda de resonancia en la región 10 de la muestra H03-0 se seleccionó arbitrariamente dándole un valor de 100, para calcular las otras intensidades de las señales y así obtener los valores de cada fracción.
Se debe tener presente por la naturaleza de la técnica 13C-RMN en estado sólido que la eficiencia CP para las diferentes bandas de resonancia puede variar significativamente, en donde la intensidad total del carbono de cada muestra no representa necesariamente la "verdadera" intensidad de la señal. Asumiendo una eficiencia igual en CP se puede obtener el siguiente número de carbonos de la materia orgánica con cada muestra: H03-0 = 100 y H03-40 = 88, I02-0 = 23 y I02-40 = 0, y finalmente I01-0 = 17 y I01-40 = 12, confirmándose que el número total de carbonos en la materia orgánica decrece a través de la profundidad del suelo, lo cual corresponde con el contenido de carbón orgánico determinado para cada uno de los suelos (Tabla 1).
Lo que se puede cuantificar y comparar es la relación entre la intensidad de la señal y la resonancia de una misma banda en dos diferentes espectros, porque en esas bandas se asume una misma eficiencia CP, encontrándose, según la Tabla 6 y la Figura 3, que la materia orgánica del suelo H03-0 presentó las mayores intensidades en las señales a δ = 190-220 ppm (C de cetona, quinona, aldehídos: C=O, HC=O); δ = 162-190 ppm (C del carboxilo, éster, quinona: COO, COOH); δ = 120-145 ppm (C aromático: CH, C); δ = 60-96 ppm (C del alcohol, éter, sacáridos: CHOH, CH2OH, CH2-O-); δ = 25-35 ppm (C del CH2 en alifáticos simples) y δ = 0-25 ppm (C del CH3), y el suelo H03-40 presentó una mayor intensidad en las señales a δ = 145-162 ppm (C del fenol: C-O-, C-OH); δ = 108-120 ppm (C aromático: CH); δ = 96-108 ppm (C aromático cerca de los carbones fenólico y el anomérico: O-CH-O, CH) y una señal muy similar respecto a la muestra H03-0 a δ= 50-60 ppm (C del metoxi, metino y cuaternario: CH3O-, CH-NH, CH, C) y δ = 35-50 ppm (C del complejo alifático).
Respecto a las otras muestras de materia orgánica, estas presentaron bandas de resonancia en las mismas regiones que las muestras H03-0 y H03-40, pero las intensidades de las señales fueron menores, encontrándose al dividir las once regiones en cuatro grupos más generales (11) el siguiente orden respecto a la fracción alifática, la fracción C=O y quinonas, y a la fracción O-alquil: H03-0 > H03-40 > I02-0 > I01-0 > I01-40; para la fracción aromática (O-aril y C-aril) se encontró el siguiente orden: H03-40 > H03-0 > I02-0 > I01-0 > I01-40. La última sucesión está muy acorde con el orden establecido, de acuerdo con las intensidades de las bandas en los espectros infrarrojo, en la región de vibración de tensión del C=C de las olefinas y compuestos aromáticos.
El carbón resonante en la región δ = 108-50 ppm de los espectros (N - y O-alquilos y acetales) dominó en toda la MOS obtenida; le siguió el carbón aromático (δ = 162-108 ppm) para los suelos I01-0 y H03-40, y el carbón alifático (δ = 0-50 ppm) para los suelos I01-40, I02-0 y H03-0. Finalmente el carbón C=O (δ = 220-162 ppm) fue el menos dominante en la MOS en todos los suelos caracterizados. Resultados similares se han reportado para la caracterización de la MOS de 25 suelos con diferentes vegetaciones provenientes de varias zonas ecológicas de Australia y Pakistán, en donde el carbón resonante a δ = 45-110 ppm dominó en la mayoría de los suelos estudiados, siguiéndole el carbón de la región δ = -10-45 ppm, y finalmente el carbón de la región δ = 110-165 ppm; generalmente el carbón de la región δ = 165-220 ppm (carbonilos) contribuyó con la porción más pequeña en la MOS (3, 11). Randall et al. encontraron que el carbón aromático fue el segundo tipo de carbón más importante en suelos provenientes de Rot-hamsted (UK) y Askov, siendo los grupos funcionales en la región de δ = 45-110 ppm los dominantes en los espectros de 13C RMN para muchos de los suelos caracterizados (16). Mahieu et al., sobre la base de datos de RMN provenientes de la literatura de alrededor de 300 suelos, reportaron que los O-alquil constituyeron el grupo más abundante seguido por los alquilos y los aromáticos; los carbonilos fueron el grupo menos abundante (17). Respecto a la abundancia del carbón alifático y aromático entre los suelos I01-40, I02-0 y H03-0, y los suelos I01-0 y H03-40, se ha reportado que la materia orgánica de los suelos con altos contenidos de arenas contiene más unidades alifáticas que los suelos con altos contenidos de arcillas (18), siendo los suelos I01-40 y I02-0 los de mayor contenido de arenas, y los suelos I01-0 y H03-40 los que presentan un contenido mayor de arcillas.
La distribución de intensidades (%) para el espectro de 13C-RMN de una muestra de ácidos húmicos, como componente de la MOS, obtenidos de un suelo andisol del departamento del Cauca, mostró que el carbón proveniente de los grupos aromáticos (δ = 150-90 ppm) fue el dominante, seguido por los grupos alifáticos (δ= 0-45 ppm), el O-alquil (δ = 45-90 ppm) y finalmente el carbón proveniente de los grupos carbonilos (δ = 200-150 ppm) (19). Estudios en donde se han combinado análisis químicos, espectros infrarrojos y de resonancia magnética nuclear, demostraron que las sustancias húmicas contienen una gran cantidad de carbón alifático (20, 21). Las diferencias en la composición química de la MOS proveniente de suelos de distintas regiones se deben, posiblemente, a varios factores como el grado de descomposición de la MOS, el origen, los materiales parentales y factores ambientales (3).
Para el caso específico de la MOS de los tres suelos a las dos profundidades provenientes del municipio de Aquitania, Boyacá, el régimen hídrico de la zona y la textura de los suelos probablemente pueden afectar la composición química de la MOS, teniendo presente que los minerales, la materia orgánica y los microorganismos están íntimamente asociados en el suelo e interactúan estrechamente en varios procesos (22), como por ejemplo, la humificación. La humificación ha sido extensamente estudiada en los suelos, en cada uno de los perfiles que lo conforman y en los diferentes tamaños de partículas de este (23-25); concluyéndose que durante el proceso de humificación la cantidad de carbonos aromáticos y alifáticos incrementa, mientras que la cantidad de carbonos O-alquil disminuye (1). Posiblemente el suelo I01-0 presentó una menor cantidad de grupos aromáticos (Tabla 6), relacionados con la condensación de la MOS (humificación), porque, además de contener una menor cantidad de carbón orgánico respecto a los suelos H03-0, H03-40 y I02-0, presentó el menor contenido de arenas, el mayor contenido de limos y un contenido de arcillas un poco mayor al de los otros suelos (excepto para el H03-40), afectando de este modo la aireación del suelo y, por ende, la actividad microbiana del sistema. En contraste, el suelo I02-0 presentó el mayor contenido de arenas, al igual que un contenido mayor de carbón orgánico respecto al suelo I01-0.
CONCLUSIONES
Los resultados de los espectros infrarrojo yde13C-RMN en estado sólido con CPMAS permiten considerar que la materia orgánica de los suelos caracterizada está conformada por anillos aromáticos, quinonas, grupos fenólicos, grupos alcohólicos, sacáridos y cadenas alifáticas. La no presencia de la banda de intensidad fuerte entre 1.900-1.650 cm-1 en el IR de los suelos H03-0 y H03-40, debida a la tensión del C=O de aldehídos, ácidos, cetonas, amidas, ésteres y anhídros, evidencia, posiblemente, que en sus estructuras moleculares exista una gran presencia de quinonas respecto a los otros suelos.
La diferencia entre los suelos estudiados en relación en el contenido de unidades alifáticas se debe a la diferencia en el contenido de arenas y arcillas. La fracción aromática y alifática en un mismo suelo cambia con respecto a la profundidad, siendo la primera un poco mayor para los suelos I01-0 y H03-40 respecto a los suelos I01-40 y H03-0, debido no solo a la cantidad de carbón orgánico en el suelo sino también a las diferencias en la textura.
El número relativo de carbonos disminuye con el incremento de la profundidad en los tres suelos. Estos resultados están en concordancia con la disminución en el contenido de carbón orgánico a través del perfil del suelo. La comparación de las diferentes profundidades muestra que no solo el contenido de carbón orgánico afecta la composición de la MOS, sino que también lo hacen los factores ambientales de la zona, tales como el régimen hídrico y la textura de los suelos, que controlan la aireación del suelo y, por ende, la actividad microbiana del sistema en el proceso de humificación de los componentes de la MOS.
AGRADECIMIENTOS
A Per Olav Kverneberg y Sissel Jorgensen de la Universidad de Oslo, por su valiosa colaboración en la toma de los espectros de resonancia magnética nuclear 13C en estado sólido.
A la Agencia Internacional de Energía Atómica (IAEA Viena, Austria), por la colaboración y financiación suministradas para la realización de este trabajo.
REFERENCIAS BIBLIOGRÁFICAS
1. Chefetz, B.; Tarchitzky, J.; Deshmukh, A. P.; Hatcher, P. G.; Chen, Y. Structural characterization of soil organic matter and humic acids in particle-size fractions of an agricultural soil. Soil Science Society of America Journal. 2002 . 66: 129-141. [ Links ]
2. Stevenson, F. J. Humus Chemistry: Genesis, Composition, Reactions. New York, USA: A Willey-Interscience Publications. 1994. [ Links ]
3. Ahmad, R.; Nelson, P. N.; Kookana, R. S. The molecular composition of soil organic matter as determined by 13C NMR and elemental analyses and correlation with pesticide sorption. European Journal of Soil Science. 2006. 57: 883-893. [ Links ]
4. Kang, S.; Amarasiriwardena, D.; Veneman P.; Xing, B. Characterization of ten sequentially extractes humic acids and a humin from a soil in western Massachusetts. Soil Science. 2003. 168: 880-886. [ Links ]
5. Baes, A. U.; Bloom, P. R. Diffuse reflectance and transmission Fourier transform infrarred (DRIFT) spectroscopy of humic and ful vic acids. Soil Science Society of America Journal. 1989. 53: 695-700. [ Links ]
6. Niemeyer, J.; Chen, J.; Bollag, J. M. Characterization of humic acids, compost and peat by diffuse reflectance Fourier-transform infrared spectroscopy. Soil Science Society of America Journal. 1992. 56: 135-140. [ Links ]
7. Ribeiro, J.; Sonay, S.; Garrigues, S.; Guardia, M. FITRTentativecharacterization of humic acids extracted from organic materials. Spectroscopy Letters. 2001. 34: 179-190. [ Links ]
8. DANE. Primer Censo del cultivo de cebolla larga. Boyacá Región de la Laguna de Tota. 2001: 5-18. [ Links ]
9. DANE. Encuesta Nacional Agropecuaria. Módulo: área, producción y rendimiento. 2000. [ Links ]
10. IGAC. Estudio general de suelos de los municipios de Aquitania, Cuitiva, Firavitoba, Iza, Mongui, Nobsa, Sogamoso, Tibasosa, Topaga y Tota (departamento de Boyacá). Bogotá, D.C. 1980. [ Links ]
11. Ahmad, R.; Kookana, R. S.; Alston, A. M.; Skjemstad, J. O. The Nature of Soil Organic Matter Affects Sorption of Pesticide. 1. Relationships with Carbon Chemistry as Determined by 13C CPMAS NMR Spectroscopy. Environmental Science and Technology. 2001. 35: 878-884. [ Links ]
12. Mao, J. D.; Hu, W. G.; Rohr, S.; Davies, G.; Grabour, E. A.; Xing, B. Quantitative characterization of humic substances by solid-state carbon-13 nuclear magnetic resonance. Soil Science SocietyofAmericaJournal. 2000. 64: 873-884. [ Links ]
13. Leinwebwe, P.; Blumenstein, O.; Schulten, H. R. Organic matter composition in sewage farm soils: investigations by 13C-NMR and pyrolisisfield ionization mass spectroscopy. European Journal of Soil Science. 1996. 47: 71-80. [ Links ]
14. Chen, Z.; Pawluk, S. Structural variations of humic acids in two sola of Alberta Mollisols. Geoderma. 1995. 65: 173-193. [ Links ]
15. Chien, S.-W. C.; Huang, C-C.; Wang, M. C. Analytical and spectroscopic characteristics of refuse compost-derived humic substances. International Journal of Applied Science and Engineering. 2003. 1: 62-71. [ Links ]
16. Randall, E. W.; Mahieu, N.; Powlson, D. S.; Christensen, B. T. Fertilization effects on organic matter in physically fractionated soils as studied by 13C NMR: Results from two long-term field experiments. European Journal of Soil Science. 1995. 46: 557-565. [ Links ]
17. Mahieu, N.; Powlson, D. S.; Randall, E. W. Statistical Analysis of Published Carbon-13 CPMAS NMR Spectra of Soil Organic Matter. Soil Science Society ofAmerica Journal. 1999. 63: 307-319. [ Links ]
18. Capriel, P. Hydrophobicity of organic matter in arable soils: influence of management. European Journal ofSoil Science. 1997. 48: 457-462. [ Links ]
19. Mosquera, C. S.; Bravo, I.; Hansen, E. W. Comportamiento estructural de los ácidos húmicos obtenidos de un suelo andisol del departamento del Cauca. Revista. Colombiana de Química. 2007. 36: 31-41. [ Links ]
20. Sciacovelli, O.; Senesi, N.; Solinas, V.; Testini, C. Spectroscopic studies on soil organic fractions i. IR and MNR spectra. Soil Biology and Biochemistry. 1977. 9: 287-293. [ Links ]
21. Hatcher, P. G.; Schnitzer, M.; Denis, L. W.; Maciel, G. E. Aromaticity of humic substances in soils. Soil Science Society ofAmerica Journal. 1981. 45: 1089-1094. [ Links ]
22. Bollag, J. M. Interactions of Soil Components and Microorganisms and their Effects on Soil Remediation. Revista de la Ciencia del Suelo y Nutrición Vegetal. 2008.8:28-32. [ Links ]
23. Chefetz, B.; Chen, Y.; Clapp, C.E.; Hatcher, P. G. J. A. Characterization of organic matter in soil by ther-mochemolysis using tetramethylammonium hydroxide (TMAH). Soil Science Society ofAmerica Journal. 2000. 64: 583-589. [ Links ]
24. Guggenberger, G.; Zech, G. W.; Thomas, R. J. Lignin and carbohydrate alteration in particle-size separetes of an oxisol under tropical pastures following native savanna. Soil Biology and Biochemistry. 1995. 27: 1629-1638. [ Links ]
25. Kogel-Knabner, L. 13C and 15N NMR spectroscopy as a tool in soil organic matter studies. Geoderma. 1997. 80: 243-270. [ Links ]