Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804On-line version ISSN 2357-3791
Rev.Colomb.Quim. vol.39 no.3 Bogotá Sept./Dec. 2010
DEGRADACIÓN QUÍMICA DEL POLI(ETILEN TEREFTALATO)
CHEMICAL DEGRADATION OF POLY(ETHYLENE TEREPHTHALATE)
DEGRADAÇÃO QUÍMICA DO POLI(TEREFTALATO DE ETILENO)
Aurelio Ramírez1,2, Leticia Guadalupe Navarro1, Jorge Conde Acevedo1
1 Universidad del Papaloapan. Circuito Central No. 200, colonia Parque Industrial, Tuxtepec, Oaxaca, México. C.P. 68301.
Recibido: 19/04/10 - Aceptado: 12/11/10
RESUMEN
En este trabajo se analizó la degradación del poli(etilen tereftalato) variando la temperatura y la concentración de hidróxido de potasio en 1-butanol, manteniendo constante el tamaño y peso de la muestra. El intervalo de temperatura utilizada fue de 110 oCa 150 oC y las concentraciones de hidróxido de potasio en 1-butanol en el intervalo 0,4 a 4,4 molar. Para estas condiciones de concentración y temperatura se observó la degradación de un 99% de poli(etilen tereftalato) en un tiempo de una hora. Se obtuvieron dos fases: una orgánica y una sólida. La fase sólida es un polvo soluble en soluciones ácidas. Este producto degradado corresponde probablemente al tereftalato de potasio. A una temperatura de 150 oC y una concentración de 3,34 M se estudió la cinética de degradación del poli(etilen tereftalato) en función del tiempo. A partir de los resultados y comparando con modelos matemáticos de degradación encontrados en la literatura, se propone que la degradación del poli(etilen tereftalato) sigue un modelo de degradación de power law.
Palabras clave: PET, degradación, modelo de reacción, power law.
ABSTRACT
In this work the degradation of poly(ethylene terephthalate) was analyzed by varying the temperature and the concentration of potassium hydroxide in 1-butanol holding constant the size and weight of the sample. The temperature range used was from 110oC to 150oC and concentrations of potassium hydroxide in 1-butanol in the range of 0,4 to 4,4 molar, obtaining 99% degradation of poly(ethylene terephthalate) in one hour. The temperature of 150°C and the concentration of 3,34 M were used to study the degradation of poly(ethylene terephthalate) as a function of time. We obtained two phases, an organic phase and solid phase. The solid phase is a soluble in acidic solutions. The solid phase probably corresponds to the of potassium terephthalate. From the results and comparing with models of degradation found in the literature this work suggests that poly(ethylene terephthalate) degradation reaction occurs type power law.
Key words: PET, degradation, reaction model, power law.
RESUMO
Neste trabalho, se analisou a degradação de poli(tereftalato de etileno) através da variação da temperatura e da concentração de hidróxido de potássio em 1-butanol, segurando o tamanho e o peso constante da amostra. A faixa de temperatura utilizada foi 110° C a 150° C e concentrações de hidróxido de potássio em 1-butanol, intervalo de 0,4-4,4 molar. Para que essas variações são 99% de degradação do poli(teref-talato de etileno) em um tempo de uma hora. Foram obtidas duas fases: uma fase orgânica e uma fase sólida. A fase sólida é um pó solúvel em soluções ácidas. Isso provavelmente corresponde ao produto degradado de tereftalato de potássio. Foram utilizadas uma temperatura de 150 °C e uma concentração de 3,34 M para estudar a cinética de degradação do poli(teref-talato de etileno) como uma função do tempo. A partir dos resultados e comparando com modelos matemáticos de degradação encontrados na literatura, se sugere que a degradação do poli(tereftalato de etileno) é um modelo de degradação do tipo lei de potência.
Palavras-chave: PET, degradação, modelo de reação, lei de potência.
INTRODUCCIÓN
El poli(etilen tereftalato) (PET) es un poliéster termoplástico, con un intervalo de cristalinidad de 0 a 60%. Este ha sido parte del desarrollo de la vida humana en las últimas décadas (1-4). En el mundo se consumen aproximadamente 26 millones de toneladas de PET al año, de estas, 20 millones son procesadas por la industria textil (fibras), 4 millones son utilizadas en cintas de audio y video (películas fotográficas), así como en transparencias, 2 millones en productos de empaque y moldeado (botellas y jarras) (5-6). Estos materiales plásticos son depositados en basureros o en lugares inapropiados después de su uso, debido a esto, en años recientes, se han creado normas sobre los problemas ambientales y de espacio que estos desechos están generando (7-8).
Por mencionar un ejemplo, en Brasil se producen 400.000 toneladas al año de PET, del cual, 90% se destina en la producción de botellas, de estas, solo 40% es reciclado, lo que convierte a Brasil en uno de los países en el mundo que contiene más desechos de botellas de PET sin reciclar.
Por otra parte, comparativamente, en Europa el reciclado de PET en 1991 fue de 1,3x104 toneladas, en 1993 de 2,2 x104 toneladas, en 1995 de 3,5x104 toneladas, en 2008 1,1 x106 y en 2009 alcanzó la cifra de 1,4 x106 toneladas.
El proceso de reciclado químico es una opción viable para este tipo de material, ya que las cantidades mundiales de PET se están elevando cada año aproximadamente 12,5% por año. Hay varios procesos de este tipo, por ejemplo, la metanólisis, glicólisis, hidrólisis, aminólisis y la oxidación, entre otros (9-14). De estos procesos se estima que la degradación del PET por hidrólisis en un intervalo de temperatura de 100 oC hasta 120 oC es 5.000 veces más rápido que el proceso de degradación por oxidación, y 10.000 veces más rápido que el proceso de degradación térmica.
El proceso de hidrólisis puede llevarse a cabo en un medio neutro, ácido o alcalino. Entre estos tres procesos, bajo las mismas condiciones de degradación, la hidrólisis alcalina del PET es más rápida que las hidrólisis ácida y neutra.
Generalmente, en la hidrólisis alcalina se han utilizado soluciones acuosas de hidróxido de sodio con intervalos de concentración de 4 a 20% en peso, temperaturas de 100 °C hasta 250 °C, presiones desde 1 hasta 2 atmósferas, y en tiempos de degradación entre 2 y 5 horas, para obtener rendimientos hasta 99%. También se ha estudiado la cinética de degradación de este proceso hidrolítico, además de proponer modelos matemáticos de degradación (15-16).
Modelos matemáticos de degradación
En el estudio de la descomposición térmica en sólidos se utilizan modelos de reacción para describir su degradación experimental. La cinética de estos procesos es descrita por la ecuación [1].
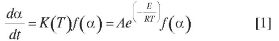
Donde 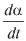 es la velocidad de la degradación, t es el tiempo, α es el grado de degradación, T es la temperatura en grados Kelvin, K es la constante de la velocidad de degradación en función de la temperatura, EA es la energía de activación, A es el factor preexponencial, f(α) es el modelo matemático de reacción y R es la constante de los gases (17-19).
es la velocidad de la degradación, t es el tiempo, α es el grado de degradación, T es la temperatura en grados Kelvin, K es la constante de la velocidad de degradación en función de la temperatura, EA es la energía de activación, A es el factor preexponencial, f(α) es el modelo matemático de reacción y R es la constante de los gases (17-19).
La integral de la ecuación [1] bajo condiciones isotérmicas es de la siguiente forma

Donde 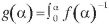 da. El término g(a) representa el comportamiento del grado de degradación (α) con respecto al tiempo y la temperatura.
da. El término g(a) representa el comportamiento del grado de degradación (α) con respecto al tiempo y la temperatura.
En la Tabla 1 se enumeran algunos modelos matemáticos de reacción, f(α),con sus respectivas formas integradas, g(α), propuestas en la literatura (20).
La constante de la velocidad, K(T), de la ecuación [2] se puede determinar graficando g(α) versus tiempo para cada modelo de la Tabla 1; y a partir de los valores de K(T) obtenidos de cada uno de los modelos, se puede estimar el grado de confiabilidad de cada uno de estos usando la suma residual de cuadrados 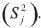
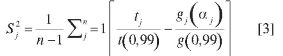
Las relaciones entre los 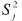 se puede expresar estadísticamente como
se puede expresar estadísticamente como

Donde 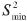 es el valor mínimo de todos los
es el valor mínimo de todos los 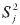 y
y 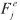 e indica la aproximación de cada modelo de reacción con los datos experimentales. Cuando el valor de Fj para un modelo es uno o se aproxima a uno, el modelo j se ajusta o se aproxima a los datos experimentales. Los valores de la energía de activación (EA) y el factor pre-exponencial (A) se pueden determinar a partir de este modelo de reacción usando la ecuación [1] (21-22).
e indica la aproximación de cada modelo de reacción con los datos experimentales. Cuando el valor de Fj para un modelo es uno o se aproxima a uno, el modelo j se ajusta o se aproxima a los datos experimentales. Los valores de la energía de activación (EA) y el factor pre-exponencial (A) se pueden determinar a partir de este modelo de reacción usando la ecuación [1] (21-22).
El objetivo del presente artículo es establecer condiciones de degradación química del PET más sencillas que las propuestas en la literatura, así como proponer un modelo matemático que permita describir la cinética de degradación experimental del PET, de forma que en futuras investigaciones esta metodología se pueda aplicar a la degradación de otros polímeros como poliuretanos, poliaminas, polilactonas, entre otros.
MATERIALES Y MÉTODOS
Material
PET comercial, hidróxido de potasio (grado reactivo Sigma Aldrich), alcohol butílico (grado reactivo Química Meyer), ácido clorhídrico (grado reactivo Química Meyer), plancha de calentamiento marca RCT Basic Ika y equipo de infrarrojo con transformada de Fourier (FT-IR) modelo Spectrum 100 Perkin Elmer.
Hidrólisis alcalina
Se colocó 1 g de PET comercial cortado en trozos de 1x1 cm en un matraz de fondo redondo de 50 mL. Al matraz se le agregó la solución de KOH en 1-butanol en un intervalo de concentración de 0,4 a 4,4 molar. La mezcla se colocó en una plancha de calentamiento con agitación suave a una temperatura de 150 °C. A partir de los resultados obtenidos, posteriormente se fijó una concentración constante para llevar la a cabo la degradación variando la temperatura en un intervalo de 110 °C a 160 °C durante un tiempo de una hora.
Análisis
Se determinó el porcentaje de degradación pesando, en seco, el PET no degradado, el cual se separó previamente por filtración. Los resultados de los valores de degradación se sustituyeron en los modelos matemáticos de reacción de la Tabla 1, y se analizó su comportamiento con respecto a los datos experimentales. Se caracterizaron los productos de degradación por FT-IR precipitando el producto degradado con HCl concentrado.
RESULTADOS Y DISCUSIÓN
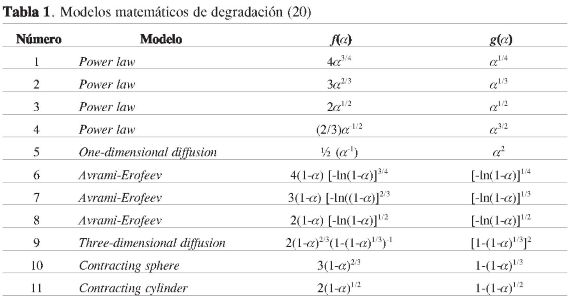
Se llevó a cabo la hidrólisis alcalina del PET. El porcentaje de PET degradado con respecto a diferentes concentraciones de KOH en 1-butanol se muestra en la Figura 1, en esta se observa que la degradación del PET se incrementa de manera significativa y de forma lineal en el intervalo de concentración de 0,4 a 2,5 M. De manera que a una concentración de 3,34 M el PET es degradado en 99,74%.
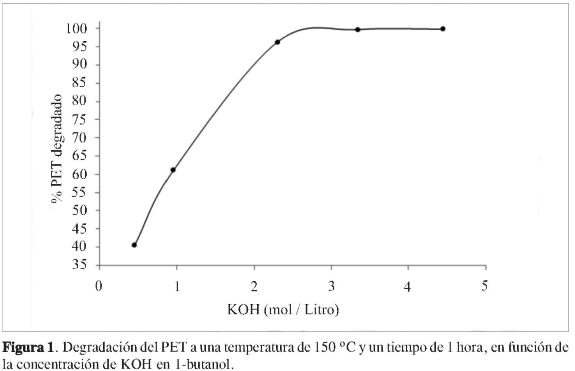
Por otra parte, la degradación del PET en función de la temperatura manteniendo una concentración fija de 3,34 M de KOH en 1-butanol y un tiempo de una hora, presenta un comportamiento ascendente no lineal conforme esta se incrementa, (Figura 2). En el intervalo de temperatura de 110 ° a 130 °C, la degradación del PET alcanza 99%. La degradación es casi total en el intervalo de 130 °C a 150 °C. Por ejemplo, a estas dos temperaturas corresponde 99,53% y 99,88% de PET degradado, respectivamente.
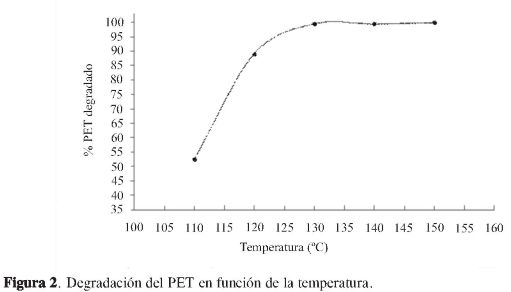
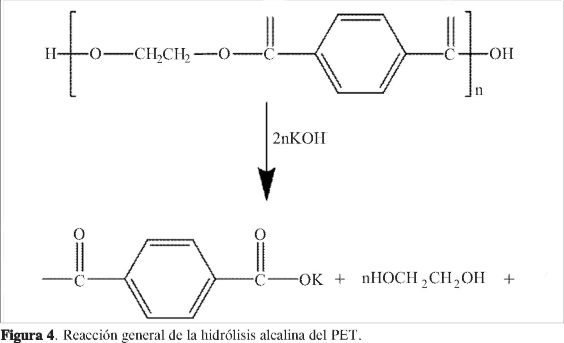
Como resultado de la degradación química tanto en la variación de concentración como de temperatura, se obtuvo como producto final una mezcla heterogénea. Una fase sólida (polvo blanco) y una fase líquida (orgánica). Se obtuvieron los espectros de FT-IR de estas dos fases, para esto, el polvo blanco se disolvió con agua y se precipitó con ácido clorhídrico (HCl) concentrado, también se obtuvo el espectro del PET comercial (Figura 3). Bourelle y Safa (23) obtuvieron también estas dos fases en la degradación química del PET pero utilizando NaOH. En la Figura 3 se observa que al comparar los espectros (a) y (c), la señal que corresponde al grupo funcional carbonilo del PET aparece en 1714 cm-1 (> C=O) en (c) y no en el espectro (a); este resultado indica que sí se llevó a cabo la degradación del PET. Además, en el espectro (a) se observa la señal del ión carboxilato asimétrico en 1635 y 1567 cm-1 y del ión carboxilato simétrico a 1.395 y 1.300 cm-1 (O-C=O). Este resultado indica que probablemente el polvo blanco sea carboxilato de potasio. Por otra parte, las señales del espectro (b) corresponden al etilenglicol y al 1-butanol; las señales de los grupos funcionales de estos dos compuestos se encuentran sobrepuestas (alcohol y metile-no); la señal del alcohol (R-OH) se encuentra a 3.354 cm-1 y la de los metilenos (-CH2) a 2.936 cm-1 (24). En la Figura 4 se muestra la reacción general propuesta de la hidrólisis alcalina del PET.
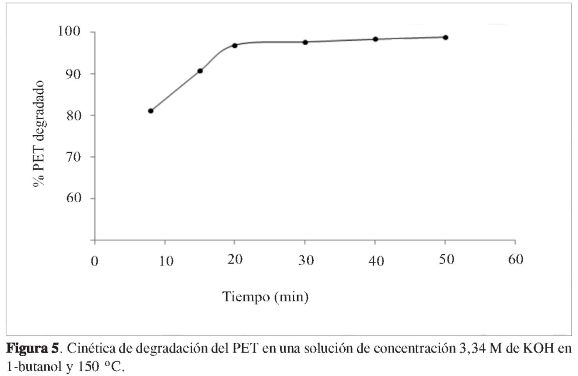
A partir de los resultados anteriores, se fijaron las condiciones siguientes de degradación: 1 g de PET comercial, una concentración de 3,34 M de KOH en 1-butanol y una temperatura de 150 °C, con el objetivo de analizar la cinética de degradación del PET. En la Figura 5 se muestra la cinética de degradación, en esta se observa que la velocidad de degradación se incrementa de manera lineal en un intervalo de 10 a 20 minutos, alcanzando en estos tiempos una degradación de 81% y 95%, respectivamente. En el intervalo de 20 a 50 minutos la pendiente de degradación disminuye comparada con el intervalo anterior, y esto es debido probablemente a la cantidad de PET que queda por degradar, es decir, de 95 a 100%; por ejemplo, a los 50 minutos la degradación es de 99%. Estas condiciones de degradación del PET propuestas probablemente a la cantidad de PET que queda por degradar, es decir, de 95 a 100%; por ejemplo, a los 50 minutos la degradación es de 99%. Estas condiciones de degradación del PET propuestas resultan ser más eficientes y con rendimientos altos en un menor tiempo, al compararse con trabajos previos. Por ejemplo, Mancini y Zanin (25) utilizaron NaOH 7,5 M, una temperatura de 100 °C, un tamaño de la muestra de PET inferior a 1,19 mm y un tiempo de 5 horas, para obtener un rendimiento de 98%.
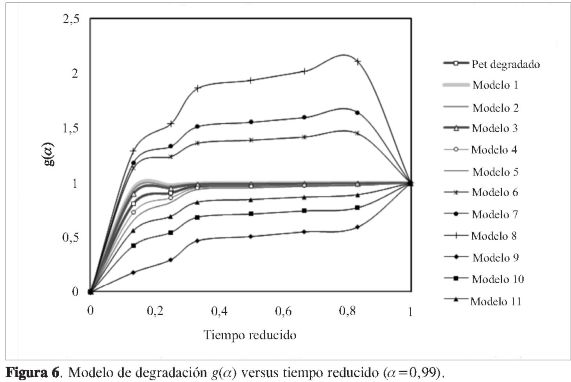
Partiendo de estos resultados, se realizó la comparación de la cinética experimental con los modelos de reacción de la Tabla 1 (Figura 6), donde la línea con cuadros en blanco representa la tendencia de los valores experimentales. La línea con triángulos en blanco es el modelo matemático que más se ajusta a los datos experimentales, y este corresponde al modelo número 3, el cual es

Donde f (α) es el modelo de reacción, 2, es un factor de proporcionalidad, a,es el grado de degradación del PET, ½, es el orden de la degradación. Este tipo de modelo matemático es conocido como ley de potencias (power law). De acuerdo con este modelo, las cadenas que están siendo degradadas van aumentando en un orden creciente de 2, es decir, 1, 3, 5, 7, 9, y así sucesivamente, conforme avanza la degradación. Y a partir de la ecuación [4], el valor de la aproximación para este modelo matemático con los datos experimentales, Fj, es de 0,95, y con una constante de degradación de 0,87 minutos-1.
Este modelo matemático es parecido al propuesto por Hsiao et al. (26), ver ecuación [6].

Donde W es el peso de la muestra del PET, t es el tiempo de reacción, C es la concentración de NaOH, A es el área de la superficie reactiva, K es la constante de velocidad de la hidrólisis alcalina, α y β son el orden de reacción.
Comparando cada uno de los términos de la ecuación [6] con las ecuaciones [1] y [5], resulta que 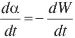 son las velocidades de degradación, K(T) = K son las constantes de la velocidad de degradación y f(α)=CαAβ = 2α1/2 son los modelos matemáticos de degradación. Cabe resaltar que Hsiao et al. utilizaron NaOH 1,33 M y una temperatura 100 °C para describir la cinética de degradación del PET, obteniendo a los 120 minutos una degradación de 30%.
son las velocidades de degradación, K(T) = K son las constantes de la velocidad de degradación y f(α)=CαAβ = 2α1/2 son los modelos matemáticos de degradación. Cabe resaltar que Hsiao et al. utilizaron NaOH 1,33 M y una temperatura 100 °C para describir la cinética de degradación del PET, obteniendo a los 120 minutos una degradación de 30%.
Finalmente, la degradación hidrolítica del PET propuesta en este trabajo sería una opción más sencilla que la hidrolisis llevada a cabo en hornos microondas en donde se han utilizado soluciones de acuosas de NaOH y soluciones alcohólicas de KOH, temperaturas de 100 °C y 180 °C, potencias de 46 W hasta 500 W y tiempos de exposición a la radiación de microondas de 3 minutos hasta 30 minutos para alcanzar rendimientos de 97% (27-28).
CONCLUSIONES
Se llevó a cabo la degradación del PET con hidróxido de potasio en 1-butanol a una concentración de 3,34 M a 150 °C, obteniéndose a los 20 minutos una degradación del plástico en 95% y en 99% en un tiempo de 50 minutos. Estas condiciones de degradación son más sencillas que las propuestas en la literatura. Se propone que el modelo matemático de degradación que más se aproxima a la curva experimental es el llamado power law, este modelo indica que la degradación de las cadenas del PET va aumentando en orden creciente de 2.
REFERENCIAS BIBLIOGRÁFICAS
1. Saeid, H. S.; Taheri, S.; Zadhoush, A.; Mehrabani-Zeinabad, A. Hydrolytic degradation of poly(ethylene terephthalate). J. Appl. Polym. Sci. 2005. 103: 2304-2309. [ Links ]
2. Genta, M.; Iwaya, T.; Sasaki, M.; Goto, M.; Hirose, T. Depolymerization mechanism of poly(ethylene terephthalate) in supercritical methanol. Ind. Eng. Chem. Res. 2005. 44: 3894-3900. [ Links ]
3. Biros, S. M.; Bridgewater, B. M.; Villeges-Estrada, A.; Tanski, J. M.; Parkin, G. Antimony ethelene glycolate and catecholate compounds: structural characterization ofpolyesterification catalysts. Inorg. Chem. 2002. 41: 4051-4057. [ Links ]
4. Yang, S.; Michielsen, S. Determination of the orientation parameters and the Raman tensor of the 998 cm-1 band of poly(ethylene terephthalate). Macromolecules. 2002. 35: 10108-10113. [ Links ]
5. Seymour, R. B.; Carraher Jr., C. E. Introducción a la ciencia de los polímeros. En: Introducciónalaquímica de polímeros. Primera edición. Barcelona, Reverte. 1995. pp. 1-20. [ Links ]
6. Brueckner, T.; Eberl, A.; Heumann, S.; Rabe, M.; Guebitz, M. G. Enzymatic and chemical hydrolysis of poly(ethylene terephthalate) fabrics. J. polym. Sci. Pol. Chem. 2008. 46: 6435-6443. [ Links ]
7. Arandes, J. M.; Iñaki, A.; López-Valerio, D.; Fernández, I.; Azkoiti, M. J.; Olazar, M.; Bilbao, J. Transformation of several plastic wastes into fuels by catalytic cracking. Ind. Eng. Chem. Res. 1997. 36: 4523-4529. [ Links ]
8. Díez, M. A.; Barriocanal C.; Álvarez, R. Plastics as modifiers ofther-moplasticity of coal. Energ. Fuel. 2005. 19: 2304-2316. [ Links ]
9. Petcore. Petcore publishes PET collection figures for 2009 - European PET bottle collection increases by more than. Disponible en: <http://www.petcore.org/22/10/2010>. [ Links ]
10. Yamaye, M.; Hashime, T.; Yama-moto, K.; Kosugi, Y.; Cho, N.; Ichi-ki, T.; Kito, T. Chemical recycling of poly(ethylene terephthalate). 2. preparation of terephthalohydroxamic acid and terephthalohydrazide. Ind. Eng. Chem. Res. 2002. 41: 3993-3998. [ Links ]
11. Yoshioka, T.; Motoki, T.; Okuwaki, A. Kinetics of hydrolysis of poly(ethylene terephthalate) powder in sulfuric acid by a modified shrinking-core model. Ind. Eng. Chem. Res. 2001. 40: 75-79. [ Links ]
12. Chih-Yu, K.; Ben-Zu, W.; Wu-Hsun, C. Kinetics of hydrolytic depolymerization of melt poly(ethylene terephthalate). Ind. Eng. Chem. Res.1998. 37: 1228-1234. [ Links ]
13. Ruvolo-Filho, A.; Curti, P. S. Chemical kinetic model and thermodynamic compensation effect of alkaline hydrolysis ofwaste poly(ethylene terephthalate) in nonaqueous ethylene glycol solution. Ind. Eng. Chem. Res. 2006. 44: 7985-7996. [ Links ]
14. Shanet, K.; Vicrunic, J. N.; Walter, K.; Trevor, W.; Rameshp, P. B.; Keely, C. M.; Blau, W.; O'Conorr, K. E. Up-cycling of PET (polyethylene terephthalate) to the biodegradable plastic PHA (polyhydroxyalkanoate). Environ. Sci. Technol. 2008. 42: 7696-7701. [ Links ]
15. PaszunD.; Tadeusz, S. (1997). Chemical recycling of poly(ethylene terephthalate). Ind. Eng. Chem. Res. 1997. 36: 1373-1383. [ Links ]
16. Buxbaum, L. H. The degradation of poly(ethylene terephthalate). Angew. Chem. Int. Ed.1968. 7 (3): 182-190. [ Links ]
17. Vyazovkin, S. Two types of uncertainty in the values of activation energy. J. Therm. Anal. Calorim. 2001. 64(2): 829-835. [ Links ]
18. Vyazovkin, S. Kinetic concepts of thermally stimulated reactions in solids: a view from a historical perspective. Int. Rev. Phys. Chem. 2000. 19 (1): 45-60. [ Links ]
19. Vyazovkin, S. Thermal analysis. Anal. Chem. 2002. 74 (12): 2749-2762. [ Links ]
20. Brown, M. E.; Dollimore, D.; Galwey, A. K. Reactions in solid state. Comprehensive chemical kinetics. Elsevier Science. 1980.22. pp. 340. [ Links ]
21. Sestak J. Thermophysical properties of solids. comprehensive analytical chemistry. Elsevier Science. 1984. 12. pp. 440. [ Links ]
22. Vyazovkin, S.; Wight, C.A. Model-free and model-fitting approaches to kinetic analysis ofisothermal and nonisothermal data. Thermochim. Acta. 1999. 340-341: 53-68. [ Links ]
23. Bourelle, F.; Safa, H. L. Studies on polyester packaging. Effects of basic washing on multi-use PET and PEN bottles. Packaging Technology and Science. 1999. 12: 67-74. [ Links ]
24. Climent, O. M. J.; García, G. H.; Ibarra, C. S.; Morera, B. I. Experimentación en química: química orgánica, ingeniería química. Valencia, Universidad Politécnica de Valencia. 2005. p. 211. [ Links ]
25. Mancini, S. D.; Zanin, M. Influência de meios reacionais na hidrólise de PET pós-consumo. Ciência e Ttecnologia. 2002. 12 (1): 34-40. [ Links ]
26. Hsiao, K. J.; Jen, Z. F.; Lu C. L. Analysis of physical properties of PET/CD-PET polyblend hollow fiber and its kinetics of alkaline hydrolysis. J. Appl. Polym. Sci. 2002. 86: 3601-3610. [ Links ]
27. Alavi, N. M. M.; Fatemeh N. Microwave-assisted depolymerization of poly(ethylene terephthalate) [PET] at atmospheric pressure. Adv. Polym. Tech. 2006.25(4): 242-246. [ Links ]
28. Siddiqui, M. N.; Achilias, D. S.; Redhwi, H. H.; Bikiaris, D. N.; Katsogiannis, A. G. K.; Karayannidis, P. G. Hydrolytic depolymerization of PET in a microwave reactor. Macromol. Mater. Eng. 2010 . 295: 575-584. [ Links ]