Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804On-line version ISSN 2357-3791
Rev.Colomb.Quim. vol.39 no.3 Bogotá Sept./Dec. 2010
EXTRACCIÓN DE RESIDUOS DE PLAGUICIDAS EN SUELOS ASISTIDA POR ULTRASONIDO
EXTRACTION OF PESTICIDE RESIDUES IN SOIL BY ULTRASOUND ASSISTED
EXTRAÇÃO DE RESÍDUOS DE PESTICIDAS EM SOLOS ASSISTIDA POR ULTRA-SOM
Andrea Mojica1, Jairo A. Guerrero1,2
1 Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia, sede Bogotá. Carrera 30 No. 45-03. Bogotá, Colombia.
Recibido: 31/05/10 - Aceptado: 22/11/10
RESUMEN
Se desarrolló un método multirresiduo para la determinación de diferentes tipos de plaguicidas en suelos. El proceso de extracción consistió en una doble extracción con acetato de etilo y metanol asistido con ultrasonido. Los plaguicidas fueron determinados por cromatografía de gases con detección por microcaptura de electrones (μ-ECD) y nitrógeno fósforo (NPD). Se evaluaron los porcentajes de recuperación de la metodología, en un rango de concentraciones entre 0,09 mg/kg y 14,60 mg/kg, y se determinó que la mayoría se encuentran entre 79% y 105%, a excepción de metamidofos, monocrotofos y oxadixyl, cuyos porcentajes de recuperación se encontraron entre 43% y 64%. Por otra parte, los límites de detección del método se encontraron en un rango de 0,02 mg/kg y 1,59 mg/kg, y los límites de cuantificación entre 0,07 mg/kg y 5,25 mg/kg. En el estudio de linealidad y precisión se encontraron resultados adecuados en el rango de concentración evaluado. Finalmente, se empleó esta metodología para evaluar los porcentajes de recuperación en 5 suelos de diferentes características fisicoquímicas.
Palabras clave: plaguicidas, suelo, método multirresiduo, validación, cromatografía de gases.
ABSTRACT
A multiresidue method for determination of pesticides in soil was developed by a double extraction process with ethyl acetate and methanol assisted with ultrasound. Pesticides were determined by gas chromatography with micro-electron capture detection (μ-ECD) and nitrogen phosphorus detection (NPD). The recovery values of the most of pesticides were between 79% and 105%, at concentration levels ranging 0.09-14.60 mg/kg, except for metamidophos, monochrotophos and oxadixyl, whose values were found at rates between 43% and 64%. The detection limits were rated at 0.02 mg/kg and 1.59 mg/kg. The quantification limits were between 0.07 mg/kg and 5.25 mg/kg. Linearity and precision studies showed adequate results in the concentration range evaluated. Finally, this methodology was used to evaluate recovery percentages in five soils with different physicochemical characteristics.
Keywords: pesticides, soils, multiresidual method, validation, gas chromatography.
RESUMO
Desenvolveu-se um método multi-residual para a determinação de diferentes tipos de agrotóxicos em solos. Realizou-se uma dupla extração com acetato de etilo e metanol assistido com ultra-som. Os agrotóxicos são determinados por cromatografia de gases com detecção por micro-captura de elétrons (μ-ECD) e nitrogênio fósforo (NPD). Avaliaram-se as porcentagens de recuperação do método, num grau de concentrações entre 0,09 mg/kg e 14,60 mg/kg. Foi determinado que estes se encontram entre 79% e 105%, a exceção de metamidofós, monocrotofós e oxadi-xil, cujas percentagens de recuperação encontraram-se entre 43% e 64%. Os limites de detecção da metodologia encontraram-se em um grau entre 0,02 mg/kg e 1,59 mg/kg e os limites de quantificação entre 0,07 mg/kg e 5,25 mg/kg. No estudo de linearidade e precisão da metodologia para todos os praguicidas, encontraram-se resultados adequados no grau de concentração avaliado. Finalmente, usou-se estametodologia para avaliar as percentagens de recuperação em 5 solos de diferentes características físico-químicas.
Palavra-chave: agrotóxicos, solo, método multi-resídual, validação, cromatografia de gases.
INTRODUCCIÓN
Desde el resurgimiento de los plaguicidas en la década de los cuarenta, son evidentes los grandes beneficios que ha presentado la utilización de estos compuestos para la lucha contra las plagas en la agricultura. Los resultados obtenidos en el mantenimiento y aumento de las cosechas han hecho que su empleo en la actualidad sea de tal magnitud, que para la mayoría de los usuarios, la utilización de otros métodos no sean una alternativa, por considerarse de menor efectividad.
El uso de los plaguicidas en la agricultura, ocasiona su liberación al medio ambiente, lo cual implica que se den procesos de descomposición y/o degradación en los diferentes compartimientos ambientales (1). Por otro lado, muchos de estos plaguicidas presentan tiempos de vida media altos, lo cual aumenta la posibilidad de encontrar residuos de estos compuestos en el aire, el agua, los sedimentos, la vegetación y los suelos (2, 3). Este hecho, unido al surgimiento en los últimos años de políticas de conservación del medio ambiente, ha dado lugar al desarrollo de diversas metodologías analíticas paralaextraccióny determinación de residuos de plaguicidas en diferentes matrices ambientales, entre estas el suelo (4, 5).
El método clásico para la determinación de estos residuos en suelo, corresponde a la extracción sólido-líquido con diferentes tipos de solventes; limpieza y posterior análisis por cromatografía de gases (6, 7). Tambiénse handesarrollado metodologías que requieren menores cantidades de solventes como es el caso de la extracción con fluidos supercríticos (8-10), extracción en fase sólida (SPE, por sus siglas en inglés) (11-14) y extracción asistida con microondas (15, 16). Los métodos cromatográficos brindan la mejor alternativa para el análisis simultáneo de varios compuestos o sus familias, por ejemplo, cromatografía de gases con detectores nitrógeno-fósforo (NPD) (17), captura de electrones (ECD) y espectrometría de masas (18, 19). En los últimos años se han planteado excelentes alternativas mediante el empleo de cromatografía líquida de alta eficiencia acoplada a espectrometría de masas.
En el presente trabajo se muestran los resultados en el análisis de 19 plaguicidas mediante doble extracción con acetato de etilo y metanol, asistida con ultrasonido, y su empleo en la evaluación de los porcentajes de recuperación en suelos con diferentes características fisicoquímicas. La determinación de estos plaguicidas se realizó por cromatografía de gases con detección por μECD y NPD.
MATERIALES Y MÉTODOS
Materiales de referencia, reactivos y soluciones
Los estándares de plaguicidas empleados en este trabajo fueron obtenidos del Dr. Ehrenstorfer y de Chemservice, cada uno de estos con una pureza superior a 95%.
Las soluciones madre fueron preparadas con concentraciones cercanas a 500 mg/mL en acetato de etilo, y fueron almacenadas en frascos ámbar a -20 °C. La mezcla de plaguicidas se preparó en acetato de etilo tomando diferentes volúmenes de cada una de las soluciones madre, hasta obtener un rango de concentraciones entre 1,5 μg/mL y 44 μg/mL. Esta se almacenó en frascos ámbar a -20 °C. Todos los solventes empleados en este estudio fueron J. T. Baker grado residuos.
Instrumentos y equipos
El proceso de extracción de plaguicidas se realizó mediante una extracción sólido-líquido asistida por ultrasonido; para ello, se empleó un equipo marca Elma con una frecuencia de 35 kHz o potencia absorbida de 30 vatios.
La determinación de los plaguicidas estudiados se realizó por cromatografía de gases con un equipo HP6890 plus con inyector automático 7683 Agilent Technologies (Palo Alto, CA, EUA) con control electrónico de presión, equipado con inyector split/splitless conectado a un divisor de flujo (Y) de borosilicato unido a una columna capilar HP-5 ( 30 m, 0,32 mm d.i, 0,25 μm) acoplada a un detector de microcaptura electrónica μ -ECD63Ni y una columna capilar HP-50 (30 m, 0,32 mm d.i, 0,25 μm) acoplada a un detector de nitrógeno-fosforo NPD en paralelo. Las condiciones cromatográficas empleadas en el análisis de los plaguicidas fueron las siguientes: volumen de inyección 2 μL, inyección en modo splitless pulsado con presión de pulso de 65 psi durante 0,8 min, tiempo de purga de 0,6 min, flujo de purga 40 mL/min y temperatura de inyector de 256 °C. El gas de transporte fue nitrógeno, el programa de temperatura en el horno fue de 52 °C (0 min) a 100 °C a una velocidad de 4 °C/min, consecutivamente se incremento la temperatura hasta 110 °C a 2 °C/min, a continuación se incremento hasta 130 °C a una velocidad de 20 °C/min, luego se llevó hasta 195 °C a 4 °C/min y, finalmente, se alcanzó una temperatura de 280 °C a una velocidad de 5 °C/min. El tiempo total del análisis fue de 64,25 min.
Metodología de extracción
Muestra y preparación de suelo blanco
La muestra de suelo blanco, libre de plaguicidas, se tomó del horizonte superficial a una profundidad de 0-20 cm en las inmediaciones de la Universidad Nacional de Colombia, sede Bogotá, cuyo suelo no tiene historia de aplicación de plaguicidas. Se secó a temperatura ambiente, se eliminaron ramas, hojas y piedras y se tamizó por una malla n°. 10 (2 mm U.S. Standard Sieve Series). El suelo fue caracterizado como un suelo franco arcilloso (20,88% arena, 46,88% arcilla y 32,24% limo) con un bajo contenido de materia orgánica (3,24%), con una humedad de 4,04% y un pH en suelo saturado de 5,29.
Muestras fortificadas: se tomaron 5 g de muestra, se adicionó 1 mL de la mezcla de plaguicidas y se dejó en reposo durante 20 min. Al cabo de este tiempo, se adicionaron 30 mL de acetato de etilo y la solución se llevó al ultrasonido durante 30 min. Luego de la extracción la fracción de solvente se filtró sobre sulfato de sodio anhidro y se recolectaron 15 mL de extracto. La fracción de suelo se secó con corriente de nitrógeno y se adicionaron 30 mL de metanol para realizar una segunda extracción con el ultrasonido durante 30 min. El extracto metanólico se filtró sobre sulfato de sodio anhidro y se recolectaron 15 mL de este. Las fracciones de acetato de etilo y metanol se reunieron y se concentraron en el evaporador rotatorio a una temperatura de 35 °C. La fracción concentrada se llevó a sequedad con corriente de nitrógeno. Se realizó una transferencia cuatitativa a un balón aforado de 2 mL con acetato de etilo. Por último, se realizó una dilución de 0,25 mL a 2 mL y se inyectó la solución en el sistema cromatográfico (20).
Validación de la metodología
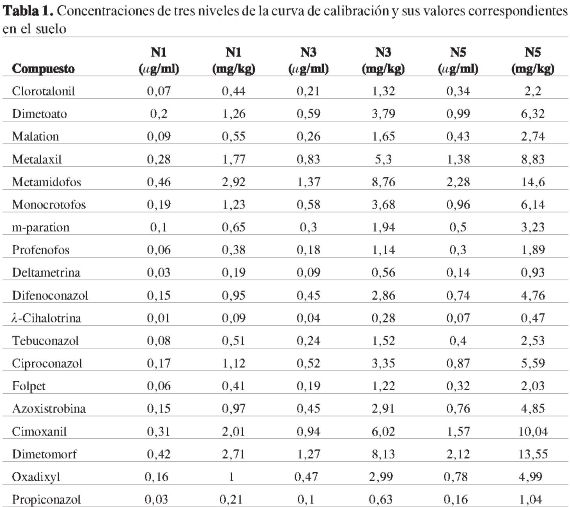
Para realizar la validación de la metodología se evaluó la especificidad y la selectividad. Para ello, se utilizaron blancos de matriz y blancos de matriz fortificados con plaguicidas. Para evaluar la exactitud y la precisión se fortificaron muestras de suelo con tres diferentes niveles de concentración. La Tabla 1 presenta las concentraciones de los plaguicidas en los niveles de concentración 1, 3y5delacurva de calibración, ylos valores correspondientes a las muestras fortificadas en el suelo.
La evaluación de la linealidad se realizó mediante la elaboración de una curva de calibración de 5 niveles con 3 réplicas por cada nivel. Los límites de detección y cuantificación se obtuvieron mediante la evaluación de la relación señal/ruido y posterior fortificación del suelo blanco con las concentraciones estimadas para evaluar la exactitud y la precisión de estos límites críticos. Finalmente, para evaluar la robustez del método se empleó el modelo de Youden Steiner.
RESULTADOS Y DISCUSIÓN
Especificidad y selectividad
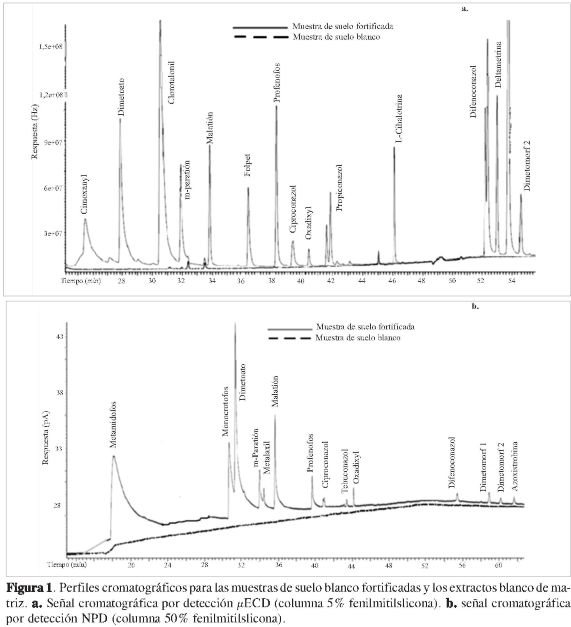
La Figura 1 presenta los cromatogramas de un blanco de matriz y un nivel 2 de la curva de calibración de la mezcla de plaguicidas en extracto de blanco de matriz. La evaluación de la especificidad de la metodología se estableció observando la presencia de señales cromatográficas en el blanco de matriz en los mismos tiempos de retención que los plaguicidas estudiados. En la Figura 1, se puede observar que no se encuentran señales cro-matográficas considerables y/o interferentes en ninguno de los detectores para los blancos de suelo inyectados, lo cual indica que la metodología es específica para los compuestos de interés. De otra parte, bajo las condiciones cromatográficas empleadas se muestra que la metodología es selectiva, ya que todas las señales cromatográficas se encuentran separadas (resolución superior a 1,5). Es importante resaltar que azoxistrobin y dime-tomorf no se pudieron separar en la columna 5% fenilmetilsilicona, pero en la columna 50% fenilmetil silicona sí se presentó una resolución satisfactoria.
Finalmente, cabe destacar que el método desarrollado proporciona extractos de blanco de matriz sin interferencias, por lo que la metodología no requiere una limpieza adicional del extracto.
Precisión
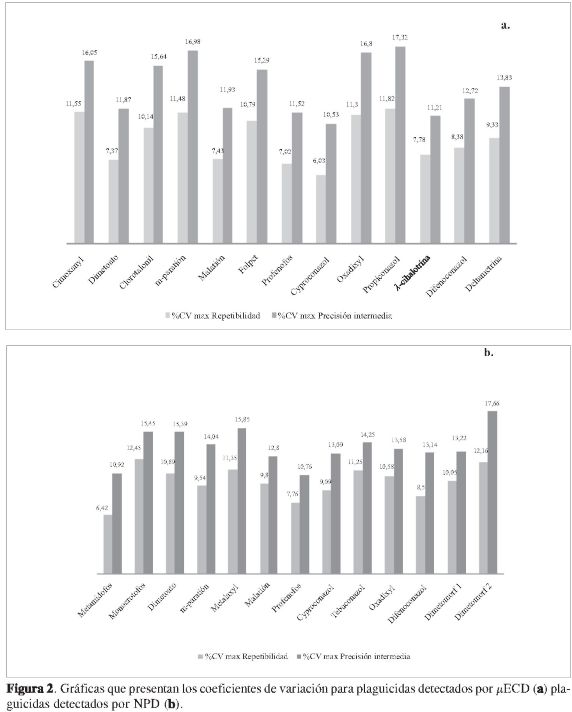
Este parámetro de validación se evaluó por medio de estudios de repetibilidad y precisión intermedia con muestras de suelo blanco fortificadas en un rango de concentración comprendido entre 0,09 mg/kg y 14,60 mg/kg. En la Figura 2 se observa que tanto en los estudios de precisión intermedia como en los de repetibilidad, las mayores dispersiones se presentan para cimoxanyl, clorotalonil, m-paratión, folpet, oxadixyl y propiconazol (detectados por μECD) y monocrotofos, metalaxyl, dimetoato y dimetomorf (detectados por NPD). En las pruebas de repetibilidad, la relación HorRat presentó valores menores que 2 para los plaguicidas estudiados, indicando que la metodología es precisa para los compuestos analizados (21). Por su parte, aunque en los estudios de precisión intermedia, compuestos como cimoxanyl, m-paratión, folpet y oxadixyl presentan un valor de la relación HorRat mayor que 2, guías de validación de metodologías analíticas de la Unión Europea establecen que en el análisis de residuos, con menores concentraciones, se presentan mayores porcentajes de CV, y para las concentraciones estudiadas estas deben ser inferiores a 20% (22). Estas variaciones se pueden atribuir a fenómenos de dispersión y perturbaciones en las respuestas cromatográficas con la estabilidad del sistema cromatográfico (23), pues estos 4 compuestos se caracterizan por ser sensibles a procesos de adsorción y/o descomposición tanto en el puerto de inyección como en la columna cromatográfica (24, 25).
Efecto matriz (26)
Para realizar la determinación del efecto matriz se prepararon curvas de calibración en solvente y en extracto blanco de suelo. Cada una de las curvas estaba constituida por 5 niveles de calibración, y cada uno de estos niveles presentaba 3 réplicas. De esta manera, para determinar la presencia de efecto matriz se realizó una prueba pareada que se contrasta con el estadístico t Student; por medio de esta prueba se encontró que 17 señales croma-tográficas (de un total de 27 señales) presentaron diferencias significativas (α=0,05), entre las respuestas en solvente y las respuestas en matriz, lo cual evidencia la presencia del efecto matriz. Es por ello que se hace indispensable preparar las curvas de calibración en extracto blanco de matriz.
Linealidad
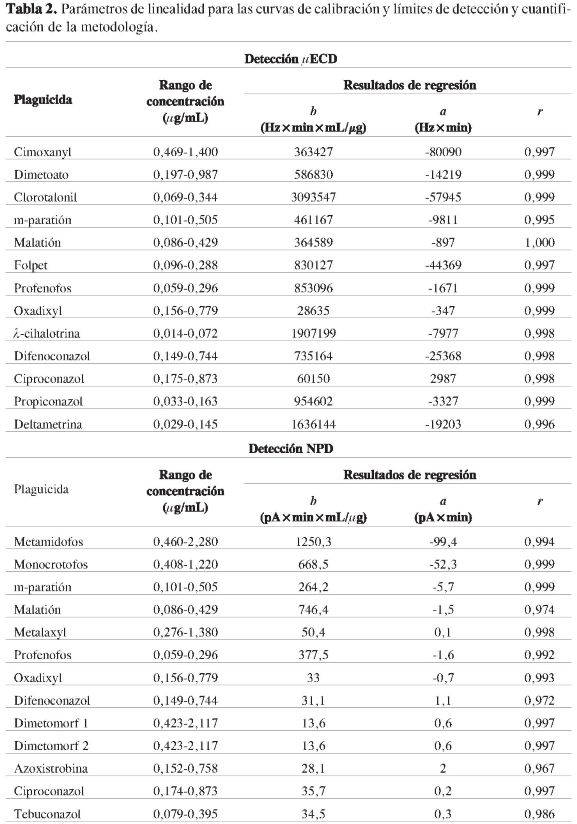
La linealidad de los plaguicidas fue determinada preparando curvas de calibración en extracto blanco de suelo; la respuesta para todos los plaguicidas fue lineal en el rango de concentraciones evaluado.
En la Tabla 2 se presenta el rango de concentración para cada uno de los plaguicidas estudiados, los valores del intercepto y de la pendiente (a y fe), así como el valor del coeficiente de correlación de Pearson (r). Todos los análisis estadísticos se realizaron mediante el paquete estadístico SAS®.
Por medio de una prueba t Student (a=0,05) se encontró que existía correlación lineal entre la respuesta del detector y la concentración del plaguicida para todos los compuestos en estudio. Para establecer si la regresión es significativa y si se presenta falta de ajuste o desvío de la linealidad, se realizó un análisis de varianza (Anava), a partir del cual se encontró que para todas las curvas de calibración se tiene que la regresión lineal es significativa (α=0,05), y en ningún caso se presentó desvío de linealidad. Por otro lado, para los interceptos y las pendientes de las curvas de calibración, se estableció mediante una prueba t Student (α=0,05), que los interceptos son estadísticamente iguales a cero y las pendientes son estadísticamente diferentes a cero.
Exactitud
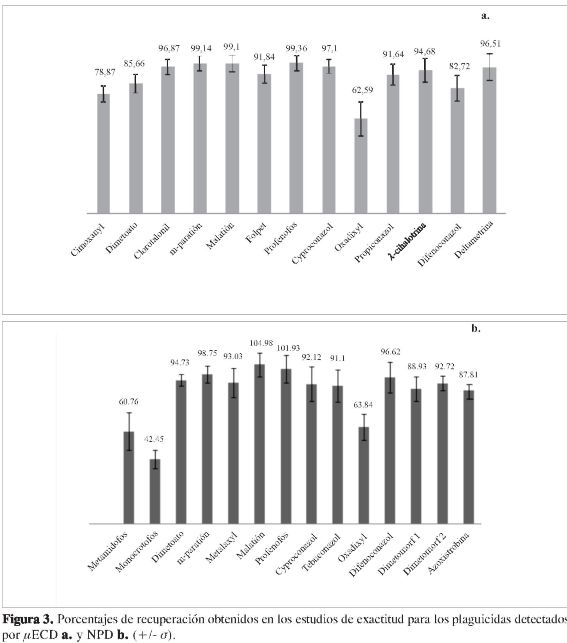
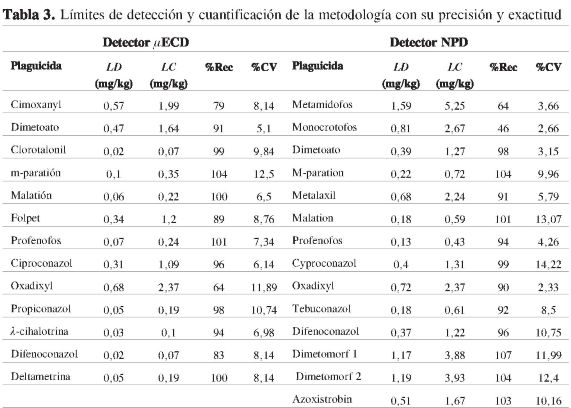
La exactitud de la metodología se evaluó mediante la determinación del porcentaje de recuperación en muestras blanco fortificadas en el rango de concentración comprendido entre 0,09 mg/kg y 14,60 mg/kg. En la Figura 3 se presentan los valores obtenidos para los porcentajes de recuperación; se observa que para la mayoría de compuestos se presentan recuperaciones superiores a 70%, lo cual indica que la metodología presenta valores de exactitud adecuados (27). Solo para el caso de metamidofos, monocrotofos y oxadixyl se encontraron porcentajes de recuperación entre 42% y 64%.
Por medio de la prueba estadística de Levenne, se estableció que se presenta homogeneidad de varianzas entre los diferentes niveles de concentración evaluados, es decir que la variabilidad de los resultados no se ve afectada por la concentración. Por su parte, mediante el estadístico t Student se encontró que los compuestos metamidofos, monocrotofos, dimetoato, metalaxyl, ciproconazol, tebuconazol, oxadixyl, dimetomorf y azoxistrobina presentan diferencias significativas con respecto a un 100% de recuperación (α=0,05), lo cual indica que para estos plaguicidas posiblemente se presentan pérdidas en el proceso de extracción.
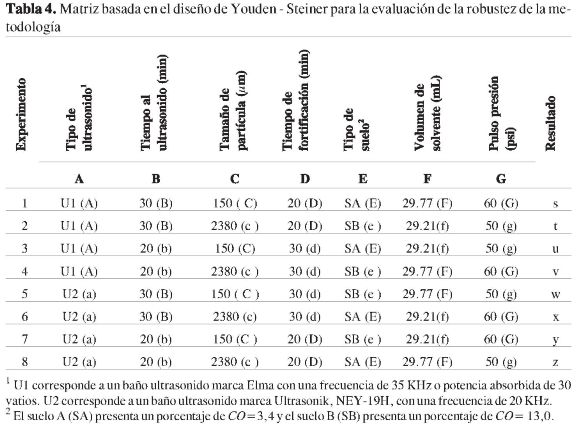
Límites de detección y cuantificación
La determinación de límites de detección (LD) y cuantificación (LC) se realizó de acuerdo con la aproximación propuesta por la Environmental Protective Agency US (US EPA) (28), la cual indica hacer una estimación previa del límite de detección y el límite de cuantificación con el valor promedio del ruido de cinco réplicas del blanco de matriz y luego corroborar estas concentraciones experimentalmente. Mediante el empleo de las relaciones 1y2se realizó la estimación correspondiente.

Donde: C = concentración del nivel 1 (μg/mL) y h = altura del pico cromato-gráfico.
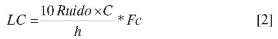
Donde: C = concentración del nivel 1 (μg/mL); Fc = factor de corrección del porcentaje de recuperación y h = altura del pico cromatográfico.
En la Tabla 3 se presentan los valores para LD y LC encontrados, así como su precisión y exactitud. En esta tabla se puede observar que los valores obtenidos en los ensayos de recuperación para las muestras fortificadas a las concentraciones correspondientes al LC, se encuentran entre 70% y 110%, y los coeficientes de variación son menores que 20%, lo cual es acorde con lo establecido en la literatura (29).
Los valores encontrados para los límites de detección y cuantificación se encuentran del mismo orden que los reportados por diversos autores para las metodologías de extracción de plaguicidas en suelos con solventes y detectores convencionales (17-18).
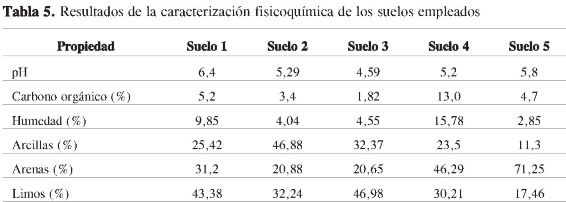
Robustez
Para evaluar la robustez, se seleccionaron 7 factores determinantes que podrían ser críticos en el desarrollo de la metodología y se hicieron variaciones a los valores establecidos en el método. Se aplicó el diseño experimental de Youden-Steiner (30) y se analizó la influencia de cada factor sobre el porcentaje de recuperación de los analitos. Para determinar la influencia de cada una de las variables ingresadas al modelo, se comparó la diferencia de medias obtenida en el cambio efectuado para ese parámetro y la expresión S √2, donde S corresponde a la desviación estándar obtenida en el ensayo de repetibilidad del método. La Tabla 4 muestra las variables y los cambios realizados en cada una de estas. Este ensayo mostró que la metodología propuesta es robusta frente a los factores estudiados.
Evaluación de la metodología con suelos de diferentes características fisicoquímicas
Para evaluar el comportamiento de la metodología desarrollada frente a suelos de diferentes características fisicoquímicas, se realizó un diseño completamente al azar con cinco réplicas para cada tratamiento. Para ello, se fortificó con la mezcla de plaguicidas con un nivel 2 de la curva de calibración, cada uno de los suelos que se presenta en la Tabla 5.
El objetivo de este ensayo fue determinar si se presentan diferencias significativas en los porcentajes de recuperación, con diversos tipos de suelos, empleando la metodología desarrollada. El procesamiento de los resultados obtenidos se realizó mediante el paquete estadístico SAS® ysetrabajócon un nivel de confianza de 95%.
Para el análisis estadístico se realizó un análisis de varianza, y de acuerdo con los resultados encontrados (si P<0,05), se realizó una prueba de Tukey (α=0,05), con el propósito de identificar el o los suelos que ocasionaban las diferencias.
Para el Anava se establecieron las siguientes hipótesis:
H0: no hay diferencias significativas en los porcentajes de recuperación para los diferentes suelos estudiados.
H1: existen diferencias significativas en el porcentaje de recuperación para al menos un suelo.
Se encontró que para folpet, metamido-fos, metalaxil, tebuconazol, dimetomorf, ciproconazol y oxadixyl no se presentaron diferencias significativas por medio de Anava, lo que indica que el porcentaje de recuperación para estos compuestos no se ve afectado por el tipo de suelo.
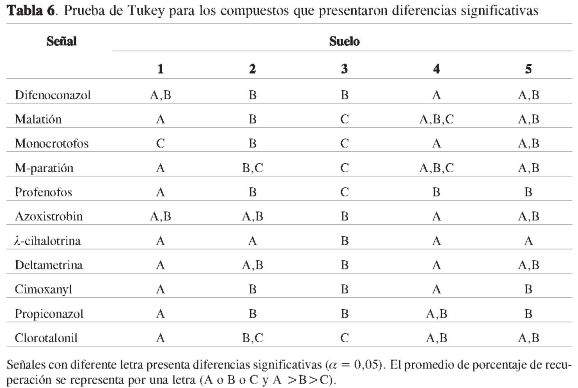
La Tabla 6 muestra los resultados de la prueba de Tukey para los compuestos en los que hubo diferencias significativas mediante Anava.
La Tabla 6 muestra que compuestos como malatión, monocrotofos, m-paratión, profenofos y clorotalonil, presentan tres diferentes promedios, es decir, presentan tres porcentajes de recuperación con diferencias estadísticas (α=0,05), esto indica que la exactitud de la metodología para estos compuestos se ve afectada por el tipo de suelo.
En la Tabla 6 se muestra que para el suelo 1 se tiene la mayoría de las veces el mayor porcentaje de recuperación (mayor número de veces la letra A únicamente), esto hace pensar que debido a las propiedades fisicoquímicas de este suelo, se presenta una menor interacción de los plaguicidas con este y, por consiguiente, se obtienen mayores porcentajes de recuperación. Por su parte, para los suelos 2, 4 y 5, solamente para monocrotofos se presentan diferencias estadísticas en los porcentajes de recuperación, lo cual indica que para estos suelos la exactitud de la metodología es independiente de las propiedades fisicoquímicas de estostressuelos.
El suelo 3 presenta la mayor frecuencia de porcentajes de recuperación bajos (mayor número de veces la letra C), lo cual implica que de alguna manera este suelo afecta el proceso de extracción, bien sea (i) adsorbiendo los plaguicidas en mayor proporción; (ii) afectando el proceso de transferencia de masa hacia el solvente de extracción, debido a una mayor compactación o a sus propiedades texturales; (iii) mayores interacciones específicas con las arcillas favorecidas por su bajo contenido de materia orgánica; y/o (iv) posible degradación de algunos plaguicidas, lo que se reflejaría en su porcentaje de recuperación.
Finalmente, aunque se presentaron diferencias estadísticas para varios compuestos, se encuentra que en general los porcentajes de recuperación de la metodología propuesta no cambian de manera desfavorable, pues ninguno de los compuestos, a excepción de los ya conocidos, presentaba valores inferiores a 70%, es decir, la exactitud de la metodología es independiente del tipo de suelo.
CONCLUSIONES
Se encontró que la metodología desarrollada es específica, selectiva y presenta una exactitud entre 79% y 105%, a excepción de metamidofos, monocrotofos y oxadixyl, para los cuales se encontraron porcentajes inferiores a 70%. En los estudios de repetibilidad se encontró que todos los plaguicidas presentan porcentajes de CV inferiores a 20%. Por otro lado, se encontró que los límites de detección se encuentran entre 0,02 mg/kg-1,59 mg/kg, y los límites de cuantificación entre 0,07 mg/kg-5,25 mg/kg. Finalmente, aunque las pruebas de robustez indicaron que la metodología no se ve afectada por las variables estudiadas, se encontró que los porcentajes de recuperación cambian con las propiedades fisicoquímicas de los suelos, pero la metodología no deja de ser exacta para el análisis de residuos de plaguicidas en suelos.
AGRADECIMIENTOS
Expresamos nuestro agradecimiento al Departamento de Química de la Universidad Nacional de Colombia, sede Bogotá, y a la Agencia Internacional de Energía Atómica (IAEA).
REFERENCIAS BIBLIOGRÁFICAS
1. Vanclooster, M.; Boesten, J. J. T. I. Application of pesticide simulation models to the Vredepeel dataset: I. water, solute and heat transport. Agricultural Water Management. 2000. 44 (1-3): 105-117. [ Links ]
2. Zhang, R.; Krzyszowska-Waitkus, A. J.; Vance, G. F.; Qi, J. Pesticide transport in field soils. Advances in Environmental Research. 2000. 4 (1): 57-65. [ Links ]
3. Arias-Estévez, M.; López-Periago, E.; Martínez-Carballo, E.; Simal-Gándara, J.; Mejuto, J-C.; García-Río, L. The mobility and degradation of pesticides in soils and the pollution of groundwater resources. Agriculture, Ecosystems & Environment. 2008. 123 (4): 247-260. [ Links ]
4. Motohashi, N.; Nagashima, H.; Párkányi, C.; Subrahmanyam, B.; Zhang, G-W. Official multiresidue methods of pesticide analysis in vegetables, fruits and soil. J Chroma-togrA. 1996. 754 (1-2): 333-346. [ Links ]
5. Lesueur, C.; Gartner, M.; Mentler, A.; Fuerhacker, M. Comparison of four extraction methods for the analysis of 24 pesticides in soil samples with gas chromatography-mass spectrometry and liquid chromatography-ion trap-mass spectrometry. Talanta. 2008. 75 (1): 284-293. [ Links ]
6. Babic, S.; Petrovic, M.; Kastelan-Macan, M. Ultrasonic solvent extraction of pesticides from soil. J ChromatogrA. 1998.823(1-2): 3-9. [ Links ]
7. Concha-Graña, E.; Turnes-Carou, M. I.; Muniategui-Lorenzo, S.; López-Mahía, P.; Fernández-Fernández, E.; Prada-Rodríguez, D. Development of pressurized liquid extraction and cleanup procedures for determination of organochlorine pesticides in soils. J Chromatogr A. 2004. 1047 (1): 147-155. [ Links ]
8. Gonçalves, C.; Carvalho, J. J.; Azenha, M. A.; Alpendurada, M. F. Optimization of supercritical fluid extraction of pesticide residues in soil by means of central composite design and analysis by gas chromatography-tandem mass spectrometry. J Chromatogr. A. 2006. 1110 (1-2): 6-14. [ Links ]
9. Kreuzig, R.; Koinecke, A.; Bahadir, M. Use of supercritical fluid extraction in the analysis of pesticides in soil. J. Biochem. Biophys. Methods. 2000. 43 (1-3): 403-409. [ Links ]
10. Van der Velde, E. G.; Dietvorst, M.; Swart, C. P.; Ramlal, M. R.; Kootstra, P. R. Optimization of supercritical fluid extraction of organochlorine pesticides from real soil samples. J Chromatogr. A. 1994. 683 (1): 167-174. [ Links ]
11. Zhu, X.; Yang, J.; Su, Q.; Cai, J.; Gao, Y. Selective solid-phase extraction using molecularly imprinted polymer for the analysis of polar or-ganophosphorus pesticides in water and soil samples. J Chromatog. A. 2005. 1092 (2): 161-169. [ Links ]
12. Bouaid, A.; Ramos, L.; Gonzalez, M. J.; Fernández, P.; Cámara, C. Solid-phase microextraction method for the determination of atrazine and four organophosphorus pesticides in soil samples by gas chromatography. J Cromatogr A. 2001. 939 (1-2):13-21. [ Links ]
13. Ruiz, M. J.; Redondo, M. J.; Font, G. Solid-phase extraction disks for determining pesticides from soil leachates. J Chromatogr. A. 1997. 776 (2): 348-354. [ Links ]
14. Asensio-Ramos, M.; Hernández-Borges, J.; Borges-Miquel, T. M.; Rodríguez-Delgado, M. A. Evaluation of multi-walled carbon nanotubes as solid-phase extraction adsorbents of pesticides from agricultural, ornamental and forestal soils. Anal. Chim. Acta. 2009. 647 (2):167-176. [ Links ]
15. Fuentes, E.; Báez, M. E.; Labra, R. Parameters affecting microwave-assisted extraction of organophosphorus pesticides from agricultural soil. J Chromatogr. A. 2007. 1169 (1-2): 40-46. [ Links ]
16. Fuentes, E.; Báez, M. E.; Reyes, D. Microwave-assisted extraction through an aqueous medium and simultaneous cleanup by partition on hexane for determining pesticides in agricultural soils by gas chromatography: a critical study. Anal. Chim. Acta. 2006. 578 (2): 122-130. [ Links ]
17. Kj0lholt, J. Determination of trace amounts of organophosphorus pesticides and related compounds in soils and sediments using capillary gas chromatography and a nitrogen-phosphorus detector. J Chromatogr. A. 1985. 325: 231-238. [ Links ]
18. Wang, X.; Zhao, X.; Liu, X. Homogeneous liquid-liquid extraction combined with gas chromatography-electron capture detector for the determination of three pesticide residues in soils. Anal. Chim. Acta. 2008. 620 (1-2): 162-169. [ Links ]
19. Sánchez-Brunete, C.; Miguel, E.; Tadeo, J. L. Multiresidue analysis of fungicides in soil by sonication-assisted extraction in small columns and gas chromatography. J Chromatogr. A. 2002. 976 (1-2): 319-327. [ Links ]
20. Mojica, A.; Guerrero, J. A. Extraction procedure for pesticide analysis in soil. En: 2nd Latin American Pesticide Residue Workshop. Food and Environment. Santa Fe-Argentina: Poster. 2009. [ Links ]
21. Horwitz-William, R. A. The horwitz ratio (HorRat): a useful index ofmethod performance with respect to precision. J. AOAC Int. 2006. 89 (4): 1095-1109. [ Links ]
22. SANCO. Method Validation and quality control procedures for pesticide residues analysis in food and feed. 2009. [cited 2009 28 Noviembre]. Disponible en: http://ec.europa.eu/food/plant/protection/resources/qualcontrol_en.pdf. [ Links ]
23. Berezkin, V. G. Capillary gas adsorption chromatography. Verlag GmbH, Wiley-VCH. 2002. pp. 247. [ Links ]
24. Kirchner, M.; Húsková, R.; Matisová, E.; Mocák, J. Fast gas chromatography for pesticide residues analysis using analyte protectants. J Chromatogr. A. 2008. 1186 (1-2): 271-280. [ Links ]
25. Ahumada, D.; Guerrero, J. A. Estudio del efecto matriz en el análisis de plaguicidas por cromatografía de gases. VITAE, 2010. 17 (1): 51-58. [ Links ]
26. Hajlová, J.; Holadová, K.; Kocourek, V. Matrix-induced effects: a critical point in the gas chromatographic analysis of pesticide residues. J Chromatogr. A. 1998. 800 (2): 283-295. [ Links ]
27. Hernández-Borges, J.; Cabrera, J.; Rodríguez Delgado, M. A.; Hernández-Suarez, E. M.; Galán, V. Analysis of pesticide residues in bananas harvested in the Canary Islands (Spain). Food Chemistry, 2009. 113 (1): 313-319. [ Links ]
28. Lee, P. W. Handbook of residue analytical methods for agrochemicals. Reino Unido, Jonh Wiley & Sons. 2003. p. 352. [ Links ]
29. Guidance Document on Estimating Persistence and Degradation Kinetics from Environmental Fate Studies on Pesticides in EU Registration. Report ofthe FOCUS Work Group on Degradation Kinetics, 2005. EC Document Reference Sanco/10058/2005 version 2.0. [ Links ]
30. Aguirre, L.; García, T.; Illera, M.; Juncadella, M. Validación de métodos analíticos AEFI. Madrid, Asociación Española de Farmaceúticos de la Industria. 2001. p. 87. [ Links ]