Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804On-line version ISSN 2357-3791
Rev.Colomb.Quim. vol.39 no.3 Bogotá Sept./Dec. 2010
INFLUENCIA DEL pH SOBRE LA ADSORCIÓN EN CARBÓN ACTIVADO DE Cd(II) Y Ni(II) DESDE SOLUCIONES ACUOSAS
INFLUENCE OF THE pH ON THE ADSORPTION IN ACTIVATED CARBON OF Cd(II) Y Ni(II) FROM AQUOEOUS SOLUTIONS
INFLUÊNCIA DO PH SOBRE A ADSORÇÃO EM CARVÃO ATIVADO DE Cd(II) E Ni(II) DESDE SOLUÇÕES ACUOSAS
Paola Rodríguez1, Liliana Giraldo1,2, Juan Carlos Moreno3
1 Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia, sede Bogotá. Bogotá, Colombia.
3 Departamento de Química, Facultad de Ciencias, Universidad de los Andes. Bogotá, Colombia.
Recibido: 02/08/10 - Aceptado: 22/11/10
RESUMEN
La adsorción de iones Cd(II) y Ni(II) desde soluciones acuosas sobre carbón activado se estudia con diferentes valores de pH. La adsorción de los iones se realiza en dos condiciones de pH de la solución: en la primera el pH varía en el transcurso del proceso a medida que los iones se adsorben y en la segunda el pH se mantiene fijo durante la adsorción.
Cuando no se realiza un control en el pH de la solución se observan incrementos en la concentración de los iones hidronio que alcanzan un valor máximo alrededor de pH 4, para los dos iones, y cuyos valores son de 346 mmol mL1 para el caso de la adsorción de Cd(II) y de 436 mmol mL-1 para el Ni(II).
Para todos los valores de pH y las dos condiciones del proceso de adsorción se observa una mayor cantidad de Ni(II) adsorbida con valores entre 0,04 y 0,42 mmol.g-1, mientras que para el Cd(II) la máxima cantidad adsorbida es de 0,16 mmol.g1.
El aumento de los iones hidronio en las soluciones de Cd(II) y Ni(II), en las que no se controla el valor del pH, favorece el proceso de adsorción, en tanto que al mantener un pH fijo en la solución, se obtienen adsorciones menores de los iones.
Palabras clave: carbón activado, pH de la solución, solución de Ni(II), solución de Cd(II), concentración de H+, isoterma de adsorción.
ABSTRACT
The Cd (II) and Ni(II) ions adsorption from aqueous solutions on activated carbon is studied to different values of pH. The ions adsorption is carried out under two conditions of pH solution: in the first one, the pH changes in the course of the process as the ions are adsorbed; in the second one, the pH is kept fixed during the adsorption.
When the solution is not controlled, the hydronium ions concentration increases, reaching a maximum value around a pH of 4, for both ions, whose values are of 346 mmolmL-1 for the case of the adsorption of Cd (II) and of 436 mmol.mL-1 for Ni(II).
For all the pH values and the two conditions of the adsorption process, much more quantity of Ni (II) is adsorbed with values between 0.04 and 0.42 mmol.g-1, while for the Cd (II) the maximum amount adsorbed is 0.16 mmol.g-1.
The increase of the hydronium ions in the Cd(II) and Ni(II) solutions, in which the value of the pH is not controlled, helps the process of adsorption, while keeping pH fixed in the solution, ions are adsorbed in a less quantity.
Keywords: activated carbon, solution pH, Ni(II) solution, Cd(II) solution, H+ concentration, adsorption isotherm.
RESUMO
Neste artigo se estuda a adsorção de iones Cd(II) e Ni(II) de soluções aquosas sobre carvão ativado a diferentes valores de pH. A adsorção dos iones se realiza baixo duas condições de pH da solução: na primeira o pH varia em decorrência do processo à medida que os iones se adsorvem; na segunda o pH se mantém fixo durante a adsorção.
Quando não se realiza um controle no pH da solução se observam incrementos na concentração de iones hidrónio, que atinge um valor máximo arredor de pH 4, para os dois iones, cujos valores são 346 mmolmL-1 para o caso da adsorção de Cd(II) e 436 mmol.mL-1 para o Ni(II).
Para todos os valores de pH e as duas condições do processo de adsorção se observa uma maior quantidade de Ni(II) adsorvida com valores entre 0,04 e 0,42 mmol.g-1, enquanto para o Cd(II) a máxima quantidade adsorvida é 0,16 mmol.g-1.
O aumento dos iones hidrónio nas soluções de Cd(II) e Ni(II), nas que não se controla o valor do pH, favorece o processo de adsorção; enquanto ao manter um pH fixo na solução se obtêm adsorções menores dos iones.
Palavra-chave: carvão ativado, pH da solução, solução de Ni(II), solução de Cd(II), concentração de H+, isotermas de adsorção.
INTRODUCCIÓN
La capacidad de adsorción de un carbón activado no depende únicamente de la textura porosa o del área superficial, los grupos quimicos presentes en la superficie de un carbón activado son otro factor importante en el proceso de adsorción. Debido a la presencia de heteroátomos en las capas de carbono, pueden llegar a coexistir grupos superficiales de carácter ácido y básico, que afectan el carácter hidrófobo del carbón activado (1-5). El hecho de que un carbón sea de carácter ácido o básico dependerá tanto de la concentración de grupos como de la fuerza de estos; las propiedades ácidas de la superficie de los carbones activados se presentan por la presencia de grupos carboxilos, algunos en su forma de anhídridos cíclicos, por lactonas o lactoles y por grupos hidroxilo de carácter fenólico, en tanto que una razón para el carácter básico de la superficie de los carbones activados se atribuye a electrones π de las capas grafénicas (2, 6).
La modificación química de la superficie del carbón activado es de gran interés para producir materiales con aplicaciones específicas. Este tratamiento se ha realizado principalmente por oxidación, que produce una estructura hidrofílica con un número elevado de grupos que contienen oxígeno. Los reactivos que generalmente son utilizados para la modificación de los carbones activos son: HNO3,H2SO4, NaClO, KMnO4,K2Cr2O7,H2O2 yO3,con lo cual se consigue que la adsorción se produzca por interacciones químicas (7-10).
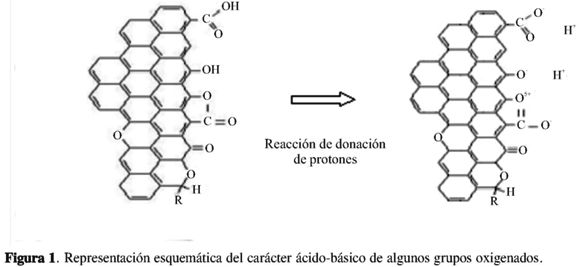
En la superficie del carbón activado se presenta un intercambio iónico de los grupos ácidos al liberar protones, especialmente en medio básico, y de los grupos básicos que tienden a captarlos cuando se encuentran en un medio ácido, lo que genera cargas positivas o negativas en la superficie del carbón. De forma general, se podría decir que si el pH del medio es mayor que el punto de carga cero del carbón, pH > pHPCC, se tiene un predominio de las cargas negativas en la superficie del carbón; por el contrario, si pH < pHPCC, se obtiene una superficie cargada positivamente (11). Así pues, las condiciones en las que un carbón activado tiene una carga neta negativa serán preferibles para adsorber cationes, y aquellas en las que presente una carga neta positiva lo serán para adsorber aniones. En la Figura 1 se encuentra una representación esquemática del carácter ácido-básico de algunos grupos oxigenados, y cómo estos producen en el medio iones hidronio (12).
Adsorción de iones
La adsorción de iones desde una solución acuosa por carbón activado es causada por las interacciones entre los iones en solución y los grupos funcionales presentes en la superficie del carbón activado, lo cual depende del pH de la solución (13, 14). En general, la adsorción de iones metálicos es atribuida a dos factores fundamentales: a las interacciones electrostáticas entre los iones y la superficie del carbón activado y a las interacciones químicas específicas entre los iones y los complejos superficiales. Por esta razón, se puede considerar que la eliminación de metales pesados mediante el proceso de adsorción con carbón activado es debida a la formación de un complejo sobre la superficie entre los iones metálicos y los grupos superficiales ácidos con el grupo carboxilo-COOH; la adsorción de iones metálicos divalentes se debe a un mecanismo de intercambio catiónico, formándose en la superficie un complejo representado como [COO-M2+] (12, 15-17).
En este trabajo se realiza la adsorción de iones Ni(II) y Cd(II) en función del pH de la solución sobre un carbón activado obtenido a partir de la cáscara de coco. Se estudia cómo el pH de la solución se modifica a medida que los iones metálicos son adsorbidos por el sólido, se calcula el aumento de la concentración de iones hidronio en la solución y se estima la diferencia en la cantidad adsorbida de los iones, comparando los resultados obtenidos en las dos condiciones de pH establecidas para el proceso de adsorción. El objetivo es mostrar como no solo influye el valor del pH de la solución en la adsorción, sino también las condiciones experimentales en las cuales dicho pH se modifica.
MATERIALES Y MÉTODOS
Carbón activado
El carbón activado de tamaño granular (CAG) que se utiliza en este trabajo, se prepara a partir de la cáscara de coco mediante activación física (18). El CAG se tamiza a un tamaño de partícula de 2 mm, se lava con agua destilada y posteriormente se seca por un período de 24 horas a 363 K, y se almacena en envases plásticos en atmósfera de nitrógeno.
Caracterización textural
El carbón activado se caracteriza mediante fisisorción de N2 a 77K para determinar los parámetros texturales de área superficial aparente y el volumen de microporo en un equipo Autosorb 3B, Quantachrome.
Titulación Boehm
La cantidad de sitios ácidos y básicos se determinan por el método propuesto por Boehm (19, 20), para lo cual se colocan 0,500 g de CAG en 50 mL de cada una de las siguientes soluciones: NaOH, Na2 CO3, NaHCO3 y HCl de concentración 0,1 M. Las soluciones se mantienen a una temperatura constante de 298 K ± 0,1 K, con agitación constante, durante cinco días. Se titula una muestra de 10 mL de cada una de las soluciones que estuvo en contacto con el carbón activado, con soluciones de NaOH o HCl estandarizadas, según corresponda.
Punto de carga cero
Se determina el pHPCC por el método de titulación de masas. Se pesan diferentes cantidades de CAG entre 4.000-4.500 g, se colocan en frascos y se adicionan 10 mL de NaCl 0,1 M. Se dejan tapados y en agitación constante durante 48 h; a continuación se determina el pH de cada solución. Se grafican los valores de la masa con respecto al pH (21).
Preparación de las soluciones
Las soluciones de los iones Ni(II) y Cd(II) se preparan con reactivos grado analítico marca Merck®, utilizando CdSO4·V8H2O como precursor metálico para el caso del Cd(II) y NiCl2·6H2O como precursor en el caso del Ni(II), así como agua doblemente destilada. El rango de concentraciones empleado para los estudios de adsorción de los iones es de 50 a 500 mg L-1. La lectura de las curvas de calibración y soluciones de las isotermas se realiza en un espectrofotómetro de absorción atómica Perkin Elmer, ANALYST 300.
Efecto de pH sobre la cantidad adsorbida de los iones
Para estudiar el efecto del pH sobre la cantidad adsorbida de los iones se colocan 50 mL de las respectivas soluciones a una concentración 500 mg.L-1 de cada metal en contacto con 0,500 g del CAG, y se realizan dos tipos de ensayos en un rango de pH 2 a 8: el primero con un ajuste inicial de pH (pHi), permitiendo una variación espontánea, y el segundo con un ajuste del pH durante el proceso de adsorción (pHa) manteniendo constante los valores por adición de soluciones de 0,1 M de HCl y NaOH durante la adsorción (22).
RESULTADOS Y DISCUSIÓN
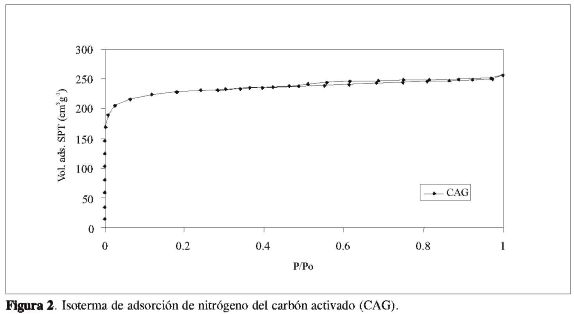
La Figura 2 muestra la isoterma de adsorción-desorción de nitrógeno obtenida para el carbón activado que posteriormente se usará como adsorbente para eliminar los iones Ni(II) y Cd(II). Como se puede observar, la isoterma de adsorción presenta un codo muy acentuado a baja presión relativa (p/p0<0,1), característico de un material microporoso, isoterma tipo I según la IUPAC (23), con una volumen final adsorbido cercano a 250 cm3g-1. Este valor es indicativo de una adecuada capacidad de adsorción. Paralelamente, la presencia de un pequeño ciclo de histé-resis en la rama de desorción indica la presencia de una pequeña proporción de mesoporosidad en este material.
En la Tabla 1 se presentan los resultados obtenidos para la caracterización textural y química del carbón activado y que se relacionan con la capacidad de adsorción que este presenta con respecto a los iones metálicos del estudio.
De acuerdo con los resultados obtenidos, se observa que el carbón activado posee un área superficial BET de 1089 m2.g-1 y un volumen de microporo de 0,33 cm3.g-1, obtenido por el modelo de Dubinin-Radishkevich. Estas son propiedades similares a las que se han utilizado en otros trabajos en la adsorción de iones metálicos (24, 25), y son comparables con materiales carbonosos preparados en trabajos anteriores en nuestro laboratorio, obtenidos a partir de materiales lignocelulósicos (26, 27).
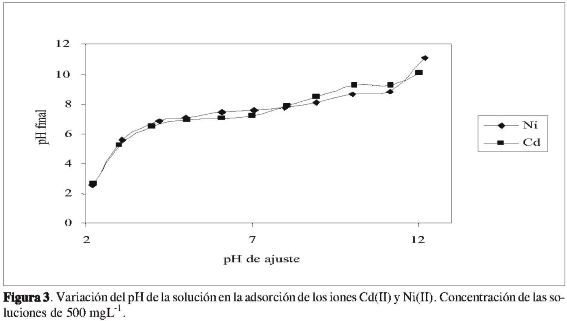
Una vez se caracteriza el carbón activado se realizan los ensayos de adsorción de Ni(II) y Cd(II) con diferentes valores de pH, que varían entre 2 y 12, y se registra su variación cuando se ha llevado a cabo el proceso de adsorción; en la Figura 3 se presentan los resultados obtenidos, y se observa que el pH de la solución aumenta al presentarse la adsorción de los iones metálicos, hasta pH 7, y de este valor de pH en adelante, los valores disminuyen con respecto a los que se ajustan al iniciar la adsorción, lo que indica que se presenta un intercambio del ión metálico, ya sea Cd(II) o Ni(II), por iones hidronio que se manifiestan en el pH de la solución aun en la zona más básica. Los iones presentes en la solución establecen equilibrios con el sólido y estos se rigen tanto por fuerzas electrostáticas como dispersivas, que se pueden determinar en las cantidades adsorbidas de los iones metálicos, Ni(II) y Cd(II), como en los valores de pH finales de las soluciones. Resultados semejantes, con respecto a la tendencia de la adsorción en función del pH, encuentran Ahn et al. (28), cuando realizan la adsorción de Cd(II) en carbones activados con diferente contenido de grupos superficiales.
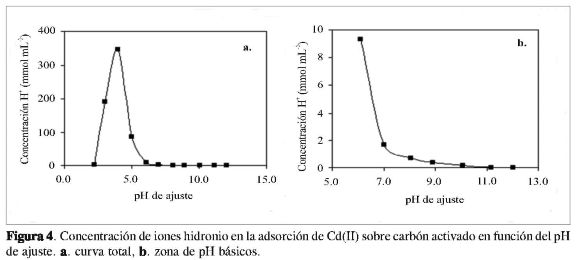
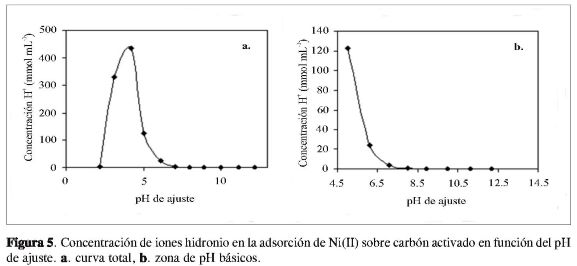
Al realizar la cuantificación de la concentración de iones hidronio que se manifiesta en la solución cuando ocurre el proceso de adsorción de los iones Cd(II) y Ni(II), se puede observar que esta presenta un máximo para después disminuir con tendencia a cero para los valores de pH básicos, lo que se relaciona con el predominio de las especies bivalentes positivas de los dos iones en los diagramas de especies en función del pH (29). Los resultados se presentan en las Figuras 4 y 5, que corresponden al cambio de concentración de los iones hidronio en la solución en función del pH para la adsorción de ión Cd(II) y de Ni(II), respectivamente.
Se observa que la concentración de iones hidronio en la solución presenta valores máximos de alrededor de 346 mmolmL1 para el caso de la adsorción de Cd(II) y de 436 mmolmL-1 para el Ni(II), alrededor de pH 4. Este valor de pH establece una diferencia en el proceso de adsorción de los dos iones que se correlaciona con las curvas de especies de los metales en función del pH (29) y con los tamaños de los iones con 0,078 y 0,097 nm para el Ni(II) y el Cd(II), respectivamente.
La concentración de iones hidronio en la zona de pH básico presenta una disminución más fuerte para el caso de la adsorción del ión Cd(II).
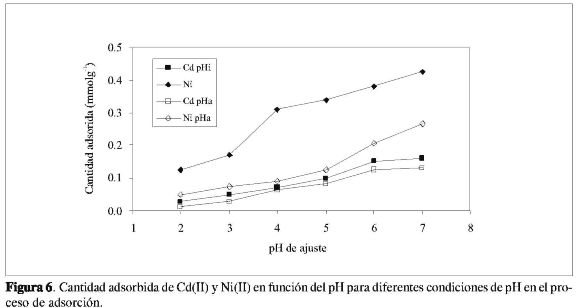
En la Figura 6 se muestra la cantidad adsorbida de los iones en función del pH ajustado, para las dos condiciones experimentales establecidas. Los símbolos sólidos representan los valores para la adsorción de los iones cuando el pH se fija al inicio del proceso y no se vuelve ajustar, mientras que los símbolos vacíos representan las cantidades adsorbidas de los iones para valores de pH que se mantienen fijos durante el proceso de adsorción.
Se observa que en los dos casos la adsorción de Ni(II) es mayor que la de Cd(II), sin embargo, cuando el pH no se controla durante el proceso, la diferencia en la cantidad adsorbida entre el ión níquel y el ión cadmio adsorbidos es mayor que cuando el pH se controla en el transcurso del proceso. Paralelamente, dicho control afecta en mayor medida la adsorción del Ni(II), pues la adsorción cuando se liberan los iones hidronio a la solución se hace mayor, teniendo en cuenta unme-canismo de intercambio; Jiang et al. (30) que estudian la adsorción de cuatro iones metálicos en caolinita, establecen la influencia de la presencia de los iones hidronio en la solución como un factor incidente en la adsorción.
Como se observa en la Figura 6, para todos los valores de pH y las dos condiciones del proceso de adsorción, se observa una mayor cantidad de Ni(II) adsorbida con valores entre 0,04 y 0,42 mmolg-1, mientras que para el Cd(II) la cantidad adsorbida se encuentra entre 0,01y0,16mmolg-1.
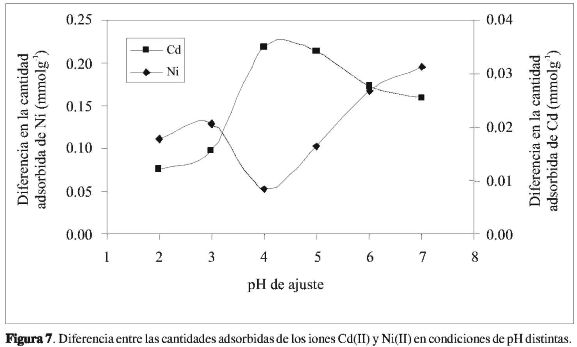
En la Figura 7 se muestra la diferencia entre las cantidades adsorbidas de los iones Cd(II) y Ni(II) en las dos condiciones de pH, ajuste inicial y ajuste durante la adsorción, lo que constituye un resultado interesante del trabajo, porque muestra que para el ión Cd(II) las diferencias son bajas y muestran un mínimo con pH entre 4 y 5,entanto que las diferencias para la adsorción del Ni(II) presentan valores más altos y un máximo para iguales valores de pH, lo que se puede asociar con distintas formas de interacción del ión Ni(II) con la superficie del carbón activado, y favorecen el proceso de adsorción.
CONCLUSIONES
Se lleva a cabo la adsorción de iones Cd(II) y Ni(II) desde una solución acuosa sobre un carbón activado granular de carácter ácido, en dos condiciones experimentales: con y sin control del pH de la solución.
Se observa que el proceso de adsorción de los iones, para el caso en el que el pH no se controla, produce un aumento en el pH de la solución hasta un valor cercano a 7, y para valores de pH mayores, el pH de la solución disminuye.
Se calcula la cantidad de iones hidronio que se presentan en la solución, y se obtienen curvas con máximos alrededor de pH 4, con valores de 346 mmolmL-1 para el caso de la adsorción de Cd(II) y de 436 mmolmL-1 para el Ni(II).
Al ajustar el valor del pH de la solución durante el proceso de adsorción, la cantidad adsorbida de los iones Cd(II) y Ni(II) es menor que cuando el pH se ajusta inicialmente y se permite el cambio de pH en el proceso.
El aumento de los iones hidronio en las soluciones de Cd(II) y Ni(II) afecta el proceso de adsorción.
AGRADECIMIENTOS
Los autores agradecen al Convenio Marco entre la Universidad de los Andes y la Universidad Nacional de Colombia, y al Acta de Acuerdo entre los departamentos de Química de las dos universidades. Se agradece a la Vicerrectoría de Investigación de la Universidad Nacional de Colombia y al Proyecto DIB 11940.
REFERENCIAS BIBLIOGRÁFICAS
1. Bansal, R. C.; Donnet, J. B.; Stoeckli, H. F. Active carbon. New York, Marcel Dekker. 1988. pp. [ Links ]
2. Boehm, H. P. Surface oxides on carbon and their analysis: a critical assessment. Carbon. 2002. 40: 145-149. [ Links ]
3. Cosnier, F.; Celzard, A.; Furdin, G.; Begin D.; Mareche J. F.; Barres O. Hydrophobisation of active carbon surface and effect on the adsorption of water. Carbon. 2005 . 43: 2554-2563. [ Links ]
4. Montes-Moran, M. A.; Suárez, D.; Menéndez, J. A.; Fuente, E. On the nature of basic sites on carbon surfaces: an overview. Carbon. 2004. 42: 1219-1225. [ Links ]
5. Rodríguez-Reinoso, F. El carbónac-tivado como adsorbente universal. En: Sólidos porosos. Preparación, caracterización y aplicaciones. Bogotá: Uniandes. 2007. p. 4. [ Links ]
6. Figueiredo, J. L.; Pereira, M. F. R. The role of surface chemistry in catalysis with carbons. Catalysis Today. 2010. 150: 1-7. [ Links ]
7. Leyva, R. Importancia y aplicaciones de la adsorción en fase líquida. En: Sólidos porosos. Preparación, caracterización y aplicaciones. Bogotá: Uniandes. 2007. p. 197. [ Links ]
8. Stoeckli, F.; Moreno-Castilla, C.; Carrasco-Marín, F.; Lopez-Ramón, M. V. Distribution of surface oxygen complexes on activated carbons from immersion calorimetry, titration and temperature programmed desorption techniques. Carbon. 2001. 39(14): 2235-2237. [ Links ]
9. Liu, M.; Yang, Y.; Zhu, T.; Liu, Z. Chemical modication of single-walled carbon nanotubes with peroxy-trifluoroacetic acid. Carbon. 2005. 43 (7): 1470-1478. [ Links ]
10. Sato, S.; Yoshihara, K.; Moriyama, K.; Machida, M.; Tatsumoto, H. Influence of activated carbon surface acidity on adsorption of heavy metal ions and aromatics from aqueous solution. Applied Surface Science. 2007. 253: 8554-8559. [ Links ]
11. Kosmulski, M. PH-dependent surface charging and points of zero charge. II Update. J. Colloid Interface Sci. 2004. 275 (1): 214-224. [ Links ]
12. Radovic, L. R.; Moreno-Castilla, C.; Rivera-Utrilla, J. Carbon materials as adsorbents in aqueous solutions. En: Chemistry and physics of carbon. A serie of advances. New York: Marcel Dekker. 2000. p. 293. [ Links ]
13. Kyung-Ryeol, K.; Seung-Kon, R.; Soo-Jin, P. Efect of ozone treatment on Cr(VI) and Cu(II) adsorption behaviors of activated carbon fibers. Carbon. 2004. 42: 1864-1867. [ Links ]
14. Hanzlik, J.; Jehlicka, J.; Sebek, O.; Weishauptova, Z.; Machovic, V. Multi-component adsorption of Ag(I), Cd(II) and Cu(II) by natural carbonaceous materials. Water Research. 2004. 38: 2178-2184. [ Links ]
15. Moreno-Castilla, C.; Álvarez-Merino, M. A.; Pastrana-Martínez, L. M.; López-Ramón, M. V. Adsorption mechanisms of metal cations from water on an oxidized carbon surface. Journal of Colloid and Interface Science. 2010. 345: 461-466. [ Links ]
16. Álvarez-Merino, M. A.; López-Ramón, M. V.; Moreno-Castilla, C. A study of the static and dynamic adsorption of Zn(II) ion son carbon materials from aqueous solutions. Journal ofColloid and Interface Science. 2005. 288: 335-341. [ Links ]
17. Swiatkowski, A.; Pakula, M.; Biniak, S.; Walczyk, M. Influence of the surface chemistry of modified activated carbon on its electrochemical behaviour in the presence of lead(II) ions. Carbon. 2004.42: 3057-3069. [ Links ]
18. Rodríguez, J. P. Estudio de algunas de las concepciones alternativas asociadas con los fenómenos de adsorción de iones. Trabajo de grado. Universidad Pedagógica Nacional. Bogotá, 2009. [ Links ]
19. Boehm, H. P. Some aspects of the surface chemistry of carbon blacks and other carbons. Carbon. 1994.32 (5): 759-769. [ Links ]
20. Giraldo, L.; Moreno-Pirajan, J. C. Pb(II) and Cr(VI) adsorption from aqueous solution on activated carbons obtained from sugar cane husk and sawdust. J. Anal. Appl. Pyrolysis. 2008. 81: 278-284. [ Links ]
21. Mohamed, F. Sh.; Khater, W. A.; Mostafa M. R. Characterization and phenol sorptive properties of carbons activated by sulfuric acid. Chem. Eng. J. 2006.116(1): 47-52. [ Links ]
22. Srivastava, V. C.; Mall, I. D.; Mishra, I. M. Competitive adsorption of Cd(II) and Ni(II) metal ions from aqueous solutions onto rice husk ash. Chem .Eng. & Process. 2009 . 48: 370-379. [ Links ]
23. Rouquerol, F.; Rouquerol, J.; Sing, K. Adsorption by powders and porous solids, principles, methodology and applications. London, Academic Press. 1999. [ Links ]
24. Jaramillo, J.; Gómez-Serrano, V.; Álvarez, P. M. Enhanced adsorption of metal ions onto functionalized granular activated carbons prepared from cherry stones. J. Hazardous Materials. 2009. 161: 670-676. [ Links ]
25. Leyva-Ramos, R.; Díaz-Flores, P.; Aragon-Piña, A.; Mendoza-Barron, J.; Guerrero-Coronado, R. Adsorption of Cadmium(II) from an aqueous solution onto activated carbon cloth. Separation Science and Technology. 2005. 40: 2079-2094. [ Links ]
26. Blanco, D. A.; Giraldo, L.; Moreno, J. C. Effect of the pH in the adsorption and in the immersion enthalpy of onohydroxylated phenols from aqueous solutions on activated carbons. J. Hazard. Mater. 2009. 169 (1-3): 291-296. [ Links ]
27. Vargas, J. E.; Giraldo, L.; Moreno, J. C. Obtención y caracterización de carbones activados a partir de semillas de Mucura sp. Rev. Colomb. Quím. 2008. 37 (1): 67-77. [ Links ]
28. Ahna, C. K.; Parka, D.; Woob, S. H.; Parka, J. M. Removal ofcationic heavy metal from aqueous solution by activated carbon impregnated with anionic surfactants. J. Hazard. Mater. 2009. 164: 1130-1136. [ Links ]
29. Srivastava, V. C.; Mall, I. D.; Mishra, I. M. Competitive adsorption of cadmium(II) and nickel(II) metal ions from aqueous solution onto rice husk ash. Chem. Eng. & Process. 2009. 48: 370-379. [ Links ]
30. Jiang, M.; Jin, X.; Lu, X. Q.; Chen, Z. Adsorption of Pb(II), Cd(II), Ni(II) and Cu(II) onto natural kaolinite clay. Desalination. 2010. 252 (1-3): 33-39. [ Links ]