Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804On-line version ISSN 2357-3791
Rev.Colomb.Quim. vol.39 no.3 Bogotá Sept./Dec. 2010
PREPARACIÓN Y CARACTERIZACIÓN DE COMPUESTOS DE ASOCIACIÓN ENTRE EL ACETATO, PROPIONATO Y BUTIRATO DE RODIO(II) CON ß-CICLODEXTRINA
PREPARATION AND CHARACTERIZATION OF COMPOUNDS OF ASSOCIATION BETWEEN RHODIUM(II) CARBOXYLATES (ACETATE, PROPIONATE AND BUTYRATE) AND ß-CYCLODEXTRLN
PREPARAÇÃO E CARACTERIZAÇÃO DE COMPOSTOS DE ASSOCIAÇÃO ENTRE O ACETATO, PROPIONATO E BUTIRATO DE RÓDIO(II) COM ß-CICLODEXTRINA
Ana E. Burgos1, 2, Rubén D. Sinisterra3
1 Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia, sede Bogotá. Bogotá, Colombia.
3 Laboratorio de Encapsulamiento Molecular e Biomateriais (LEMB), Departamento de Química, Instituto de Ciências Exatas, Universidade Federal de Minas Gerais (UFMG), Av. Antônio Carlos 6627, Belo Horizonte 31270-901, MG, Brasil.
Recibido: 26/07/10 - Aceptado: 12/11/10
RESUMEN
En el presente trabajo se describe la preparación y caracterización del acetato, propionato y butirato de rodio(II), y sus respectivos compuestos de inclusión y/o asociación con ß-ciclodextrina (ßCD). Estos complejos fueron caracterizados por análisis elemental (CHN), espectroscopia de absorción en la región de infrarrojo (IR), análisis térmico (TG/DTG/ DSC), difracción de rayos X en polvo (DRX), espectroscopia de resonancia magnética nuclear de protón y de carbo-no-13 (RMN 1H, 13C). Además, se realizaron experimentos para la determinación de tiempos de relajación longitudinal (T1 lH) en Cross Polarization Magic Angle Spinning (CP/MAS). Los resultados encontrados a través de estos métodos indican la formación de compuestos de asociación y/o inclusión parcial entre los carboxilatos de rodio(II) acetato, propio-nato y butirato con ß-ciclodextrina.
Palabras clave: carboxilatos de rodio(II), ciclodextrinas, dispositivos de liberación controlada de fármacos, compuestos de inclusión.
ABSTRACT
This article describes the preparation and characterization of rhodium (II) acetate, propionate and butyrate, and their inclusion and/or association compounds with ß-cyclodextrin (ßCD). The characterization of the compounds in this study was performed by elemental analysis (CHN), FTIR spectroscopy, thermal analysis (TG/DTG/DSC), XRD powder pattern diffraction, 1Hand 13C nuclear magnetic resonance in solution 13C, and 31PCP/ MAS NMR in solid state. Besides, experiments for the determination oflongitudinal T1 relaxation times were also used. The results indicated the formation of inclusion or association compounds between rhodium (II) carboxylates (acetate, propionate or butyrate) and ß-cyclodextryn.
Key words: rhodium (II) carboxylates, cyclodextrins, controlled release devices of drugs, inclusion compounds.
RESUMO
Neste artigo descreve-se a preparação e caracterização de acetato, propionato e butirato de ródio(II), seus respectivos compostos de inclusão ou associação com ß-ciclodextrina (ßCD). Estes compostos de estudo foram caraterizados por análise elementar (CHN), espectroscopia de absorção na região de infravermelho (IV), análise térmica (TG/DTG/DSC), difração de raios-X em pó (DRX), espectrome-tria de ressonância magnética nuclear de próton e de carbono-13. Além disso, se conduziram experimentos para a determinação de tempos de relaxação longitudinal (Tj 1H) em solução e de espectros no estado sólido de 13C CP-MAS, "Cross Polarization Magic Angle Spinning". Os resultados encontrados através desses métodos indicaram a formação de compostos de associação ou inclusão parcial entre os carboxilatos de ródio(II) acetato, propionato e butirato com a ß-ciclodex-trina.
Palavras-chave: carboxilatos de ródio(II), ciclodextrinas, dispositivos de liberação controlada de fármacos, compostos de inclusão.
INTRODUCCIÓN
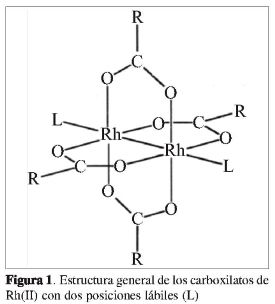
Los carboxilatos de rodio(II) presentan una estructura dimérica en forma de jaula, con un enlace metal-metal. Los grupos carboxilatos se coordinan al centro metálico en forma de puente bidentado, generando un anillo de cinco miembros (Figura 1), y la posición axial (L) puede ser fácilmente ocupada por bases de Lewis (1-4). Los carboxilatos de rodio(II) hacen parte de la segunda generación de complejos promisorios con metales de transición que presentan actividad antitumoral, esa propiedad fue descubierta por Bear et al. en 1972 (2,5). Una mayor actividad anticancerígena ha sido observada cuando se aumenta la cadena lipofílica de los carboxilatos de rodio(II) (2, 6). Pero este incremento puede provocar también disminución de la solubilidad acuosa y aumento de la toxicidad. Estas características han sido un inconveniente significativo para la utilización de estos compuestos en quimioterapia (2, 7-9). Pretendiendo disminuir la toxicidad, aumentar la actividad farmacológica y mejorar la solubilidad de estos complejos, el presente trabajo tiene como objeto la preparación y caracterización de compuestos de inclusión de los carboxilatos de rodio(II): acetato, propionato y butirato con ß-ciclodextrina.
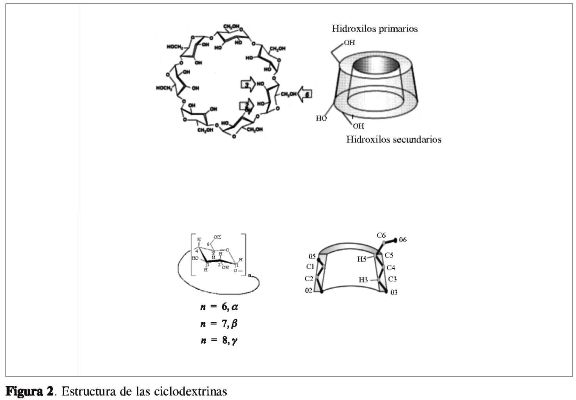
Las ciclodextrinas (CD) son oligosa-cáridos cíclicos formados por unidades de glucosa unidas mutuamente por enlaces a(1—4) (Figura 2), obtenidas a partir de la degradación enzimática del almidón. Las CD más comunes son a-CD, ß-CD y y-CD, formadas por 6, 7 y 8 unidades de glucopiranosa, respectivamente. Las CD presentan una estructura en forma de cono truncado. Este tipo de estructura proporciona una cavidad hidrofóbica, que permite la formación de compuestos de inclusión (CI) con una gran variedad de moléculas en solución acuosa y/o en fase sólida (10-13). Cuando se forman estos compuestos de inclusión, se pueden modificar las propiedades físico-químicas y biológicas de moléculas huéspedes, como por ejemplo, en el caso de los carboxilatos de rodio(II) (14, 15).
MATERIALES Y MÉTODOS
Preparación de los compuestos de asociación con ßCD
General
La composición química de los carboxilatos de Rh(II) acetato, propionato y butirato fue confirmada por análisis elemental (CHN). Estos resultados concuerdan con los obtenidos anteriormente por otros autores (1-3, 16-19), y sugieren la obtención de compuestos diméricos de fórmula mínima Rh2C8H16O10 Rh2C12H20O8 y Rh2C16H28O8, correspondientes a los compuestos tetra-ií-acetato, tetra-µ-propionato y tetra-µ-butirato dirodio(II), respectivamente.
Estos complejos fueron sintetizados por métodos modificados relatados en la literatura (1-6) para ser usados como moléculas huésped (guest) en la preparación de compuestos de inclusión y/o asociación con ßCD (host). Los compuestos de inclusión parcial y/o asociación fueron preparados disolviendo cantidades estequiométricas 1:1 (11, 14-15) entre acetato, propionato y butirato de rodio(II) con ßCD. La solución acuosa resultante fue mantenida entre 40 y 50 °C bajo agitación, luego fue congelada en nitrógeno líquido y liofilizada hasta obtener un sólido verde.
Para efectos de comparación, se preparó una mezcla mecánica en relación molar 1:1 entre el carboxilato de rodio(II) correspondiente y la ßCD. Los sólidos fueron triturados separadamente y luego mezclados hasta obtener una disolución sólida homogénea.
Preparación del compuesto de asociación entre el acetato de rodio(II) y ßCD, [Rh2(Ac)4-ßCD]
Se disolvieron cantidades estequiométricas 1:1 entre el Rh2(Ac)4 y la ßCD en 10 mL de agua deionizada. La solución fue congelada utilizando nitrógeno líquido y liofilizada hasta obtener un sólido verde claro.
Para efectos de comparación, se prepararon por separado las mezclas mecánicas del acetato, propionato y butirato de rodio(II) con la ßCD. Se mezclaron cantidades estequiométricas 1:1 entre el correspondiente carboxilato de rodio(II) y la ßCD. Los sólidos fueron triturados separadamente y luego mezclados hasta obtener una disolución sólida homogénea.
Preparación del compuesto de asociación entre el propionate de rodio(II) y ßCD, [Rh2(Pro)4-ßCD]
Se disolvieron cantidades estequiométricas 1:1 del Rh2(Pro)4 en 20 mL de agua deionizada con ßCD. La solución fue dejada en agitación por 24 horas. Luego fue congelada con nitrógeno líquido y liofilizada. También se preparó la mezcla mecánica del propionate de Rh(II) y la ßCD,delamisma forma descrita anteriormente.
Preparación del compuesto de asociación entre butirato de rodio(II) y ßCD, [Rh2(But)4-ßCD]
Fueron disueltos en relación molar 1:1 el Rh2(But)4 yla ßCD en 20 mL de agua deionizada. La mezcla fue sometida a agitación por 24 horas. La solución fue congelada en nitrógeno líquido y liofilizada. También se preparó la mezcla mecánica como se describió anteriormente.
Caracterización de los compuestos
La caracterización de los complejos y materiales de este estudio se realizó a través de técnicas de análisis físico-químico. El análisis elemental (CHN) fue obtenido en un equipo Perkin Elmer CHN 2400. Los espectros de absorción en la región de infrarrojo (IR) fueron obtenidos en un aparato de FTIR-Galaxy 300 Mattson y en un espectrofotómetro Perkin Elmer 283B, de resolución 4.000 a 200 cm-1. Las curvas termogravimétricas TG/DTG fueron obtenidas en un aparato Shimadzu TGA-50H. Las curvas DSC fueron obtenidas utilizando un aparato Shimadzu DSC-50. La cantidad de muestra utilizada para las curvas TG/DTG y DSC fue de 2,5 mg para cada una. Los análisis fueron realizados enatmósferadinámicadenitrógeno a velocidad de calentamiento de 10 °C.min-1. Los difractogramas de rayos X fueron obtenidos en um aparato Rigaku Geirgerflex 2037. Se utilizó un tubo de Cu y radiación CuKa= 1,54051, en ángulo de 2θ variando de 4 a 60 grados. La velocidad de barrido utilizado fue de 4 °6 por minuto. Los espectros de RMN de 1H y 13C y demás experimentos para la determinación de tiempos de relajación longitudinal (T l 1H) en Cross Polarization Magic Angle Spinning, fueron obtenidos en los espectrofotómetros Bruker DPX-200 Avance (200 MHz) y Bruker DPX-400 Avance (400 MHZ). Se empleó DMSO-d6 o D2O como solvente y TMS como patrón interno.
RESULTADOS Y DISCUSIÓN
Compuestos de asociación y/o inclusión entre los carboxilatos de Rh(II) y ßCD
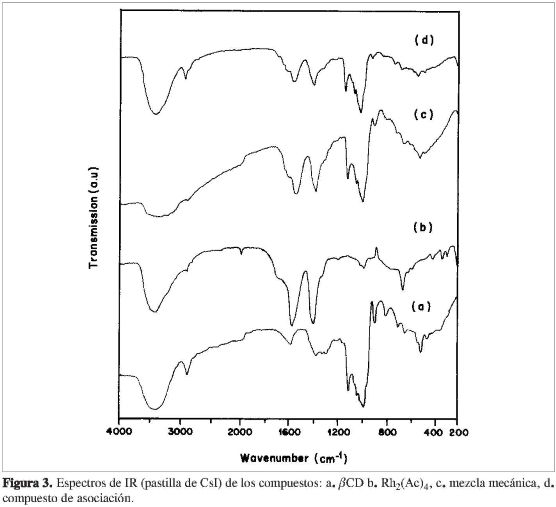
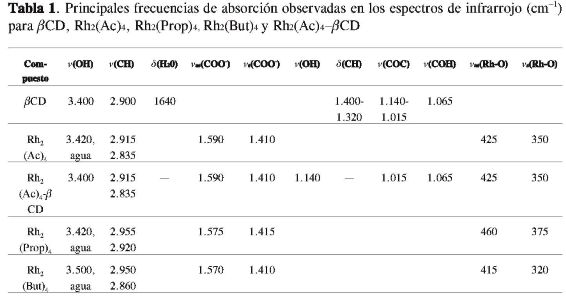
El espectro de infrarrojo de la ßCD (Figura 3a, Tabla 1) presenta una banda ancha en 3.400 cm-1 atribuida a los estiramientos v(C-H), involucrados en enlaces de hidrógeno. Las bandas en 2.900 y 1.640 cm-1 fueron asignadas a los estiramientos v(C-H) y al modo de deformación (δ) del agua, respectivamente. Las bandas en torno a 1.320-1.400 cm-1 fueron atribuidas a la δ(C-H). Las bandas en 1.140 y 1.015 cm-1 fueron asignadas a los estiramientos v(C-O-C), y la banda en 1.065 cm-1 fue atribuida a los estiramientos v(C-O-H) (20-22).
El espectro de infrarrojo del compuesto de asociación y/o inclusión parcial (Figura 3d), mostró afinamiento de las bandas en 3.400 cm-1 y 1.140-1.015 cm-1 atribuidas a los estiramientos v(O-H) y v(C-O-C), respectivamente, cuando fue comparado con el espectro de la mezcla mecánica (Figura 3c) y ßCD. Además, las bandas de la ßCD en torno de 1.640 cm-1 y 1.300-1.400 cm-1 atribuidas a las deformaciones δ(O-H) y δ(C-H) no fueron observadas. Cuando fueron comparados los espectros del compuesto de asociación con los de la mezcla mecánica, se observó un afinamiento y disminución de la intensidad de las bandas en el compuesto de asociación de los estiramientos Vass(COO-)y Vs(COO-) del acetato de Rh(II), atribuidos a las posibles formaciones de enlaces de hidrógeno entre estos grupos y la ßCD. El afinamiento de esa banda sugiere la ruptura de enlaces de hidrógeno ßCD-ßCD cuando se forma el compuesto de asociación entre el acetato de Rh(II)y la ßCD.
Los espectros de infrarrojo de la ßCD, del Rh2(Pro)4 (Tabla 1), de su compuesto de asociación y su mezcla mecánica y los del Rh2(But)4, su respectivo compuesto de asociación como el de su mezcla mecánica, mostraron comportamientos semejantes a los descritos anteriormente para el acetato de Rh2(Ac)4.
En general, cuando se comparan los espectros de infrarrojo de los compuestos de asociación de Rh(II)-ß-ciclodextrina con los espectros de los compuestos libres, se observan pequeñas variaciones, debido a las fuerzas intermoleculares débiles de las interacciones de la ß-ciclodextrina con los complejos de Rh(II). Estudios descritos en la literatura afirman que el afinamiento de las bandas en las regiones 3.400 cm-1 y 1.150-1.000 cm-1 son indicativos de la formación de compuestos de inclusión (20-23). El afinamiento de estas bandas ocurre tanto en los compuestos de asociación como en las mezclas mecánicas del acetato, propionato y butirato de rodio(II), sugiriendo que estos compuestos presentan, en estado sólido, asociaciones de tipo hospedero-huésped (host-guest) por la parte externa de la ßCD, a través de interacciones débiles de tipo de Van der Waals, dipolo-dipolo y enlaces de hidrógeno.
Mediante estudios de termodescomposición de los complejos, se verificó que el rompimiento de la estructura de los carboxilatos de rodio(II) tipo jaula es un proceso endotérmico, cuando se realiza el análisis bajo la atmósfera de nitrógeno. Por otro lado, fue reportada en la literatura la obtención de varios óxidos de rodio como residuos, después de la formación de rodio metálico, una vez que se observa una ganancia de masa arriba de 400 °C en la curva termogravimétrica realizada para diversos carboxilatos de Rh(II) (24-25).
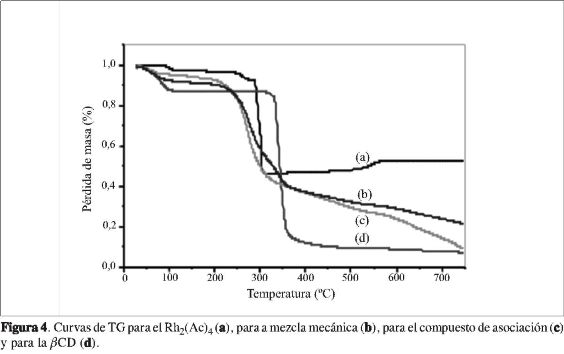
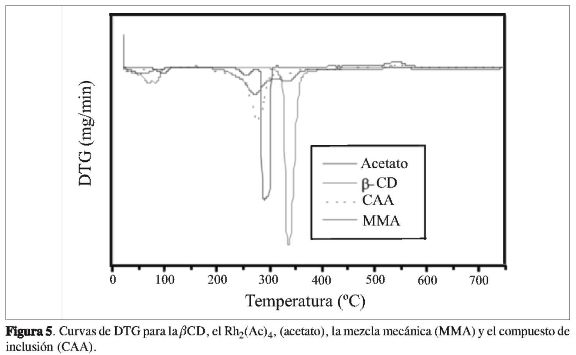
Las curvas TG y DTG de la ßCD (Figuras 4, 5), mostraron 2 eventos térmicos bien definidos: el primero corresponde a la salida de aproximadamente 7 moléculas de agua, con pérdida de masa de aproximadamente 11%, entre 30 y 129 °C con un máximo en 79 °C. Estas moléculas están localizadas en la cavidad como aguas de inclusión, y entre las moléculas de ci-clodextrinas, como aguas intersticiales, manteniendo la estructura cristalina de la ßCD (12).
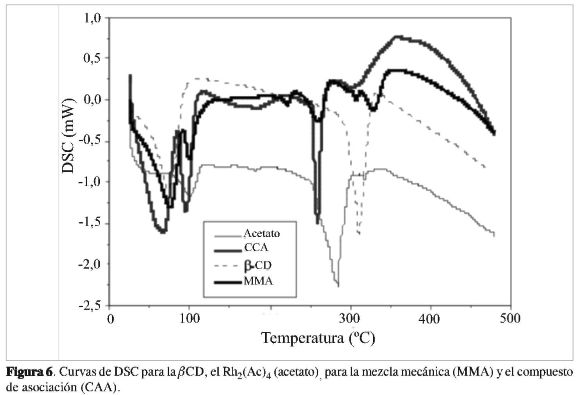
En seguida de este evento, la curva TG de la ßCD muestra estabilidad térmica hasta temperaturas de 300 °C. El segundo evento térmico, entre 280 °C y 370 °C, con un máximo en 319 °C, asociado con pérdida de masa de 81% aproximadamente, corresponde a la descomposición del anillo glicosídico de la ßCD, con la formación de residuos carbonizados (12). Estos mismos fenómenos térmicos son también verificados en la curva DSC (Figura 6) en 79 °C y 319 °C, como eventos endotérmicos, debido a la pérdida de moléculas de agua con un ΔH=-276,76J/g y la descomposición de la ßCD con ΔH=-418,69J/g.
Analizando la curva TG (Figura 4a), del Rh2(Ac)4, se observa la descomposición térmica del acetato de Rh(II) en varios eventos: el primero ocurre aproximadamente entre 80 °C y 250 °C con una pérdida de masa de 7,6%, correspondiente a la salida de 2 moléculas de agua. Estas moléculas pueden estar coordinadas probablemente en las posiciones axiales del complejo. El segundo evento, entre 280 °C y 325 °C con un máximo en 283 °C aproximadamente, asociado con
la posible ruptura de la jaula, con pérdida de masa de 46%, produce rodio metálico [2Rh(0)], seguido de un franja de estabilidad entre 350 °C y 500 °C. Luego, se observó una ganancia de masa de 6,5%, entre 500 y 580 °C. El total de pérdida de
masa fue de 53%, sugiriendo la oxidación de Rh(0) a Rh2O3 y como fuente de oxígeno para la formación de estos compuestos el mismo acetato (26), coincidiendo con los datos encontrados en la literatura (24-25). Según estos autores, la descomposición de la jaula ocurre primero en la formación de RhO2, seguida de la formación del Rh(0). Estos sucesos fueron observados en las curvas TG y DTG del ace-tatode Rh(II) (Figura 5).
La curva de DSC para el Rh2(Ac)4 muestra dos eventos térmicos (Figura 6). El primero, endotérmico, que corresponde a la salida de las moléculas de agua, aproximadamente en 100 °C. El segundo evento también endotérmico, está asociado probablemente con la fusión seguida de termodecomposición de la jaula a 290 °C.
La curva TG para el compuesto de asociación y/o inclusión parcial, muestra un perfil de termodecomposición diferente cuando se comparan las curvas TG de la ßCD, del Rh2(Ac)4 y de la mezcla mecánica. Inicialmente se observa un evento térmico en torno a 35-126 °C con un máximo de temperatura en 54 °C, correspondiente a la pérdida de masa de 6,7%, o a 6 moléculas de agua. Se verifica otro evento térmico entre 150 °C y 318 °C con un máximo en 290 °C, que corresponde probablemente a la ruptura de la estructura de jaula del carboxilato junto con la termodecomposición de la ßCD. También se presenta estabilidad térmica entre 450 °C y 500 °C, sugiriendo la reducción del Rh(II) a rodio metálico. Se observa una ganancia de 1% en torno a 490 °C y 580 °C, que corresponde posiblemente a la formación del óxido Rh2O3. Además, se observa una mayor estabilidad térmica cuando se compara el residuo obtenido de la termodecomposición del compuesto de asociación del acetato de Rh(II) con el obtenido en la termodecomposición de la ßCD libre, y menor estabilidad térmica cuando se compara con el acetato de Rh(II) libre y la mezcla mecánica, sugiriendo nuevas interacciones ßCD-acetato de Rh(II). Finalmente, auna temperatura de 750 °C, se observa que el proceso de termodecomposición aún no ha terminado. Este resultado sugiere que las interacciones hospedero: huésped cambian el comportamiento de la termodecomposición del acetato de rodio(II) y de la ßCD libre. Cuando se comparan las curvas DTG del compuesto de asociación con el de mezcla mecánica, se observa un comportamiento térmico muy semejante.
LacurvaDSC (Figura6)delcompues-to de asociación del acetato de Rh(II), presenta cuatro eventos térmicos. El primer y segundo evento endotérmico se relacionan con la salida de las moléculas de agua de coordinación, aproximadamente a70°C, el tercer y cuarto evento endotérmico en el rango de temperatura entre 250°Cy320°C, puedenestarasociados tal vez con el punto de fusión seguido de la descomposición del compuesto de asociación. Estos procesos indican que hubo interacciones entre el hospedero-huésped, y la formación de un compuesto de asociación y/o inclusión parcial entre la ßCD y el acetato de Rh(II), cuando son comparados con la mezcla mecánica.
Las curvas TG, DTG y DSC de las Figuras 4b, 5 y 6 de la mezcla mecánica, se pueden interpretar como una superposición de las curvas de los componentes libres. En la curva DSC de la mezcla mecánica se observa un comportamiento muy parecido al del carboxilato de Rh(II) libre, en el rango de temperatura entre 25 °C a 100 °C. Se observa también la termodescomposición de la ßCD y del carboxilato de Rh(II), en el rango de temperatura entre 250 y 300 °C.
En general, se puede concluir que los estudios de termodescomposición de los compuestos de asociación entre la ßCD y los carboxilatos de rodio(II), mostraron que para el acetato la descomposición ocurre en una sola etapa, para el propionato ocurre en dos etapas y para el butirato ocurre también en dos etapas, pero más separadas que las del propionato de Rh(II). Estos resultados sugieren una mayor interacción entre las moléculas de Rh(II) y ßCD, en el acetato, seguida del propionato y, por último, del butirato.
Cuando fueron comparadas las curvas TG del acetato, propionato y butirato de rodio(II), se observó que el perfil de termodecomposición fue diferente para el acetato, propionato y butirato, aunque se haya indicado la ruptura de la jaula a temperaturas entre 200 y 300 °C. Se confirma que después de la salida de moléculas de agua del acetato de Rh(II), este presenta una mayor estabilidad térmica cuando se compara con el propionato y butirato. Esa mayor estabilidad térmica del acetato de Rh(II) sugiere la formación del polímero inorgánico, a través de las interacciones entre Rh2(Ac)-Rh2(Ac) cuando el compuesto se calienta, como es descrito en la literatura por Boyar y colaboradores (2-4).
Medidas de difracción de rayos X
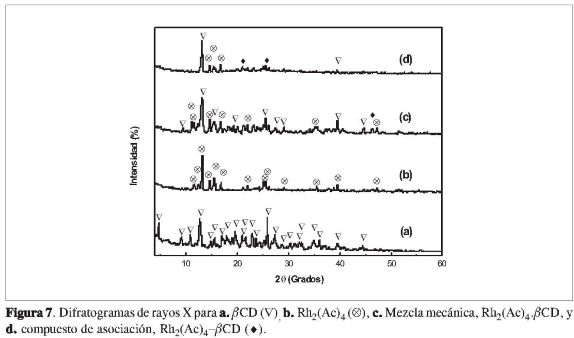
La ßCD presenta un patrón de difracción de rayos X policristalino (Figura 7a). Al comparar los difratogramas de la ßCD, del Rh2(Ac)4 y de la mezcla mecánica, con el compuesto de asociación (Figura 7d), se observa que en este último compuesto están ausentes gran cantidad de picos característicos de los compuestos libres. Estos resultados sugieren que se está obteniendo una estructura diferente, debido a la formación de un compuesto de asociación entre ßCD y el Rh2(Ac)4. También se observa que picos característicos de los componentes libres (Figura 7a y 7b), Rh2(Ac)4 y ßCD, desaparecen y aparecen nuevos, cuando hay formación del compuesto de asociación (26-27). Además, se verifica una disminución de las intensidades relativas de las señales de la ßCD, sugiriendo la existencia de interacciones tipo Van der Waals y/o enlaces de hidrógeno entre los compuestos (20-21).
El difractograma de la mezcla mecánica no presenta una "superposición" de los compuestos libres, de la ßCD y del Rh2(Ac)4 Se observa que, desaparecen picos como el 4,67 y 6,33 (2θ) correspondiente a la ßCD. Estos resultados sugieren que en estado sólido el Rh2(Ac)4 está sufriendo interacciones débiles con la ßCD, de tipo enlaces de hidrógeno, para formar el compuesto de asociación.
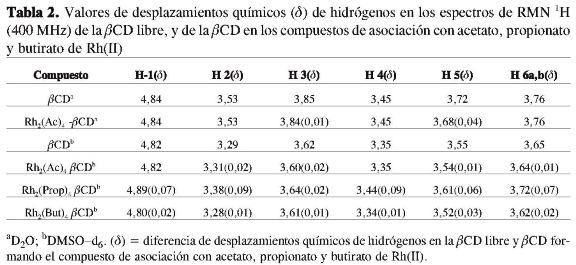
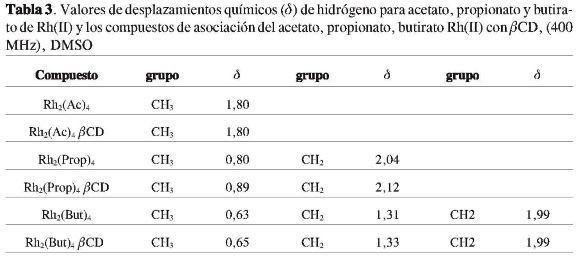
Un comportamiento similar fue observado cuando se compararon los patrones de difracción de rayos X del compuesto de asociación del propionato de Rh(II) con la mezcla mecánica (Figura 8), y el compuesto de asociación del butiratode Rh(II) con su respectiva mezcla mecánica (Figura 9).
Los residuos sólidos obtenidos de los análisis de TG, de los carboxilatos de ro-dio(II) acetato, propionato, butirato y sus respectivos compuestos de asociación, en el rango temperatura entre 730 °C y 745 °C, bajo atmósfera de nitrógeno, fueron analizadas por difracción de rayos X. Los resultados obtenidos sugieren que el material corresponde al rodio metálico, Rh0, y a los óxidos Rh2O3 y RhO. Tanto para los carboxilatos de rodio(II) cuanto para los respectivos compuestos de asociación (24-25, 28).
Resonancia magnética nuclear
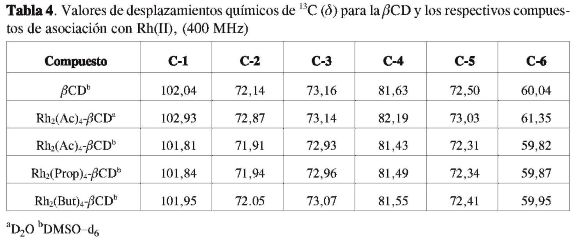
Los desplazamientos químicos de RMN de 1H y de 13C de la ßCD, del compuesto de asociación del acetato, propionato y butirato de Rh(II), se presentan en las tablas 2,3 y 4.
Las atribuciones fueron realizadas con base en los datos reportados en literatura (20-21, 29-30). En la Tabla 2, se presentan las señales de RMN de 1H de los espectros y sus atribuciones para los compuestos de asociación entre los carboxilatos de Rh(II) y ßCD. Se comparan los desplazamientos químicos del compuesto de asociación del acetato de Rh(II) con la ßCDa, y se observan pequeños cambios en los valores de casi todos los hidrógenos de la ßCD, posiblemente debido a la formación de enlaces de hidrógeno entre el hospedero y el huésped (host-guest).
La señal perteneciente a los hidrógenos del grupo CH3 del acetato de Rh(II) fue observada en δ 1,80 (s). Al comparar los desplazamientos químicos de las señales de 1H para los compuestos de asociación entre el propionato de rodio(II) y ßCD, se observaron pequeñas variaciones de δ en todos los hidrógenos en los compuestos de asociación, siendo más acentuados para los H-2yH-4(Δδ=0,09). Esto permite suponer la formación de enlaces de hidrógeno hospedero-huésped. Los hidrógenos en cuestión se encuentran del lado de afuera de la cavidad de la ßCD (Figura 2), sugiriendo la interacción de tipo hospedero-huésped en la parte exterior de la cavidad, formando los respectivos compuestos de asociación. En el caso de butirato Rh(II) con la ßCD, se notan pequeñas variaciones en los valores de δ para casi todos los hidrógenos de los compuestos de asociación. Los datos de RMN publicados en la literatura sobre compuestos de inclusión también presentan pequeños desplazamientos químicos (δ ppm) para los H-3 y H-5 localizados dentro de la cavidad, y los H-1, H-2y H-4 que están localizados en el lado externo de la cavidad de la ßCD donde se concluye que se ha formado un compuesto de inclusión (20, 31-32). Estos resultados corroboran con los obtenidos en este trabajo, donde se sugiere la formación de compuestos de asociación entre los carboxilatos de rodio(II) y la ßCD.
En la Tabla 3 se observa que los valores de δ dos hidrógenos pertenecientes a los grupos CH3 y CH2 del propionato de rodio(II), muestran resonancia a una frecuencia más baja que la que presenta el compuesto de asociación (δ 0,80 y δ 2,04). La misma observación se realizó con el butirato de rodio(II) y su respectivo compuesto de asociación, sugiriendo interacciones muy débiles entre el compuesto de rodio(II) y la ß-ciclodextrina (20-21).
En la Tabla 4 se presentan los desplazamientos químicos de las señales de RMN de 13Cdela ßCD y de los compuestos de asociación del acetato, propionato y butirato de Rh(II). En el espectro se observaron ocho señales, de estas, seis corresponden a la ßCD y las otras dos, en δ 23,04 y δ 193,45, corresponden a la resonancia del grupo CH3 del acetato de Rh(II) y al carbono del grupo COO-, respectivamente. En el compuesto de asociación se observa que estos mismos desplazamientos aparecen en δ 23,49 y δ 191,02. El carbono del grupo carboxilo se desplaza para frecuencias menores debido a la formación de enlaces de hidrógeno entre los oxígenos de este grupo y los grupos hidroxilos de la ßCD y/o los hidrógenos que están localizados del lado de afuera de la cavidad de la ßCD.
El espectro de RMN de 13C del compuesto de asociación del propionato presenta nueve señales, tres corresponden al propionato y seis a la ßCD. Estos desplazamientos se observan en las regiones de δ 9,98 (CH3), δ 30,06 (CH2) y δ 194,47 (COO-), respectivamente.
El espectro de RMN de 13C del compuesto de asociación presenta desplazamientos en δ 9,86(CH3), δ 29,94(CH2)y δ 194,31(COO-), donde se observan pequeños cambios. Para las señales de resonancia de los carbonos C-1, C-2 y C-3, las variaciones en el desplazamiento químico (Δδ) fueron de 0,2 ppm, para el C-4yC-5 fue de 0,14 y 0,16, respectivamente. El mayor desplazamiento químico ocurrió para el C-6 (0,22 ppm) lo que sugiere la formación de un compuesto de asociación. Los desplazamientos químicos de las señales pertenecientes a los carbonos C-1 y C-4 (0,2 y 0,14 pm, respectivamente) se pueden atribuir a los cambios conformacionales de la ßCD cuando se forma el compuesto de asociación (20-21, 30-35).
También se observaron pequeños desplazamientos químicos para las señales correspondientes al propionato de Rh(II), y presentó mayor desplazamiento el carbono correspondiente al grupo carboxilato (0,16 ppm). Todos estos resultados contribuyen a proponer la formación del compuesto de asociación entre los carbo-xilatos de Rh(II) y la ßCD.
El espectro de RMN de 13C del butira-to de Rh(II) presenta cuatro señales en δ 12,88, δ 18,65, δ 38,47 y δ 193,63, que corresponden a los grupos CH3, (-CH2-), (-CH2-) y COO-, respectivamente. El espectro del compuesto de asociación del butirato presenta diez señales, cuatro corresponden al butirato de Rh(II) en δ 12,92, δ 18,65, δ 38,52 y δ 193,67, y seis de la ßCD. La señalenô 102,04 fue atribuida al carbono anomérico de la ß-CD (C-1).
Se observa que los desplazamientos químicos de RMN de 1Hyde13Cdela ßCD son débilmente influenciados por la presencia de la molécula huésped, indicando que los complejos se pueden formar a través de los grupos hidroxilos de la molécula de ß-ciclodextrina, que están presentes fuera de la cavidad, formando un compuesto de asociación con los carboxilatos de rodio(II).
Medidas de tiempos de relajación longitudinal (T1 1H)
Cuando se comparan los valores de los tiempos de relajación T1 de 1H de la ß-ci-clodextrina con los del compuesto de asociación del acetato de rodio(II), se observa un aumento en el valor de T1 para los grupos hidroxilos OH-2, OH-6 y el hidrógeno H-4. Este resultado se corrobora con la propuesta anterior, la formación de un compuesto de asociación entre el acetato de rodio(II) y la ß-ciclodextrina, a través de enlaces de hidrógeno entre los grupos de hidroxilos OH-2, OH-6 y H-4 con el grupo CH3 del acetato de rodio(II). Los datos obtenidos indican la existencia de interacciones con la molécula huésped (guest), del lado de afuera de la cavidad de la ciclodextrina; la formación del compuesto de asociación pudo haber propiciado una alteración en la dinámica de estos hidrógenos, y como consecuencia, una disminución en los valores de T1 (20-21).
Al comparar los tiempos de relajación T1 de 1H de la ß-ciclodextrina (20) con los del compuesto de asociación del butirato de rodio(II), se observó un pequeño aumento en los valores de los tiempos de relajación spin-rede para los hidrógenos pertenecientes a los hidroxilos OH-3y OH-6, en el compuesto de asociación y en los hidrógenos correspondientes al butirato de rodio(II), sugiriendo la formación de una mezcla entre el compuesto de asociación, e inclusión parcial entre la ß-ciclodextrina y el butirato de rodio(II). Los mayores cambios de T1 observados fueron para los hidrógenos H-3yH-4en el compuesto de asociación. Se sugiere que el butirato interactúa tanto por dentro como por fuera de la cavidad de la ciclodextrina. Esto no se verificó en el acetato de rodio(II), tal vez porque su cadena ali-fática es más corta cuando se compara con la del butirato (20-21).
Resonancia magnética nuclear de 13C-estado sólido (CP/MAS)
El espectro en estado sólido del acetato de rodio(II), presenta únicamente dos señales. Una señal en δ 192,09 corresponde al desplazamiento químico del grupo carboxilato, y la otra se encuentra en δ 23,30. Estos desplazamientos químicos están bien próximos a los encontrados para el análisis realizado en solución. El espectro de RMN de 13C CP/MAS del compuesto de asociación del acetato de rodio(II) con la ßCD presentó dos señales correspondientes al grupo carboxilato δ 193,4 (s) y δ 188,69 (s), y 2 señales para el grupo CH3 en δ 24,56 (s) y δ 21,31(s). Estos resultados refuerzan la hipótesis de la formación del compuesto de asociación entre el acetato de rodio(II) y a /3CD. Los valores de δ correspondientes a los carbonos de la ßCD en el compuesto de asociación, presenta cambios en los desplazamientos químicos de los carbonos C-1, 2, 3, 5, y especialmente en C-6 (31). La presencia de las 2 señales correspondientes a los grupos carboxilatos, sugieren la no equivalencia entre estos; se atribuye a que uno de los 2 conjuntos está formado por 2 grupos carboxilatos de la misma unidad molecular, formando solamente enlaces en puente con los átomos de rodio. El otro, además de formar enlaces en puente con la propia unidad, se enlaza a la ß-ciclodextrina a través de enlaces de hidrógeno (20).
El espectro de RMN de 13C CP/MAS del propionato de rodio(II), presenta tres señales correspondientes a las resonancias de los carbonos de los grupos COO-, -CH2-,y CH3,en δ 195,98, δ 30,22 y δ 10,09, respectivamente. Las otras señales observadas son atribuidas a la ßCD. Cuando se compara este espectro al de la ßCD libre, se observan cambios en los desplazamientos químicos en todas las señales de los carbonos, indicando posibles interacciones hospedero-huésped entre la ciclodextrina y el propionato de rodio(II). En el caso del butirato de ródio(II) el espectro de RMN de 13C CP/MAS, se observan cuatro señales en δ 193,38, δ 38,26, δ 18,87 y δ 13,14, correspondientes a los grupos COO-, -CH2-, -CH2- y CH3, respectivamente. Comparando estos datos con los obtenidos en solución, se puedenobservar pequeños cambios enlos desplazamientos químicos (20, 32).
La base para atribuir los desplazamientos químicos de las señales de RMN de 13C CP/MAS para los carboxilatos de rodio(II), fueron los datos encontrados en solución para estos compuestos y los datos reportados en la literatura (20-21, 31-35). Los resultados encontrados refuerzan la hipótesis de la formación de los compuestos de asociación y/o inclusión parcial entre los carboxilatos de rodio(II) y pTD.
En general, el estudio de RMN ha sido el método más importante para elucidar estructuras de los compuestos supramoleculares, particularmente en solución. A través de esta técnica se corroboró la formación de compuestos de asociación entre los carboxilatos de rodio(II) y la ßCD. Las referidas interacciones ocurren en la parte externa de la ßCD, a través de los hidroxilos primarios y secundarios. Estos resultados concuerdan con los obtenidos por otras técnicas de caracterización como IR, Rayos X en polvo, las curvas TG/DTG/DSC.
CONCLUSIONES
Se prepararon nuevos compuestos de asociación y/o inclusión parcial entre el acetato, propionato y butirato de rodio(II) con ß-ciclodextrina en relación molar 1:1.
Los resultados obtenidos por espectrometría de RMN a partir de las medidas de tiempos de relajación longitudinales de 1H(T1), para los carboxilatos de rodio(II) y sus respectivos compuestos de asociación y/o inclusión parcial, mostraron variaciones considerables tanto en la relajación de T1 de los hidrógenos de la molécula hospedera (ß-ciclodextrina), cuanto en los T1 de los hidrógenos de la molécula huésped (acetato, propionato y butirato) de rodio(II).
REFERENCIAS BIBLIOGRÁFICAS
1. Erck, A.; Rainen, L.; Whileyman, J.; Chang, I. M.; Kimball, A. P.; Bear, J. L. Studies of rhodium(II) carboxylates as potential antitumor agents. Proc. Soc. Exp. Bio. Med. 1974. 145(4): 1278-1283. [ Links ]
2. Hughes, R. G.; Bear, J. L.; Kimball, A. P. Synergistic effect of rhodium(II) acetate and anabinosylcyto-sine on L210. Proc. Am. Assoc. Cancer Res. 1972. 13: 120. [ Links ]
3. Bear, J. L.; Gray, H. B.; Rainen, L.; Chan, I. M.; Howard, R.; Serio, G.; Kimball, A. P. Interaction of rhodium(II) carboxylate with molecules of biologic importance. Cancer Chemother. Rep. 1975. 59: 611-620. [ Links ]
4. Howard, R. A.; Kimball, A. P., Bear, J. L. Mechanism of action of tetra-µ- carboxilatodirhodium(II) in L1210 tumor suspension culture. Cancer Res. 1979. 39: 2568-2573. [ Links ]
5. Zynger, S.; Kimura, E.; Najjar, R. Antitumor effects of rhodium(II) citrate in mice bearing ehrlich tumors. Braz. J. Med. Biol. Res.1989, 22: 397-401. [ Links ]
6. Howard, R. A.; Sherwood, E.; Kimball, A. P.; Bear, J. L. Hydrophobicity of several rhodium(II) carboxy-lates correlated with their biologic activity. J. Med. Chem. 1977 . 20: 943-946. [ Links ]
7. Rao, P. N.; Smith, M. L.; Pathak, S.; Howard, R. A.; Bear, J. L. Rhodium(II) butyrate: a potential anticancer drug with cycle phase specific effects in hela cells. J. Natl. Cancer Inst. 1980. 64: 905-911. [ Links ]
8. Chifotides, H. T.; Fu, P. K.; Dunbar, K. R.; Turro, C. Effect of equatorial ligands of dirhodium(II) complexes on the efficiency and mechanism of transcription inhibition in vitro. Inorg. Chem. 2004. 43: 1175-1183. [ Links ]
9. De Souza, A. R.; Coelho, E. P.; Zyngier, S. B. Comparison of the anti-neoplastic effects of dirhodium(II) tetrapropionate and its adducts with nicotinate and isonicotinate anions in mice bearing ehrlich tumors. Eur. J. Med. Chem. 2006. 41 (10): 1214-1216. [ Links ]
10. Hamai, S. Association of inclusion compounds of ß-cyclodextrin in aquos solution. Bull. Chem. Soc. Jpn. 1982. 55: 2721-2729. [ Links ]
11. Szejtli, J. Introduction and general overview of cyclodextrin chemistry. Chem. Rev. 1998. 98 (5): 1743-1754. [ Links ]
12. Kohata, S.; Jyodoi, K.; Ohyoshi, A. Thermal decomposition ofcyclodex-trins (a-, b-, y- and modified ß-CyD) complexes in the solid phase. Thermoch. Acta. 1993. 217: 187-198. [ Links ]
13. Burgos, A. E.; Sinisterra, R. D.; Augusti, R.; Lago, M. R. Application of the MIMS technique to study the stability constants of small organic guest molecules into cyclodextrin hosts in aqueous medium. J. Incl. Phenom. Macro. Chem. 2003 . 45 (1-2): 149-154. [ Links ]
14. Sinisterra, R. D.; Shastri, V. P.; Najjar, R.; Langer, R. Encapsulation and release of rhodium(II) citrate and its association complex with hydroxypropyl- â-cyclodextrin from biodegradable polymer microspheras. J. Pharm. Sci. 1999. 88 (5): 574-576. [ Links ]
15. Burgos, A. E.; Belchior, J. C.; Sinisterra, R. D. controlled release of rhodium(II) carboxylates and their association complexes with cyclodextrins from hydroxyapatite matrix. Biomaterials. 2002. 23: 2519-2526. [ Links ]
16. De Souza, A. R., Najjar, R.; Glikmanas, S.; Zyngier, S. B. Water soluble rhodium(II) carboxylate adducts: cytotoxicity of the new compounds. J. Inorg. Biochem. 1996. 64: 1-5. [ Links ]
17. Boyar, E. B.; Robinson, S. D. Rhodium(II) carboxylates. Coord. Chem. Rev. 1983. 50: 109-208. [ Links ]
18. Katsaros, N. Anagnostopoulou. Rhodium and its compounds as potential agents in cancer treatment. Crit. rev. Oncol. Hem. 2002. 42: 279-308. [ Links ]
19. Pruchnil, F. P., Starosta, R.; Ciunik, Z.; Opolski, A.; Wietrzyk, J.; Wojdat, E.; Dus, D. Tetraacetatodirhodium(II) complexes with tris(methoxiphenyl)phosphines, their reactivity, structure and antitumor activity. Can J. Chem. 2001. 79: 868-877. [ Links ]
20. Machado, F. C. Preparação de compostos de inclusão entre carboxilatos de ródio(II) e a ß-ciclodextrina: caracterização e estudo das propriedades físico-químicas. Ph.D. Tese, Universidade Federal de Minas Gerais, Belo Horizonte, IN, 2000, p. 149. [ Links ]
21. Burgos, A. E. Preparação e caracterização de dispositivos de liberação controlada dos carboxilatos de ródio(II), seus compostos de inclusão e/ou associação com ciclodextrinas a partir de matrizes biocerâmicas. Ph.D. Tese, Universidade Federal de Minas Gerais, Belo Horizonte, IN. 2002, p. 140. [ Links ]
22. De Sousa, F. B.; Denadai; A. M. L.; Lula, I. S.; Lopes, J. F.; Dos santos, H. F.; De Almeida, W. B.; Sinisterra, R. D. Int. J. Pharm. 2008. 352: 160-169. [ Links ]
23. Nascimento, J. R.; Dos santos H. F.; De Almeida, W. B. Theorical study of the formation of alpha-cyclodextrin hexahydrate. Chem. Phys. Lett. 2004. 397: 422-428. [ Links ]
24. Braga, M. M.; Yoshida, M. I.; Sinisterra, R. D.; Carvalho, C. F. Thermal behaviour and isothermal kinectics of rhodium(II) acetato. Thermochim. Act. 1997. 296: 141-148. [ Links ]
25. Howard, R. A.; Wynne, A. M.; Bear, J. L.; Wendlandt, W. W. The thermal decomposition of the dimethyl sulfoxide and pyridine adducts of rhodium(II) acetate, propionate and butyrate. Inorg.Nucl. Chem.1976. 38: 115-118. [ Links ]
26. Bogdan, D.; Morari, C. Electronic structure and driving forces in b-Cyclodextrin: diclofenac inclusion complexes. Phys. Lett. 2007 . 366: 454-459. [ Links ]
27. Steiner, T.; Koellner, G. Crystalline ß-cyclodextrin hydrate at various humidities fast, continuous, and reversible dehydration studied by X-raydiffraction. J. Am. Chem. Soc. 1994. 116: 5122-5128. [ Links ]
28. Souza, A.; Najjar, R. Matos, J. R. Thermal behaviour of some rhodium(II) cycloalkanocarboxylate complexes. Thermochim. Acta. 2000. 342: 119-125. [ Links ]
29. Gidley, M. J.; Bociek, S. M. 13C cross polarization-magic angle spinning (CP-MAS) N. M. R. studies of a- and ß-Cyclodextrins: resolution of all conformationally-important sites. J. Chem. Soc. Commun. 1986. 15: 1223-1226. [ Links ]
30. Gidley, M. J.; Bociek, S. M. Carbon-13 CP/MAS NMR studies of amylose inclusion complexes, cyclodextrins, and the amorphous phaseof starch Granules: relationships between glycosidic linkage conformation and solid-state carbon-13 chemical shifts. J. Am. Chem. Soc., 1988. 110 (12): 3820-3829. [ Links ]
31. Heyes, S. J.; Clayden, N. J.; Dobson, C. M. 13C-CP/MAS NMR studies of the cyclomalyo-oligosaccharide (cyclodextrin) hidrates. Carbohydr. Res. 1992. 23: 1-14. [ Links ]
32. De Sousa F.; Denadai, A. M.; Lula, S. I.; Nascimento, C. S.; Fernandes, N. N.; Lima, A. C.; De Almeida, W. B.; Sinisterra, R. D. Supramolecular self-assembly of cyclodextrin and higher water soluble guest: thermodynamics and topological studies. J. Am. Chem. Soc. 2008. 130 (26): 8426-8436. [ Links ]
33. Connor, K. A. The stability of cyclodextrin complexes in solution. Chem. Rev. 1997. 97: 1325-1357. [ Links ]
34. Poveda, A.; Berbero-Jiménez. NMR studies of carbohydrate-protein interactions in solution. Chem. Soc. Rev. 1998. 27: 133-143. [ Links ]
35. Jianbin, C.; Liang, C.; hao, X.; Dongpin, M. Preparation and study on the solid inclusion complex of ciprofloxacin with ß-cyclodextrin. Spectrochim. Acta. 2002. 58 (13): 2809-2815. [ Links ]