Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804On-line version ISSN 2357-3791
Rev.Colomb.Quim. vol.40 no.1 Bogotá Jan./Apr. 2011
DESARROLLO DE MÉTODOS DE ANÁLISIS POR INYECCIÓN EN FLUJO A PARTIR DE PROCEDIMIENTOS CLÁSICOS: Determinación de Pb en agua
DEVELOPMENT OF FLOW INJECTION ANALYSIS METHODS BY CLASSICAL PROCEDURES: Determination of Pb in water
DESENVOLVIMENTO DE MÉTODOS DE ANÁLISE POR INJEÇÃO EM FLUXO A PARTIR DE PROCEDIMENTOS CLÁSSICOS: determinação de Pb em água
Walter H. Pérez1, Elianna Castillo1, Jesús A. Agreda1'2
1 Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia. sede Bogotá. Bogotá, Colombia.
Recibido: 24/09/10 - Aceptado: 29/04/11
RESUMEN
El análisis químico día a día se acerca más a la automatización, buscando satisfacer las necesidades actuales de resultados rápidos y confiables. Los sistemas de análisis en flujo (FIA - Flow Injection Analysis) son una de las formas de aproximarse a la automatización. En este artículo se presentan los pasos necesarios para implementar una metodología FIA, para la determinación de Pb(II) en agua, partiendo de la revisión de los procedimientos clásicos y describiendo detalladamente los pasos necesarios para implementar la técnica de análisis en flujo. El trabajo produjo un método de análisis de Pb en agua que usa ditizona disuelta en isopropanol (agente cromogénico), en presencia de bromuro de cetiltrimetil amonio (CTAB), para solubilizar en agua el complejo, cuyas características más sobresalientes fueron: volumen de inyección de muestra de 81,7 µL, velocidad de flujo de 8,0 mL/min, tiempo de toma de espectros 1,4 s e intervalo lineal de 1,0 a 40 mg L-1.
Palabras clave: análisis por inyección en flujo (FIA), Pb(II)-ditizona, bromuro de cetiltrimetil amonio (CTAB), implementación de métodos en flujo.
ABSTRACT
Chemical analysis has evolved towards automation to satisfy the current requirements: fast analysis and certainty in the results. Flow injection analysis (FIA) is a way to reach automation. This work presents the necessary steps to obtain an optimized FIA methodology for the determination of Pb(II) in water by classic methods. The result was a FIA method to determinate Pb with dithizone (chromogenic agent) dissolved in iso-propyl alcohol, using cethyltrimethylammonium bromide (CTAB) to solubilize the complex. The main characteristics of the method were: injection sample volume 81.7 µL, flow 8.0 mL/min, spectra acquisition time 1.4 s and linear range 1 to 40 mg L-1.
Key words: Flow-injection analysis (FIA), Pb(II)-Dithizone complex, cethyltrimethylammonium bromide (CTAB), flow injection methods implementation.
RESUMO
Cada dia, a análise química é mais cerca da automatização com o fim de satisfazer as necessidades atuais de resultados rápidos e confiáveis. Os sistemas de análise em fluxo (FIA - Flow Inyection Analysis) são uma das formas de aproximação à automatização. Este artigo apresenta os passos necessários para implementar uma metodologia FIA para a determinação de Pb(II) em água, partindo da revisão dos procedimentos clássicos e descrevendo detalhadamente os passos necessários para implementar a técnica de análise em fluxo. Os resultado são um método de análise de Pb em água que usa ditizona dissolvida em isopropanol (agente cromogénico) na presença de bromuro de cetiltrimetil amônio (CTAB), usado para solubilizar o complexo em água. As características principais do método foram: volume de injeção de amostra de 81,7 µL, velocidade de fluxo de 8,0 mL min-1, tempo de aquisição de espectros de 1,4 s e intervalo linear de 0.9 a 40 mg L-1.
Palavras-chave: Análise por injeção em fluxo (FIA), Pb(II)-ditizona, bromuro de cetiltrimetil amônio (CTAB), implementação de método de fluxo.
INTRODUCCIÓN
Existe gran cantidad de procedimientos de análisis químico. Por ejemplo, si se revisan referencias clásicas como The Official Methods of Analysis of AOAC International (1) o Standard Methods for the Examination of Water and Wastewater (2) (para nombrar solo dos de las más famosas y utilizadas), se encontrarán procedimientos bien establecidos para determinar diferentes analitos. La mayoría de estos métodos usan lo que llamaremos procesos "sin flujo", nombre que se empleará para contrastar con los métodos en línea o en flujo, desarrollados en las últimas décadas y muy apreciados debido a que son automatizados, rápidos, versátiles, con alta reproducibilidad y límites de detección bajos (3). En este trabajo, mostramos cómo convertir un método clásico sin flujo en un método de análisis por inyección en flujo (FIA). El estudio se lleva a cabo desde la revisión del método tradicional de análisis (sin flujo) hasta la implementación del sistema FIA, mostrando detalladamente la metodología para pasar de un sistema al otro, las dificultades del proceso y las ventajas del sistema FIA. El estudio incluye la caracterización del método FIA, para lo cual se usaron los parámetros de calidad básicos de un método de análisis químico: línea base, nivel de ruido, intervalo de linealidad, límite de detección, reproducibilidad y selectividad (4).
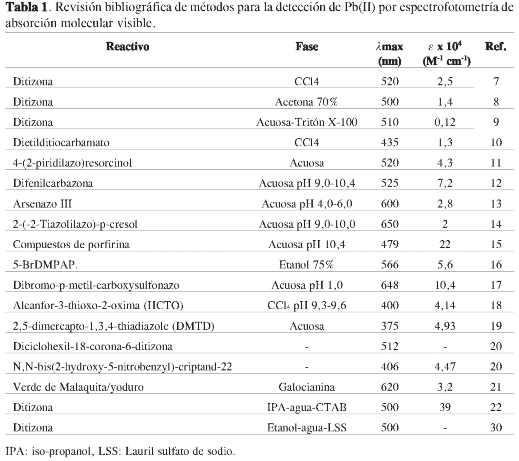
Pb(II) con ditizona, debido a tres razones: 1. El plomo es un analito de particular interés por sus efectos adversos sobre los seres vivos (5), 2. La determinación de Pb con ditizona, como reactivo cromogénico, es una reacción bien establecida, lo que genera una técnica de análisis, accesible, barata, tradicional y bien documentada (6), 3. El sistema espectrofotométrico Pb-ditizona ha cobrado interés en los últimos años, particularmente por la búsqueda de la sustitución del disolvente orgánico (organoclorado), por otros medios más amigables con el medio ambiente (agua más un surfactante) y por la posibilidad de automatizar el método (7-30).
MATERIALES Y MÉTODOS Instrumentación
Se utilizó un sistema FIAlab 2500 (bomba peristáltica de cuatro canales y una válvula de seis vías y dos posiciones con mangueras de 1,02 mm de diámetro interno), acoplado a un espectrofotómetro UV-Vis Ocean Optics USB2000. El pH se midió con un pH-metro CG818 SCHOOT GERATE.
Reactivos
Se preparó una solución patrón de 100,0 ± 0,1 mg L-1 en Pb(II), disolviendo la cantidad necesaria de Pb(NO3)2, A.R, Merck, en agua desionizada. Las demás soluciones se prepararon pesando las cantidades adecuadas a partir de ditizona, Hopkin & Williams Ltd.; bromuro de cetiltrimetil amonio (CTAB), con pureza grado reactivo (99%), Sigma; 2-propanol R.A. Merck; Acetona A.R (ACS) y HCl GR ACS EM Science.
Procedimiento experimental
Como punto de partida se hizo una revisión bibliográfica sobre las opciones para la determinación colorimétrica de Pb(II). Se seleccionaron tres métodos de análisis: (A) ditizona 1,90 ± 0,05 x 10-4 M disuelta en Tritón X-100 al 5% en HCl 0,1 M, la solución se mantuvo en oscuridad; (B)ditizona3,90 ± 0,01 x 10-4 M disuelta en acetona al 70% en agua, en este caso se incluyó una solución reguladora de pH y un complejante, KCN 0,046 M en sodio barbital al 0,3 % y; (C) ditizona 1,95 ± 0,05 x 10-3 M disuelta en isopropanol, solución que se mezcla posteriormente con CTAB (concentración variable entre 0,04 y 0,3 M). La solución de CTAB se preparó agregando la cantidad necesaria de CTAB en agua, lo que forma una suspensión que luego fue sometida a ultrasonido por 30 minutos, se afora con agua destilada y se obtiene una solución transparente. Todas las soluciones se prepararon frescas cada día.
Optimización. Se realizó siguiendo el método de variación de un solo parámetro mientras los otros permanecen constantes, lo que permitió una exploración razonable de toda la superficie de respuesta. Así se obtiene una visión clara del comportamiento global del sistema.
Experimentos sin flujo. En una serie de matraces aforados se introdujo el volumen necesario de cada reactivo para que las concentraciones finales fuesen: CTAB 0,120 ± 0,002 M, ditizona 3,0 ± 0,1 x 10-4 M y HCl 4,00 ± 0,02 x 10-4 M. La concentración del Pb(II) se estudió en intervalos amplios de concentración para encontrar la región de comportamiento lineal entre absorbancia y concentración. Los espectros se registraron entre 300 y 700 nm.
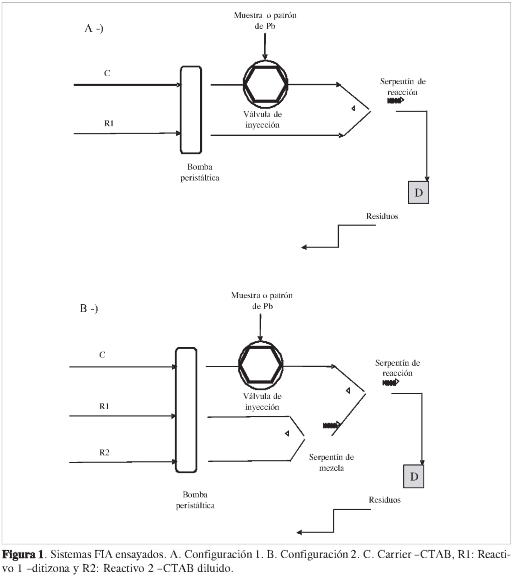
Experimentos con flujo. En la metodología FIA, se estudiaron dos configuraciones. En la primera se tenían dos canales (Figura 1A): uno para la solución portadora CTAB 0,12 M en HCl 8,0 x 10-4 M (de aquí en adelante C, del inglés Carrier), y uno para la ditizona en isopropanol (de aquí en adelante R1, de Reactivo 1), unabombaperistáltica, unaválvula de inyección, un serpentín de reacción en donde se mezclan los reactivos y el detector UV-Vis, D. En C se inyecta la muestra de Pb(II), que posteriormente se mezcla con R1. En la segunda configuración se tienen tres canales (Figura 1B): uno para el CTAB, de la mismaconcentración del caso anterior, R1; otro para la ditizo na, R2, igual concentración que la anterior; y otro para la solución portadora, C, que ahora es una solución diluida de CTAB (0,01 M en HCl 8,0 x 10-4 M), diferente a la anterior, que busca aumentar la solubilidad del complejo. En este caso, los canales R1 y R2 (CTAB y ditizona) se mezclan en un serpentín, antes de unirse al canal C, con lo que se favorece la solubilización de la ditizona, antes de la reacción con el Pb(II), cosa que no sucedía en la primera configuración.
Los picos FIA se obtuvieron en periodos de 1,4 s a la longitud de máxima absorción del complejo: 500 nm. Igualmente, se optimizaron las variables que afectan la señal desde el punto de vista químico y las que afectan directamente a los métodos FIA, parámetros hidrodinámicos (3). Para la optimización de estos últimos se utilizaron las siguientes condiciones experimentales: Pb(II) 4,0 mg L-1; R1, CTAB 0,12 M en HCl 8,0 x 10-4 M a un flujo de 2,9 mL min-1; R2, ditizona en isopropanol 1,2 x 10-4 M aun flujo de 2,7 mL min-1; C, solución portadora, CTAB 0,01 M en HCl 8,0 x 10-4 M aun flujo de 2,9 mL min-1; longitud de los serpentines 165,5 ± 0,1 cm y volumen de inyección 81,6 ± 0,1 µL; las cuales permanecieron constantes, excepto para el parámetro que se ensayaba. Además, cada experimento se repitió entre 3 y 4 veces. Los parámetros optimizados y los intervalos utilizados fueron: 1. Forma de los serpentines: se probaron dos configuraciones, enrollado y recto; 2. Longitud de los serpentines : se evaluaron diferentes longitudes de serpentines, entre 40 y 165,5 cm; 3. Volumen de inyección: se optimizó entre 32 y 82 µL, utilizando un patrón de Pb(II) de 8 mg L-1;y 4. Velocidad de flujo: se exploró entre 3,0 y 14,5 mL min-1.
RESULTADOS Y DISCUSIÓN
El trabajo realizado se dividió en dos partes. En la primera se estandarizó, bajo las condiciones de trabajo de nuestro laboratorio, un método clásico de análisis químico de Pb usando espectrofotometría visible. La segunda parte consistió en la implementación del método clásico en una metodología en flujo para la determinación de Pb(II). La revisión bibliográfica, resumida en la Tabla 1, nos da un panorama de los diferentes caminos que podemos seguir. Del abanico de posibilidades que existen en la literatura, se destacan los métodos que evitan el uso de solventes halogenados (como el tetracloruro de carbono), de uso común en los métodos espectrofotométricos con ditizona (23). Una alternativa a estos disolventes, es usar un surfactante o un solvente miscible con agua que sea capaz de solubilizar al agente complejante. Así, tres opciones de la Tabla 1 resultaron llamativas: ditizona-tritón X-100, propuesto por Paradkar y Williams (9), ditizona-Acetona 70% p/v, propuesto por Diaper y Kuksis (8), y ditizona-isopropanol-CTAB, propuesto por Khan, Ahmed y Bhanger (22). Si bien estos tres métodos no presentan las absortividades molares más altas de la revisión bibliográfica realizada, su selectividad al plomo, por usar ditizona, es comparable con las obtenidas con otros ligantes; por ejemplo, 4-(2-piridilazo) resorcinol (PAR) (24). Sin embargo, el criterio más importante es usar reactivos menos tóxicos y más fáciles de degradar, en concordancia con el concepto de química limpia (25), que busca eliminar el uso de disolventes como CCl4, utilizado en el método tradicional como disolvente de la ditizona (26). El trabajo experimental empezó probando el sistema ditizona-tritón X-100, que en las condiciones del presente trabajo (ditizona saturada entritón X-100al5,0% en HCl 0,1 M) mostró inestabilidad en el tiempo, pues el pico característico de la ditizona a 600 nm desaparecía aproximadamente a los 11 minutos de preparada la solución. Evidentemente, en este caso la línea base cambia bruscamente con el tiempo; por esta razón se descartó esta opción. El segundo caso, ditizona-acetona 70% p/v, mostró linealidad aceptable con un valor de R2 = 0,979, pero en las condiciones de trabajo usadas, el intervalo lineal fue muy estrecho (0,50 a 4,0 mg L-1), además de que las soluciones de prueba generaron burbujas. Esta situación es inaceptable para la detección espectrofotométrica (27), por lo cual este método se descartó. Finalmente, se probó la mezcla ditizona-iso-propanol-CTAB, que arrojó una relación lineal con un R2 = 0,952, para el intervalode0,50a10,0mgL-1 de Pb(II), significativamente mayor que el obtenido para el sistema acetona 70% p/v. A partir de estos resultados, el método espectrofotométrico seleccionado para la implementación del método de análisis en flujo (FIA) fue la mezcla ditizona-iso-propanol-CTAB. Sin embargo, antes de empezar el trabajo en flujo y para tener un punto de comparación, se optimizó el método escogido en condiciones sin flujo.
Método espectrofotométrico sin flujo
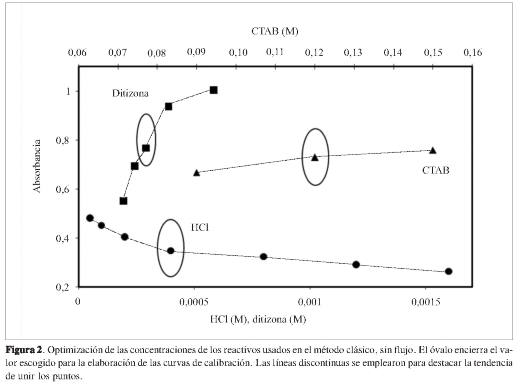
En primer lugar, se estudiaron los efectos de las concentraciones de los componentes utilizados en el sistema (CTAB ditizona y HCl) en la absorción del complejo. La Figura 2 resume los resultados obtenidos al variar cada componente.
Se observó que al aumentar la concentración de CTAB también aumentaba la absorción del complejo Pb(II)-ditizona; sin embargo, con cantidades altas de CTAB se presentó un precipitado en algunos experimentos, lo cual es inconveniente, entre otros aspectos porque puede taponar los canales de inyección del sistema FIA. Por tanto, la concentración óptima escogida fue 0,120 ± 0,002 M, un valor intermedio (Figura 2 - CTAB).
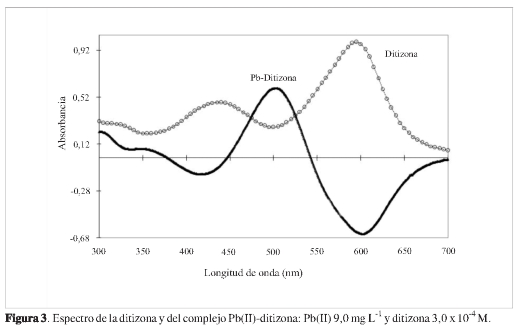
Al variar la concentración de la ditizona, la absorbancia del complejo sube cuando aumenta su concentración. Asimismo, aumenta la línea base, lo que lleva a que sea pequeño el cambio neto en la altura del pico. Igualmente, una mayor concentración de ditizona puede generar precipitados indeseables; por consiguiente, para este experimento, se seleccionó una concentración de ditizona de 3,0 x 10-4 M (Figura 2 -ditizona). En cuanto a la concentración de HCl, a menor concentración de ácido, aumenta la absortividad molar del complejo; sin embargo, la solubilidad del CTAB disminuyó a pH básico; en consecuencia, el compromiso entre estas dos tendencias contrarias se alcanzó con una concentración de HCl de 4,00 ± 0,02 x10-4M, pues con ella se garantiza la solubilidad del CTAB y mejor reproducibilidad (al evitar posibles precipitados). En la Figura 3 se puede observar el espectro del complejo Pb(II)-ditizona en las condiciones previamente optimizadas. Es clara la gran absorción de la ditizona, al extremo que cuando se forma el complejo, se obtienen absorbancias negativas; no obstante, este hecho fue poco relevante, dado que se trabajó con el máximo de absorción, 500 nm.
Linealidad: con las condiciones óptimas encontradas anteriormente, se evaluó la linealidad mediante curvas de calibración de patrón externo usando seis soluciones de Pb(II) entre 1,0 y 10,0 mg L-1 y ajustando los resultados obtenidos a una línea recta (absorbancia vs concentración), lo cual arrojó los siguientes resultados: pendiente: 0,0652 ± 0,0005 UA3 mg-1 L; intercepto: 0,0117 ± 0,0005 UA yR2 0,9976. El coeficiente de absortividad molar promedio encontrado fue 1,37 ±0,01x104M-1 cm-1.
Método espectrofotométrico en flujo (FIA)
En esta etapa se debe tener en cuenta que al pasar al método en flujo, aumenta el número de parámetros que se deben optimizar, dado que debemos incluir variables como flujo y volumen de muestra, las cuales no existen en el método clásico. Las concentraciones y las cantidades utilizadas en el método clásico, sin flujo, cambian al llevarlas a una metodología en continuo (FIA), ya que el proceso incluye la mezcla de varios flujos (generalmente uno por cada reactivo diferente) que al mezclarse generan una dilución proporcional al números de flujos diferentes (canales) y al caudal de estos. El modelo más sencillo para este comportamiento se presenta en la ecuación [1], aplicada a sistemas FIA (28). En general, corresponde a reactores en flujo continuo bien agitados o CSTR (Continuous Stirred Tank Reactor), concepto ampliamente estudiado por los ingenieros químicos (29).
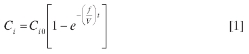
En la ecuación [1], Cies la concentración del reactivo o analito que llega al detector, Ci0es la concentración inicial del i-ésimo reactivo o analito, fes el flujo total de los canales involucrados, Ves el volumen del sistema de reacción y t es el tiempo. Esta ecuación muestra que la selección de los canales, su número y disposición, tendrá efectos marcados en los resultados finales. Los efectos se estudiaron usando las dos configuraciones FIA (Figura 1). La configuración 1A mostró inestabilidad en la línea base, lo que indica que la mezcla de la fase orgánica (ditizona en iso-propanol) y la fase acuosa no era buena a pesar del surfactante CTAB; por tanto, fue necesario realizar un proceso de mezclado efectivo y, por consiguiente, un cambio en la configuración. La Figura 1B muestra la configuración propuesta para mejorar esta situación. Se observa un nuevo canal, R2 (Reactivo 2), por el que circula la solución de ditizona (manteniendo la misma concentración). Este nuevo canal se mezcla con el canal R1, por donde circula CTAB en HCl (de igual concentración que en la configuración 1); así, se asegura una buena mezcla y la solubilización de la ditizona en la fase acuosa. Finalmente, el canal C lleva una solución diluida adicional de CTAB (0,01 M en HCl 8,0 x 10-4 M), la cual se unirá con la mezcla previa. Así se consiguió una mezcla homogénea que redujo significativamente el ruido de la señal y una línea base más plana y estable; por tanto, resultados más reproducibles. Esto confirmó que la causa de los problemas que presentaba la configuración 1 era la presencia de partículas de ditizona, complejo Pb-ditizona o CTAB que no se solubilizaban. Una vez seleccionada la configuración del sistema FIA (Figura 1B), se optimizaron las demás variables: sistema de detección y las condiciones hidrodinámicas y químicas del sistema.
Optimización del sistema de detección. El espectrofotómetro usado -un UV-Vis Ocean-Optics- tiene un detector de arreglo de diodos que permite el ajuste del tiempo de barrido (usualmente entre 1 y 2000 milisegundos para recorrer de 200 a 800 nm), el número de barridos que se toman para promediar y el intervalo de puntos para suavizar el espectro. El tiempo de toma de un barrido multiplicado por el número de barridos da el tiempo de toma del espectro, que no debe ser muy alto, pues la señal a medir es transitoria, ni muy bajo, pues la línea base se hace muy inestable y baja la reproducibilidad. Usando un tiempo de 1,4 s por espectro (700 ms por barrido por 2 barridos) se consigue una señal aceptable, libre de ruido y suficientemente rápida. El parámetro analítico fue la altura del pico FIA; en todos los experimentos se tuvo especial cuidado de tener una línea base en cero (salvo el ruido aleatorio), de manera que la absorbancia fuese una medida directa de la altura de los picos FIA.
Parámetros hidrodinámicos del sistema FIA
Los parámetros hidrodinámicos considerados en este trabajo fueron la forma de los serpentines de mezcla y de reacción, la longitud de dichos serpentines, el volumen de inyección de muestra y la velocidad de flujo.
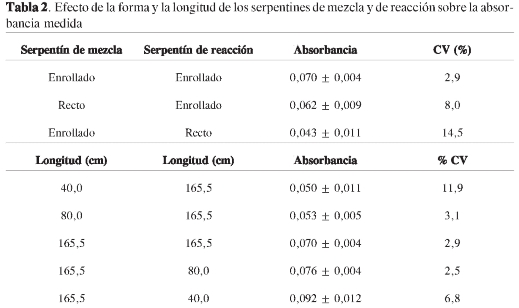
En sistemas FIA, uno de los punto más crítico es el serpentín donde se llevan a cabo las mezclas y las reacciones del sistema; en nuestro caso, el serpentín de reacción es donde se forma el complejo Pb(II)-ditizona. Se probaron dos tipos de serpentín: rectos y enrollados. Los resultados obtenidos se presentan en la Tabla 2, la cual muestra que la mejor configuración son los serpentines de mezcla y de reacción enrollados, ya que para igual concentración de plomo e iguales condiciones experimentales se generan mayores absorbancias y menor variación en las medidas.
Al variar la longitud de los serpentines de mezcla y de reacción se observa que a mayor longitud del serpentín de mezcla se favorece el aumento de la señal y de la reproducibilidad (Tabla 2), debido a una mayor homogeneidad de la solución que fluye, pues caminos más largos producen soluciones más homogéneas. En consecuencia, la línea base presenta menos ruido. La longitud escogida para el serpentín de mezcla fue 165,5 cm, la más larga de las estudiadas. No se probaron serpentines más largos a pesar de la tendencia a aumentar la señal con la longitud de estos, porque esto también implica mayor consumo de reactivos y mayor volumen de desechos. Por consiguiente, se sacrificó el mejoramiento de la señal en aras de la química verde, uno de los parámetros que se quieren hacer prevalecer en este estudio. El caso del serpentín de reacción fue más complicado: se obtuvo mayor señal al disminuir la longitud, pero se presentó mayor fluctuación en la absorbancia (mayor coeficiente de variación), lo que corresponde a picos más intensos y con más ruido (menor homogeneidad de la solución); por el contrario, con serpentines largos se obtienen picos más pequeños (suavizados por la homogeneización de la solución) y con menos ruido. En este trabajo hemos sacrificado la sensibilidad en favor de la reproducibilidad; por tanto, en el serpentín de reacción también se usará una longitud de 165,5 cm.
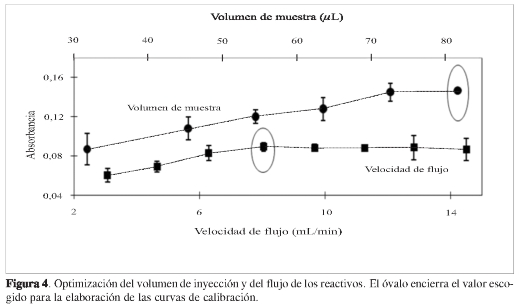
Respecto al volumen de muestra inyectado (Figura 4), se observa que al aumentarlo también aumenta la señal, tendiendo a ser constante a volúmenes altos. En el intervalo de volúmenes evaluados se escogió como valor óptimo el más alto de los estudiados: 81,7 ±0,1 µL. De nuevo, al igual que en el caso del serpentín de mezcla, si bien la tendencia indica que volúmenes de muestra mayores dan mejores señales, esto va en contra de la aplicabilidad del método para el caso de muestras de volumen limitado; por ejemplo sangre u orina, dos matrices en las que se espera aplicar la metodología desarrollada. En consecuencia, no se investigaron volúmenes de inyección mayores.
Finalmente, el estudio de la velocidad de flujo reveló que aunque la señal aumenta a flujos altos, cuando estos superan el valor de 8,0 mL min-1 el aumento es casi nulo y la dispersión en las medidas tiende a aumentar (Figura 4); por tanto, para el trabajo experimental realizado se seleccionó el flujo de 8,0 mL min1.
Parámetros químicos del sistema FIA
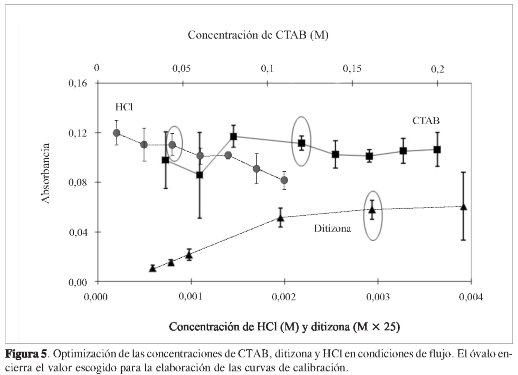
Una vez optimizadas las variables hidrodinámicas del sistema FIA, es necesario evaluar de nuevo, en las mejores condiciones hidrodinámicas FIA, los parámetros químicos optimizados en el sistema clásico sin flujo: concentración de CTAB, ditizona y HCl. La Figura 5 muestra el comportamiento de la señal de una solución de Pb(II) de 5,0 ± 0,1 mg L-1, cuando se cambia estos parámetros.
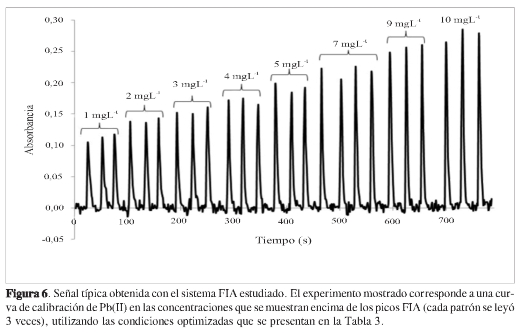
La concentración del CTAB se varió entre 0,04 y 0,2 M; en este intervalo, no se observa tendencia alguna con el cambio de la concentración de CTAB. Sin embargo, la dispersión es significativamente mayor a concentraciones extremas respecto de los valores intermedios. De acuerdo con este resultado, se seleccionó la concentración de 0,12 M, valor igual al usado en el sistema sin flujo, que además presenta dispersión baja (Figura 5 -CTAB). La concentración de la ditizona se estudió entre de 2,3 x 105 y 3,0 x 104 M. Se encontró que al aumentar la concentración, la señal aumenta, con tendencia a permanecer constante por encima de 7,8 x 10-5M (Figura 5 -ditizona). Sin embargo, lo más destacado es que al llegar a 1,6 x 10-4 M se presenta una dispersión muy grande, lo cual se puede atribuir a una competencia entre las estequiometrías Pb(II)-ditizona 1:1a concentración baja de ditizona y 1:2 a concentraciones de ditizona alta. A partir de estos resultados se decidió usar una concentración de ditizona de 1,2 x 10-4 M, que permite obtener señales considerablemente altas con dispersión baja. En cuanto a la concentración de HCl, se observó comportamiento igual al del caso sin flujo, aumento de la absorbancia al aumentar la concentración del ácido (Figura 5 -HCl). Se seleccionó una concentración de HCl, tal que se obtenía un pH de 3,1 en la solución final, ya que es un valor que favorece la solubilidad del CTAB, el componente más importante en este sistema, debido a su papel en la solubilización del complejo. Además, decidimos ser cautelosos con el aumento del pH, ya que puede causar precipitados que taponan el sistema y aparentes aumentos de la señal. Una señal característica del sistema en flujo optimizado se muestra en la Figura 6; los picos FIA corresponden a soluciones patrón de Pb(II) en concentraciones de 1,0 a 10 mg L-1, inyectadas por triplicado en un tiempo de 13 minutos.
Parámetros analíticos para la cuantificación, sistema FIA
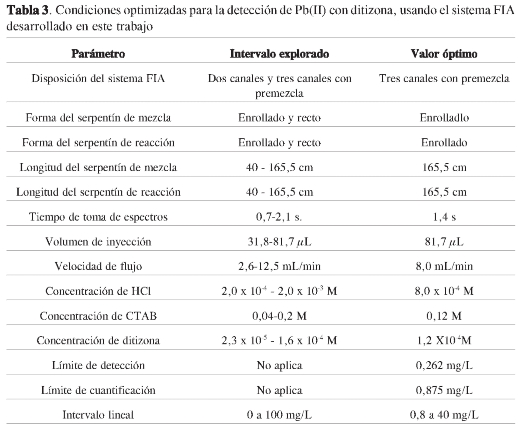
Usando el sistema optimizado, según los valores antes descritos y que se resumen en la Tabla 3, se determinó el límite de detección y de cuantificación, el intervalo lineal, la precisión en la medida, la reproducibilidad de las curvas de calibración y los interferentes.
Límite de detección y de cuantificación. Se inyectó una solución blanco, repitiendo el procedimiento 9 veces y se obtuvo una desviación estándar de las medidas de 0,002 UA, que representan un límite de detección de 0,3 mg L-1 y un límite de cuantificación de 0,9 mg L-1,se-gún el criterio IUPAC (31).
Intervalo lineal. Se inyectaron patrones de Pb(II) entre 0,0 y 100,0 mg L-1.
Los resultados muestran comportamiento lineal hasta 40 mg L-1, luego del cual empieza una clara curvatura. La regresión lineal para el intervalo de 0,9 a 40,0 mg L-1 arrojó: pendiente = 0,0153 ± 0.0004 UA mg-1 L, intercepto = 0,0043 ± 0.0004 UA y R2 = 0,9865.
Precisiónenlamedida. Se inyectó una muestra de Pb(II) de 5,0 ± 0,1 mg L-1,re-pitiendo el procedimiento 11 veces. El coeficiente de variación en las medidas obtenidas fue 3,1%.
Interferentes. Se estudió la interferencia de los metales Cd, Cu, Fe, Hg, Ni y Zn. Cada uno de ellos se inyectó en las condiciones optimizadas del sistema FIA y en concentración de 5,0 ± 0,1 mg L-1, con presencia y sin presencia de Pb(II). La absorbancia se determinó a 500 nm. La interferencia del Cd, Cu y Hg fue evidente; el Zn, Fe y Ni presentaron menor interferencia. Es interesante destacar que, además de que los interferentes absorben a la longitud de onda de trabajo cuando están solos, tal absorbancia no se suma exactamente a la del Pb(II), cuando se mezclan con este, es decir, existe una interacción adicional de tipo no lineal que afecta las medidas. Se debe aclarar que los interferentes se estudiaron con el objetivo de completar la visión global del experimento, puesto que tales interferencias son cruciales para un análisis. Sin embargo, y dada la extensión y el objetivo del presente trabajo, ésta etapa se completará en un trabajo próximo.
Uso de la metodología desarrollada en muestras reales. Usando las condiciones de trabajo encontradas anteriormente, se determinó Pb(II) en agua potable de botella y de la llave del laboratorio, a las cuales se le adicionó un patrón para obtener 2,0 ± 0,1 mg L-1 de Pb(II) en solución. Para el agua de llave, el blanco, una muestra del agua usada sin adición de Pb(II), presentó una absorbancia de 0,13 ±0,01 UA, lo que sería equivalente a 6,6 mg L-1 de plomo. Es claro que no se esperan tales concentraciones de Pb en agua potable; por consiguiente, es segura la interferencia de metales como hierro y zinc, particularmente presentes si las tuberías son metálicas, por lo que este análisis se contrastó con espectroscopia de absorción atómica (AAS). En ambas muestras se encontraron porcentajes de recuperación comparables. En el agua potable de botella, el porcentaje de recuperación fue el 99%, mientras que el análisis de la muestra de la llave del laboratorio arrojó un porcentaje de recuperación del 92% por ambas técnicas.
CONCLUSIONES
Este artículo muestra en detalle el procedimiento metodológico para la implementación del análisis por inyección en flujo (FIA) de Pb(II) con ditizona en agua, usando un surfactante para la solubilización del complejo. En la primera parte, se optimizó el sistema clásico sin flujo, haciendo énfasis en las concentraciones de los reactivos usados para el desarrollo de color y para la solubilización del complejo. Así, se encontraron como valores óptimos: CTAB = 0,120 ± 0,002 M, ditizona = 3,0 ± 0,1 x 10-4 M y HCl = 4,00 ± 0,02 x10-4 M. Con estas condiciones, como punto de partida para la comparación, se inició el proceso de optimización del sistema FIA, que incluyó -además de los parámetros de optimización mencionados-los propios de los sistemas FIA, así como condiciones hidrodinámicas y geométricas. El trabajo realizado condujo a una configuración FIA de tres canales en los que se inyectaba CTAB = 0,120 ± 0,002 M, ditizona = 1,2 ± 0,1 x 10-4 M, y HCl = 8,00 ± 0,02 x 10-4 M, los cuales difieren del sistema sin flujo (excepto para el caso del CTAB), poniendo en evidencia la necesidad de reoptimizar tales parámetros cuando se pasa de un sistemaclásico sin flujo a un sistemaFIA. Utilizando las condiciones FIA óptimas, se obtuvieron curvas de calibración por patrón externo y adición estándar, lineales entre 0,9 y 40 mg L-1, límite de detección de 0,3 mg L-1 y límite de cuantificación de 0,9 mg L-1. El volumen de muestra inyectado óptimo fue 81,7 µL a una velocidad de 8,0 mL min-1.Sise comparan estos dos últimos valores con otros sistemas FIA, como el reportado recientemente por Ruengsitagoon, Chisvert y Liawruangrath (30), quienes presentan un sistema en flujo para determinar Pb usando laurilsulfato de sodio como medio surfactante, que solo alcanza una velocidad de flujo de 2,0 mL min-1 y que usa un volumen de muestra de 150 µL, mayor que el nuestro, se puede ver lo significativo del trabajo realizado: velocidad de flujo mayor (que implica análisis en tiempos más cortos) y volumen de inyección más pequeño, lo que es conveniente en los casos en que se dispone de cantidades limitadas de la muestra. Además, las interferencias más importantes del grupo de cationes estudiados fueron Cd, Cu y Hg y, en menor medida, Zn, Fe y Ni. Finalmente, se probó la metodología, aplicándola a muestras de agua embotellada y agua de la llave del laboratorio en donde se realizó el trabajo, encontrando 99 y 92% de recuperación, respectivamente. Así se realizó el proceso completo desde la revisión bibliográfica hasta la aplicación del método optimizado a muestras reales, obteniendo un método rápido, confiable y potencialmente útil para trabajos de rutina en laboratorios de análisis químico. Por supuesto, el trabajo se puede ampliar a muestras más complejas, incorporando sistemas de tratamiento de interferencias sobre los que se trabajará en el futuro.
AGRADECIMIENTOS
Los autores agradecen la financiación otorgada por la División de Investigación (DIB) de la Universidad Nacional de Colombia, con la cual se compró el sistema FIA-Lab 2500, proyecto Calorimetría y Termodinámica de Procesos Irreversibles, código QUIPU 20101009550, y los reactivos proyecto Desarrollo de una Metodología Analítica para la Determinación de Metales Tóxicos en Matrices de Interés: Juguetes, Aguas, Suelos, Plásticos, Alimentos y Cosméticos, código QUIPU 202010011557.
3 UA: Unidades de absorbancia.
REFERENCIAS BIBLIOGRÁFICAS
1. Association of Official Analytical Chemists (AOAC). Official methods of analysis of the Association of Official Analytical Chemists. 14th ed. Arlington, Virginia. 1984. [ Links ]
2. American Public Health Association (APHA). American Water Work Association (AWWA). Water Environment Federation (WEF). Standard methods for the examination of water and wastewater. 21st ed. Washington D.C. 2005. [ Links ]
3. Hansen, E.; Miró, M. How flow-injection analysis (FIA) over the past 25 years has changed our way of performing chemical analyses. Trends in Analytical Chemistry. 2007. 26: 18-26. [ Links ]
4. Skoog, D.; Holler, F.; Crouch, S. Principios de análisis instrumental. 6.a ed., México, D.F., Cengage Learning. 2008. [ Links ]
5. Mayer, M.; Wilson, D. Health and safety The downward trend in lead levels. Journal of Power Sources. 1998. 73: 17-22. [ Links ]
6. Snyder, L. Improved dithizone method for determination of lead. Anal. Chem., 1947, 19: 684-687. [ Links ]
7. Marczenko, Z. Spectrophotometric determination of elements. New York. 1973. p. 110. [ Links ]
8. Diaper, G.; Kuksis, A.; Determination of lead by dithizone in the single phase water-acetone system. Can. J. Chem. 1957. 35: 1278-1284. [ Links ]
9. Paradkar, R.; Williams, R. Micellar colorimetric determination of dithizone metal chelates. Anal. Chem. 1994, 66: 2752-2756. [ Links ]
10. Tertoolen, J.; Detmar, D.; Buijze, C.; Die spektrophotometrische Bestimmung von Kleinen Mengen Blei in Aluminium- und Kup ferlegierungen, Eisen und Stahl und anderen Materialien. Z. Analit. Chem. 1959. 167: 401-408. [ Links ]
11. Dagnall, R.; West, T.; Young, P. Determination of lead with 4-(2-pyridylazo)-resorcinolI. Spectrophotometry and solvent extraction. Talanta. 1965. 12:583-588. [ Links ]
12. Trinder, N. The use of diphenylcarbazone for the determination of microgram amounts of lead. Analyst. 1966. 91: 587-590. [ Links ]
13. V. Michaylova and N. Kuleva. Arsenazo III as a spectrophotometric reagent for determination of lead. Talanta, 1980. 27: 63-66. [ Links ]
14. Ferreira, S.; Lobo, I.; Costa, A. 2-(2-Thiazolylazo)-p-cresol (TAC) as a reagent for the spectrophotometric determination of lead(II). Anal. Lett. 1991. 24: 1675-1684. [ Links ]
15. Zaijun, L.; Jian, T.; Jiaomai, P.; The determination of lead in preserved food by spectrophotometry with dibromohydroxyphenylporphyrin. Food Control. 2004. 15: 565-570. [ Links ]
16. Luconi, M.; Silva, M. Flow injection spectrophotometric analysis of lead in human saliva for monitoring environmental pollution. Talanta. 2001. 54: 45-52. [ Links ]
17. Guozhen, F; Yongwen, L.; Shuangming, Meng.; Yong, Guo. Spectrophotometric determination of lead in vegetables with dibromo-p-methyl-carboxysulfonazo. Talanta. 2002. 57: 1155-1160. [ Links ]
18. Ninan, S.; Varadarajan, A.; Jadhav, S.B.; Kulkarni, A.J.; Malve, S.P. Spectrochimica Acta Part A. 1999. 55: 825-831. [ Links ]
19. Jamaluddin, A. M.; Al Mamun, M. Spectrophotometric determination of lead in industrial, environmental, biological and soil samples using 2,5-dimercapto-1,3,4-thiadiazole. Talanta. 2001. 55: 43-54. [ Links ]
20. Zaijun, L.; Zhengzhong, Z.; Tang, J.; Jiaomai, P. Meso-tetra-(3,5-di-bromo-4-hydroxylphenyl) porfirina. [T(DBHP)P]. Analyst. 1999. 124: 1227-1231. [ Links ]
21. Lau, K.; McHugh, E.; Baldwin, S.; Diamond, D. Paired emitter-detector light emitting diodes for the measurement of lead(II) and cadmium(II). Analytica Chimica Acta. 2006. 569: 221-226. [ Links ]
22. Khan, H.; Ahmed, M. J.; Bhanger, M.I. A rapid spectrophotometric method for the determination of trace level lead using 1,5-Diphenylthiocarbazone in aqueous Micellar Solutions. Analiytical sciences. 2007. 23: 193-199. [ Links ]
23. Mathre, O.; Sandell E. Lead-dithizone equilibria in water-carbon tetrachloride systems. Talanta. 1964. 11: 295-314. [ Links ]
24. Argekar, A.; Shetty, A.; Extraction of lead(II) with cyanex 302 and its spectrophotometric determination with PAR. Talanta. 1998. 45: 909-915. [ Links ]
25. Fan, J.; Sun Y.; Wang, J.; Fan, M. An organic-reagent-free method for determination of chromium(VI) in steel alloys, sewage sludge and wastewater. Analytica Chimica Acta. 2009. 640: 58-62. [ Links ]
26. Fries, J.; Getrost, H. Organic reagents for trace analysis. Darmstadt, E. Merck. 1975. [ Links ]
27. Harris, D. Quantitative chemical analysis,5th ed. New York, W.H. Freeman and Company.. 1999. [ Links ]
28. Martínez, J. Flow injection analysis of pharmaceuticals automation in the laboratory. Londres, Taylor & Francis e-Library. 2003. [ Links ]
29. Nauman, B. Chemical reactor design. New York, John Wiley & Sons. 1987. [ Links ]
30. Ruengsitagoon, W.; Chisvert, A.; Liawruangrath, S. Flow injection spectrophotometric determination of lead using 1,5-diphenylthiocarbazo-ne in aqueous micellar. Talanta. 2010. 81: 709-713. [ Links ]
31. IUPAC. Compendium of Chemical Terminology. 2nd ed. (the Gold Book). Compiled by A. D. Mc Naught and A. Wilkinson. Blackwell Scientific Publications. Oxford. 1997. XML on-line corrected version: http://goldbook.iupac.org (2006-). Created by M. Nic, J. Jirat, B. Kosata; updates compiled by A. Jenkins. ISBN 0-9678550-9-8, doi:10.1351/goldbook. [ Links ]