Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804On-line version ISSN 2357-3791
Rev.Colomb.Quim. vol.40 no.1 Bogotá Jan./Apr. 2011
DETERMINACIÓN DE LA CINÉTICA DE ADSORCIÓN DE 2,4-DINITROFENOL EN CARBONIZADO DE HUESO BOVINO POR ESPECTROFOTOMETRÍA UV-VIS
DETERMINATION OF THE 2,4-DINITROFENOL ADSORPTION KINETIC ON BOVINE BONE CHAR BY UV-VIS SPECTROPHOTOMETRY
DETERMINAÇÃO DA CINÉTICA DE ADSORÇÃO DE 2,4-DINITROFENOL EM CARBONIZADO DE OSSO BOVINO POR ESPECTROFOTOMETRÍA UV-VIS
Yesid S. Murillo1, Liliana Giraldo1,2, Juan Carlos Moreno3
1 Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia, sede Bogotá, Carrera 30 No. 45-03, Bogotá, Colombia.
3 Departamento de Química, Facultad de Ciencias, Universidad de los Andes, Bogotá, Colombia.
Recibido: 30/11/10 - Aceptado: 15/04/11
RESUMEN
Se obtuvo un material adsorbente mediante tratamiento térmico de hueso bovino. Este carbonizado presenta un área superficial de 171 m2g-1, características texturales de un material mesoporoso y presencia del componente principal de la matriz ósea: hidroxiapatita.
Se llevó a cabo la adsorción de 2,4-di-nitrofenol sobre el carbonizado en solución acuosa, en función del tiempo, y se determinó la cinética de adsorción por los modelos de seudo primer y seudo segundo orden. Además, se identificó el mecanismo de difusión mediante el modelo de difusión intrapartícula.
Se observa que los datos cinéticos experimentales tienen mayor correlación con el modelo de seudo segundo orden. El modelo de difusión intrapartícula muestra que el proceso de adsorción está gobernado por la etapa en donde el mecanismo de difusión de partícula es la limitante de la velocidad.
Palabras clave: cinética de adsorción, 2,4-dinitrofenol, carbonizado de hueso bovino, adsorción desde solución.
ABSTRACT
Adsorbent material was obtained by heat treatment of bovine bone. This char has a surface area of 171 m2g-1, textural characteristics of a mesoporous material, and presence of the principal component of bone matrix-hidroxiapatite.
The 2,4-dinitrophenol adsorption from aqueous solution in function of time was carried on the charred and determined the kinetics of adsorption by models of pseudo-first and pseudo second order. Additionally, we identified the diffusion mechanism through intraparticle diffusion model.
The experimental kinetic data are more correlated with the pseudo second order model. The intraparticle diffusion model shows that the adsorption process is governed by stage where the diffusion particle mechanism is the rate-limiting.
Key words: Kinetic adsorption, 2,4-dinitrophenol, char bovine bone, adsorption from solution.
RESUMO
Se obteve um material adsorbente mediante tratamento térmico de osso bovino. Este carbonizado apresenta um área superficial de 171 m2g-1, características texturais de um material mesoporoso e presença do componente principal da matriz óssea: hidroxiapatita.
A adsorção de 2,4-dinitrofenol desde solução acuosa, em função do tempo, se levou a cabo sobre o carbonizado e se determinou a cinética de adsorção pelos modelos de seudo primeiro e seudo segundo ordem. Além disso, identifica-se o mecanismo de difusão mediante o modelo de difusão intrapartícula.
Se observa que os dados cinéticos experimentais têm maior correlação com o modelo de seudo segundo ordem. O modelo de difusão intrapartícula mostra que o processo de adsorção está governado pela etapa onde o mecanismo de difusão de partícula é a limitante da velocidade.
Palavras-chave: cinética de adsorção, 2,4-dinitrofenol, carbonizado de osso bovino, adsorção desde solução.
INTRODUCCIÓN
La adsorción es un método sencillo y atractivo para la eliminación de contaminantes en fase acuosa, debido a su alta eficiencia y fácil manejo. La viabilidad económica de estos procesos puede alcanzarse mediante la utilización de adsorbentes obtenidos de desechos industriales (1).
La normativa sobre manejo de subproductos de industrias cárnicas ha dispuesto la incineración como método de eliminación, debido a que se consideran biodegradables y suponen un riesgo ambiental y sanitario, puesto que con su disposición pueden contaminar aire, suelo y cuerpos de agua (2).
Actualmente, los carbonizados de hueso bovino (CHB) han recibido atención de la industria de tratamientos de aguas residuales, debido a sus ventajas frente a otros adsorbentes, entre las que se citan su bajo costo y versatilidad adsorbente para una amplia variedad de contaminantes (3). Por esta razón, la obtención de CHB como adsorbente es una alternativa a las problemáticas ambientales porque permite utilizar un subproducto y darle un valor adicional aprovechando sus propiedades adsorbentes para una amplia variedad de compuestos electrolitos (4).
En el mundo, las aguas naturales están contaminadas con diversos compuestos tóxicos, entre estos los nitrofenoles. Comercialmente, el nitrofenol más importante es el 2,4-dinitrofenol (DNF) que se usa para fabricar tinturas, preservativos para madera, explosivos, sustancias para controlar insectos y otros productos químicos (5, 6). Estos compuestos son altamente tóxicos para el ser humano y mamíferos, dado que pueden formar meta-hemoglobina y son potentes desacoplantes de la fosforilación oxidativa (7).
Por consiguiente, es importante determinar la cinética de adsorción para conocer cómo varia la concentración de DNF en función del tiempo para una proporción dada entre la cantidad adsorbible y el adsorbente. La cinética de adsorción permite conocer el tiempo en que se realiza el proceso y ha de practicarse antes de la determinación de una isoterma de adsorción.
Puesto que se trabaja con solución, se tienen en cuenta los factores que influyen en el proceso, ya que el tiempo necesario para alcanzar el equilibrio está en función de las características del adsorbente y del adsorbato, de la química de la disolución, de la temperatura y del pH (8).
En este estudio se preparó un carbonizado en atmósfera de nitrógeno a partir de hueso bovino que se utilizó en la adsorción de DNF de solución acuosa, Se determinó la cinética de adsorción correlacionando los datos experimentales con los modelos de seudo-primer orden y seudo-segundo orden; además, se identificó el mecanismo de difusión mediante el modelo de difusión intrapartícula.
MATERIALES Y MÉTODOS
Carbonizado de hueso bovino
El carbonizado de hueso granular usado fue preparado a partir de huesos de bovino. Estos se limpian manualmente para eliminar parte de la grasa y carne, se cortan en piezas de aproximadamente 5 a 10 cm. Posteriormente, se realizan lavados con agua destilada a ebullición durante 2 h varias veces para eliminar el exceso de grasa y se transfieren a una estufa a una temperatura de 80 °C durante 48 h. Los huesos secos se parten y muelen a un tamaño de partícula de 2 mm y se les realiza un tratamiento térmico en atmósfera inerte (N2). Este proceso se llevó a cabo en un reactor tubular de lecho fijo desde temperatura ambiente hasta 800 °C, con una velocidad de calentamiento de 3 °C min-1 y un flujo de N2 de 60 cm3 min-1.
Caracterización del carbonizado de hueso bovino
En el material obtenido se determinaron las características texturales, el área superficial y la distribución de tamaño de poro mediante la determinación de isotermas de adsorción de nitrógeno obtenidas a 77 K. Las medidas fueron realizadas en un equipo Autosorb Quantachrome Model 3B.
Se obtuvieron espectros de difracción de rayos X, DRX, macerando el hueso hasta obtener un polvo fino. En el estudio se utilizó una velocidad de 0,1° (2θ) por minuto en un intervalo de 5° < 2θ < 80° en un equipo Rigaku MiniFlex.
Experimentos de adsorción
El adsorbato utilizado en este estudio es 2,4-dinitrofenol (2,4-DNF) de Sigma-Aldrich; las soluciones se prepararon utilizando agua desionizada a 50 °C. Estos experimentos se realizaron en un espectrofotómetro Milton Roy Co. Spectronic Genesys SN. Las distintas concentraciones del adsorbible se obtuvieron de una solución patrón de 500 mg L-1 de DNF.
Para evaluar la cinética de adsorción se puso en contacto una muestra de 50 mg CHB con 4 mL de una solución de DNF a diferente concentración, y se realizó un seguimiento capturando datos en el cambio de concentración en intervalos de 30 min durante 40 h. Las concentraciones de DNF fueron determinadas a una longitud de onda de 354 nm.
RESULTADOS Y DISCUSIÓN
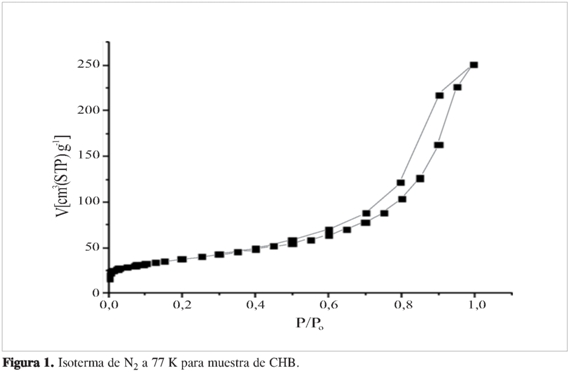
La isoterma de nitrógeno a 77 K del CHB (Figura 1) se clasifica como tipo IV, de acuerdo con la clasificación de la IUPAC. Esta es característica de sólidos mesoporosos (9). Además, presenta una histéresis tipo H3 característica de poros con forma de hendidura, tamaño o forma no uniforme (10). La Tabla 1 muestra los parámetros texturales calculados desde la isoterma de adsorción.
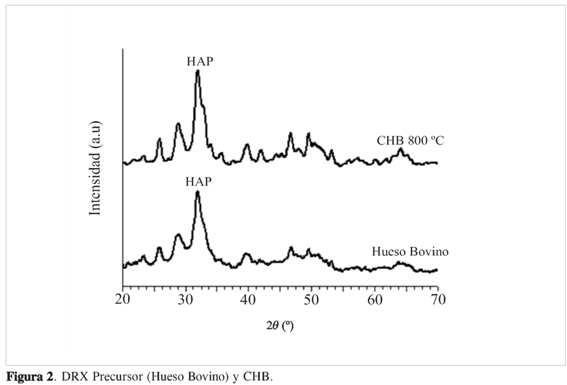
En el estudio de difracción de rayos X (DRX) que se observa en la Figura 2 se comparan los picos obtenidos del precursor y el CHB, donde se observan tres picos muy definidos entre 31,5-33,5°, característicos de las hidroxiapatitas, reportados en la literatura (11, 12). En comparación con los patrones del hueso bovino se observa la presencia de hidroxiapatita nanocristalina en la matriz ósea.
Después del tratamiento térmico se encontró aumento en la altura del pico y disminución en la anchura en comparación con el precursor.
Estudio cinético de adsorción
La cinética describe la velocidad de adsorción del adsorbato en el adsorbente y determina el tiempo en que se alcanza el equilibrio. Los modelos de seudo primer orden y seudo segundo orden se aplicaron en el estudio de adsorción de DNF en carbonizado de hueso bovino.
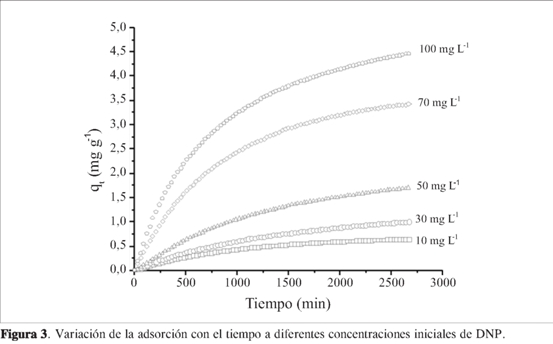
En la Figura 3, se observa la cinética de adsorción de DNF sobre el CHB, donde se graficaron los valores de cantidad adsorbida qt; expresados en mg g-1 en función del tiempo a diferente concentración. Esto permitió determinar que el tiempo de equilibrio para cada concentración fue 40 horas, el cual se establece en el momento en que la variación de la concentración de la solución cambia menos del 0,2%.
Modelo cinético de seudo primer orden
El modelo cinético de seudo primer orden ha sido ampliamente utilizado para predecir la cinética de adsorción (13-15). El modelo dado por Langergren es definido como

Integrando la ecuación 1 con respecto a las condiciones límites q = 0 a t = 0 y q =qe a t = t, se obtiene
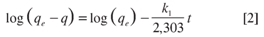
Donde k1 es la constante velocidad de adsorción de Lagergren (min-1); qt y qe son las cantidades de DNF adsorbido a un tiempo t y en el equilibrio respectivamente, t (min) (16).
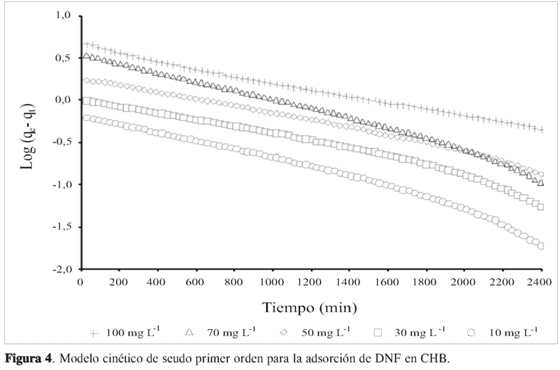
La gráfica de log (qe-qt) en función del tiempo se observa en la Figura 4, en la que el intercepto es log qe y la pendiente es k1. Los valores de k1 y el coeficiente de correlación R2se obtienen de los puntos de adsorción de DNF en el CHB y se presentan en la Tabla 2. Los valores de R2varian de 0,942 a 0,957 para concentraciones iniciales de 10 a 100 mg L-1. Además, se observa que los valores experimentales qeno concuerdan con los valores calculados a partir del modelo. Esto muestra que la adsorción de DNF en CHB no se ajusta a este modelo cinético.
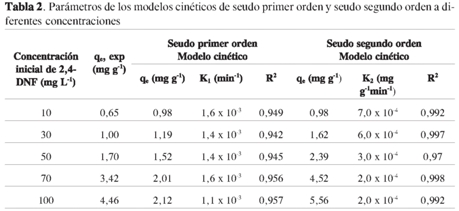
Modelo cinético de seudo segundo orden
La ecuación de seudo segundo orden basado en la adsorción de equilibrio se expresa como

Separando las variables de la ecuación [3] se llega a

Integrando la ecuación [4] con respecto a las condiciones límites q = 0a t = 0y q = qea t = t, se obtiene:

Donde k2es la constante de velocidad de seudo segundo orden (g mg-1 min-1); qty qeson las cantidades de DNF adsorbido a un tiempo t y en el equilibrio, respectivamente (17).
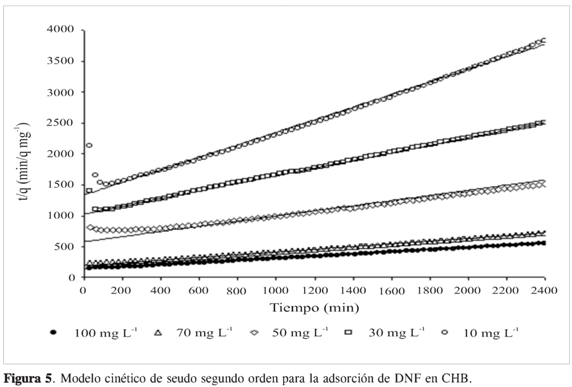
La gráfica lineal de t/qt en función del tiempo tiene 1/qe como la pendiente y 1/k2qe2 como el intercepto. En la Figura 5, se observa una correlación entre el qe experimental y los valores calculados de qe por el modelo (Tabla 2). Además, los coeficientes de correlación para el modelo cinético de segundo orden variaron en un rango de 0,970 a 0,998, lo que indica la aplicabilidad del modelo para describir la cinética de adsorción del DNF en el CHB.
Los resultados muestran una mayor correlación con el modelo de seudo segundo orden. Este representa la quimisorción o adsorción química debida a la formación de enlaces químicos entre adsorbente y adsorbato en una monocapa en la superficie (18, 19).
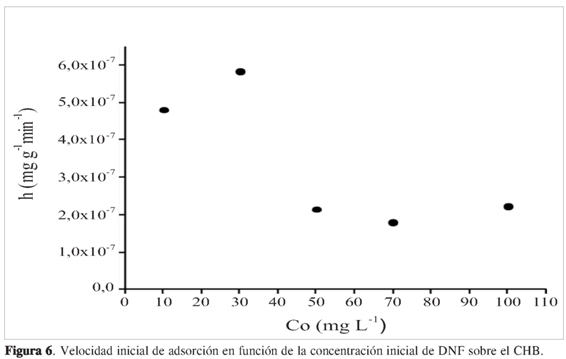
Las constantes de velocidad del modelo de seudo segundo orden se emplean para calcular la velocidad de adsorción inicial, h (mg g-1min-1), donde qe es la capacidad de adsorción en el equilibrio, k2 (mg g-1min-1) es determinado experimentalmente de la pendiente e intercepto de la gráfica t/q versus t. Según las correlaciones obtenidas con el modelo de seudo segundo orden que se ajustan favorablemente al modelo DNF en CHB se puede determinar el valor de h como se muestra en la ecuación [6] (19):

Los valores calculados de h se representan frente a la concentración inicial de DNF, como se muestra en la Figura 6. Se encontró un incremento en la velocidad inicial de adsorción, h, con la concentración inicial, Co; sin embargo, el valor empezó a disminuir cuando la concentración inicial es mayor de 30 mg L-1.La posible razón es que cuando se aumenta la concentración hay una mayor interacción entre moleculas de adsorbato, lo que disminuiria el proceso de adsorción, aunque se utilizó la misma cantidad de adsorbente. Esta puede no ser suficiente para que las moleculas de DNF sean adsorbidas rápidamente cuando se aumenta la concentración.
Mecanismo de adsorción
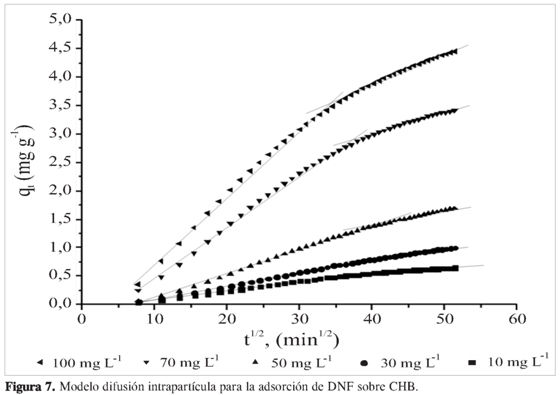
Los modelos cinéticos no identifican el mecanismo de difusión; por tanto, con el propósito de conocer la forma como se realiza la adsorción, se aplicó el modelo de difusión intrapartícula basado en la teoría propuesta por Weber y Morris (20). Esta es una relación empírica común en la mayoría de procesos de adsorción, ya que esta varía proporcionalmente con t1/2más que con el tiempo de contacto t. De acuerdo con esta teoría se tiene:

Donde kpi(mg g-1 min1/2) parámetro de velocidad para cada etapa, se obtiene de la pendiente de la recta qtversus t1/2. Cies el intercepto de la etapa i, dando una idea del grosor de la capa límite. Si la difusión intrapartícula ocurre, entonces qtversus t1/2 será lineal; si la gráfica pasa por el origen, entonces el proceso que limita la velocidad solo se debe a la difusión intrapartícula. De lo contrario, está involucrado otro mecanismo junto con la difusión intrapartícula (21).
Para las gráficas de difusión intrapartícula, la primera etapa se debe a una adsorción instantánea o adsorción en la superficie externa, donde el adsorbato viaja hacia la superficie externa del adsorbente. En la segunda etapa ocurre una adsorción gradual donde la difusión intrapartícula es la limitante de la velocidad, es decir, el adsorbato viaja dentro de los poros del adsorbente. En algunos casos, existe una tercera etapa que representa el equilibrio final donde la difusión intrapartícula comienza a disminuir debido a la baja concentración de adsorbato; la adsorción ocurre en el interior del adsorbente (18). En la Figura 7, para todas las concentraciones iniciales, la primera etapa se completó a los 60 minutos. Entonces se logra la segunda región de difusión intrapartícula; la tercera etapa se produce para todas las concentraciones. Las diferentes regiones de velocidad de adsorción observadas indican que la velocidad de adsorción es lenta en la etapa I, aumenta en la etapa II y disminuye nuevamente en la etapa III.
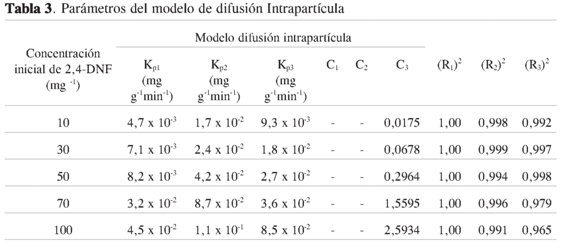
En la Figura 7 se observa que las tendencias de la segunda y la tercera etapas no pasan por el origen. Esta desviación desde el origen se debe a la diferencia en la velocidad de transferencia de masa en las etapas de adsorción inicial y final, mostrando que el proceso de difusión intrapartícula no es el único mecanismo limitante en el proceso de adsorción. Los valores de kpi,Ci y los coeficientes de correlación, R2, se muestran en la Tabla 3.
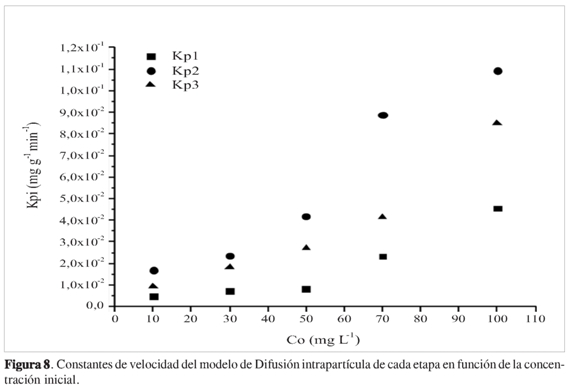
Los valores de kpiexperimentales en función de la concentración inicial (Co)de DNF se presentan en la Figura 8 y se muestra que para una etapa fija a medida que aumenta la concentración hay un incremento en la constante de velocidad. Sin embargo, se observa un cambio en las velocidades de cada etapa manteniendo fija la concentración inicial, mostrando que la etapa que gobierna el proceso de adsorción para los diferentes rangos de concentración es el mecanismo de difusión.
CONCLUSIONES
El carbonizado de hueso bovino obtenido se caracteriza por ser un material mesoporoso, con tamaño promedio de poro de 5,9 nm y área superficial de 171 m2g-1. Los resultados de DRX confirman la presencia del componente principal de la matriz ósea hidroxiapatita.
La cinética de adsorción de DNF es descrita por el modelo de seudo segundo orden y representa la quimisorción entre el adsorbato-adsorbente en una monocapa en la superficie. Se encontró que estos procesos son rápidos a concentraciones bajas; sin embargo, a concentraciones altas se observa una disminución en las velocidades de adsorción. Los coeficientes de correlación para dicho modelo fueron 0,970-0,998.
Para la adsorción de DNF en CHB se encontró que la difusión de partículas es el mecanismo predominante en la velocidad de adsorción donde los coeficientes de correlación están entre 0,991-0,999.
El modelo de difusión intrapartícula muestra que el proceso de adsorción está gobernado por la etapa en donde el mecanismo de difusión de partícula es la limitante de la velocidad.
AGRADECIMIENTOS
Los autores agradecen a la Universidad Nacional de Colombia y a la División de Investigaciones de la sede Bogotá (DIB), código DIB-11922. Además, al Convenio Marco entre la Universidad de los Andes y la Universidad Nacional de Colombia y al Acta de Acuerdo entre los Departamentos de Química de las dos universidades.
REFERENCIAS BIBLIOGRÁFICAS
1. Su-Hsia, L.; Ruey-Shin, J. Adsorption of phenol and its derivatives from water using synthetic resins and low-cost natural adsorbents: A review. J. Environ. Manag. 2009. 90 (3): 1336-1349. [ Links ]
2. López, M.; Echavarria, A.; Suárez, R.; Herrera, N. Hidroxiapatita macroporosa obtenida en la Universidad de Antioquia: síntesis, caracterización y comparación con el hueso esponjoso y calcinado de bovino. Rev. Fac. Ing. Univ. Antioquia. 2003. 30: 109-124. [ Links ]
3. Deydier, E.; Guilet, R.; Sarda, S.; Sharrock, P. Physical and chemical characterisation of crude meat and bone meal combustion residue: "waste or raw material ?" J. Hazard. Mater. 2005. 121 (1-3): 141-148. [ Links ]
4. Leyva-Ramos, R.; Rivera-Utrilla, J.; Medellin-Castillo, N.A.; Sánchez-Polo, M. Kinetic modeling of fluoride adsorption from aqueous solution onto bone char. Chem. Eng. J. 2008. 158 (3): 1-37. [ Links ]
5. Su-Hsia, L.; Ruey-Shin, J. Adsorption of phenol and its derivatives from water using synthetic resins and low-cost natural adsorbents: A review. J. Environ. Manag. 2009. 90 (3): 1336-1349. [ Links ]
6. Tae Young, K.; Seung Jai, K.; Sung Young, C. Effect of pH on adsorption of 2,4-dinitrophenol onto an activated carbon. Korean J. Chem. Eng. 2001. 18 (5): 755-760. [ Links ]
7. Gemini, V.; Correa, E.; Gallego, A.; Korol, S. Factores que influyen en la biodegradación de efluentes liquidos conteniendo 2,4-dinitrofenol. CONAGUA. 2007. [ Links ]
8. Moreno-Castilla, C. Adsorption of organic molecules from aqueous solutions on carbon materials. Carbon. 2004. 42 (1): 83-94. [ Links ]
9. Rouquerol, F.; Rouquerol, J.; Sing, K.S.W. Adsorption by powders and porous solids. San Diego, Academic Press. 1999. [ Links ]
10. Leofanti, G.; Padovan, M.; Tozzola, G.; Venturelli, B. Surface area and pore texture of catalysts. Catal. Today. 1998. 41 (1-3): 207-219. [ Links ]
11. Smiciklas, I.; Dimovic, S.; Sljivic, M.; Plecas, I. The batch study of Sr2+ sorption by bone char. J. Environ. Sci. Health A. 2008 . 43 (2): 210-217. [ Links ]
12. Kaili, L.; Jiayong, P.; Yiwei, C.; Rongming C.; Xuecheng X. Study the adsorption of phenol from aqueous solution on hydroxyapatite nanopowders. J. Hazard. Mater. 2009. 161 (1): 231-240. [ Links ]
13. Ho, Y.S.; McKay. G. Comparative sorption kinetics studies of dyes and aromatic compounds onto fly ash. J. Environ. Sci. Health A. 1999.34 (5): 1179-1204. [ Links ]
14. McKay, G.; Ho, Y.S.; Ng, J.C.Y. Biosorption of copper from waste waters: a review. Sep. Pur. Method. 1999. 28 (1): 87-125. [ Links ]
15. McKay, G.; Ho, Y.S. The sorption of lead (II) ions on peat. Water Res. 1999. 33 (2): 578-584. [ Links ]
16. Ahmad, A.A.; Hameed, B.H.; Aziz, N. Adsorption of direct dyes on palm ash: Kinetic and equilibrium modeling. J. Hazard. Mater. 2007. 141 (1):170-76. [ Links ]
17. Ho, Y.S. Review of second-order models for adsorption systems. J. Hazard. Mater. 2006. 136 (3): 6681-689. [ Links ]
18. Hameed, B.H.; Tan, I. A. W.; Ahmad, A.L. Adsorption isotherm, kinetic modeling and mechanism of 2,4,6-trichlorophenol on coconut husk-based activated carbon. Chem. Eng. J. 2008. 144 (2): 235-244. [ Links ]
19. Kavitha, D.; Namasivayam, C. Experimental and kinetic studies on methylene blue adsorption by coir pith carbon. Bioresour. Technol. 2007. 98 (1): 14-21. [ Links ]
20. Weber, W.J.; Morris, J.C. Proc. Int. Conf. Water pollution symposium. Vol. 2. Oxford, Pergamon. 1962. pp. 231-266. [ Links ]
21. Sinan, M. Adsorption of 4-chlorop-henol from aqueous solutions by xad-4 resin: Isotherm, kinetic, and thermodynamic analyisis. J. Hazard.Mater. 2006.137(1): 157-164. [ Links ]