Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804On-line version ISSN 2357-3791
Rev.Colomb.Quim. vol.40 no.2 Bogotá May/Aug. 2011
INMOVILIZACIÓN DE LIPASA de Candida antarctica SOBRE SOPORTES DE QUITOSANO-GELATINA
IMMOBILIZATION OF LIPASE FROM Candida antarctica ON CHITOSAN-GELATIN SUPPORTS
IMOBILIZAÇÃO DA LIPASE DE Candida antarctica EM SUPORTES DE QUITOSANA-GELATINA
Sandra X. Rangel1, Jorge García1, Carlos E. Orrego2,3
1 Departamento de Ingeniería Química, Facultad de Ingeniería, Universidad Nacional de Colombia, sede Bogotá, carrera 30 45-03, Bogotá D.C., Colombia.
2 Instituto de Biotecnología y Agroindustria, Departamento de Física y Química, Universidad Nacional de Colombia, sede Manizales, Campus La Nubia km 4 Vía al Magdalena, AA 127, Manizales, Colombia.
Recibido: 15/03/11 - Aceptado: 09/09/11
RESUMEN
Se preparó una serie de películas de quitosano-gelatina variando la relación de los constituyentes, quitosano-gelatina entre 1:2, 1:5 y 1:10, con concentración total de biopolímeros entre 3,0%, 3,5%, 4,0% y pH de 5,5. Se deshidrataron los soportes por crioconcentración (congelaciones descongelaciones sucesivas) y secado convectivo con aire. La inmovilización de lipasa de Candida antarctica se realizó sobre un hidrogel entrecruzado iónicamente con quitosano por atrapamiento y por adsorción; los mejores resultados en cuanto a actividad enzimática y reutilización del soporte se obtuvieron con el método por atrapamiento. Se llevaron a cabo pruebas de caracterización fisicoquímica de los soportes, actividad del sistema biocatalítico y estabilidad.
Palabras clave: inmovilización, gelatina, quitosano, lipasa de Candida antarctica, gel iónico, atrapamiento, adsorción, actividad enzimática, sistema biocatalítico.
ABSTRACT
A set of chitosan-gelatin films were prepared by varying the chitosan-gelatin ratio between 1:2, 1:5 and 1:10, with total concentration of biopolymers from 3,0% 3,5%, 4,0 and pH of 5,5. We carried out the dehydration of the supports through cryoconcentration (successive freeze thawing) and convective drying with air. Immobilization of lipase from Candida antarctica was performed on an ionically crosslinked hydrogel with chitosan by entrapment and adsorption, getting the best results in terms of enzymatic activity and reuse of the support with the entrapment method. Tests of physicochemical characterization of the supports, biocatalytic system activity and stability were carried out.
Key words: Immobilization, gelatin, chitosan, lipase from Candida Antarctica, ionic gel, trapping, adsorption, enzymatic activity, biocatalytic system.
RESUMO
Uma serie de filmes de gelatina quitosana foi preparada variando a proporção dos componentes, a quitosana-gelatina entre 01:02, 01:05 e 01:10, com concentração total de biopolímeros de 3,0%, 3,5% 4,0% e pH de 5,5. Realizou-se a desidratação dos suportes por crioconcentração (ciclos sucessivos de descongelamento-congelamento) e secagem por convecção com o ar. A imobilização de lipase de Candida antarctica foi realizada em um hidrogel ionicamente entrecruzado com quitosana por adsorção e atrapamento, obtendo os melhores resultados em termos de atividade enzimática e reutilização do suporte com o método de atrapamento. Foram realizados testes de caracterização físico-química dos suportes, da atividade do sistema biocatalítico e da estabilidade.
Palavras-chave: Imobilização, quitosana, gelatina, lipase de Candida antarctica, atrapamento, adsorção, atividade enzimática, sistema biocatalítico
INTRODUCCIÓN
La catálisis enzimática en medios no acuosos ha adquirido considerable importancia por su aplicación en la fabricación de ingredientes, productos intermedios y finales de muy variadas actividades industriales (1). El bioprocesamiento en fase no acuosa es muy interesante porque favorece la estabilidad térmica de los sistemas biocatalíticos, predominan las reacciones de síntesis sobre las de hidrólisis (2), se puede manipular la selectividad de las enzimas por la elección del medio y facilita la recuperación de los productos debido a que se separan simple y económicamente del solvente por evaporación (3).
Para usar los catalizadores enzimáticos repetidamente, se deben llevar a cabo procesos de inmovilización que se pueden aplicar a procesos por lotes o continuos. La inmovilización de enzimas consiste en la restricción deliberada de la movilidad de la enzima. Después de inmovilizadas, las enzimas quedan localizadas en una región definida del espacio, limitada por barreras materiales o electrostáticas, que separan físicamente la enzima del seno del medio de reacción, pero permeables a las moléculas de reactivos y de productos. La inmovilización puede servir para dos objetivos: mejorar la estabilidad de la enzima y reducir su consumo, ya que puede ser retirada y reutilizada en varios ciclos de reacciones. El grado de mejora de esta estabilidad operacional depende de la estructura de la enzima, del método de inmovilización y del tipo de soporte (4).
Los métodos de inmovilización de enzimas pueden ser diferenciados en dos categorías generales: por retención física y mediante enlace químico (5). La adsorción, que forma parte de la primera categoría, es el método más simple e involucra interacciones superficiales reversibles entre la enzima y el material de soporte. Se ha observado que la inmovilización por adsorción no covalente es muy útil en sistemas no acuosos, en los cuales la desorción puede ser despreciada debido a la baja solubilidad de enzimas en estos disolventes (6, 7). Otro método de inmovilización física es el atrapamiento en matrices, en el cual la solución de enzima se mezcla con un fluido polimérico que luego se solidifica. Ejemplos característicos de este tipo de inmovilización son el atrapamiento en geles de polisacáridos como alginatos, k-carragenanos, agar, quitosano y ácido poligalcturónico u otras matrices poliméricas como gelatina, colágeno y polivinilalcohol (8, 9).
El quitosano es un amino polisacárido [(1-4)-2-amino-2-deoxi-b-D-glucano] obtenido por N-desacetilación alcalina de la quitina. Es uno de los polisacáridos más ampliamente distribuidos en la naturaleza. No es tóxico y ha sido utilizado para la inmovilización de enzimas, en particular lipasas, no solo porque su método de obtención es simple, sino también porque brinda propiedades físicas y químicas de interacción enzima-soporte interesantes para llevar a cabo reacciones biológicas con buen grado de eficiencia y actividad enzimática (10).
La selección del quitosano como soporte para la inmovilización de enzimas en este estudio se justifica por su afinidad con las proteínas, la presencia en sus moléculas de grupos amino reactivos, su biocompatibilidad y porque se puede moldear en distintas formas. La formación de hidrogeles híbridos de quitosano con otros biopolímeros puede incrementar la densidad del gel, mejorar su resistencia mecánica y, consecuentemente, ampliar sus posibilidades de aplicación. Estos complejos polielectrolíticos se forman por las interacciones iónicas entre los grupos amino cargados positivamente del quitosano con las cargas negativas (tales como las de los grupos sulfónicos y carboxilos) de otros biopolímeros. Entre los biopolímeros que se han usado para combinar con el quitosano se incluyen la gelatina, el colágeno, el carragenano, el alginato, el acohol polivinílico y la carboximetilcelulosa. La gelatina contiene grupos carboxilo en sus cadenas principales y tiene el potencial de establecer interacciones asociativas con el quitosano debido a su capacidad de formar puentes de hidrógeno con este, dando lugar a una estructura reversible de hidrogel que se ha denominado de red polimérica híbrida (11).
La yema de huevo expuesta a temperaturas por debajo de -6 °C experimenta gelificación (12). De forma similar, las soluciones acuosas de muchos polímeros sintéticos y naturales tales como alcohol polivinílico (PVA), quitosano, xantano, goma locust, amilopectina, amilasa y maltodextrinas experimentan cambios físicos como resultado de su congelación, almacenamiento en frío y subsecuente descongelación de sus dispersiones acuosas. La estructura, estabilidad química y mecánica de estos criogeles y los materiales secos que se obtienen por su deshidratación, los hace útiles como matrices atractivas para cromatografía y soportes de nanopartículas biológicas, células y enzimas (13,14). En los materiales basados en quitosano, obtenidos por congelación y descongelación seguidas o no por un proceso final de deshidratación, el tamaño de los cristales y, por tanto, el tamaño promedio y la orientación de los poros en el producto seco se ajustan variando la temperatura, la velocidad de congelación y los tratamientos de congelación y descongelación. Otro factor que afecta el tamaño del poro y la morfología de los poros de los criogeles secos es la concentración de los monómeros usados en la dispersión precursora del criogel (14, 15).
En este trabajo, a partir de los hidrogeles híbridos de quitosano-gelatina, y mediante distintas técnicas de deshidratación, se prepararon y caracterizaron soportes tipo película variando, en la dispersión biopolimérica inicial, la relación másica de los biopolímeros, su concentración total y el pH. En los distintos tipos de soportes obtenidos se inmovilizó una lipasa de Candida antarctica tanto por adsorción como por atrapamiento. Para la medida de la actividad del sistema inmovilizado se utilizó la reacción de esterificación de ácido oleico y butanol en hexano.
MATERIALES Y MÉTODOS
Materiales
Quitosano, con un grado de de-acetilación 76,2% y peso molecular de 602 KDa, en forma de hojuelas de la compañía Sigma-Aldrich (St Louis, MO, EE. UU.). La gelatina comercial de carnaza de res fue donada por la compañía PROGEL (Empresa Productora de Gelatina S.A.), Manizales, Colombia. La lipasa utilizada fue de Candida antarctica (Novozym 435), con una actividad específica lipolítica nominal de 910 U/mg de sólido y un contenido aproximado de 9,02% de proteína (medido según el análisis de Biuret), fue adquirida en Novo Nordisk A/S (Bagsvaerd, Denmark). Los demás reactivos fueron grado analítico de diferentes casas comerciales.
Preparación de los hidrogeles biopoliméricos
Se preparó una serie de dispersiones de gelatina y quitosano adaptando el procedimiento descrito por Chen et al. (2003) (16). En ellas se varió la relación de los biopolímeros quitosano:gelatina (1:2, 1:5 y 1:10) y su concentración total (3,0, 3,5 y 4,0% w/w). Por ejemplo, para la preparación de dispersión de relación 1:5 quitosano:gelatina con una concentración final de biopolímeros del 3%, se adicionaron 0,5 g de quitosano en 50 mL de agua y 2,5 g de gelatina en otros 50 mL de agua. Al mezclar se obtuvieron 100 mL de una dispersión con un contenido del 3% en peso de biopolímeros, en una proporción 1:5 quitosano:gelatina.
Las dispersiones poliméricas de quitosano se prepararon en soluciones acuosas previamente aciduladas hasta pH 2 a 3 utilizando HCl 2 M. Se homogeneizaron por agitación (120 rpm) durante dos horas a temperatura ambiente (20 °C). A las dispersiones homogéneas de quitosano se les elevó el pH hasta un valor entre 5,5-6,0 por adición lenta de NaOH 1 M con agitación de 150 rpm. Paralelamente se prepararon dispersiones de gelatina en agua destilada a una temperatura entre 60 y 80 °C, y un pH de 5,5. Después de solubilizada la gelatina, se dejaron enfriar hasta temperatura ambiente.
Se mezclaron las dispersiones de quitosano y de gelatina ajustando su pH hasta alcanzar tres niveles (5,5, 6,0 y 6,5). Estos sistemas compuestos se colocaron en cajas de Petri (10 cm de diámetro interno, ~50 mL de dispersión biopolimérica) hasta que gelificaron (20 °C); posteriormente fueron sometidas a deshidratación.
Procedimientos de deshidratación de los hidrogeles
Procedimiento de secado convectivo con aire. Los soportes gelificados de diferentes concentraciones y relaciones biopoliméricas se deshidrataron exponiéndolos al ambiente (20 °C, 70-80% de humedad relativa) por 72 horas.
Procedimiento de secado por congelaciones-descongelaciones sucesivas (CDS). Los soportes gelificados fueron sometidos a una temperatura de -20 °C durante 24 horas, seguidos de descongelamiento a temperatura ambiente durante 4 horas. Por efecto de la descongelación de los soportes gelificados, una parte de su contenido de agua se pudo separar y extraer fácilmente al inclinar la caja de Petri que contenía la muestra. El exceso de humedad superficial del gel se retiró utilizando una servilleta de papel. Este procedimiento se repitió 5 veces (ciclos).
Inmovilización de la enzima
Preparación de la solución enzimática. Se preparó una solución buffer de NaH2PO4.2H2O de pH 7,5. En esta solución se disolvió la enzima comercial (30 mg/mL) a temperatura ambiente. Luego se agitó a 150 rpm durante 30 horas, se centrifugó por 2 horas (15,000 X g, temperatura ambiente 20 °C) y se filtró.
Inmovilización por atrapamiento. Se adicionó la cantidad necesaria de solución enzimática a la mezcla de las dispersiones de quitosano y gelatina de forma que la concentración final de la proteína en este sistema fuera 5 mg/mL. El gel biopolimérico con la enzima atrapada se sometió a deshidratación por el procedimiento descrito de congelaciones-descongelaciones sucesivas (CDS).
Inmovilización por adsorción. Se sumergieron 1,78 g de soportes en una solución de 5 mg/mL de enzima comercial obtenida de la dilución de la solución enzimática en la solución buffer. Después de 24 horas y agitación esporádica, se retiró el soporte; el líquido residual fue almacenado para análisis de proteína. Enseguida se realizaron dos lavados con fosfato de sodio a pH 7,5 de dos minutos cada uno. Luego, el biocatalizador se almacenó en refrigeración a 5 °C. Las soluciones de lavado fueron almacenadas para determinar su contenido de proteína.
Análisis del contenido de proteína. La confirmación de la proteína presente en la solución enzimática y la fijada en el soporte durante el procedimiento de inmovilización por adsorción (a partir de las concentraciones y volúmenes de las soluciones enzimática, de lavado y de los exudados de las descongelaciones de los geles secados por CDS) se calcularon a partir de ensayos de medida de proteína usando el método de Biuret a una longitud de onda de 540 nm, utilizando un espectrofotómetro de doble haz Lambda 20 de Perkin Elmer con una celda de 1 cm y una curva de calibración hecha con albúmina de suero bovino.
Caracterización de los soportes y de los sistema biocatalíticos
Determinación de humedad de los soportes. Se midió la humedad por el método gravimétrico hasta peso constante a 95 °C, utilizando una balanza analítica Kern de 0,1 mg de precisión.
Pruebas cualitativas de estabilidad en medios acuosos y no acuosos. Teniendo en cuenta que los soportes se fabricaron con el propósito de evaluar su capacidad de ser matrices de inmovilización de lipasas en medios acuosos y no acuosos, se decidió hacer ensayos cualitativos que dieran una idea de sus resistencias mecánica y química, y del grado de hinchamiento último que mostraban en un variado conjunto de disolventes, fijando algunas condiciones típicas de reacciones enzimáticas o protocolos de inmovilización. Así, para establecer la resistencia a la agitación, se hizo la inmersión de los distintos soportes en 80 mL de agua destilada (pH = 6,5) a diferentes velocidades de agitación (800 rpm, 500 rpm y 120 rpm) por 8 horas. Para medir la estabilidad química se realizó la inmersión de los soportes en diferentes solventes a temperatura ambiente (HCl 5%, NaOH diluido, agua, ácido acético, glicerina, hexano, butanol, etanol, acetona, isopropanol, aceite de higuerilla, aceite de palma, biodiesel) por 48 horas. En todos los casos, al final de los ensayos se hizo una inspección visual de la preservación, desintegración parcial o total, o desaparición de los soportes en el medio.
Espectroscopia infrarroja por transformada de Fourier. Los diferentes soportes fueron pulverizados (3 mg de muestra) y se mezclaron con 2 g de KBr para formar una pastilla que se analizó en un espectrofotómetro Perkin Elmer Spectrum BX II.
Análisis superficial por microscopía de fuerza atómica. La estructura superficial de las películas de geles secas, con o sin enzima, se visualizó utilizando un microscopio de fuerza atómica (Park Scientific Instruments, modelo Auto Probe CP) en modo no contacto (25 °C) con una sonda ultra-lever. Las imágenes fueron obtenidas en una atmósfera de humedad controlada a una velocidad de 1 Hz, un área de barrido de 100 µm2 y una resolución de 256x256 pixeles.
Determinación del área superficial. Las pruebas de área superficial se efectuaron en un analizador de porosidad y área superficial ASAP 2020 (Micromeritics Instrument Corporation, Gosford, New South Wales, Australia). Como estándares para calibrar el equipo se utilizaron a-alúmina y caolinita, de área superficial = 0,52 ± 0,03 m2 g-1 y = 15,8 ± 0,09 m2 g-1, respectivamente. La muestra se desgasificó a 100 °C con una rampa de calentamiento de 10 °C/min, por 24 horas, hasta alcanzar una presión estable de 7 mm Hg y una velocidad de evacuación de 10 mm Hg/s. Luego de este procedimiento, las isotermas de adsorción y desorción de nitrógeno se tomaron a 77 K. Los datos de volumen adsorbido a condiciones estándar de temperatura y presión se transformaron matemáticamente de acuerdo con la ecuación de Brunauer, Emmett y Teller (BET).
Medida de la actividad enzimática del biocatalizador. Para la medida de la actividad se utilizó la reacción de esterificación de ácido oleico y butanol en hexano. La enzima inmovilizada fue incubada previamente durante 20 min en la solución de ácido oleico en hexano. Para iniciar la reacción, se mezclaron 37,5 mL de soluciones 0,2 M de ácido oleico y butanol en hexano para obtener una relación equimolar (0,1 M) de sustratos. Cada sistema de reacción, que contenía 1,28 g de sistema biocatalítico (soporte más enzima inmovilizada) se agitó a 300 rpm a una temperatura de 40 °C.
El seguimiento de la reacción se hizo tomando 1 mL de la mezcla de reacción cada 5 minutos, que se diluyó hasta 10 mL en una solución de etanol/acetona (1:1 v/v); luego se agregó fenolftaleína al 1% y se tituló con NaOH acuoso 0,01 N. Las muestras se tomaron en un periodo de 30 minutos.
Este procedimiento se realizó sin catalizador (blanco), con lipasa comercial y con la lipasa inmovilizada en los geles de quitosano-gelatina tanto por atrapamiento como por adsorción.
La actividad enzimática, calculada a partir de la pendiente de la gráfica de la desaparición de ácido oleico vs. tiempo, se midió en mM mol de ácido consumido/min.g de enzima inmovilizada.
RESULTADOS Y DISCUSIÓN
Estabilidad de los soportes de quitosano-gelatina en medios acuosos y no acuosos
Aunque se presentó algún grado de hinchamiento, los soportes no se desintegraron en agua destilada (20 °C, pH = 6,5) luego de permanecer en ella 8 horas a diferentes velocidades de agitación (800 rpm, 500 rpm y 120 rpm).
En la Tabla 1 se muestran los resultados de las pruebas de solubilidad e hinchamiento.
Los resultados de la Tabla 1 corresponden a la inspección visual de cada material luego de que este permaneciera inmerso durante 48 horas en los distintos medios a 20 °C. Independientemente de las proporciones de quitosano:gelatina, del porcentaje total de biopolímero en la dispersión original y del tipo de secado utilizado en este registro cualitativo, no hubo distinción en cuanto a la calificación del estado final de cada uno de los soportes. El propósito de esta sencilla prueba fue determinar si los hidrogeles deshidratados, destinados a ser soportes de inmovilización de enzimas, tenían suficiente estabilidad para permanecer íntegros en ensayos de seguimiento de una reacción enzimática, que pueden durar 48 o más horas.
En conclusión, los soportes quitosano-gelatina analizados en este estudio, aunque presentaron alguna estabilidad mecánica en agua durante ocho horas, solo tienen potencial de uso como soportes para inmovilización de enzimas en reacciones en medios no acuosos.
Análisis de las alternativas de fabricación y humedad final de los soportes de quitosano:gelatina
El pH en el que las mezclas de las dispersiones de gelatina y quitosano fueron estables y homogéneas fue 5,5. A pH de 6,0, y más evidentemente en 6,5, se formaron pequeños precipitados blancos. Este comportamiento coincide con lo reportado en la literatura para dispersiones acuosas de quitosano puro en las que este biopolímero comienza a precipitar a valores de pH mayores de o iguales a 6 (16).
En cuanto a la concentración total de la mezcla de biopolímeros se observó, para el caso de las mezclas de 3,5 y 4,0%, que la viscosidad del hidrogel era muy elevada y dificultaba su manipulación y la obtención final de películas de gel secas homogéneas.
El propósito de la deshidratación del hidrogel es obtener un soporte seco con características estructurales adecuadas para inmovilizar la lipasa en una matriz con suficiente agua disponible para que la enzima preserve su actividad catalítica en un medio no acuoso. El método de CDS proporcionó un tipo de soporte más húmedo, esponjoso y con porosidad superficial evidente. Con el método de secado convectivo se generaron estructuras rígidas, compactas y de baja humedad.
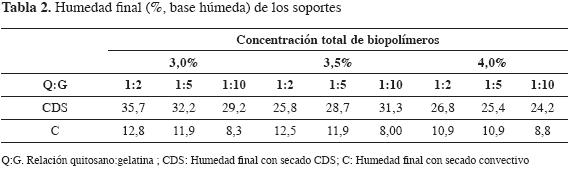
En la Tabla 2 se muestran los valores de humedad final de los soportes.
En este trabajo se usaron mezclas de quitosano-gelatina en diferentes proporciones, concentraciones totales y valores de pH en la dispersión original, y se aplicaron dos métodos de secado: con aire o convectivo y CDS. De acuerdo con los resultados descritos relativos al efecto del pH -la concentración total de biopolímeros en la dispersión original-, se decidió continuar el estudio solamente con los materiales preparados con pH y concentración de biopolímeros de 5,5 y 3%, respectivamente. Respecto del método de secado, se restringió a soportes obtenidos mediante CDS por su mayor porosidad aparente y contenido de humedad suficiente para garantizar la disponibilidad de agua para la enzima que se iba a inmovilizar y a utilizar en un medio no acuoso.
Estructura y área superficial de los soportes
Independientemente de la técnica aplicada para la producción de un soporte catalítico, debe tenerse en cuenta algunos factores asociados a su estructura, que pueden limitar su actividad catalítica: la macroporosidad, que afecta la difusión externa de los sustratos desde el medio de reacción hacia los sitios de ubicación de las enzimas en el soporte sólido, y la mesoporosidad, principalmente relacionada con el tamaño de las cavidades que alojan las moléculas de enzima y que, para una mejor eficiencia y capacidad de inmovilización, idealmente, debiera ser de un tamaño ligeramente mayor que el radio hidráulico de la proteína inmovilizada en la matriz (17). Para lograr estas características estructurales, en el caso de dispersiones de quitosano, se han utilizado criogeles estructurados y deshidratados mediante procesos de congelación-descongelación (CDS) (15).
Estructura superficial. La microscopía de fuerza atómica (AFM), una técnica que permite estudiar la estructura superficial, ha sido utilizada por investigadores interesados en el estudio de la topografía superficial de membranas (18)
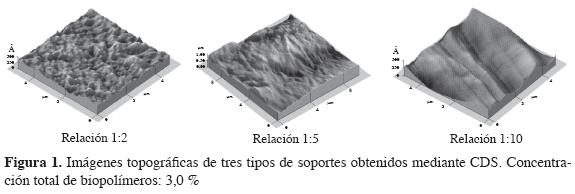
La morfología observada para tres soportes (3% de contenido total de biopolímeros, deshidratados mediante CDS) de diferente relación quitosano:gelatina fue distinta, como se observa en las imágenes topográficas mostradas en la Figura 1. Las micrografías tomadas a las diferentes películas corresponden a un tamaño de 5x5 µm2. La superficie de las tres muestras no es lisa y en ella se observan estructuras nodulosas y de agregados de nódulos que aparecen brillantes, mientras que las zonas más oscuras corresponden a superficies más profundas.
El efecto de los tratamientos CDS en la producción de membranas o soportes de quitosano es estructurar la superficie, es decir, hacerla homogénea y porosa (19). En el caso de mezclas quitosano-gelatina se evidencia, de acuerdo con las micrografías de la Figura 1, que para la proporción más baja de gelatina esta técnica también produce este tipo de estructuración. Sin embargo, el efecto se pierde a medida que se incrementa la presencia de gelatina en la mezcla inicial de biopolímeros.
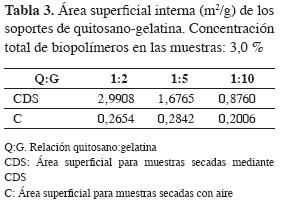
Área superficial. En la Tabla 3 se observan los resultados promedio de dos determinaciones de área superficial para tres diferentes tipos de soportes de quitosano-gelatina obtenidos con los dos métodos de deshidratación utilizados en este trabajo.
Las cifras de área superficial de la Tabla 3 son coherentes con las apreciaciones cualitativas sobre estructura acerca de los materiales secos obtenidos mediante secado por convección y CDS. Los primeros, rígidos y compactos, tienen los valores más bajos de área superficial; los segundos muestran cifras entre cuatro y doce veces superiores respecto de esta característica y, entre ellos, los de proporción 1:2 en la relación quitosano:gelatina tuvieron mayor área superficial por gramo de muestra (2,9908 m2/g). También es evidente que para los soportes deshidratados por CDS hay correspondencia entre estas cifras y la estructura superficial que aparece en las micrografías de la Figura 1: la mayor área superficial corresponde a la superficie más estructurada.
El área superficial de los soportes de quitosano depende principalmente del procedimiento de secado de los hidrogeles. Cuando se usa secado convectivo con aire se ha reportado, para pequeñas esferas de quitosano, áreas superficiales menores de 0,5 m2 g-1(20); usando secado por aspersión se obtienen valores ligeramente superiores (0,74-3,01 m2 g-1) (21). El secado al vacío y la liofilización permiten alcanzar entre 10 y 150 m2 g-1 (22); el secado supercrítico conduce a la obtención de las más altas áreas superficiales (hasta 200 m 2 g-1) (23). Puede concluirse que mediante la técnica descrita, para mezclas de quitosano-gelatina con concentración toral de biopolímeros de 3,0% secadas mediante CDS, se logran estructuras semejantes en área superficial a las que se alcanzan deshidratando dispersiones de quitosano mediante secado por aspersión. Para el caso del quitosano se ha sugerido que las superficies porosas tienen una capacidad de retención superior de enzima en procesos de adsorción de lipasas sobre esta clase de soportes y, consecuentemente, mayor actividad catalítica (17). Por esta razón se consideró que el soporte de relación 1:2 (quitosano:gelatina) era el más adecuado para inmovilizar la lipasa.
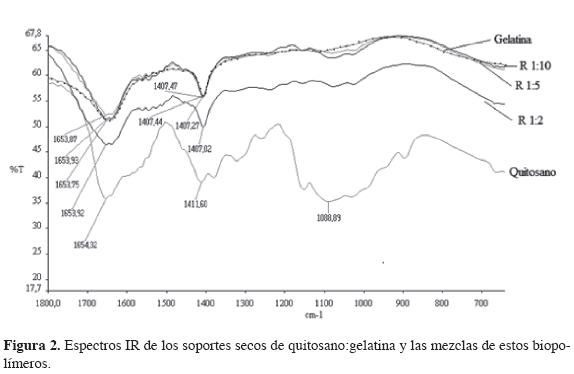
Espectroscopia infrarroja por transformada de Fourier. Los espectros infrarrojos de transformada de Fourier de los soportes de quitosano-gelatina obtenidos por deshidratación mediante CDS son mostrados en la Figura 2.
El espectro del quitosano muestra un fuerte pico característico de amida a 1.654 cm−1; una banda amplia con tres pequeños picos (1.300 cm-1, 1.350 cm-1 y 1.412 cm-1) que se atribuyen a distintos modos de vibración de los grupos CH, CH2 y CH3 (24) y una segunda amplia banda con dos pequeños picos y un mínimo en 1.089 cm-1 producidos por los grupos C-O, C-O-C, C-C y C-N del biopolímero y que, en conjunto, usualmente se asocian a la estructura sacárida del quitosano (25).
En el espectro de la gelatina (Figura 2) se observa un pico en una ubicación ligeramente menor a 1.654 cm−1 que se asocia al grupo carbonilo y a una pequeña banda amino alrededor de 1.537 cm-1.
La incorporación de la gelatina llevó a pequeñas modificaciones en el espectro de quitosano, variando las posiciones de bandas y picos hacia valores ligeramente menores, pero observables, de los números de onda, a medida que se incrementa el contenido de gelatina. Estos pequeños cambios indican la interacción de las moléculas de gelatina y quitosano por la formación de puentes de hidrógeno entre ellas en el complejo polielectrolítico creado entre los dos biopolímeros (26).
Inmovilización de la enzima
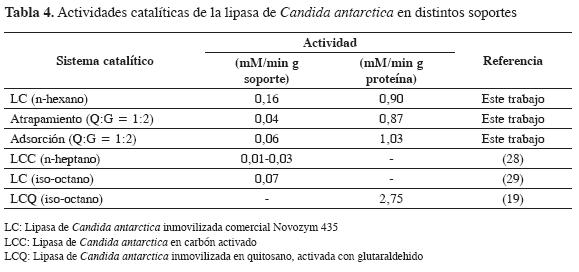
De acuerdo con los resultados de la Tabla 3, el área superficial de los soportes obtenidos mediante CDS es baja. Generalmente, la eficiencia de la inmovilización de una enzima la determina el área superficial del soporte. Esto ha sido cuestionado para el caso de la inmovilización de lipasas en soportes biopoliméricos en los que resulta ser más importante la afinidad del material de soporte por las enzimas que su área superficial(27). Tal parece ser la el caso en este estudio pues los resultados de actividad catalítica en la inmovilización de la lipasa de Candida antarctica fueron satisfactorios y, en algunos casos superiores a las publicadas en trabajos similares, tal como se observa en la Tabla 4.
De acuerdo con las mediciones de carga de proteína de las soluciones enzimáticas, de lavado y de los exudados de las descongelaciones de los geles secados por CDS, los balances de proteína mostraron que la cantidad de enzima adsorbida por el soporte fue 61,8 mg/g para el procedimiento de adsorción y 48,7 mg/g de soporte para inmovilización por atrapamiento.
Actividad enzimática del biocatalizador
Sin presencia del biocatalizador no se observó disminución de la concentración de ácido oleico en condiciones de ensayo (40 °C y 300 rpm) durante media hora.
En la Tabla 4 se comparan los resultados de actividad específica (U/g de proteína o U/g de soporte) obtenidos en este estudio con los de trabajos similares en los que se utilizó la misma reacción de síntesis para la medida de la actividad en el medio orgánico.
Los resultados de actividad de los sistemas inmovilizados obtenidos en este trabajo muestran actividades catalíticas comparables a las reportadas por estudios similares en sistemas de reacción semejantes que usaron medios no acuosos distintos al hexano. Este hecho puede explicar en parte las variaciones de los valores de la actividad. En el caso de la inmovilización por atrapamiento, la actividad es menor respecto de la de la inmovilización por adsorción, posiblemente por las restricciones a la transferencia de masa que lleva a restringir más el flujo de sustratos a través de la matriz biopolimérica.
Para estimar en una primera aproximación la estabilidad operacional de los sistemas biocatalíticos, la actividad catalítica fue medida durante dos reusos más, tanto de la lipasa inmovilizada por atrapamiento como por adsorción, mostrando una pérdida de la actividad de aproximadamente 20,5 y 38,4% en el caso de atrapamiento y de 45,6 y 80,2% en al caso de adsorción, lo cual indica que la inmovilización por atrapamiento es más estable.
CONCLUSIONES
En la preparación de los soportes, el factor determinante de la estabilidad y la homogeneidad de las dispersiones fue el pH, siendo 5,5 el valor en el que se no se presentó precipitación del quitosano. En cuanto a la concentración total de biopolímeros, las mezclas de 3,5 y 4,0% proporcionaron hidrogeles de alta viscosidad, lo que dificultó los pasos posteriores de los protocolos de obtención de los soportes. Respecto del método de secado, los materiales obtenidos mediante CDS (6 ciclos) fueron escogidos para llevar a cabo la inmovilización de la lipasa por tener mayor porosidad, área superficial y contenido de humedad.
Los soportes quitosano-gelatina preparados en este estudio, aunque presentaron alguna estabilidad mecánica en agua durante 8 horas, solo tienen potencial de uso como soportes para inmovilización de enzimas en reacciones en medios no acuosos.
Utilizando seis ciclos de CDS se logró obtener un gel con la estructura y la humedad adecuadas para ser utilizado como soporte para inmovilización de la enzima.
Como consecuencia de los resultados de las pruebas de AFM y la medida del área superficial, para propósitos de inmovilización, se consideró que el soporte más adecuado fue la relación quitosano-gelatina = 1:2.
Los resultados de actividad de los sistemas inmovilizados en este trabajo muestran actividades catalíticas de esterificación en medio no acuoso, comparables a las reportadas por estudios similares. En el caso de la inmovilización por atrapamiento, la actividad es menor respecto de la de la inmovilización por adsorción, posiblemente por las restricciones al flujo de sustratos que impone la matriz. Sin embargo, este resultó mejor que el de adsorción en cuanto a la reutilización o estabilidad operacional del sistema biocatalítico.
REFERENCIAS BIBLIOGRÁFICAS
1. Carrea, G.; Riva, S. Properties and synthetic applications of enzymes in organic solvents. Angewelde Chemie International Edition. 2000. 39: 2226-2254. [ Links ]
2. Van Unen, D. J.; Engbersen, J. F. J.; Reinhoudt, D. N. Studies on the mechanism of crown-ether-induced activation of enzymes in non-aqueous media. Journal of Molecular Catalysis B: Enzymatic. 2001. 11: 877-882. [ Links ]
3. Lee, M. Y.; Dordick, J. S. Enzyme activation for nonaqueous media. Current Opinion in Biotechnology 2002. 13: 379-384. [ Links ]
4. Dosanjh, N.; Kaur, J. Immobilization, stability and esterification studies of a lipase from a Bacillus sp. Biotechnology and applied biochemistry. 2002. 36: 7-12. [ Links ]
5. Arroyo, M. Inmovilización de enzimas. Fundamentos, métodos y aplicaciones. Ars Pharmaceutica. 1998. 39 (2): 23-39. [ Links ]
6. Khare, S. K.; Nakajima, M. Immobilization of Rhizopus japonicus lipase on celite and its application for enrichment of docosahexaenoic acid in soybean oil. Food Chemistry. 2000. 68 (2): 153-157. [ Links ]
7. Pereira, E. B.; Zanin, G. M.; Castro, H. F. Immobilization and catalytic properties of lipase on chitosan for hydrolysis and esterification reactions Brazilian Journal of Chemical Engineering. 2003. 20: 343 - 355. [ Links ]
8. Furukawa, S.-y.; Ono, T.; Ijima, H.; Kawakami, K. Enhancement of activity of sol-gel immobilized lipase in organic media by pretreatment with substrate analogues. Journal of Molecular Catalysis B: Enzymatic. 2001. 15 (1-3): 65-70. [ Links ]
9. Hsu, A. F.; Foglia, T. A.; Shen, S. Immobilization of Pseudomonas cepacia lipase in a phyllosilicate sol-gel matrix: effectiveness as a biocatalyst. Biotechnol Appl Biochem. 2000. 31: 179-83. [ Links ]
10. Orrego, C. E.; Valencia, J. S.; Zapata, C. Candida rugosa Lipase Supported on High Crystallinity Chitosan as Biocatalyst for the Synthesis of 1-Butyl Oleate Catalysis Letters. 2009. 129 (3/4): 312-322. [ Links ]
11. Berger, J.; Reist, M.; Mayer, J. M.; Felt, O.; Peppas, N. A.; Gurny, R. Structure and interactions in covalently and ionically crosslinked chitosan hydrogels for biomedical applications. European Journal of Pharmaceutics and Biopharmaceutics. 2004. 57: 19-34. [ Links ]
12. Fennema, O. R.; Powrie, W. D.; Marth, E. H., Low temperature preservation of foods and living matter. Marcel Dekker: New York., 1973. [ Links ]
13. Filippova, I. Y.; Bacheva, A. V.; Baivak, O. B.; Plieva, F. M.; Lysogorskaya, E. N.; Oksenoit., E. S.; Lozinsky, V. Proteinases immobilized on poly(vinil alcohol) cryogel: a novel biocatalysts for peptide synthesis in organic media. Russian Chemical Bulletin. 2001. 50: 1986. [ Links ]
14. Suh, J. K. F.; Matthew, H. W. T. Application of chitosan-based polysaccharide biomaterials in cartilage tissue engineering: a review. Biomaterials. 2000. 21: 2589-2598. [ Links ]
15. Orrego, C. E.; Valencia, J. S. Preparation and characterization of chitosan membranes by using a combined freeze gelation and mild crosslinking method. Bioprocess and Biosystems Engineering. 2009. 32 (2): 197-206. [ Links ]
16. Chen, T.; Embree, H.; Brown, E.; Taylor, M.; Payne, G. Enzyme-catalyzed gel formation of gelatin and chitosan: potential for in situ applications. Biomaterials. Biomaterials. 2003. 24 (17): 2831-2841. [ Links ]
17. Kang, Y.; He, J.; Guo, X.; Guo, X.; Guo, X.; Song, Z. Influence of Pore Diameters on the Immobilization of Lipase in SBA-15 Industrial and Engineering Chemistry Research. 2007. 46 (13): 4474-4479 [ Links ]
18. Hilal, N.; Al-ZoubP, H.; Darwish , N. A.; Mohammad , A. W.; Abu Arabi, M. A comprehensive review of nanofiltration membranes: Treatment, pretreatment, modelling, and atomic force microscopy. Desalination. 2004. 170: 281-308. [ Links ]
19. Orrego, C. E.; Salgado, N.; Valencia, J. S.; Giraldo, G. I.; Giraldo, O. H.; Cardona, C. A. Novel chitosan membranes as support for lipases immobilization: Characterization aspects Carbohydrate Polymers. 2010. 79 (1): 9-16. [ Links ]
20. Roberts, G. A. F.; Taylor, K. E. The Formation of Gels by Reaction of Chitosan with Glutaraldehyde. Makromolekulare Chemie 1989. 190: 951-960. [ Links ]
21. Rege, P. R.; R.J., G.; Block, L. H. Spray-dried chitinosans Part I: preparation and characterization. International Journal of Pharmaceutics. 2003. 252: 41-51. [ Links ]
22. Juang, R. S.; Wu, F. C.; Tseng, R. L. Use of chemically modified chitosan beads for sorption and enzyme immobilization. Advances in Environmental Research. 2002. 6: 171-177. [ Links ]
23. Valentin, R.; Bonelli, B.; Garrone, E.; Di Renzo, F.; Quignard, F. Accessibility of the Functional Groups of Chitosan Aerogel Probed by FT-IR-Monitored Deuteration. Biomacromolecules. 2007. 8: 3646-3650. [ Links ]
24. Ahmad, M. B.; Lim, J. J.; Shameli, K.; Ibrahim, N. A.; Tay, M. Y. Synthesis of Silver Nanoparticles in Chitosan, Gelatin and Chitosan/Gelatin Bionanocomposites by a Chemical Reducing Agent and Their Characterization. Molecules. 2011. 16: 7237-7248. [ Links ]
25. Boonsongrit, Y.; Mueller, B. W.; Mitrevej, A. Characterization of drug-chitosan interaction by 1H NMR, FTIR and isothermal titration calorimetry. European Journal of Pharmaceutics and Biopharmaceutics. 2008. 69: 388-395. [ Links ]
26. Mi, F. L. Synthesis and Characterization of a Novel Chitosan-Gelatin Bioconjugate with Fluorescence Emission. Biomacromolecules. 2005. 6: 975-987. [ Links ]
27. Al-Duri, B.; Robinson, E.; McNerlan, S.; Bailie, P. Hydrolysis of Edible Oils by Lipases Immobilized on Hydrophobic Supports: Effects of Internal Support Structure. Journal of American Oil Chemist's Society. 1995. 72 (11): 1351-1359. [ Links ]
28. Rodrigues, D. S.; Cavalcante, G. P.; Silva, G. F.; Ferreira, A. L. O.; Goncalves, L. R. B. Effect of additives on the esterification activity of immobilized Candida antarctica lipase. World Journal of Microbiology and Biotechnology. 2008. 24: 833-839. [ Links ]
29. Petkar, M.; Lali, A.; Caimi, P.; Daminati, M. Immobilization of lipases for non-aqueous synthesis. Journal of Molecular Catalysis B: Enzymatic. 2006. 39 (1-4): 83-90. [ Links ]